La hipertensión portal idiopática no cirrótica (HPINC) es una causa rara de hipertensión portal (HTP) intrahepática de etiología incierta. Esta entidad ha recibido otros nombres como esclerosis hepatoportal, fibrosis portal no cirrótica, cirrosis septal incompleta, hiperplasia nodular regenerativa, trasformación nodular parcial del hígado o venopatía portal obliterativa1–7. Aunque en el pasado se habían considerado estas entidades como diferentes enfermedades, actualmente se consideran una misma enfermedad en la que el amplio espectro histológico hallado en la biopsia hepática representaría diferentes estadios de la misma8. No obstante, no se puede descartar que dentro del mismo término se englobaran diferentes entidades nosológicas que tuvieran una manifestación fenotípica similar.
Para el diagnóstico de la HPINC se requiere la presencia de signos inequívocos de HTP con permeabilidad de las venas suprahepáticas y del eje esplenoportal en ausencia de cirrosis hepática y de otras causas conocidas de HTP9–11. Las alteraciones arquitecturales hepáticas abarcan un amplio espectro de lesiones que va desde cambios mínimos hasta alteraciones histológicas más relevantes, como la hiperplasia nodular regenerativa, pasando por una leve o moderada fibrosis portal pero ninguna de estas alteraciones histológicas son patognomónicas. Típicamente los pacientes con HPINC tienen un curso más benigno que la HTP cirrótica y la función hepática suele estar conservada.
EpidemiologíaLa HPINC tiene una distribución mundial pero su prevalencia es variable. Se ha descrito una mayor prevalencia en países subdesarrollados afectando fundamentalmente a personas de un nivel socioeconómico bajo1,10–13. Es particularmente frecuente en Asia: en India, la HPINC constituye el 7,9-48% de los pacientes con HTP8,14,15 y en Japón es responsable del 30%9,16. No existe una clara predominancia en cuanto al sexo y edad, sin embargo, pueden observarse discretas diferencias entre estudios de diferentes países9,17,18. Aunque no está claramente establecido, las diferencias en el nivel socioeconómico, las condiciones de vida, exposición a diferentes patógenos o la etnia podrían jugar un papel. En Japón, la incidencia de HPINC ha disminuido en las últimas décadas, probablemente debido a una mejora en la higiene y en los estándares de vida18.
EtiopatogeniaLa etiología de la HPINC es desconocida. Se han postulado diferentes mecanismos en la etiopatogenia de esta entidad, pero hasta el momento ninguno de ellos ha sido demostrado.
- •
Infecciones crónicas o recurrentes. Las infecciones repetidas del tracto digestivo con émbolos sépticos y la sepsis umbilical han sido propuestas como una de las causas de HPINC, ya que ocasionarían pileflebitis y consecuentemente daño endotelial, microtrombosis, esclerosis y obstrucción de las ramas portales de pequeño y mediano tamaño19.
- •
Tóxicos y drogas. La exposición a algunos tóxicos y drogas se ha relacionado con la inducción de fibrosis en el espacio de Disse y desarrollo de HPINC7. Entre los tóxicos asociados a HPINC se encuentra la azatioprina y otros citotóxicos20,21.
- •
Infección por el virus de la inmunodeficiencia humana (VIH). Se ha relacionado la infección por VIH en la patogenia de la HPINC, fundamentalmente aquellos pacientes que habían recibido tratamiento con terapia antiviral (en especial larga exposición a didanosina y/o estavudina)22 o por efecto directo del VIH23–27. La discontinuación del tratamiento con didanosina se ha relacionado, en algunos estudios, con una reducción de la progresión de la HPINC28,29.
- •
Predisposición genética. Hasta la fecha no se ha identificado una base genética de la enfermedad. Sin embargo, se ha visto agregación familiar30 y una mayor prevalencia de HLA-DR3 en pacientes indios31.
- •
Alteraciones inmunológicas. Se ha descrito una mayor prevalencia de trastornos de la respuesta inmune y disminución en la respuesta inmune celular en pacientes con HPINC32,33. En la mayoría de series de pacientes con HPINC se constata una asociación más frecuente de lo esperado con enfermedades autoinmunes (enfermedades del tejido conectivo, tiroiditis)34–36 y se ha descrito la presencia de anticuerpos anti-DNA hasta en un 65% de pacientes japoneses con HPINC. Estudios recientes han descrito la presencia de HPINC en pacientes con deficiencias inmunes primarias severas37.
- •
Hipercoagulabilidad. Varios estudios muestran una mayor prevalencia de alteraciones protrombóticas en pacientes con HPINC. Estas se hallaron hasta en un 50% de pacientes en un estudio europeo incluyendo 28 pacientes, de los cuales 13 desarrollaron trombosis portal durante el seguimiento10. En cambio, otro estudio más reciente38 objetivó alteraciones protrombóticas en tan solo un 7% de pacientes. Por ello, el papel de estas alteraciones requiere más estudios.
Miscelánea. Otros estudios han descrito el papel de endotelina-1, óxido nítrico y factor de crecimiento del tejido conectivo en el desarrollo de HPINC39–43.
PresentaciónLa HPINC se caracteriza por la presencia de complicaciones derivadas de la HTP. Habitualmente, la función hepática está conservada10,11,44. Las varices gastroesofágicas están presentes en un 85-95% de los pacientes en el momento del diagnóstico de la enfermedad45. La gastropatía de la HTP está presente en menor frecuencia que en los pacientes con cirrosis hepática, sin embargo, las varices rectales son más comunes que en la cirrosis45,46. Es característico hallar una gran esplenomegalia10,11.
La hemorragia digestiva por HTP es la manifestación clínica más frecuente pero tiene mejor pronóstico que en la cirrosis hepática8,10,11,47,48. La causa principal son las varices esofágicas13. Se ha descrito la presencia de ascitis en aproximadamente el 50% de los pacientes con HPINC10 y su presencia se ha relacionado con un peor pronóstico49. Suele ocurrir de forma transitoria, igual que el empeoramiento de las pruebas de función hepática, en contexto de un episodio de hemorragia digestiva, cirugía o infección8,10,11.
La encefalopatía hepática es una complicación rara, pero que en ocasiones puede ser grave50–52. Dos estudios prospectivos han descrito una prevalencia de síndrome hepatopulmonar del 10%53,54. No hay una relación evidente entre la HPINC y el desarrollo de hepatocarcinoma55–58. Hasta en un 45% de los casos puede evidenciarse anemia, leucopenia y trombocitopenia como manifestación del hiperesplenismo11. La trombosis de la vena porta tiene una incidencia superior a la observada en los pacientes con cirrosis hepática, siendo de aproximadamente 15% en un año10,22,49,59 y llegando al 75% en pacientes con HPINC asociada al VIH22,59,60. En una cohorte de 69 pacientes con HPINC, la infección por VIH y la hemorragia variceal como manifestación al diagnóstico de la enfermedad fueron los 2 únicos factores independientes asociados al desarrollo de trombosis portal durante el seguimiento38.
DiagnósticoFrecuentemente, los pacientes con HPINC son diagnosticados erróneamente de cirrosis hepática. En un estudio patológico de hígados explantados se halló que de aquellos que tenían diagnóstico histológico compatible con HTINC, cerca del 80% llegaron al trasplante con el diagnóstico previo de cirrosis hepática criptogénica52. Ello probablemente refleja el hecho que en la actualidad no hay ninguna prueba que permita el diagnóstico definitivo de HPINC y este es un diagnóstico de exclusión. Sin embargo, existen datos que nos pueden hacen sospechar que estamos ante un caso de HPINC.
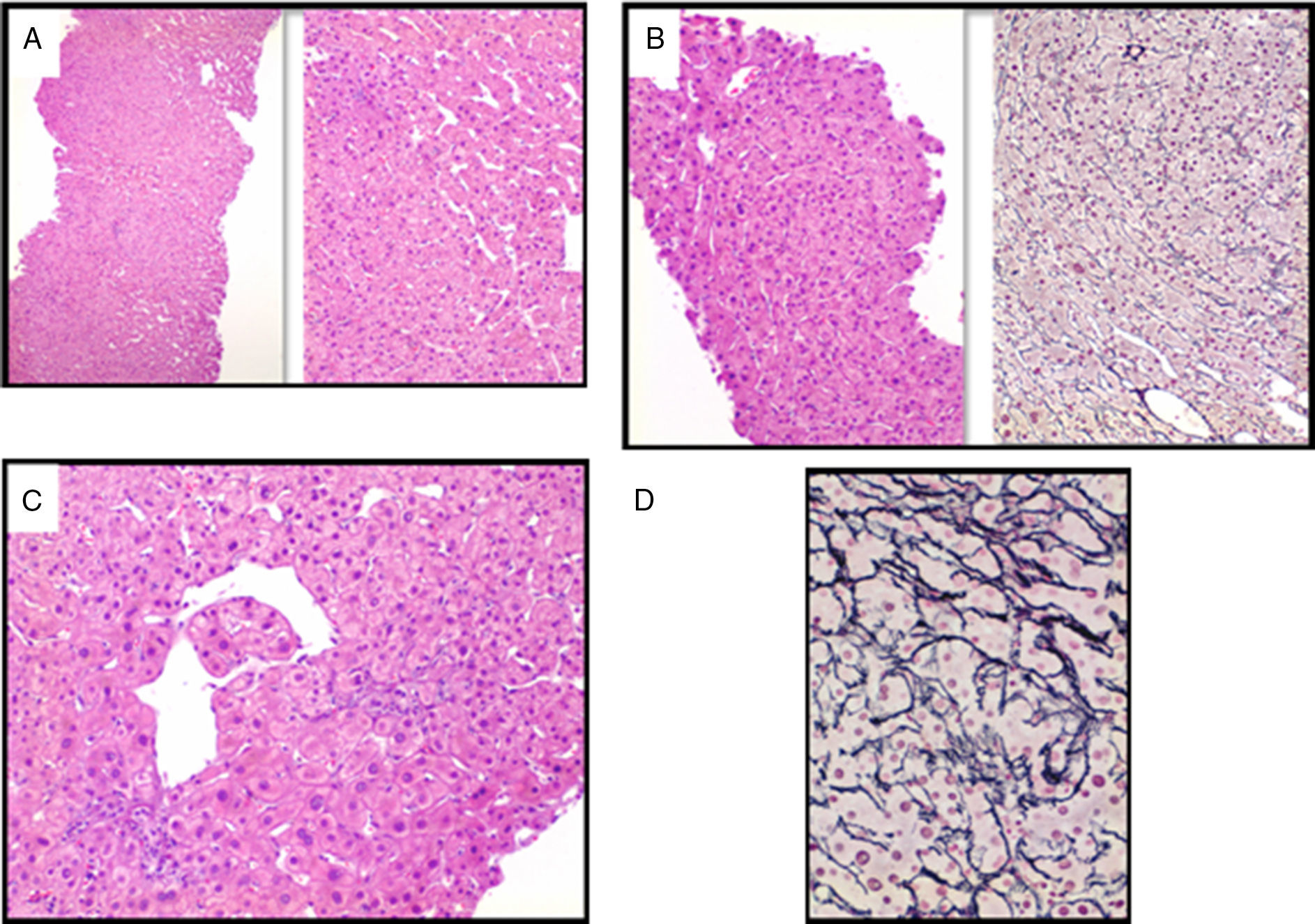
Las alteraciones histolo¿gicas son variables y aunque pueden ser sugestivas de HPINC no son patognomónicas. Son hallazgos comunes la esclerosis portal, con engrosamiento de la capa íntima e hipertrofia de la muscular, que ocasionan un estrechamiento y la obliteracio¿n de la luz de las vénulas portales, la dilatacio¿n sinusoidal, la presencia de vasos portales aberrantes, fibrosis perisinusoidal, microtrombosis o la presencia de hiperplasia nodular regenerativa10,44,61,62 (fig. 1). Sin embargo, la biopsia hepática es fundamental para descartar cirrosis y otras causas de HTP.
Las exploraciones de imagen pueden mostrar un hi¿gado de taman¿o normal y ecoestructura homogénea61. Sin embargo, más frecuentemente las alteraciones ecográficas sugieren una enfermedad hepática crónica: superficie hepática nodular, engrosamiento de las paredes de la vena porta >3mm (principalmente en las ramas intrahepáticas) y afilamiento repentino de segunda división de las radículas intrahepáticas de la vena porta5,11,63. Como ya hemos mencionado, con mucha frecuencia el bazo es de gran taman¿o y si se realiza una RNM pueden visualizarse los nódulos de Gamma Gandy (nu¿cleos sidero¿ticos que se encuentran frecuentemente en el bazo congestivo)61. Otro hallazgo frecuente en las pruebas de imagen es la existencia de colaterales portosistémicas. El estudio ecográfico y el TAC o RNM son indispensables para evaluar el eje esplenoportal y las venas suprahepáticas, que por definicio¿n deben ser permeables para el diagnóstico de esta entidad. Sin embargo, no es infrecuente que estos pacientes desarrollen a lo largo de su historia natural trombosis del eje esplenoportal, pudiendo ser erróneamente diagnosticados de trombosis portal primaria si son estudiados por primera vez en el momento en el que la trombosis ya esté presente.
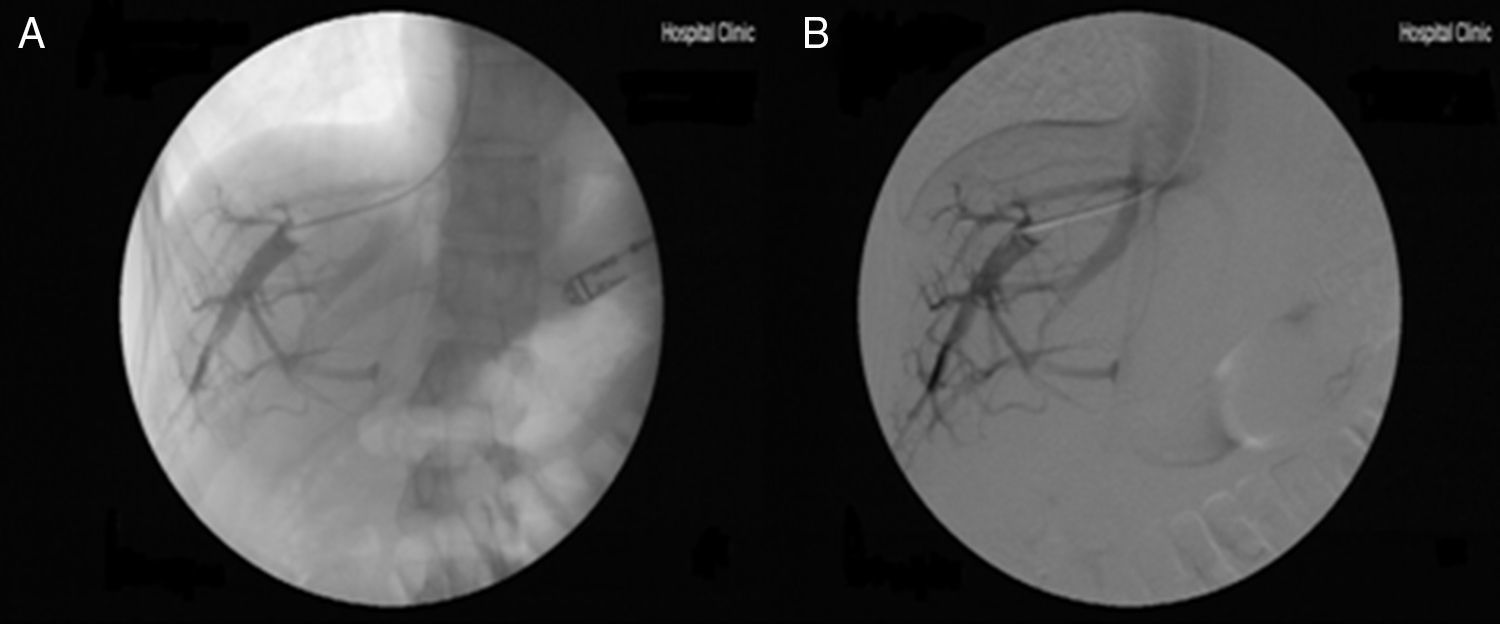
La práctica de un estudio hemodinámico hepático y/o la elastografía hepática pueden dar datos muy útiles de sospecha de HPINC. Así, los pacientes con HPINC presentan una alta incidencia de comunicantes vena-vena en el cateterismo de venas suprahepáticas (que en muchas ocasiones dificultan lograr una correcta oclusión de la vena suprahepática) (fig. 2) e, incluso si se logra una adecuada oclusión, el gradiente de presión venosa hepática es habitualmente normal o está sólo discretamente elevado, muy por debajo de lo esperado en un paciente con cirrosis hepática y signos semejantes de HTP, infraestimando la verdadera presión portal que presentan10,22,64,65. Ello se debe fundamentalmente al aumento de la resistencia intrahepática a nivel presinusoidal66,67. De forma semejante, los pacientes con HPINC presentan valores usualmente elevados en la elastografía hepática de transición (Fibroscan®) pero claramente inferiores a los valores descritos en pacientes con cirrosis hepática22,68. Raramente los pacientes con HPINC presentan valores superiores a 12kPa22,65. Ante un paciente con signos claros de HTP, estos hallazgos en el GPVH y en el Fibroscan nos deberían hacer sospechar la presencia de una HPINC. Un estudio reciente utilizando acoustic radiation force impulse (ARFI); una técnica ecográfica que también mide la rigidez hepática de forma no invasiva sugiere que el hallazgo de una razón rigidez del bazo/hígado ≥1,71, tendría una gran capacidad diagnóstica para diferenciar los pacientes con HPINC de los pacientes con cirrosis hepática y hepatitis crónica69. Se están evaluando otros métodos no invasivos para ayudar a establecer el diagnóstico de HPINC. Datos preliminares sugieren que los pacientes con HPINC presentan un perfil metabolómico sérico diferencial (que incluye entre 3 y 5 metabolitos) cuya determinación podría permitir el diagnóstico especifico positivo de esta entidad70. También se ha sugerido que el estudio del patrón de perfusión hepática mediante ultrasonografía con contraste71 o el hallazgo de niveles séricos de vitamina B12≤250pg/ml72 podrían permitir la diferenciación entre HPINC y cirrosis hepática criptogénica. No existen estudios en la actualidad que hayan validado estos hallazgos en muestra amplias de pacientes.
En resumen, el diagnóstico de HPINC se basa en la presencia de signos inequívocos de HTP (varices gastroesofágicas, esplenomegalia, ascitis, colaterales), la exclusión de cirrosis hepática mediante biopsia hepática o de otras enfermedades que ocasionen HTP y además, la evidencia de permeabilidad de las venas suprahepáticas y del eje esplenoportal. En ocasiones, nos encontraremos con pacientes en los que tenemos una alta sospecha de se traten de HPINC, pero que no cumplen todos estos criterios (por ejemplo presencia de trombosis portal en el momento del diagnóstico) y, hasta el descubrimiento de una prueba diagnóstica específica de esta entidad, deberemos de catalogarlos como de «posible» HPINC.
TratamientoNo existen guías clínicas de manejo de esta enfermedad ni un tratamiento específico de la misma. Por lo tanto, se aplican las mismas medidas terapéuticas y preventivas que en pacientes con cirrosis hepática e HTP, que parecen tener la misma aplicabilidad y efectividad que en estos73.
Hemorragia agudaExisten escasos estudios que evalúen de forma específica el manejo de la hemorragia aguda en estos pacientes74–76. Por lo tanto, el tratamiento del episodio agudo de la hemorragia no difiere del manejo en un paciente con cirrosis hepática77. La terapia combinada con drogas vasoactivas y el uso de la profilaxis antibiótica en pacientes con HPINC son temas de controversia ya que el comportamiento hemodinámico y la función hepática de estos pacientes son diferentes de los pacientes con cirrosis. No obstante, no existen datos que contraindiquen el uso de estos tratamientos en pacientes con HPINC, por lo que se recomienda la aplicación de los mismos. La terapia endoscópica se ha mostrado efectiva en el control de la hemorragia aguda variceal en 95% de los pacientes con HPINC78. El transjugular intrahepatic porto-systemic shunt (TIPS) o el shunt portosistémico quirúrgico son alternativas para aquellos pacientes en los que falla el tratamiento médico y endoscópico. Bissonnette et al. reportaron recientemente una muy buena supervivencia en pacientes con HPINC y hemorragia variceal no controlada, que fueron tratados con la colocación de TIPS79. La encefalopatía pos-TIPS puede aparecer y usualmente es de fácil control aunque ocasionalmente requiere reducir el calibre del TIPS79. En referencia a la profilaxis primaria y secundaria de la hemorragia variceal, actualmente se recomienda seguir las mismas guías clínicas que se aplican en los pacientes cirróticos.
Tratamiento anticoagulanteDebe de considerarse el uso de anticoagulación en pacientes con HPINC que tengan una condición protrombótica asociada o en aquellos que han desarrollado trombosis del eje portal7. No obstante, no existen estudios que hayan demostrado la efectividad de esta actitud y por ello la indicación o no del tratamiento anticoagulante deberá de individualizarse.
Trasplante hepáticoHay varios casos publicados de trasplante hepático en pacientes con HPINC10,44,52,80–83. Las indicaciones han sido el desarrollo de complicaciones progresivas y potencialmente mortales de la hipertensio¿n portal unido a la imposibilidad de realizacio¿n de un shunt quiru¿rgico o TIPS. El pronóstico postrasplante a largo plazo es bueno y probablemente sin recurrencia de la enfermedad52,81,82. Si bien, como hemos indicado, la experiencia no es amplia.
Soporte financieroFinanciado en parte por el Ministerio de Educación y Ciencia (SAF-2013-44723-R). CIBERehd está financiado por el Instituto de Salud Carlos III. Gilberto Silva-Junior es becario de la fundación CAPES, Ministerio de la Educación de Brasil, Brasília–DF 70040-020, Brasil (Número del proceso BEX 5960/13-4).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.