Entre los pacientes con enfermedad inflamatoria intestinal (EII), tanto colitis ulcerosa (CU) como enfermedad de Crohn (EC), existe un riesgo aumentado de desarrollo de cáncer de piel no melanoma sobre todo en aquellos pacientes que toman o han tomado fármacos tiopurínicos1. La relación de la EII con el melanoma ha sido recientemente estudiada en un extenso metaanálisis que reúne datos de más de 170.000 pacientes de 12 estudios2. En dicho estudio se llegó a la conclusión de que la EII incrementaba, independientemente del uso de tiopurinas o anti-TNF, el riesgo de melanoma con un riesgo relativo de 1,37 (IC 95% 1,10-1,70).
Pese a los grandes avances acontecidos en el tratamiento del melanoma, con fármacos antidiana como el vemurafenib y anticuerpos inmunomoduladores como el ipilimumab y el nivolumab, el tratamiento adyuvante de los melanomas de alto riesgo no se ha modificado desde finales de los años noventa. El interferón (IFN) alfa 2b (IFN α-2b) a dosis altas, esquema Kirkwood et al.3, es el único tratamiento que ha demostrado prolongar la supervivencia libre de progresión y un beneficio más cuestionable en términos de supervivencia global. El IFN es un fármaco con un efecto inmunomodulador cuya repercusión sobre la EII no es completamente conocido.
Presentamos el caso clínico de una mujer que tiene 42 años en la actualidad. Como antecedentes relevantes cabe destacar que es fumadora de hasta medio paquete diario. A los 27 años de edad fue diagnosticada de EC con afectación ileocólica y perianal (A2L3pB1). Inicialmente fue tratada con azatioprina y ciclos prolongados de corticoesteroides. Presentó una evolución tórpida tanto de la clínica intestinal como de los síntomas generales (artralgias, astenia, etc.). También recibió infliximab (que fue retirado por reacción anafiláctica) y adalimumab. Este último anti-TNF fue suspendido al año por pérdida paulatina de eficacia. A pesar de todo el tratamiento anteriormente comentado, la enfermedad perianal de la paciente también evolucionó desfavorablemente. Desarrolló diversas complicaciones piógenas (fístulas y abscesos) que requirieron tratamiento quirúrgico para drenaje de abscesos y colocación de sedales en las fístulas hasta en 7 ocasiones a lo largo de 4 años.
Diez años tras el diagnóstico de la EC, a los 37 años de edad, la paciente consulta por una lesión pigmentada con mal aspecto en su hombro izquierdo. Tras una biopsia escisional es diagnosticada de melanoma maligno nodular con ulceración microscópica, y más de 6 mitosis/mm2. El espesor de Breslow fue de 3,4mm (estadio de Clark III). Se realizó un estudio de extensión con TAC de cuerpo entero y biopsia selectiva de 3 ganglios centinelas que resultó negativo, siendo finalmente diagnosticado de estadio iib (pT3bN0M0). Se completó el tratamiento quirúrgico con ampliación de los bordes, libres de enfermedad en el estudio anatomopatológico. La paciente fue remitida al Servicio de Oncología Médica donde, dada la ulceración y el número de mitosis por mm2 del tumor primario y pese a no tener ganglios afectos, se le propone tratamiento adyuvante con IFN α-2b a altas dosis. Comenzó con dicho tratamiento según el esquema de Kirkwood et al. (15 millonesUI, 3 veces/sem durante 48 semanas)3. Antes de comenzar el tratamiento con IFN la paciente se encontraba con una calidad de vida muy limitada (hasta 4-5 deposiciones al día e importante astenia además de la clínica perianal comentada anteriormente) y en tratamiento con azatioprina 150mg/día; tratamiento que se mantuvo mientras la paciente recibió el IFN.
La paciente completó el tratamiento con IFN, presentando toxicidades leves (grado 1-2), entre las que destacaron: síndrome seudogripal, astenia, mialgias, cefalea, disgeusia, náuseas, eneuresis y neuropatía sensitiva leve. No fueron necesarias reducciones de dosis durante el tratamiento debidas a estas toxicidades.
Tras completar el tratamiento oncológico con IFN, la paciente experimentó mejoría de su EC a las pocas semanas y solo ha requerido una cirugía más para colocación de setón por su enfermedad perianal. Desde entonces hasta la actualidad se encuentra con muy buen estado general, asintomática desde el punto de vista intestinal y le han sido retirados todos los tratamientos inmunosupresores o inmunomoduladores para el Crohn. Por otro lado, continúa libre de enfermedad oncológica tras más de 5 años de seguimiento.
Los interferones constituyen una familia de moléculas con actividad antiviral introducidas por primera vez en la clínica en el año 1957. Según el receptor en el que actúen se clasifican en tipo i y tipo ii. El IFN α se encuentra codificado en un gen del cromosoma 9 y posee una amplia variedad de funciones biológicas que van desde un efecto antiproliferativo e inmunomodulador hasta una potente actividad antiviral4. Sus efectos se deben a la regulación de la expresión de gran multitud de genes de rutas de señalización intracelular. Se ha postulado que intervienen en la regulación de más de 300 genes una vez inician su acción tras ligarse a su receptor específico de membrana. Entre dichos genes y rutas moleculares se encuentran, entre otros, la óxido nítrico sintetasa inducible y los complejos mayores de histocompatibilidad i y ii.
Debido a estos efectos pleiotrópicos, estos fármacos han sido utilizados en el tratamiento de numerosas dolencias de diversa índole: La esclerosis múltiple (IFN β), diversas neoplasias como el melanoma maligno, o las hepatitis crónicas causadas por los virus B y C. Sobre su efecto en el curso de otras entidades crónicas de fisiopatología autoinmune como la EC existe menos información. Como se ha comentado anteriormente, el que un paciente con EII reciba IFN no es una situación excepcional, dada la mayor prevalencia de melanomas2 en este grupo poblacional. A continuación revisaremos la escasa evidencia existente respecto al uso del IFN en la EC:
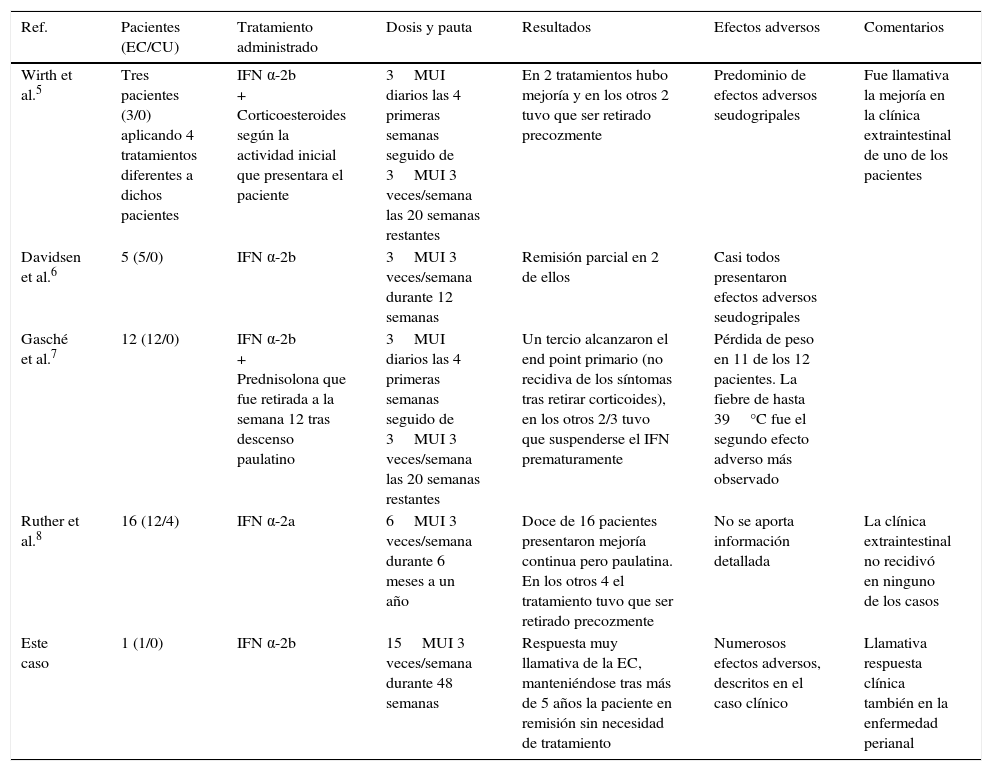
Una primera aproximación al efecto del IFN α-2b sobre la EC la podemos encontrar en el pequeño estudio publicado por Wirth et al.5. Estos autores aplicaron 4 tratamientos a 3 pacientes con EC durante 24 semanas. Se mantuvo el tratamiento con corticoides según la actividad inflamatoria inicial que presentara el paciente determinada por el Crohn Disease Activity Index (índice CDAI). El tratamiento tuvo que ser retirado en 3 de los pacientes, a las 12 y 14 semanas, por empeoramiento de la enfermedad. En los otros 2 tratamientos administrados, sí se observó una mejoría en la actividad de la enfermedad (descenso en 118 y 70 puntos del CDAI) y fue especialmente llamativo el caso de una mujer con abundante clínica extraintestinal.
En otro estudio piloto6, se trató a 5 pacientes con EC activa (CDAI entre 235 y 517 puntos) con IFN α-2b. Solo 2 de ellos consiguieron remisiones parciales de su enfermedad (descenso en el CDAI del 39% y del 50%) presentando todos los pacientes efectos adversos predominantemente seudogripales que fueron controlados con paracetamol.
Por su parte, Gasché et al.7 publicaron una serie más amplia, de 12 pacientes con EC activa tratada con IFN α-2b durante 24 semanas. Los pacientes recibieron prednisolona, cuya dosis fue disminuyéndose hasta ser retirada a la semana 12 de tratamiento. El objetivo primario (ver si era posible retirar el tratamiento con corticoides sin que se produjese un empeoramiento clínico de la enfermedad) fue alcanzado en un tercio de los pacientes, teniendo que retirarse de forma prematura el tratamiento con IFN en los 2 tercios restantes debido a la falta de eficacia y a la aparición de importantes efectos adversos (entre los que destacaron la fiebre y la pérdida de peso).
Otro estudio llamativo al respecto es el publicado por un grupo alemán8. Estos autores, de forma extraordinaria respecto a la literatura médica, han relacionado las exacerbaciones de la EII con infecciones del tracto respiratorio superior por virus de la familia herpes e hipotetizaban que el IFN α-2a podría ser un tratamiento efectivo en estos casos al potenciar la respuesta antiviral natural frente a estos virus. En el estudio incluyeron a 12 pacientes con EC y 4 con CU. Iniciaron tratamiento con IFN α-2a (retirando previamente el tratamiento de base que llevara el paciente) durante al menos 6 meses y llegando hasta un año en algunos pacientes. Doce de los 16 pacientes tratados presentaron una mejoría paulatina, necesitando una media de 8 semanas para alcanzarla. La mejoría fue muy llamativa en lo que respecta a las manifestaciones extraintestinales, que no recurrieron en ningún caso. Los 4 pacientes restantes no presentaron ninguna respuesta y el tratamiento tuvo que ser retirado precozmente.
En la otra cara de la moneda en la relación entre el IFN y la EII, en series de casos y publicaciones aisladas se ha relacionado el uso de este fármaco con el desarrollo o exacerbación de cuadros de EII. Un grupo portugués9 reportó 3 casos de EII (uno de CU y 2 de EC) iniciados poco después (entre 3 y 12 meses) de finalizar el tratamiento para una hepatitis crónica por virus C con peg-IFN y ribavirina. Sin embargo, a este respecto, se ha publicado recientemente un estudio retrospectivo realizado en la clínica Mayo10 con 15 pacientes (8 con CU y 7 con EC) en el que solo se observó una exacerbación de la EII durante o tras el tratamiento con IFN para hepatitis virales. Los autores concluyen, por tanto, que el tratamiento con este fármaco parece ser igual de seguro y efectivo en pacientes con EII que en controles sanos. La explicación de que el IFN pueda ser, a su vez, causa de remisión o de exacerbación de la EII podría ser el hecho de que es una citocina que estimula la respuesta inmunitaria tipo Th1 (que predomina en la EC) pero que a su vez tiene propiedades antiinflamatorias, disminuyendo la respuesta tipo Th2 (que está aumentada en la CU)10. Dicha hipótesis no ha sido corroborada en la literatura.
En la tabla 1 se recogen resumidos los resultados de los estudios comentados. A la vista de los mismos, parece que el tratamiento con IFN tiene un efecto variable sobre el curso de la EC. Algunos pacientes entran en remisión parcial, otros presentan una mejoría espectacular (especialmente llamativa en las manifestaciones extraintestinales) mientras que otros tienen escasa o nula mejoría e incluso un empeoramiento que obliga a la retira precoz del tratamiento. La mayoría de los estudios expuestos son de la era prebiológicos y con muy escaso número de pacientes. Adolecen asimismo de otras limitaciones metodológicas importantes como la ausencia de enmascaramiento (difícil de conseguir con el uso del IFN por los inconfundibles efectos adversos que produce) o de grupo control. El caso presentado es especialmente llamativo debido a que las dosis de IFN utilizadas son muy superiores a los casos publicados en la literatura y también a la espectacular respuesta clínica que presentó la paciente.
Estudios sobre el uso del IFN α en la EC
| Ref. | Pacientes (EC/CU) | Tratamiento administrado | Dosis y pauta | Resultados | Efectos adversos | Comentarios |
|---|---|---|---|---|---|---|
| Wirth et al.5 | Tres pacientes (3/0) aplicando 4 tratamientos diferentes a dichos pacientes | IFN α-2b + Corticoesteroides según la actividad inicial que presentara el paciente | 3MUI diarios las 4 primeras semanas seguido de 3MUI 3 veces/semana las 20 semanas restantes | En 2 tratamientos hubo mejoría y en los otros 2 tuvo que ser retirado precozmente | Predominio de efectos adversos seudogripales | Fue llamativa la mejoría en la clínica extraintestinal de uno de los pacientes |
| Davidsen et al.6 | 5 (5/0) | IFN α-2b | 3MUI 3 veces/semana durante 12 semanas | Remisión parcial en 2 de ellos | Casi todos presentaron efectos adversos seudogripales | |
| Gasché et al.7 | 12 (12/0) | IFN α-2b + Prednisolona que fue retirada a la semana 12 tras descenso paulatino | 3MUI diarios las 4 primeras semanas seguido de 3MUI 3 veces/semana las 20 semanas restantes | Un tercio alcanzaron el end point primario (no recidiva de los síntomas tras retirar corticoides), en los otros 2/3 tuvo que suspenderse el IFN prematuramente | Pérdida de peso en 11 de los 12 pacientes. La fiebre de hasta 39°C fue el segundo efecto adverso más observado | |
| Ruther et al.8 | 16 (12/4) | IFN α-2a | 6MUI 3 veces/semana durante 6 meses a un año | Doce de 16 pacientes presentaron mejoría continua pero paulatina. En los otros 4 el tratamiento tuvo que ser retirado precozmente | No se aporta información detallada | La clínica extraintestinal no recidivó en ninguno de los casos |
| Este caso | 1 (1/0) | IFN α-2b | 15MUI 3 veces/semana durante 48 semanas | Respuesta muy llamativa de la EC, manteniéndose tras más de 5 años la paciente en remisión sin necesidad de tratamiento | Numerosos efectos adversos, descritos en el caso clínico | Llamativa respuesta clínica también en la enfermedad perianal |
CU: colitis ulcerosa; EC: enfermedad de Crohn; IFN: interferón; MUI: millones de unidades internacionales.
Ante la manifiesta escasez de evidencia científica disponible, parece prudente una aproximación individualizada ante cada paciente con EC que requiera tratamiento con IFN, valorando de cerca el curso de la EII y de la enfermedad que suscitó el tratamiento con IFN.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.