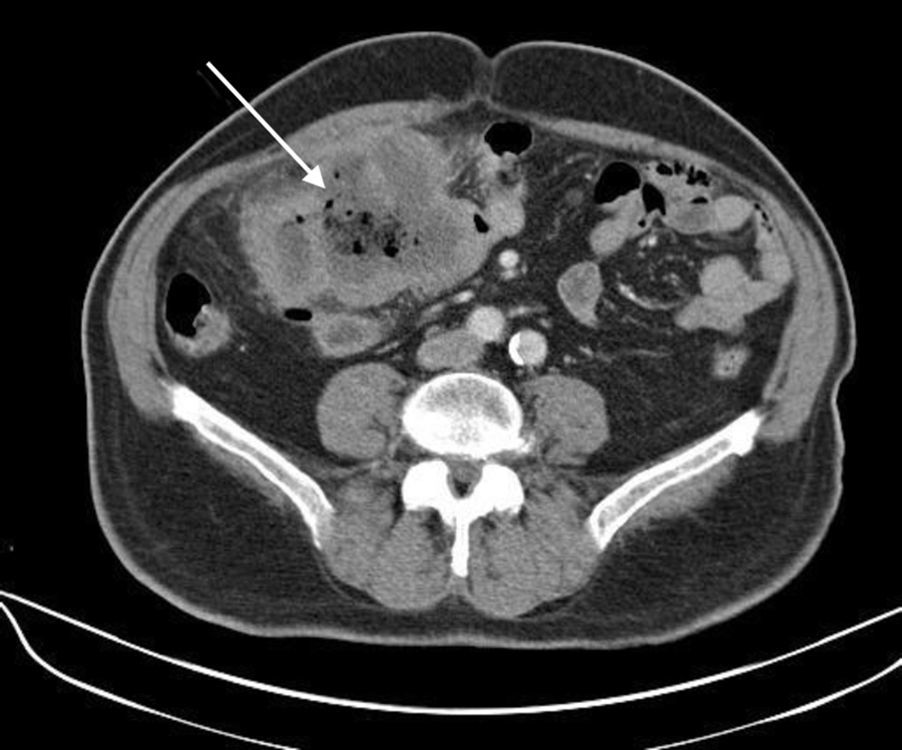
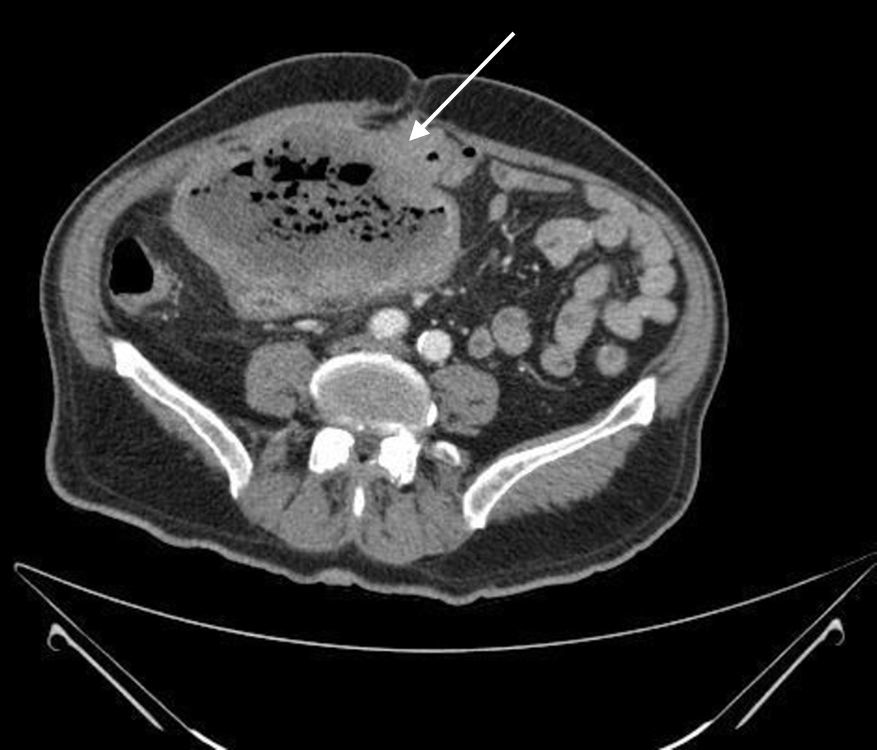
Presentamos el caso de un varón de 78 años de edad, sin antecedentes personales ni familiares de interés y fumador de 5 puros diarios. Es remitido a la consulta de digestivo por presentar un cuadro de un mes de evolución de dolor ocasional en fosa ilíaca derecha, que calma con metamizol, y que no se modifica ni con la deposición ni con la emisión de gases por ano, con ritmo intestinal conservado sin productos patológicos. El paciente presenta buen estado general, destacando únicamente a la exploración empastamiento a nivel de la fosa ilíaca derecha. La analítica sanguínea muestra una discreta leucocitosis con neutrofilia (10.900 leucocitos/mm3 con el 75,4% de neutrófilos), INR de 1,24, fibrinógeno de 734mg/dl (VN: 150-450mg/dl), con el resto de parámetros dentro de la normalidad. Se realizaron radiografías de tórax y abdomen, así como una ecografía, que no mostró hallazgos patológicos. Se decidió completar el estudio mediante una tomografía computarizada (TC) abdominal (fig. 1), en la que se apreció una masa de 8,7×6,7cm con amplias áreas de necrosis a nivel del ángulo hepático del colon, de aspecto tumoral, con adenopatías adyacentes de aspecto patológico. Ante estos hallazgos se realizó una colonoscopia explorando hasta 5cm de íleon terminal. La preparación de la colonoscopia fue aceptable, con restos líquidos y semisólidos aspirables. Se hallaron divertículos, además de un pólipo de 1mm en fondo de ciego, un pólipo de 4mm en colon ascendente y un pólipo pediculado de 1cm en sigma. Los 3 pólipos eran hiperplásicos al estudio histológico, y no se apreció ninguna lesión neoplásica. Los marcadores tumorales analizados fueron normales. Tras la colonoscopia presentó un cuadro sincopal con fiebre y escalofríos. El paciente presentó regular estado general, encontrándose nauseoso y con tendencia a la hipotensión, aunque presentaba una frecuencia cardíaca dentro de los límites normales. El análisis mostró una leucocitosis de 15.000/mm3 con neutrofilia del 86% y anemia Hb: 9,9g/dl. Los hemocultivos extraídos fueron negativos y el paciente, sin requerir valoración por la UCI, fue ingresado en el servicio de digestivo, con tratamiento antibiótico de amplio espectro y fluidoterapia. Se solicitó una nueva TC abdominal (fig. 2), observándose una voluminosa colección (14cm) con contenido líquido y burbujas rodeada de una pared gruesa que realza con el contraste, relacionada con el colon transverso a través de una fístula-perforación gruesa (1,4cm), con desplazamiento de las asas intestinales. El paciente fue valorado por cirugía general, decidiendo intervenir quirúrgicamente de manera urgente. Se halló una gran tumoración que comprometía el ángulo hepático y que infiltraba la pared abdominal y un grupo de 3 asas plegadas sobre sí mismas, en cuyo meso se encontraba un absceso secundario a perforación del colon. El absceso a su vez se comunicaba con asas de intestino delgado. Se resecaron en bloque las asas de delgado con el colon derecho. El paciente precisó tratamiento inotrópico en las 72h tras la intervención por su estado séptico, con buena evolución posterior con tratamiento antibiótico y nutrición parenteral en primera instancia, con posterior buena tolerancia oral. En el estudio histológico de la muestra se observó una neoformación atípica de estirpe mieloide, con células de aspecto blástico e intensa inmunorreactividad de la membrana frente a CD45 e inmunorreactividad granular citoplasmática focal frente a mieloperoxidasa, por lo que el diagnóstico fue de sarcoma mieloide o cloroma. El paciente fue trasladado a hematología, donde se realizó un medulograma que descartó un posible proceso leucémico, siendo dado de alta. Dada la edad y el buen estado general previo del paciente, tras explicar los riesgos y beneficios de un tratamiento sistémico, se decidió mantener una actitud expectante con seguimiento por parte de hematología.
El sarcoma mieloide es un infrecuente tumor maligno formado por células inmaduras de estirpe mieloide, conocido como cloroma por su coloración verde debida a la presencia de mieloperoxidasa en las células malignas1. Pueden presentarse durante la fase activa de la leucemia mieloide aguda o como primer signo de recaída, como primera manifestación de una transformación blástica de un trastorno mieloproliferativo o de un síndrome mielodisplásico o en pacientes sin trastornos hematológicos de base. La mayoría de estos pacientes (88%), si no toleran el tratamiento, desarrollarán una leucemia mieloide aguda en los siguientes 11 meses2,3. Pueden desarrollarse en cualquier localización, siendo las localizaciones más frecuentes los huesos (25%), los ganglios linfáticos (15-25%), la piel (21%) y los tejidos blandos (10%)2–4. La localización intestinal solo supone un 6,5% de los casos3. En el tracto gastrointestinal, el intestino delgado es una localización más frecuente que el colon. La afectación del colon suele asociarse a la ausencia de trastornos hematológicos5–7. La clínica es variada, y depende en gran medida de la localización del tumor. En tumores localizados en el intestino delgado pueden producir cuadros de dolor abdominal recurrente secundarios a crisis suboclusivas; la afectación del estómago, más frecuente en pacientes leucémicos, puede provocar epigastralgia, hemorragia digestiva e incluso perforación; la afectación del colon simula los cuadros debidos al cáncer colorrectal. En todos los casos el aspecto endoscópico puede ser muy variado: puede manifestarse como formaciones polipoideas o masas exofíticas, estenosis de la luz intestinal o ulceraciones de la mucosa intestinal. Las lesiones suelen ser de color rosado o blanco-grisáceo. Por todo ello el diagnóstico es difícil, confundiéndose muchas veces con el linfoma no-Hodgkin y otros tumores pobremente diferenciados8. El diagnóstico se ha facilitado en gran medida con la aparición de las técnicas inmunohistoquímicas. Los sarcomas mieloides se caracterizan por la positividad para CD45, CD43, mieloperoxidasa y lisozima, estas 2 últimas marcadores mieloides9. Además se asocian con la translocación (8;21) y con la inversión del cromosoma 1610.
En aquellos casos sin trastornos hematológicos previos, el diagnóstico certero y temprano es de gran importancia, ya que el tratamiento con quimioterapia sistémica permite un mayor período libre de enfermedad leucémica, así como una mayor supervivencia, por lo que está recomendada una terapia precoz e intensiva siguiendo los protocolos de tratamiento de la leucemia mieloide aguda2. En casos como el que presentamos, con un tumor localizado, debe considerarse la resección de la masa tumoral, mientras que en el caso de enfermedad diseminada, el tratamiento deberá ser sistémico. En la literatura revisada, la resección de la masa tumoral se sigue de un tratamiento sistémico para evitar el posterior desarrollo de un proceso leucémico. Pero hay que tener en cuenta que todos los casos hacen referencia a pacientes de una edad menor a la del paciente de nuestro caso, por lo que se beneficiarían en mayor medida del tratamiento sistémico. Por lo tanto, debe realizarse ante todo un tratamiento individualizado según las características propias del paciente, eligiendo la opción con un mejor balance riesgo-beneficio para el mismo.