El tumor desmoplásico de células redondas pequeñas (TDCRP) es una neoplasia mesenquimal infrecuente y altamente agresiva. Se origina en el peritoneo y, generalmente, se presenta con una afectación intraabdominal difusa y multifocal1. Fue descrito como entidad clinicopatológica propia por primera vez por Gerald y Rosai2 en el año 1989 y, desde entonces, han sido reportados menos de 200 casos, describiéndose, en la mayoría de los trabajos publicados, casos aislados.
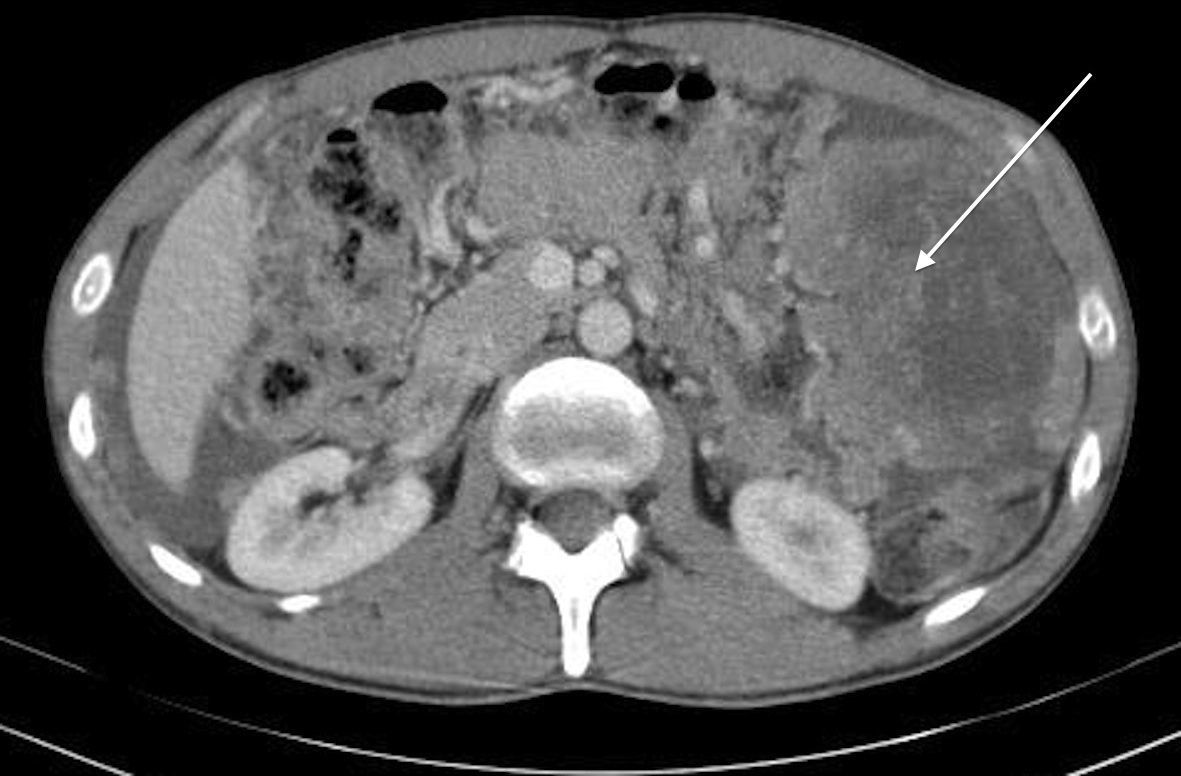
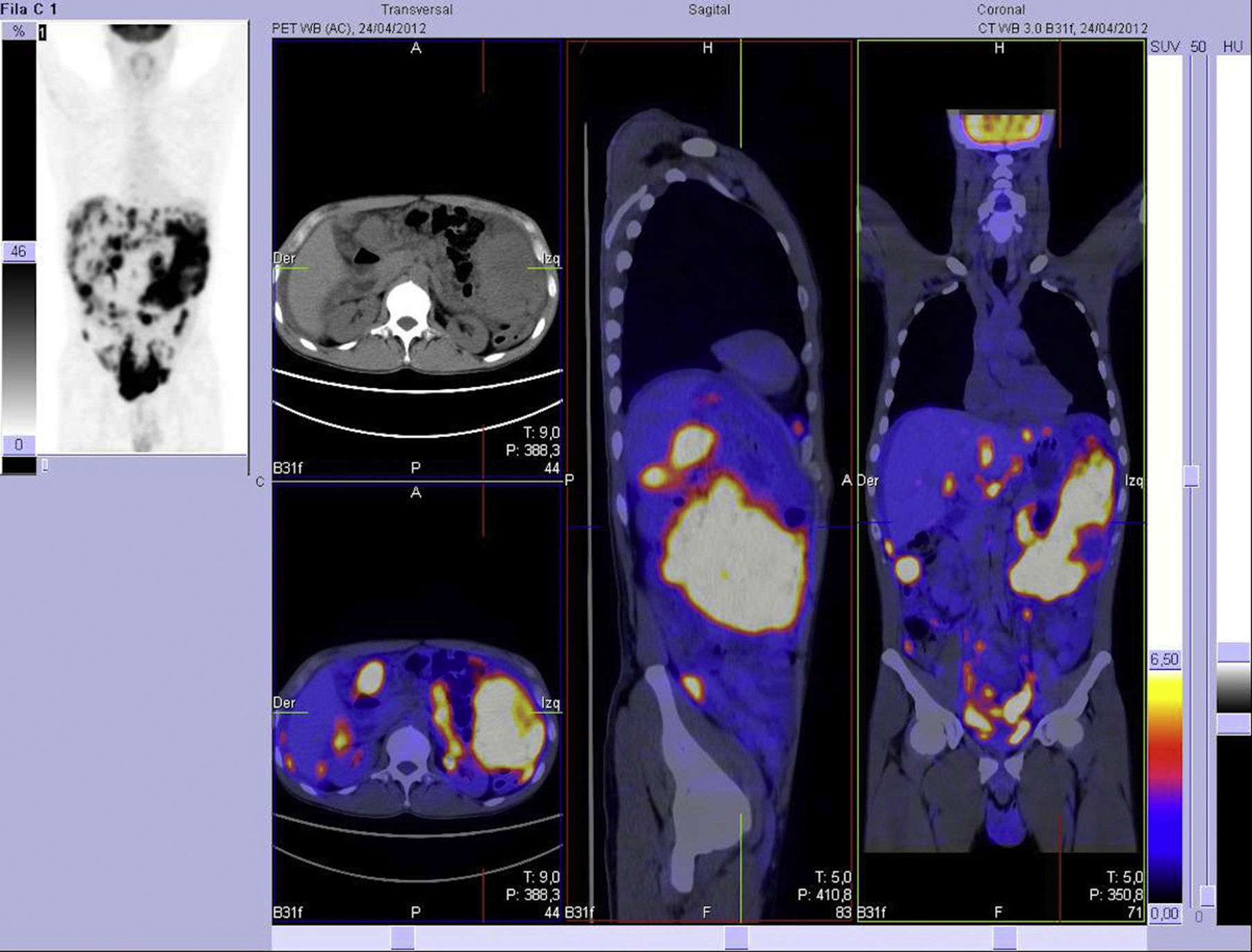
Presentamos el caso de un varón sano de 37 años, que consulta por cuadro inespecífico de dispepsia de 5 meses de evolución, con empeoramiento progresivo, acompañado de proctalgia defecatoria y distensión abdominal. En la exploración abdominal se palpa masa en hipocondrio-flanco izquierdo y presencia de ascitis. La determinación analítica sérica mostró únicamente un CA 125 de 93,09U/ml. Se realiza tomografía axial computarizada (TC) abdomino-pélvica, informando de la presencia de una masa en hipocondrio izquierdo de 13cm en relación con la cola pancreática y el bazo, junto a lesiones peritoneales, compatibles con carcinomatosis peritoneal, LOE hepáticas múltiples y adenopatías de tamaño aumentado en tronco celíaco, paraórticas e ilíacas (fig. 1). Tras presentar el caso en el comité de tumores multidisciplinario y, debido a la existencia de una enfermedad intraabdominal avanzada con posibilidad de extensión extraabdominal de la misma, se indicó la realización, como estudio de extensión, de una tomografía por emisión de positrones que confirmó los hallazgos de la TC abdomino-pélvica previa y descartó la existencia de enfermedad extraabdominal (fig. 2). La biopsia radioguiada aportó el diagnóstico de tumor desmoplásico de células redondas pequeñas, indicando un índice de proliferación Ki67 >50%, sin indicarse otras características inmunohistoquímicas.
Ante el cuadro clínico del paciente, con clínica de distensión abdominal importante secundaria a una suboclusión intestinal provocado probablemente por el tumor, se decide, en este caso, posponer el inicio del tratamiento quimioterápico, que debería ser el primer tratamiento por la extensión del tumor y la agresividad, realizándose en primer lugar la intervención quirúrgica con el objetivo de resolver los cuadros de suboclusión que presenta el paciente e intentar una citorreducción. En el acto operatorio se evidencia la presencia ascitis (3.000cc) y una gran tumoración en hipocondrio izquierdo, englobando el epiplón mayor y el bazo, junto a implantes tumorales distribuidos por todos los cuadrantes abdominales y metástasis hepáticas múltiples bilobales. Se realiza resección de la masa localizada en hipocondrio izquierdo, incluyendo el epiplón, bazo y cola pancreática, junto a varias lesiones metastásicas hepáticas. Distribuidos por la cavidad abdominal, existen implantes tumorales peritoneales, principalmente en la zona pélvica, donde provocan la adherencia de varias asas de intestino delgado, causantes del cuadro de suboclusión intestinal. Se consigue extirpar gran parte de los implantes peritoneales, liberándose las asas intestinales afectadas y solucionándose el problema de suboclusión. El postoperatorio cursa con íleo prolongado y su estancia postoperatoria fue de 23 días.
La anatomía patológica diagnosticó un tumor de células pequeñas redondas azules (hematoxilina-eoxina) con positividad para queratina AE1-AE3, antígeno epitelial de membrana, desmina, WT1, CD99, enolasa específica neuronal y Ki67>50%.
Al paciente se le administró tratamiento oncológico quimioterápico con el esquema VAC/IE (vincristina, adriamicina, ciclofosfamida alternado con ifosfamida y etopóxido). Tras 15 meses de tratamiento quimioterápico y, ante la evidencia radiológica de la no progresión de las metástasis hepáticas ni de la aparición de nueva enfermedad intraabdominal y la existencia de nuevos cuadros clínico de suboclusión intestinal que requieren ingreso hospitalario sin respuesta a tratamiento médico, se planteó nueva intervención quirúrgica con el objetivo de resolver el cuadro de suboclusión intestinal y realizar una cirugía de las metástasis hepáticas. En la intervención se observó, junto a las metástasis hepáticas bilobales ya conocidas, múltiples implantes de pequeño tamaño de predominio pélvico causante de la suboclusión intestinal, sin posibilidad de exéresis quirúrgica. Tras iniciar nuevo tratamiento quimioterápico con trabectedina, el paciente falleció 2 meses más tarde.
El TDCRP es una neoplasia de origen mesenquimal infrecuente que afecta, con mayor frecuencia, a niños y adultos jóvenes, con una edad media de presentación de 22 años y un predominio por el sexo masculino (4:1)1. Pertenece al grupo de tumores de células redondas pequeñas que incluye al rabdomiosarcoma, linfoma no Hodgkin, sarcoma neuroectodérmico primitivo, tumor de Wilms y neuroblastoma2 y afecta difusamente al peritoneo, con participación de órganos abdominales secundariamente, como en nuestro caso. Otras localizaciones, como la pleura, túnica vaginalis, sistema nervioso central, hígado u ovario3, han sido descritas con baja frecuencia. La aparición de metástasis a distancia, principalmente en hígado y pulmón, ocurre tardíamente4.
Los pacientes suelen permanecer asintomáticos en las primeras fases de la enfermedad o presentar síntomas abdominales inespecíficos, como ocurrió en nuestro caso, hasta que la carga tumoral es suficientemente grande para producir sintomatología (dolor abdominal, distensión, estreñimiento o signos de obstrucción intestinal, pérdida de peso o ascitis)1,2,4.
De utilidad en el diagnóstico son la ecografía, la TC y la resonancia nuclear magnética, presentándose como una o varias masas de tejido blando con áreas centrales de necrosis o hemorragia intratumoral, sin identificarse el órgano origen de las lesiones, localizándose en peritoneo, omento mayor, mesenterio o en la zona pélvica perivesical5.
El estudio histológico confirma el diagnóstico, mostrando pequeñas células azules redondas en nidos separados por abundante estroma desmoplásico con la tinción de hematoxilina-eoxina6. En el estudio inmunohistoquímico, existe positividad para marcadores epiteliales (queratina y antígeno epitelial de membrana), marcadores neuronales (enolasa neuronal específica), y marcadores musculares (desmina)6, como mostraba la histología de nuestro caso. El TDCRP se asocia a una alteración cromosómica, la translocación t (11:22) (p13; q12), que involucra a los genes EWSR1 y WT1, alterando la expresión génica y permitiendo el crecimiento tumoral3,4,6,7.
Importante es la estadificación de la enfermedad, permitiendo un correcto manejo y la comparación de diferentes estrategias terapéuticas, aunque actualmente no existe un sistema de clasificación validado para el TDCRP. En un intento de clasificación, recientemente, los investigadores del MD Anderson Cancer Center han sugerido un nuevo sistema basado en la clasificación de la carcinomatosis peritoneal y la presencia de metástasis hepáticas y extraabdominales8.
El manejo terapéutico de los TDCRP sigue siendo un reto con baja eficacia a pesar de los agresivos tratamientos multimodales utilizados. La mediana de supervivencia presenta un rango de 17-25 meses (17 meses en el caso expuesto), con menos del 20% de supervivencia a los 5 años7. La citorreducción quirúrgica agresiva (>90% de la carga tumoral) como pilar de la estrategia terapéutica, junto a la poliquimioterapia, con diferentes esquemas utilizados, representan el tratamiento estándar a partir de principios de 20124,7–9. La mayoría de los estudios publicados recientes indican que el manejo de estos pacientes, principalmente los que presentan una enfermedad avanzada y con alta agresividad, debe iniciarse con el tratamiento quimoterápico, seguido de la cirugía de citorreducción4,7,8. En nuestro caso, a pesar de ser un tumor en un estadio avanzado y con un alto grado de agresividad (Ki67>50%) se optó, en primer lugar, por la cirugía al presentar el paciente clínica de suboclusión intestinal, lo que impedía retrasar dicha cirugía y comenzar con el tratamiento quimioterápico, como hubiera estado indicado. El impacto de nuevas técnicas, como la quimioterapia intraabdominal hipertérmica8 o la radioterapia10, tiene que ser aun claramente definido con nuevos estudios prospectivos aleatorizados, no estando indicados actualmente fuera de ensayos clínicos.