Describir el proceso de creación y desarrollo de la norma de certificación de calidad de la atención farmacéutica a pacientes externos de los servicios de Farmacia.
MétodoLa metodología fue realizada por un grupo de expertos de la Sociedad Española de Farmacia Hospitalaria (SEFH) y constó de tres fases: análisis de situación, desarrollo de la norma y definición de la herramienta de autoevaluación y, por último, pilotaje en varios hospitales, determinando su factibilidad, realizando nueva revisión y readaptación.
Finalmente, se consensuó la definición final del proceso de evaluación externa, el nombre definitivo y el registro de propiedad intelectual.
ResultadosSe definió una norma con 118 requisitos distribuidos en diez ámbitos. De ellos, 19 se consideraron obligatorios, 36 básicos, 40 medios y 23 avanzados. Se establecieron tres niveles de certificación, así como la definición y los porcentajes del cumplimiento de los mismos.
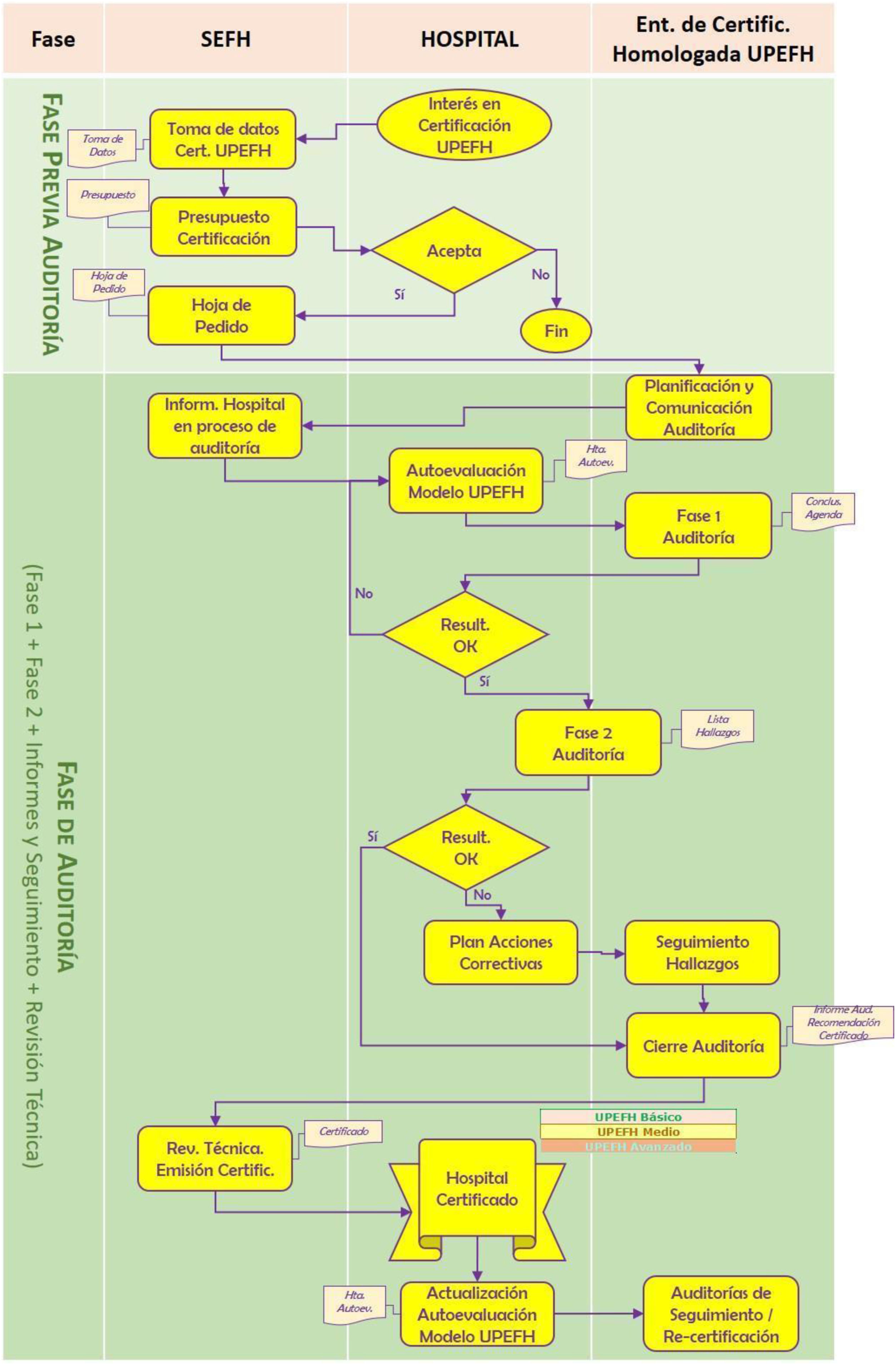
El proceso de certificación se distribuyó en dos etapas, la de preparación previa y la auditoría propiamente dicha donde se abarcaría la certificación inicial, con cuatro fases, las tres primeras lideradas por la entidad de certificación y, la última, por la SEFH y las auditorías posteriores de seguimiento y recertificación.
Dos hospitales realizaron el pilotaje del proceso, obteniendo ambos un nivel básico tras la adopción de medidas y acciones correctivas, tras el cual se consensuó la definición final de la evaluación externa de la norma y su nombre «Q-PEX», así como el registro de su propiedad intelectual en julio del 2020.
ConclusionesLa norma de certificación de la calidad de la atención farmacéutica a pacientes externos desarrollada pretende ayudar al avance continuo de los servicios de Farmacia Hospitalaria.
The objective of this study is to describe the process of creation and development of the quality certification standard for pharmaceutical care for outpatients of the Pharmacy services.
MethodThe methodology was carried out by a group of experts from the Spanish Society of Hospital Pharmacy (SEFH) and consisted of three phases: situation analysis, development of the standard and definition of the self-assessment tool and, finally, piloting in several hospitals, determining its feasibility, carrying out a new revision and readaptation.
ResultsA standard was defined with 118 items distributed in ten areas. Of these, 19 were considered compulsory, 36 basic, 40 medium and 23 advanced. Three levels of certification were established, as well as the definition and percentages of compliance with the requirements.
The certification process was divided into two stages, the one of previous preparation and the audit itself, where the initial certification would be covered, with four phases – first three led by the certification Company, and the last one by SEFH and the subsequent follow-up and re-certification audits.
Two hospitals piloted the process carried out the piloting of the whole process, both obtaining a basic level after the adoption of measures and corrective actions, after which the final definition of the external evaluation of the standard and the name of the standard was agreed upon «Q-PEX», as well as, the registration of the intellectual property of said standard in July-2020.
ConclusionsThe standard for certification of the quality of pharmaceutical care for outpatients developed aims to help the continuous advancement of Hospital Pharmacy services.
La esperanza de vida asociada a la mejora en las condiciones sociales, especialmente las sanitarias y a los avances tecnológicos y terapéuticos, están conllevando un envejecimiento poblacional, así como un incremento de pacientes con enfermedades crónicas1.
Estos cambios han supuesto que, en los últimos años, cobren cada vez mayor relevancia, dentro del ámbito hospitalario, el denominado paciente externo (PE), por el volumen creciente de actividad que implican y las consultas externas de los servicios de Farmacia Hospitalaria (UPEFH), tanto desde el punto de vista de gestión como de estrategia asistencial. El manejo del PE está evolucionando hacia una mayor complejidad clínica exigiendo una mayor especialización por parte de los profesionales2. En los últimos años el número de PE se ha incrementado enormemente, suponiendo la mayor partida presupuestaria en la farmacia hospitalaria (FH). Sin embargo, el número de profesionales que se dedican a esta actividad no ha aumentado proporcionalmente, obligando a rediseñar estrategias asistenciales para no disminuir la calidad asistencial prestada3.
Por otra parte, el paciente ha evolucionado hacia un rol más activo e implicado en sus decisiones terapéuticas4. Actualmente tiene mayor exigencia sobre la calidad asistencial, la accesibilidad y demanda coordinación y continuidad por parte del equipo multidisciplinar y la incorporación de nuevas tecnologías a su seguimiento.
Por ello, resulta indispensable dar respuesta a estos retos, tanto desde la perspectiva de resultados de salud como económicos, para garantizar la sostenibilidad del sistema en un entorno sanitario con una incesante presión sobre los costes. Así, el Ministerio de Sanidad, las Consejerías de Salud de las comunidades autónomas, las sociedades científicas y los hospitales están desarrollando normativas, planes y estrategias en torno a este tema5–9. En esta línea, resulta conveniente, además, establecer normas de decisión, desarrolladas por los propios profesionales basándose en su experiencia y en las evidencias actuales. De esta forma surge un marco de referencia que permite evaluar situaciones similares y actuaciones ante casos semejantes, construyéndose así el entorno de calidad10,11. En este escenario, la certificación externa es el procedimiento mediante el cual un organismo garantiza que un proceso está conforme a los requisitos especificados, aumentando así los niveles de autoexigencia profesional.
En 2015, la Sociedad Española de Farmacia Hospitalaria (SEFH) comenzó a desarrollar el «Mapa Estratégico para la Atención al paciente Externo» (MAPEX)12, cuyo objetivo principal era abrir una línea de trabajo para la mejora de la atención a los PE por parte del farmacéutico especialista en FH, con la idea de reforzar su liderazgo en el manejo farmacoterapéutico y la coordinación asistencial. Tras la realización, en 2016, de la encuesta de situación y la celebración de una conferencia de consenso, la SEFH llevó a cabo un proceso de reflexión interna para abordar las líneas estratégicas del Plan (redefinición del modelo de Atención Farmacéutica [AF], integración en los equipos multidisciplinares, desarrollo de modelos de estratificación e incorporación de nuevas tecnologías para el seguimiento farmacoterapéutico).
Fruto de ello, se acuña el nuevo modelo de AF denominado «CMO: capacidad-motivación-oportunidad», basado en los tres pilares asistenciales identificados como prioritarios en el paciente actual: estratificación asistencial, alcance de objetivos farmacoterapéuticos y utilización de nuevas tecnologías para el seguimiento longitudinal13. Así, en 2019, se publica el documento de consenso sobre AF, proponiéndose una nueva definición para esta actividad profesional14.
El nuevo modelo se concibe en un marco que permita estandarizar los criterios en la práctica asistencial. Se identifica, además, la necesidad de establecer una hoja de ruta que guíe de forma homogénea y ordenada este cambio con el fin de que todos los pacientes y UPEFH puedan beneficiarse, así como el disponer de una herramienta que permita la evolución hacia la mejora continua y la obtención de un mayor nivel de requisitos implantados.
El objetivo de este estudio es describir el proceso de creación y desarrollo de la norma de certificación de calidad de la AF en las UPEFH elaborado por la SEFH.
Material y métodosLa creación de esta norma de certificación tuvo lugar entre febrero-2018 y mayo-2019. Fue desarrollada por un grupo de expertos de diferentes hospitales de España, con diferentes perfiles profesionales dentro de la FH (dirección, normativa, calidad y AF a PE), en el seno de la SEFH.
La metodología constó de tres fases. En la primera se realizó un análisis de situación, incluyendo la identificación de experiencias de éxito y recomendaciones internacionales a través de la búsqueda y análisis sistemático de información, análisis de normativas y estándares de calidad desarrollados en otras sociedades científicas y la extracción de elementos clave de los requisitos de calidad en las instituciones sanitarias.
En la segunda fase el grupo de expertos, en base a la información recopilada y, en función de su experiencia en AF, desarrolló la definición de la norma en la que se describieron los requisitos necesarios para alcanzar los diferentes niveles de calidad, incluyendo recomendaciones para impulsar su integración en las UPEFH a diferentes niveles dentro de su organigrama de trabajo y de su interacción con el entorno sanitario y con el paciente al que atienden. Este desarrollo se hizo en base al ciclo Plan-Do-Check-Act15, el cual se ha utilizado en la mayoría de las normas internacionales de certificación.
En esta fase también se desarrolló una herramienta de autoevaluación respecto a los requisitos definidos, con el fin de que cada UPEFH pudiera testar su situación antes de solicitar la certificación, pudiendo con ello implementar proactivamente las medidas de mejora necesarias.
En la tercera fase se realizó un pilotaje, a través de auditorías realizadas por una consultora independiente en dos hospitales seleccionados en diferentes comunidades autónomas (Andalucía y Comunidad Valenciana). Todo ello, con el fin de analizar su factibilidad, realizar una nueva revisión de la norma y una readaptación tras las experiencias piloto.
Los dos hospitales fueron propuestos por el comité de expertos atendiendo a su representatividad dentro del mapa de UPEFH en nuestro país, debiendo ser hospitales de tercer nivel, con unidades específicas de PE, con dedicación plena de sus profesionales a esta labor y que no pertenecieran a la misma comunidad autónoma, para incorporar normativas sanitarias diferentes. Ninguno de ellos pagó por el desarrollo de este proceso.
En la última fase, tras los dos pilotos realizados y tras las aportaciones de los auditores y auditados, se consensuó la definición final del proceso de autoevaluación externa de la norma, donde se establecieron, de modo definitivo, los requisitos con su descripción y niveles de cumplimiento. Finalmente, se seleccionó, por parte del grupo de expertos, un nombre para la norma y se propuso el registro de la propiedad intelectual tanto de su imagen de marca como del contenido.
ResultadosSe estableció una norma de certificación que definió un conjunto de requisitos clasificados según una tipología atendiendo a su complejidad (tabla 1), planteándose como una norma escalable, con distintos niveles de certificación según el cumplimiento de los mismos y con enfoque acumulativo, siendo necesario cumplir con el criterio de certificación de niveles inferiores para progresar al superior. Se definieron requisitos:
- -
«Obligatorios»: imprescindible cumplir con el 100% de ellos para poder acceder a la certificación.
- -
«Básicos»: sin ser obligatorios también tienen la consideración de ser requisitos que no tengan un especial grado de dificultad en su implantación.
- -
«Medios»: cláusulas que requieren un nivel adicional en cuanto a los aspectos a considerar en el sistema de gestión.
- -
«Avanzados»: los de mayor nivel de dificultad.
Niveles de certificación y porcentajes del cumplimiento de los requisitos en cada uno de los mismos
| Nivel de certificación | Obligatorios | Básicos | Medios | Avanzados |
|---|---|---|---|---|
| Porcentaje de cumplimiento de los requisitos | ||||
| No certificación | <100% | <70% | ||
| Básico | 100% | ≥70% | ||
| Medio | 100% | 100% | ≥70% | |
| Avanzado | 100% | 100% | 100% | ≥80% |
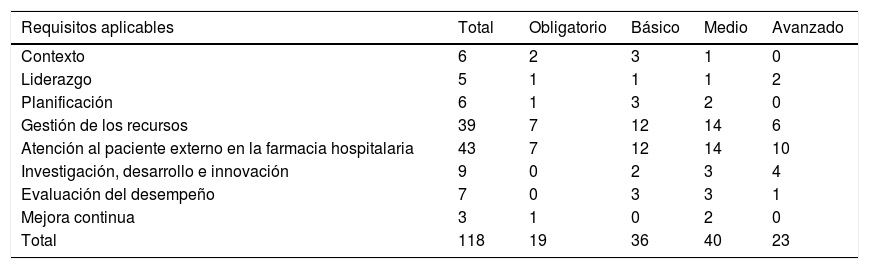
Se definieron 118 requisitos en los siguientes ámbitos (alineado con la Estructura de Alto Nivel de las normas ISO11): contexto, liderazgo, planificación, gestión de los recursos, atención al PE en la FH, investigación, desarrollo e innovación, evaluación del desempeño y mejora. De ellos, 19 se consideraron obligatorios, 36 básicos, 40 medios y 23 avanzados. Además, para adaptar la norma a la particularidad de la actividad de la FH se diferenciaron las siguientes secciones: selección y estratificación, optimización de la validación de la prescripción, AF y seguimiento farmacoterapéutico, dispensación, gestión, investigación, desarrollo e innovación (tabla 2).
Requisitos aplicables en cada uno de los apartados de la norma
| Requisitos aplicables | Total | Obligatorio | Básico | Medio | Avanzado |
|---|---|---|---|---|---|
| Contexto | 6 | 2 | 3 | 1 | 0 |
| Liderazgo | 5 | 1 | 1 | 1 | 2 |
| Planificación | 6 | 1 | 3 | 2 | 0 |
| Gestión de los recursos | 39 | 7 | 12 | 14 | 6 |
| Atención al paciente externo en la farmacia hospitalaria | 43 | 7 | 12 | 14 | 10 |
| Investigación, desarrollo e innovación | 9 | 0 | 2 | 3 | 4 |
| Evaluación del desempeño | 7 | 0 | 3 | 3 | 1 |
| Mejora continua | 3 | 1 | 0 | 2 | 0 |
| Total | 118 | 19 | 36 | 40 | 23 |
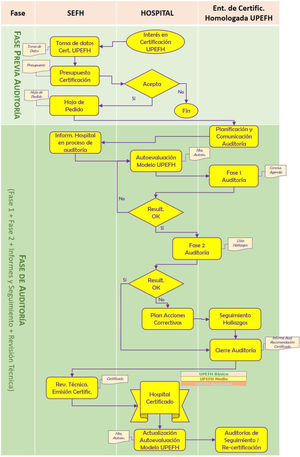
El proceso de certificación se distribuyó en dos etapas (fig. 1). La etapa previa a la auditoría recogería tanto las actividades de implantación interna, por parte del hospital, como la de preparación externa. Se estableció que la decisión por parte de un centro de acceder a la certificación debía ser una decisión estratégica por parte de la alta dirección, no pudiendo ser solicitada de manera unilateral por un servicio de Farmacia sin el consentimiento, aprobación y solicitud directa de su dirección. A partir de ahí, el hospital comunicaría el interés por la certificación a la SEFH. Para ello se consideró obligatorio cumplimentar un formulario con los datos necesarios: descriptivos del hospital, responsables del proyecto, actividad y fecha tentativa para la auditoría teniendo en consideración que la norma no incorpora requisitos que pudiesen ser excluyentes en base a la actividad que desarrollara y describiera la FH solicitante.
La etapa de auditoría propiamente dicha abarcaría la certificación inicial y las auditorías posteriores (de seguimiento y recertificación).
La auditoría inicial constaría, a su vez, de cuatro fases: fase uno o revisión preliminar, fase dos o auditoría in situ, la tercera de resolución de hallazgos y generación de informes (incluyendo la recomendación de la certificación) y, la cuarta, de revisión técnica y emisión del certificado. Las tres primeras las lideraría directamente la entidad de certificación (EC), mientras que la última sería competencia de la SEFH.
En la fase uno de revisión preliminar se consideró prioritario la realización previa de una «autoevaluación» del modelo, utilizando la herramienta proporcionada por la SEFH. El resultado de esta se compartió con la EC, sirviendo de elemento principal de análisis, permitiendo asimismo que la EC se familiarizara con la FH objeto de la auditoría.
En la fase dos o de (auditoría in situ) se seguiría el plan de trabajo previamente definido, acordado entre la EC y el hospital con el objetivo de identificar las evidencias de conformidad con los requisitos del modelo empleando técnicas como son: observación directa, entrevistas a profesionales sanitarios y acceso a información documentada.
A continuación, se determinó la resolución de hallazgos y la emisión de un informe en el que se podían identificar las siguientes situaciones:
- -
No conformidad: evidencia de no cumplimiento de un requisito aplicable.
- -
Observación: relacionado con incumplimientos potenciales o requisitos aplicables distintos de los obligatorios que no se cumplan.
- -
Oportunidad de mejora: aspecto del sistema de gestión de PE evaluado que puede ser mejorado de forma objetiva, no siendo una desviación ni actual ni futura respecto al requisito y criterio de cumplimiento.
- -
Punto fuerte: aspecto positivo que merece ser destacado especialmente.
Como consecuencia de la auditoría, eventualmente se podrían identificar hallazgos tipificados como «no conformidades» que debían resolverse para la obtención del certificado lo cual implicaría realizar las siguientes actuaciones: análisis de causa raíz que había motivado el incumplimiento y/o el establecimiento de la acción reparadora inmediata y correctiva que asegurara que se estaba actuando sobre la causa de desviación.
En esta fase se revisaría la adecuación del análisis y la acción correctiva asociada a cada no conformidad identificada. No se precisarían evidencias del cierre efectivo de la no conformidad por parte del hospital (este aspecto se tendría en cuenta en las auditorías de seguimiento posteriores). El entregable de esta fase sería un informe con el resumen de los hallazgos (con la correspondiente aceptación de no conformidades identificadas) y la conclusión de la EC sobre la recomendación del certificado.
En la fase de revisión técnica y emisión del certificado, una vez recibido por parte de la EC el correspondiente informe de auditoría, la SEFH procedería a realizar la revisión técnica del expediente y, con su correspondiente conclusión favorable, a emitir el certificado con el nivel logrado con fecha de la realización de la revisión técnica de resultado favorable y una validez de 3 años.
Se consensuó que, al tratarse de una norma de excelencia de calidad de la FH, si esta ya contaba con una certificación de Sistema de Gestión de Calidad basada en normas ISO, se promovería la integración práctica del modelo en el sistema de gestión de calidad implantado. Así, el proceso de auditoría de certificación podría abordarse de forma integrada, aprovechando las sinergias existentes entre el modelo UPEFH y la norma ISO-9001. Para ello, se consensuó que debían darse las siguientes condiciones:
La FH-Hospital debe contar con un certificado acreditado vigente ISO 9001 que incluya en su alcance la prestación de servicios de FH.
La auditoría de certificación debe ser coincidente en el tiempo con la auditoría de certificación ISO-9001.
La EC debe contar con la debida acreditación tanto para ISO-9001 como para la norma de UPEFH.
El equipo auditor implicado en la auditoría debe ser competente y cualificado tanto para ISO-9001 como la norma de UPEFH.
Si estas cuatro condiciones se reunían, se establecía una reducción de tiempos de auditoría al realizar conjuntamente ISO-9001+UPEFH.
Por último, se consensuó que el ciclo de certificación se constituyera por un periodo de 3 años. Pero para mantener la vigencia del certificado, el hospital debía pasar de forma satisfactoria una auditoría de seguimiento de forma «remota» no más tarde de los 18 meses desde la auditoría inicial.
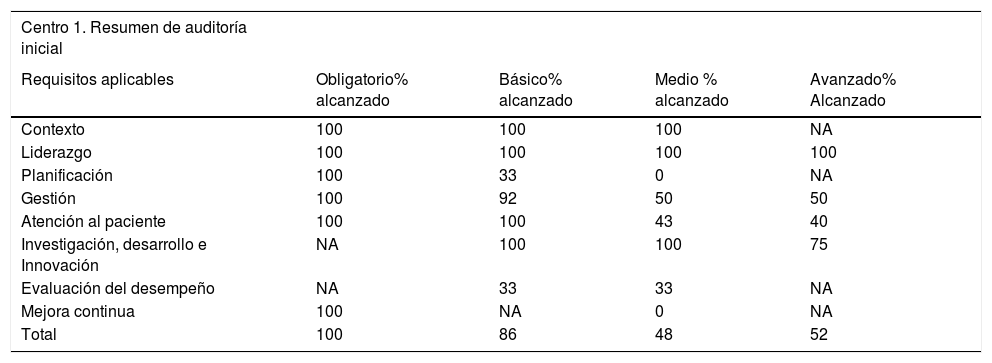
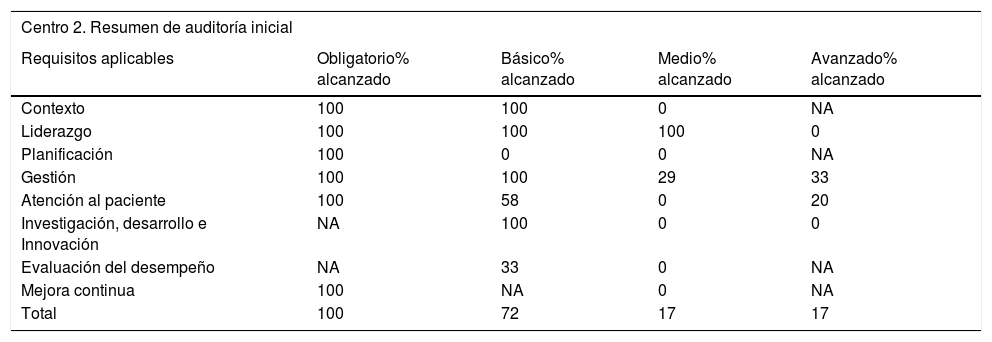
Para poder realizar el pilotaje de todo el proceso de la norma, se estableció que dos hospitales generales de especialidades y universitarios de diferentes comunidades autónomas pasaran el proceso de certificación, con los pasos descritos previamente. Los resultados, puntuaciones obtenidas y resumen de medidas y acciones correctivas a llevar a cabo para ambos centros se incluyen en las tablas 3 y 4. El resultado final fue la obtención de un nivel de certificación básico en ambas UPEFH.
Resultados, puntuaciones obtenidas y resumen de medidas y acciones correctivas a llevar en el centro 1 participante en el pilotaje
| Centro 1. Resumen de auditoría inicial | ||||
|---|---|---|---|---|
| Requisitos aplicables | Obligatorio% alcanzado | Básico% alcanzado | Medio % alcanzado | Avanzado% Alcanzado |
| Contexto | 100 | 100 | 100 | NA |
| Liderazgo | 100 | 100 | 100 | 100 |
| Planificación | 100 | 33 | 0 | NA |
| Gestión | 100 | 92 | 50 | 50 |
| Atención al paciente | 100 | 100 | 43 | 40 |
| Investigación, desarrollo e Innovación | NA | 100 | 100 | 75 |
| Evaluación del desempeño | NA | 33 | 33 | NA |
| Mejora continua | 100 | NA | 0 | NA |
| Total | 100 | 86 | 48 | 52 |
| Centro 1. Resumen de la descripción de hallazgos | |
|---|---|
| PF=2 | -Niveles de integración multidisciplinar-Página web propia |
| OM=5 | -Diagrama de procesos visual-Incluir en documentos «fuentes de información»-Temáticas a tratar con asociaciones de pacientes-Incluir a personal suplente-Extender protocolo quejas, reclamaciones y sugerencias |
| OBS=9 | -Fechas de creación de protocolos-Definición de objetivos-Responsables de cumplimiento de objetivos-Evaluación carga asistencial-Identificar áreas de sala de espera-Unificación de formatos en protocolos y documentos-Seguimiento del cumplimiento indicadores-Indicadores para medir impacto en calidad-Objetivos de indicadores medidos |
| NC=1 | -No verificación de termómetros de las neveras |
NA: no aplicable; NC: no conformidad; OBS: observación; OM: oportunidad de mejora; PF: punto fuerte.
Resultados, puntuaciones obtenidas y resumen de medidas y acciones correctivas a llevar en el centro 2 participante en el pilotaje
| Centro 2. Resumen de auditoría inicial | ||||
|---|---|---|---|---|
| Requisitos aplicables | Obligatorio% alcanzado | Básico% alcanzado | Medio% alcanzado | Avanzado% alcanzado |
| Contexto | 100 | 100 | 0 | NA |
| Liderazgo | 100 | 100 | 100 | 0 |
| Planificación | 100 | 0 | 0 | NA |
| Gestión | 100 | 100 | 29 | 33 |
| Atención al paciente | 100 | 58 | 0 | 20 |
| Investigación, desarrollo e Innovación | NA | 100 | 0 | 0 |
| Evaluación del desempeño | NA | 33 | 0 | NA |
| Mejora continua | 100 | NA | 0 | NA |
| Total | 100 | 72 | 17 | 17 |
| Centro 2. Resumen de la descripción de hallazgos | |
|---|---|
| PF=4 | -Contexto actividades en consultas externas-Objetivos estratégicos de la unidad-Herramienta de comunicación con pacientes-ciudadanos-Entrevista motivacional como herramienta de trabajo |
| OM=4 | -Unificación mapa de procesos-Funciones y responsabilidades del personal-Protocolo de comunicación con pacientes-Control de caducidades en gestión de medicación |
| OBS=6 | -Plan de formación individual-Desarrollo actividades consultas-Registro de incidencias-Acceso a consultas externas-Establecimiento objetivos anuales-Planificación y despliegue objetivos |
| NC=5 | -Sistema de llamada a pacientes no confidencial-Procedimiento de validación de prescripciones-Protocolos pendientes de actualizar-Protocolo dispensación según tipología y nivel pacientes-Procedimiento quejas, reclamaciones y sugerencias |
NA: no aplicable; NC: no conformidad; OBS: observación; OM: oportunidad de mejora; PF: punto fuerte.
Finalmente, analizada su factibilidad, realizada una nueva versión y readaptación de la norma en base a las observaciones realizadas tras las auditorías piloto, se consensuó la definición final del proceso de evaluación externa de la norma, así como el nombre elegido para la misma, que fue «Q-PEX» y se procedió al registro de su propiedad intelectual en julio-2020.
DiscusiónEsta es la primera norma que, entre las diferentes sociedades científicas del ámbito farmacéutico especializado, se ha desarrollado para su implantación y ejecución real en las UPEFH, surgiendo como fruto del trabajo desarrollado en el proyecto MAPEX-SEFH.
La necesidad de reorientar los sistemas para dar una prestación asistencial que se ajuste a las necesidades de los pacientes, permitiendo preservar la sostenibilidad, lleva a la necesidad de transformar el modelo, particularmente, la AF. Esto implica una nueva visión profesional en gestión y asistencia16. Se presenta como una oportunidad para la FH de replantearse qué rol quiere desempeñar, cuáles son sus áreas de mejora y qué retos ha de superar para afrontar con éxito el cambio. El principal elemento de esta transformación es disponer de un modelo de AF centrado en el paciente, como palanca de cambio para cumplir con sus expectativas, del sistema sanitario y los profesionales, en contraposición a la atención centrada en el medicamento. Este nuevo modelo se ha desarrollado y adaptado a diferentes tipologías de entre las más prevalentes en UPEFH y sigue su desarrollo y expansión, en asistencia, docencia e investigación17–21. Ambos aspectos, gestión y atención directa a paciente, dada su importancia y trascendencia presente y futura para la profesión, han sido recogidos en la norma y ponderados con casi dos tercios de los requisitos aplicables, incluyendo la mayoría de los obligatorios.
La norma Q-PEX sitúa a la FH como nexo entre los integrantes del equipo multidisciplinar, como responsable de la validación integral de la farmacoterapia prescrita y ejerciendo un liderazgo asistencial con intervenciones específicas para cada paciente y momento. De esta manera la norma pretende contribuir a minimizar la variabilidad asistencial. En la misma línea que otras sociedades que se están orientando hacia la excelencia y han desarrollado sus propias normas22–24. Asimismo, se ha establecido un enfoque asistencial alineado con otros marcos de referencia internacional en calidad asistencial como ISO11 o EFQM25, donde se promueve la participación, el liderazgo, la autoevaluación y la implicación del alto nivel de dirección.
Se impulsa, además, la asistencia basada en la evidencia, ya que irá incorporando las mejores prácticas publicadas en el entorno. Se fomenta, también, la cultura del compromiso con el cumplimiento de objetivos farmacoterapéuticos, para lo cual será fundamental desarrollar plataformas para optimizar el seguimiento de los pacientes26–28. Aquel hospital que aplique sistemas de evaluación de resultados en salud, mediante indicadores clínicos que ayuden a medir el resultado de las actuaciones en el ámbito farmacéutico, estará más cerca de los niveles avanzados de certificación.
Por otra parte, la necesidad de una atención orientada a las necesidades individuales de los pacientes, que vaya más allá de la farmacoterapia prescrita, se ha incorporado en la norma mediante los requisitos sobre los modelos de estratificación, que se han ido desarrollando en diferentes tipologías de pacientes en los últimos años. Así, la norma establece que cuanto mayor número de sujetos estratificados, mayor probabilidad de obtener niveles superiores en la certificación.
La demanda de asistencia en tiempo útil del nuevo perfil de paciente ha sido incluida con requisitos específicos sobre las nuevas tecnologías. Así se contribuye a garantizar una atención accesible. Se plantea también la incorporación y/o redefinición de circuitos entre los servicios asistenciales para reducir desplazamientos y fomentar la coordinación y continuidad asistencial que garantice la integración de procesos y la responsabilidad compartida de prestar una atención integral y continuada. De esta manera servirá, también, para que las unidades se apoyen en una planificación estratégica, analice indicadores de seguimiento que permitan una continua reflexión para la anticipación a los retos del entorno, además de ayudar a los hospitales, que cada vez tendrán mayor intensidad tecnológica y un carácter dual, con actividad presencial y telemática28.
Esta norma permite contribuir, desde la perspectiva y ámbito de actuación de una sociedad científica, a las demandas existentes de un marco regulador específico del procedimiento para la prestación farmacéutica al PE, así como en la protocolización de la AF presencial y no presencial (telefarmacia) y acercamiento de la medicación29.
La principal limitación ha sido que, dado que la norma es pionera, muchos de los requisitos y su cumplimiento se han determinado por consenso de expertos, al no haber posibilidad de comparación. La norma, no obstante, se ha elaborado valorando el equilibrio entre el esfuerzo que supone las mejoras a implantar localmente para obtener la certificación y los beneficios en cuanto a calidad, resultados en salud y satisfacción expresados por los pacientes. Se contempla, además, como una norma viva, planteando futuras adaptaciones por las circunstancias del entorno. Por otra parte, pese a la limitación en cuanto al número de hospitales que han realizado el proceso de certificación, su caracterización, ya que ambos son de tamaño y áreas asistenciales representativas, muestran perfectamente la situación actual de la atención al PE en España.
Futuros proyectos de investigación permitirán conocer los resultados en el avance de la satisfacción y experiencia del paciente antes y después de obtener la certificación en los centros auditados. En esta línea de actuación, aunque la norma se ha desarrollado en España, incluye requisitos y aspectos de atención extensibles a otros países, por lo que futuras investigaciones permitirán conocer el grado de expansión de la misma.
ConclusionesLa norma de certificación desarrollada identifica y define un gran número de requisitos a alcanzar, lo que permitirá el avance reglado de todas las UPEFH hacia una mejora en la calidad global del proceso asistencial y la obtención de los mejores resultados en la atención a los PE.
FinanciaciónEl presente proyecto ha sido realizado gracias a fondos propios de la Sociedad Española de Farmacia Hospitalaria.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
A todos los participantes en el desarrollo del proyecto MAPEX-SEFH. A la consultora DNVGL por su apoyo metodológico en el proyecto.