Analizar los resultados de la implantación de un protocolo de abordaje ambulatorio del paciente pediátrico con enfermedad tuberculosa y compararlo con el manejo previo.
Material y métodosSe estudiaron todos los pacientes menores de 14 años diagnosticados de enfermedad tuberculosa en Cantabria entre los años 2005 y 2014. Hasta el año 2010 todos los pacientes ingresaban para la recogida de aspirados gástricos e inicio de tratamiento (periodo preimplantación). A partir del año 2010 se instauró un protocolo para el manejo ambulatorio, ingresando únicamente por motivos clínicos o sociales (periodo postimplantación).
ResultadosSe estudiaron 82 pacientes: 29 del grupo preimplantación y 53 post implantación. Se ingresaron sistemáticamente todos los pacientes del grupo preimplantación frente al 26,4% del postimplantación (p<0,001) La estancia media fue inferior en el grupo postimplantación (3,4±11,5 días vs. 7,3±7,1 días p<0,0001). Solo en el 6,9% de los pacientes del primer grupo se extrajeron las 3 muestras microbiológicas recomendadas en las guías para el diagnóstico, frente al 73,5% del segundo grupo (p<0,001). El 26,6% de los cultivos realizados fue positivo a Mycobacterium tuberculosis: 37,5% del grupo preimplantación y 21,6% del postimplantación (p=0,121). En otros parámetros relativos al tratamiento como: adherencia terapéutica, pautas de tratamiento no ajustadas a las guías, abandono y recaídas no se detectaron diferencias significativas.
DiscusiónAunque en las guías se recomienda la extracción de 3 muestras para cultivo microbiológico no se detectó incremento del aislamiento microbiológico en los pacientes a los que se extrajeron mayor número de muestras respiratorias. El manejo en consultas hospitalarias de los pacientes con sospecha de tuberculosis, cuya situación clínica lo permite, presenta resultados clínicos y microbiológicos similares o mejores al manejo previo, con menor tasa de ingreso hospitalario y con el consiguiente ahorro de costes.
To assess the results of the implementation of a protocol for the outpatient management of paediatric patients with tuberculosis, and to compare it with the previous approach.
Material and methodsAll patients younger than 14 years of age diagnosed with tuberculosis in Cantabria between 2005 and 2014 were included in the study. The pre-implementation period included patients admitted for gastric aspirate collection and to start treatment until 2010 (Pre-group). The post-implementation period was from 2010 onwards, using a protocol established for the outpatient management of these patients, with admission only being for clinical or social reasons, post-implantation period (Post-group).
ResultsA total of 82 patients were studied: 29 from the Pre-group and 53 from Post-group. The median age was 61 months (IQR 32.5-97.75). All patients in the Pre-group were systematically admitted, compared to 26.4% of the Post-group (P<.001). The mean hospital stay was higher (7.27±7.1 days) in the Pre-group than in Post-group (3.4±11.46 days) (P<.0001). Only in 6.9% of patients from Pre-group were the 3 microbiological samples recommended for diagnosis following the international guidelines were provided, whereas they were provided by 73.58% patients from Post-group (P<.001). Of the cultures performed, 26.6% were positive for Mycobacterium tuberculosis, 37.5% of the Pre-group and 21.6% of the Post-group (P=.121). No significant differences were observed between the groups in other parameters related to treatment such as, therapeutic adherence, treatment not adjusted to the guidelines, treatment withdrawal or relapse..
DiscussionAlthough guidelines recommend three microbiological samples for culture, no superior microbiological isolation was detected despite the increased number of samples collected. The management in hospital clinics of patients with suspected tuberculosis with stable clinical situation show similar or better clinical and microbiological results to the previous management, with lower hospital admission rate and with the subsequent cost savings.
La tuberculosis es una enfermedad infecciosa que causa una elevada mortalidad en la edad pediátrica, fundamentalmente en los países en vías de desarrollo1,2. Constituye la segunda causa de muerte en el mundo por enfermedad infecciosa después del VIH3.
Las recomendaciones sobre el manejo de la enfermedad tuberculosa (ET) durante la edad pediátrica son similares a las establecidas en los adultos4, aunque existen diferencias tanto en las técnicas diagnósticas utilizadas como en el enfoque terapéutico. En la infancia es mayor la dificultad para obtener muestras microbiológicas para cultivo y confirmar así el diagnóstico. Resulta también más difícil administrar las dosis adecuadas de medicación y conseguir los niveles plasmáticos para que el tratamiento sea eficaz, evitando posibles efectos tóxicos5.
En nuestro medio los pacientes pediátricos con ET suelen ingresar, independientemente de su situación clínica, para recogida de muestras microbiológicas mediante aspirado gástrico e instauración del tratamiento tuberculostático. El ingreso se recomienda porque el aspirado gástrico es un procedimiento invasivo que requiere ser realizado por personal experimentado. Además, algunos autores defienden su realización inmediatamente después del despertar para mejorar el rendimiento6. La hospitalización del paciente permite también instaurar el tratamiento tuberculostático y comprobar la tolerancia mejorando la adherencia. No hay evidencias concluyentes que muestren que el abordaje hospitalario sea claramente superior al ambulatorio7 aunque sí se ha constatado la existencia de un mayor riesgo de transmisión intrahospitalaria de la infección8, así como una mayor repercusión socioeconómica sobre las familias9.
El objetivo de este estudio es analizar los resultados de la implantación de un protocolo de abordaje ambulatorio del paciente pediátrico con ET cuya situación clínica lo permita y compararlo con el manejo previo.
Material y métodosDesarrollo del protocoloEn el año 2010 se implantó en Cantabria un protocolo de manejo clínico del paciente menor de 14 años con sospecha de ET basado en las recomendaciones de la Sociedad Española de Infectología Pediátrica (SEIP). Se adaptó en todo a las recomendaciones de la SEIP, excepto en 2 incorporaciones: se realizaron controles de transaminasas durante el seguimiento y se utilizó la ecografía mediastínica como método de apoyo diagnóstico. El objetivo fundamental era abordar el tratamiento de estos pacientes de forma ambulatoria, pero centralizando su seguimiento en las consultas de infectología y neumología pediátrica puesto que, en ocasiones, el seguimiento se realizaba en atención primaria.
Desde la implantación del protocolo la extracción de los aspirados gástricos, así como la instauración y monitorización del tratamiento pasó a realizarse de forma ambulatoria, excepto en aquellos casos en que fuera necesario el ingreso por motivos clínicos o sociales. Se consideraron motivos clínicos de ingreso: paciente inestable, afectación del estado general o falta de tolerancia de la medicación y motivos sociales: incapacidad para administrar la medicación o dudas sobre su cumplimiento. Además, en este protocolo se inició la pauta de tratamiento tuberculostático con 4 fármacos, en lugar de 3, en los casos en los que se desconocía la sensibilidad del caso índice.
Diseño del estudioSe realizó un estudio descriptivo retrospectivo en el Hospital Universitario Marqués de Valdecilla de Cantabria, a partir de los datos administrativos y la información de las historias clínicas. La cohorte estudiada comprendía todos los pacientes menores de 14 años con ET valorados entre el 1 de enero de 2005 y el 31 de diciembre de 2014.
La población a estudio se dividió en 2 grupos: el primero pacientes evaluados durante los años 2005 a 2009 (grupo preimplantación del protocolo). El segundo incluyó los evaluados durante los años 2010 a 2014 (grupo postimplantación).
Variables analizadasPara evaluar los resultados de la implantación del protocolo se analizaron, en primer lugar, las variables relacionadas con los principales cambios instaurados: número y características de ingresos hospitalarios y, por otro lado, pautas terapéuticas administradas.
En segundo lugar se analizaron los resultados microbiológicos en ambos periodos: número de muestras extraídas y cultivos positivos a Mycobacterium tuberculosis (MT).
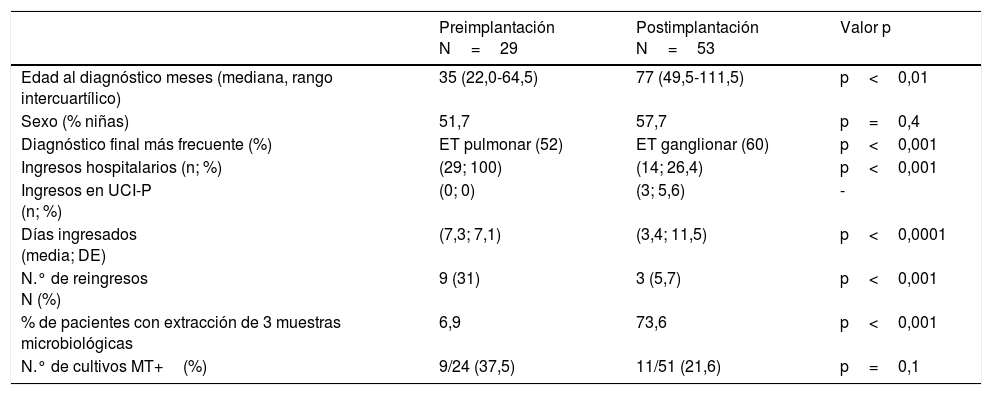
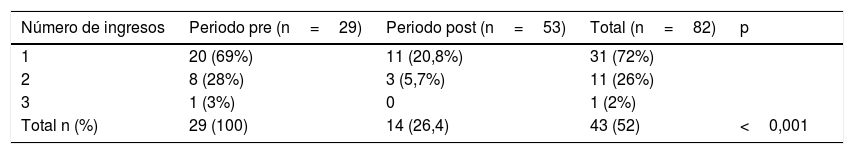
Las variables demográficas, de diagnóstico y microbiológicas se resumen en la tabla 1, los datos relativos a la hospitalización se describen en la tabla 2 y los datos de tratamiento farmacológico se detallan en la tabla 3.
Comparación de los datos demográficos, diagnósticos y microbiológicos entre los grupos de pacientes diagnosticados de enfermedad tuberculosa pre y postimplantación del protocolo
| Preimplantación N=29 | Postimplantación N=53 | Valor p | |
|---|---|---|---|
| Edad al diagnóstico meses (mediana, rango intercuartílico) | 35 (22,0-64,5) | 77 (49,5-111,5) | p<0,01 |
| Sexo (% niñas) | 51,7 | 57,7 | p=0,4 |
| Diagnóstico final más frecuente (%) | ET pulmonar (52) | ET ganglionar (60) | p<0,001 |
| Ingresos hospitalarios (n; %) | (29; 100) | (14; 26,4) | p<0,001 |
| Ingresos en UCI-P (n; %) | (0; 0) | (3; 5,6) | - |
| Días ingresados (media; DE) | (7,3; 7,1) | (3,4; 11,5) | p<0,0001 |
| N.° de reingresos N (%) | 9 (31) | 3 (5,7) | p<0,001 |
| % de pacientes con extracción de 3 muestras microbiológicas | 6,9 | 73,6 | p<0,001 |
| N.° de cultivos MT+(%) | 9/24 (37,5) | 11/51 (21,6) | p=0,1 |
DE: desviación estándar; ET: enfermedad tuberculosa; MT+: Mycobacterium tuberculosis positivo; UCI-P: unidad de cuidados intensivos pediátricos.
Número de ingresos hospitalarios de los pacientes diagnosticados de enfermedad tuberculosa durante los periodos pre y postimplantación del protocolo
| Número de ingresos | Periodo pre (n=29) | Periodo post (n=53) | Total (n=82) | p |
|---|---|---|---|---|
| 1 | 20 (69%) | 11 (20,8%) | 31 (72%) | |
| 2 | 8 (28%) | 3 (5,7%) | 11 (26%) | |
| 3 | 1 (3%) | 0 | 1 (2%) | |
| Total n (%) | 29 (100) | 14 (26,4) | 43 (52) | <0,001 |
Comparación de las variables relacionadas con el tratamiento tuberculostático entre los pacientes del periodos pre y postimplantación del protocolo
| Periodo preimplantación | Periodo postimplantación | Total | Valor p | |
|---|---|---|---|---|
| Inicio de tratamiento con 4 fármacos | 1 | 27 | 28 | <0,001 |
| Pautas no ajustadas a las guías | 4 | 1 | 5 | 0,04 |
| Abandono del tratamiento | 1 | 1 | 2 | pNS |
| Recaídas | 2 | 2 | 4 | pNS |
pNS: p no significativa.
Se realizó el test de Kolmogorov-Smirnof para evaluar si las variables cuantitativas se ajustaban a una distribución normal, y se aplicaron los test correspondientes en las comparaciones: «t» de Student y U de Mann-Whitney.
Los valores de las variables cuantitativas aparecen como media y desviación estándar o medianas con el rango intercuartílico para variables paramétricas y no paramétricas respectivamente. Se utilizó el test Chi-cuadrado y la prueba exacta de Fisher para evaluar las relaciones entre variables cualitativas. Todos los análisis estadísticos se efectuaron con el programa SPSS versión 20.0 para Mac (SPSS Inc, Chicago, Illinois).
ResultadosEntre los años 2005 a 2014 se evaluaron 82 pacientes con ET, 29 del periodo preimplantación y 53 del periodo postimplantación. Aunque no se encontraron diferencias significativas en la distribución por sexos entre ambos grupos (p=0,67) la edad de los pacientes fue significativamente inferior en el grupo preimplantación (p=0,0043).
El diagnóstico final de los pacientes estudiados fue de ET ganglionar intratorácica en el 40% de los casos, ET pulmonar en el 24%, ET extrapulmonar en el 21% y en el 15% presentaron TBC con afectación pulmonar y ganglionar. El diagnóstico final más frecuente en el grupo preimplantación fue el de ET pulmonar (52%), mientras que en el postimplantación fue ET ganglionar (60%) (p<0,001) (tabla 1).
Comparación del número y tipo de ingresos en ambos periodosTras la implantación del protocolo se redujeron de manera significativa el número de ingresos y de la estancia media hospitalaria pasando de ser 7,3±7,1 días en el pre-implantación a una media de 3,4±11,5 (p<0,0001) en el post-implantación. No se registraron ingresos en la Unidad de Cuidados intensivos Pediátricos en el primer periodo pero sí en el segundo. Los pacientes ingresados en esta unidad lo hicieron en el momento del diagnóstico. El número de reingresos en cada periodos se describe en la tabla 2.
Análisis del tratamiento farmacológico en ambos periodosEn los dos grupos predominó la pauta de tres fármacos frente a la de cuatro aunque en el grupo post-implantación 27 pacientes iniciaron pauta con 4 fármacos hasta conocer la sensibilidad del caso índice en que se redujo a 3 por ser todas las cepas sensibles a los fármacos tuberculostáticos de primera línea (tabla 3).
No hubo diferencias significativas en ambos grupos en relación a abandono de tratamiento ni en las recaídas pero sí se detectaron menos número de pautas ajustadas a las guías en el periodo pre-implantación. Tampoco se observaron efectos secundarios graves en ningún paciente que recibió tratamiento con estos fármacos.
Análisis del diagnóstico microbiológico en ambos periodosSe analizó el número de muestras extraídas en cada paciente para el estudio microbiológico en cada uno de los grupos. El número de muestras extraídas por paciente en el grupo postimplantación fue significativamente mayor que en el grupo preimplantación. Aunque en las guías se recomienda la extracción de 3 muestras microbiológicas para mejorar el rendimiento, solo en el 6,9% de los pacientes del periodo preimplantación se les extrajeron 3 muestras frente a un 73,5% del periodo postimplantación (tabla 2, p<0,001).
Se obtuvieron 20 cultivos positivos para MT entre los realizados en la cohorte estudiada (26,6%), 9 en el primer periodo (37,5%) y 11 en el segundo (21,6%). Aunque no existían diferencias significativas entre los 2 periodos el porcentaje de aislamientos fue superior en el periodo preimplantación (p=0,121) (tabla 1). En 2 pacientes del grupo postimplantación derivados de atención primaria no se realizó cultivo para MT, porque ambos habían comenzado ya el tratamiento tuberculostático. Además, en 5 pacientes del grupo preimplantación no constaba la realización de cultivos para MT en la historia clínica. No se detectó ningún MT resistente en los aislamientos microbiológicos de los enfermos.
DiscusiónLa implantación de un protocolo para el manejo de los pacientes con ET supuso la introducción de diversas modificaciones en el diagnóstico y tratamiento de esta enfermedad respecto al abordaje previo. En los últimos años se ha incrementado la publicación de nuevas guías clínicas, pero esto no garantiza su uso en la práctica médica10. Este protocolo se elaboró con el fin de uniformar el manejo de la ET en la edad pediátrica y disminuir el número de ingresos hospitalarios en pacientes estables con ET.
Las recomendaciones de los documentos de consenso de la SEIP11–16 que se utilizaron sintetizan los aspectos más importantes del manejo de la tuberculosis pediátrica, aunque no establecen los criterios de hospitalización en estos pacientes.
En muchos centros hospitalarios los niños con sospecha de ET ingresan independientemente de su situación clínica, sin embargo, algunos estudios publicados recientemente establecen las indicaciones de hospitalización de estos pacientes17. La centralización en consultas mejora y uniformiza los criterios diagnóstico-terapéuticos, así como su seguimiento. Para ello, resulta imprescindible la coordinación con el resto de unidades donde se diagnostica esta enfermedad, como la unidad de urgencias, la planta de hospitalización y las consultas de atención primaria.
La ecografía mediastínica se incorporó de forma habitual en la práctica clínica tras la instauración del protocolo por ser un método accesible, inocuo y muy utilizado en nuestro medio18,19. Por otro lado, las guías no consideran necesaria la monitorización de enzimas hepáticas en el niño asintomático sin factores de riesgo, pero la SEIP recomienda modificar la dosis de fármacos tuberculostáticos en aquellos casos en que las cifras de transaminasas sean 5 veces superiores a las cifras normales, aunque el paciente no presente síntomas15. Por ello en el grupo postimplantación se incluyó la realización de un estudio de perfil hepático y de la velocidad de sedimentación globular (VSG), puesto que esta se considera un marcador evolutivo y de respuesta al tratamiento20,21.
Para evaluar las mejoras establecidas por el protocolo se analizaron en primer lugar el número y las características de los ingresos hospitalarios, y posteriormente las nuevas pautas terapéuticas establecidas. En el grupo postimplantación, a pesar de existir un mayor número de pacientes diagnosticados de ET, el número de ingresos, reingresos y estancia media hospitalaria fue significativamente menor (tabla 2). La disminución de estos parámetros supone una reducción en los costes, una mejora en el bienestar para el paciente y su familia, con menor número de pérdida de días de trabajo para los padres, un menor número de infecciones hospitalarias y una mayor autonomía y confianza en las familias. Además, estas mejoras se consiguieron sin que existiese repercusión en el número de recaídas ni en la adherencia terapéutica.
Con respecto al tratamiento se podría pensar que el paciente tratado desde el inicio de forma ambulatoria toma peor la medicación, abandona antes el tratamiento y comete más errores, o estos no se detectan, sin embargo no se encontraron peores resultados en estas variables porque el tratamiento se iniciase de forma ambulatoria.
Los cambios en el tratamiento supusieron el uso de nuevas pautas terapéuticas con 4 fármacos tuberculostáticos en aquellos casos en los que la sensibilidad del caso índice era desconocida, de acuerdo con las recomendaciones establecidas por la SEIP16, en lugar de 3, como se realizaba previamente. Sin embargo, no se detectó ningún aislamiento de MT resistente en los pacientes pediátricos diagnosticados de ET en esta cohorte. Se debería de replantear si es necesario utilizar esta pauta de tratamiento de manera sistemática en Cantabria.
En relación con el diagnóstico microbiológico en varios estudios se concluye que el rendimiento microbiológico es mayor cuando se extraen 3 aspirados gástricos22 o con la combinación de varias muestras y varios test23. La SEIP aconseja la extracción de 3 muestras microbiológicas para aumentar el rendimiento. Al analizar el número de muestras extraídas en esta cohorte se objetivó que en la mayoría de los pacientes del grupo postimplantación se habían extraído las 3 muestras, mientras que en el grupo preimplantación la media de muestras extraídas por paciente fue menor. A pesar del menor número de muestras realizadas en el grupo preimplantación el rendimiento microbiológico fue similar en ambos grupos. El resultado obtenido en Cantabria está acorde con una serie en la que se sugiere que un solo aspirado gástrico para niños menores de 6 años proporciona buen rendimiento microbiológico24. Para poder tener resultados concluyentes se debería correlacionar con otros aspectos, como el número de cepas, metodología del aspirado y tiempo de procesamiento de la muestra, entre otros. Si se realizasen estudios aleatorizados y se confirmasen estos resultados se debería plantear la modificación de las recomendaciones actuales de las guías en las que se aconseja la extracción de 3 muestras respiratorias para el estudio de MT. Puesto que el aspirado gástrico es una técnica invasiva que causa importante rechazo en el niño y la familia, esto mejoraría el bienestar del paciente y supondría un ahorro en los costes.
Para evaluar la repercusión en el diagnóstico microbiológico del nuevo protocolo se estudió también el rendimiento microbiológico, es decir, la relación entre los casos de ET y el aislamiento microbiológico de MT en ambos periodos. Algunos autores defienden un mayor rendimiento microbiológico cuando el paciente se encuentra ingresado6. En las series revisadas en la literatura existe una gran variabilidad en el porcentaje de aislamientos de MT en niños con ET. En algunas se describen cifras de aislamiento de 30-40%25,26, pero en otras el rendimiento es mucho menor (5,0-14,6%) 27,28. En este estudio el número de aislamientos microbiológicos de MT es equiparable a algunas series descritas en la literatura, y además no se objetivaron diferencias significativas en el aislamiento en ambos periodos estudiados, a pesar de que en el segundo periodo la recogida de muestras se realizó de modo ambulatorio en la mayoría de pacientes. Sin embargo, aunque las diferencias no fueron estadísticamente significativas, la proporción de aislamientos fue ligeramente superior en el grupo preimplantación. El menor porcentaje de aislamientos microbiológicos en el grupo postimplantación se podría explicar por existir mayor número de pacientes con formas ganglionares o formas precoces de la enfermedad, puesto que muchos de los pacientes de este segundo grupo fueron detectados en el estudio de contactos de 2 brotes escolares. Aunque la técnica de aspirado gástrico se realizaba igual en ambos periodos, el tiempo transcurrido entre el despertar y la extracción se supone mayor en los casos realizados en consultas externas6. Sin embargo, estos resultados demuestran que la ambulatorización del diagnóstico bacteriológico en aquellos casos en que la situación clínica lo permite no ha empeorado la sensibilidad del cultivo para la detección de MT.
En el grupo preimplantación se detectó un número significativamente superior de pautas terapéuticas no ajustadas a las recomendaciones de las guías en duración y/o número de fármacos administrados. Sería útil realizar un seguimiento prolongado de estos pacientes para determinar si aquellos con pautas erróneas presentan mayor número de recaídas a largo plazo.
Este estudio demuestra que el manejo ambulatorio en consultas hospitalarias de los pacientes pediátricos con ET, en los casos en los que su situación clínica lo permite, presenta resultados clínicos y microbiológicos similares o mejores al manejo previo, con menor tasa de ingreso hospitalario y el consiguiente ahorro de costes. Además estos resultados muestran que la extracción de 3 muestras microbiológicas para cultivo no mejoran el rendimiento microbiológico.
Para que el manejo sea adecuado es necesario que se agrupen los pacientes en una consulta y que exista buena coordinación con las unidades que detectan al paciente con sospecha de ET: urgencias, atención primaria y planta de hospitalización. La evaluación del enfermo debe ser precoz para poder realizar, en el menor tiempo posible, los estudios diagnósticos y las intervenciones terapéuticas necesarias.
Una de las limitaciones de este trabajo es el número de pacientes estudiado en cada grupo, y que además es un estudio unicéntrico. Para poder superar estas limitaciones se debería confirmar los resultados con los de otros centros cuyos pacientes se hayan manejado de manera similar al grupo anterior a la aplicación del protocolo, y de esta manera se podrían evaluar de manera prospectiva los parámetros estudiados en este trabajo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses relacionado con el trabajo.