El cáncer de mama es una enfermedad prevalente con implicaciones en todas las esferas de la vida de las pacientes, por lo que el médico de familia debe conocer en profundidad esta patología para optimizar la atención con los mejores recursos disponibles.
Los 5 artículos que componen esta revisión ofrecen un resumen de la literatura sobre el cáncer de mama publicada en los últimos 10 años. Este cuarto artículo aborda el tratamiento de la enfermedad, el papel del médico de atención primaria al respecto y el manejo de las principales complicaciones.
Esta revisión pretende ofrecer una visión global, actualizada y práctica sobre esta enfermedad que permita resolver los interrogantes que se presentan en la consulta de atención primaria, facilitar respuestas a las mujeres que las soliciten y en definitiva, permanecer al lado de las pacientes a lo largo de su enfermedad con la tranquilidad del conocimiento.
Breast cancer is a prevalent disease affecting all areas of patients’ lives. Therefore, family physicians must thoroughly understand this pathology in order to optimize the health care services and make the best use of available resources, for these patients.
A series of 5 articles on breast cancer is presented below. It is based on a review of the scientific literature over the last 10 years. This fourth article deals with the treatment of the disease, the role of the primary care physician, and management of major complications.
This summary report aims to provide a current and practical review about this problem, providing answers to family doctors and helping them to support their patients and care for them throughout their illness.
En el primer artículo de los 5 que componen esta actualización sobre cáncer de mama para atención primaria, se expusieron los motivos para la realización de este trabajo, así como el objetivo final de ofrecer una visión global, actualizada y práctica sobre este tumor.
En la cuarta parte de esta revisión se abordan todos los aspectos terapéuticos de la enfermedad (cirugía, quimioterapia, radioterapia, terapias biológicas y nuevas terapias), seguimiento de la enfermedad, el papel del médico de atención primaria al respecto y el manejo de los principales efectos secundarios del tratamiento.
Para elaborar este artículo se ha revisado la literatura científica de los últimos 10 años, consultando bases de datos (Pubmed, Cochrane, MEDES, IBECS), plataformas (BMJ, Science Direct, OVID), e información ofrecida por distintas sociedades científicas e institutos nacionales sobre cáncer.
Tratamiento del cáncer de mama. CirugíaEl tratamiento quirúrgico del cáncer de mama ha ido evolucionando desde la mastectomía radical hacia tratamientos más conservadores y el manejo de la afectación axilar lo ha hecho de forma paralela.
La mastectomía radical (Halsted) ha sido el tratamiento habitual hasta los años 70. Consiste en la extirpación de la mama, músculos pectorales y ganglios linfáticos axilares. Se consideraba la única opción de curación. Esta técnica disminuía en un 39% la recurrencia local y ofrecía un 50-60% de supervivencia a los 5 años. Se trata de un procedimiento que genera mucha morbilidad, discapacidad del brazo ipsilateral y deformidad de la pared torácica1.
La mastectomía radical modificada, descrita por Patey en 1948, mantiene el músculo pectoral mayor como única diferencia. Esta última técnica reemplazó a la anterior al no detectarse cambios en la supervivencia.
Ambas cirugías incluyen la extirpación de piel (aréola y pezón).
La mastectomía simple consiste en extirpar la mama con cáncer. Existe una variante que permite conservar aréola y pezón. No está indicada en tumores próximos a piel. Los problemas de conservar el pezón son: la atrofia o deformación (al estar poco vascularizado), disminución de la sensibilidad en la zona (por sección de nervios) y mayor riesgo de reaparición del tumor. Se realiza incisión independiente para la extirpación de los ganglios linfáticos bajos (niveles 1-2).
La cirugía conservadora de la mama (mastectomía parcial o segmentaria) iniciada por Crile (1960) consiste en la cuadrantectomía o la tumorectomía. En la cuadrantectomía se extrae un cuadrante mamario, con bordes peritumorales amplios. Su indicación se centró fundamentalmente en tumores asentados en el cuadrante superoexterno donde el impacto de la deformidad era menor. La tumorectomía consiste en la extirpación tumoral con una cantidad suficiente de tejido sano para garantizar los bordes en la pieza quirúrgica. No incluye extirpación del músculo ni de una extensa superficie de piel consiguiendo mejor resultado estético. Es la técnica de elección en tumores pequeños menores de 2cm o en tumores con buena relación de tamaño mama/tumor.
Actualmente hay 3 opciones para tratar el tumor primario1:
- 1.
Cirugía conservadora de la mama junto a radioterapia
- 2.
Mastectomía con reconstrucción mamaria
- 3.
Mastectomía sin reconstrucción
La selección de la cirugía depende de la localización y tamaño de la lesión, o del deseo de la paciente de preservar la mama. Son contraindicaciones para tratamiento conservador: la enfermedad multifocal, antecedentes de enfermedades del colágeno, tumores mayores de 5cm que no se reducen con quimioterapia neoadyuvante, mama pequeña en relación con el tamaño del tumor, mujeres embarazadas que precisen radioterapia posterior, cirugía previa en la que no se extirpó totalmente el tumor, radioterapia previa en esa mama, o que la mujer prefiera la realización de mastectomía.
Tumores grandes (T2), histología lobular, afectación ganglionar axilar, tumores palpables y aquellos con componente ductal extenso tienen más riesgo de tumor residual.
En mujeres con antecedentes familiares de mutaciones BRCA 1 y 2 tampoco parece una buena opción la cirugía conservadora por aumento de riesgo de segundo tumor en la misma mama. La cirugía axilar sigue siendo un asunto controvertido.
La linfadenectomía axilar ha sido durante mucho tiempo un componente rutinario del tratamiento. Sus beneficios incluyen un mayor impacto en el control de la enfermedad (recurrencia axilar y supervivencia), su valor pronóstico y su papel en la selección del tratamiento. Sin embargo, conlleva una serie de posibles efectos secundarios que impactan negativamente en la calidad de vida de las pacientes (linfedema, daño nervioso, disfunción del hombro…).
El estadio de los ganglios linfáticos axilares es uno de los factores pronósticos más importantes en el cáncer de mama precoz.
Ante la presencia de enfermedad axilar clínicamente positiva (definida por palpación o técnicas de imagen) debe realizarse una punción aspiración con aguja fina (PAAF) o una biopsia axilar ganglionar (BAG).
Si la PAAF o la BAG del ganglio axilar resultan positivas, se recomienda linfadenectomía axilar reglada.
Si el resultado de la PAAF o de la BAG es negativo debe realizarse una biopsia del ganglio centinela (BGC). Esta técnica consiste en la inyección de un radiotrazador en la zona peritumoral que permite localizar el primer ganglio de drenaje del tumor, para su posterior resección y análisis anatomopatológico de forma intraoperatoria. Si el ganglio centinela no está afectado por metástasis, no es preciso llevar a cabo la linfadenectomía axilar reglada. Si por el contrario estuviera infiltrado, entonces sí debe realizarse dicha resección axilar.
La biopsia del ganglio centinela conlleva mucha menor morbilidad y mantiene el mismo valor pronóstico. Su realización es controvertida en situaciones especiales, como tras recibir terapia neoadyuvante.
En el caso de axila clínica y radiológicamente negativa, también se recomienda biopsia de ganglio centinela. Sin embargo, la observación puede ser una opción. En un estudio de más de 400 pacientes con tumores menores de1,2cm, tratadas con cirugía conservadora y que fueron aleatorizadas para observación axilar o radiación no hubo diferencias significativas en recurrencia axilar, si bien es cierto que el 80% de todas estas pacientes habían recibido quimioterapia2.
La cirugía oncoplástica consiste en la combinación de cirugía del cáncer y técnicas de cirugía plástica de reconstrucción. Esto implica darle una buena forma al seno durante la cirugía inicial, y puede conllevar cirugía del otro seno para que el resultado sea más simétrico. Este enfoque aún es relativamente nuevo, y no todos los profesionales implicados están de acuerdo3.
La cirugía reconstructiva de la mama es una opción solicitada por muchas mujeres para restaurar la apariencia de la mama. Se puede realizar de forma inmediata en el momento de la extirpación del tumor o diferida (semanas, meses o años después). Existen básicamente 3 modalidades: la reconstrucción utilizando el propio tejido corporal, la reconstrucción con implantes mamarios y la que combina ambas técnicas.
La primera consiste en extirpar la piel, la grasa, y parte del músculo recto abdominal por debajo del ombligo que se colocan en la zona del tórax. La segunda conlleva la implantación de prótesis mamaria y precisa que tras la mastectomía existan tejidos de cobertura en cantidad y calidad adecuados. El implante o prótesis de silicona se coloca por debajo de la capa muscular. En caso de no quedar tejido disponible para poner directamente un implante o prótesis mamaria, se necesita previamente estirar los tejidos mediante expansores que se van llenando gradualmente de suero, para ser sustituidos posteriormente por el implante. La ultima técnica combina la extirpación de una sección de la piel y músculo de la espalda (músculo dorsal ancho) que se lleva a la zona del tórax para reconstruir la mama, junto con un implante mamario. Existe también la posibilidad de mantener la unidad aréola-pezón en la mastectomía, precisando entonces solamente la colocación de prótesis.
En cuanto al momento idóneo para la reconstrucción mamaria (inmediata versus tardía) en términos de morbimortalidad, satisfacción y bienestar de las pacientes, una revisión Cochrane reciente encontró un único ensayo clínico que no pudo detectar diferencias entre ambas por presentar deficiencias metodológicas importantes y alto riesgo de sesgo4. En este sentido, es cierto que la mayoría de los oncólogos recomiendan una reconstrucción diferida si es previsible que se vaya a administrar radioterapia sobre la zona intervenida.
En el caso de enfermedad metastásica, la cirugía del tumor primario tendría un papel paliativo para evitar complicaciones como la ulceración. En cuanto a la cirugía de metástasis, solo estaría indicada cuando la metástasis es única y en pacientes seleccionadas.
Tratamiento del cáncer de mama. QuimioterapiaEn los últimos 50 años se ha producido una revolución en el tratamiento farmacológico del cáncer de mama. Tras los agentes quimioterápicos tradicionales (adriamicina, ciclofosfamida, etc.) usados como terapia única hasta los años 70, aparecieron los primeros fármacos antiestrógenos (tamoxifeno) y, cerca del cambio de milenio, el primer anticuerpo monoclonal para el cáncer de mama HER2/neu+ (trastuzumab). Estos nuevos agentes han supuesto un cambio radical en la historia de la enfermedad. Asimismo, los avances en el conocimiento molecular, las nuevas clasificaciones y las recientes plataformas que analizan los genes de un tumor, como Mamaprint® y Oncotype® ayudan a predecir el riesgo de recaídas y a tomar decisiones respecto al tratamiento.
Es importante destacar que los nuevos conocimientos sobre la biología molecular y genética del cáncer de mama están permitiendo la administración de terapias individualizadas para cada tipo de tumor.
Aunque hay protocolos de tratamiento para cada estadio y tipo tumoral, existen generalidades que merecen ser mencionadas:
- 1.
Los tumores con receptores hormonales positivos son, en general, susceptibles de tratamiento hormonal.
- 2.
Los tumores con sobreexpresión o amplificación de HER2/neu (receptor de membrana, con un papel fundamental en el crecimiento y diferenciación celular), suelen responder a terapias dirigidas anti-HER2 (anticuerpos monoclonales como trastuzumab o pequeñas moléculas como lapatinib, etc.)
- 3.
Los tumores triple negativos (receptores para estrógenos, progesterona y HER2/neu−) son tumores más agresivos, en general y en ellos se están ensayando terapias similares a las empleadas en el cáncer de pulmón (combinaciones con platino).
Antes de comenzar a hablar del tratamiento en sí, conviene aclarar ciertos términos:
Se entiende por tratamiento local el tratamiento del tumor circunscrito, sea primario o metastásico. La radioterapia y la cirugía son tratamientos locales.
El tratamiento sistémico va dirigido a eliminar células tumorales o metástasis a distancia e incluye la quimioterapia convencional, las terapias dirigidas a tumores HER2/neu+ y la hormonoterapia.
Quimioterapia en adyuvancia es la que se administra tras la cirugía en tumores en los que no se detecta enfermedad sistémica con el objetivo de evitar recurrencias, y quimioterapia en neoadyuvancia es la que se administra de forma preoperatoria con el objetivo de reducir el tamaño tumoral que permita el abordaje quirúrgico u obtener respuestas patológicas completas y evaluar la quimiosensibilidad del tumor. Se utiliza en tumores localmente avanzados o inflamatorios que no son susceptibles de cirugía de inicio5.
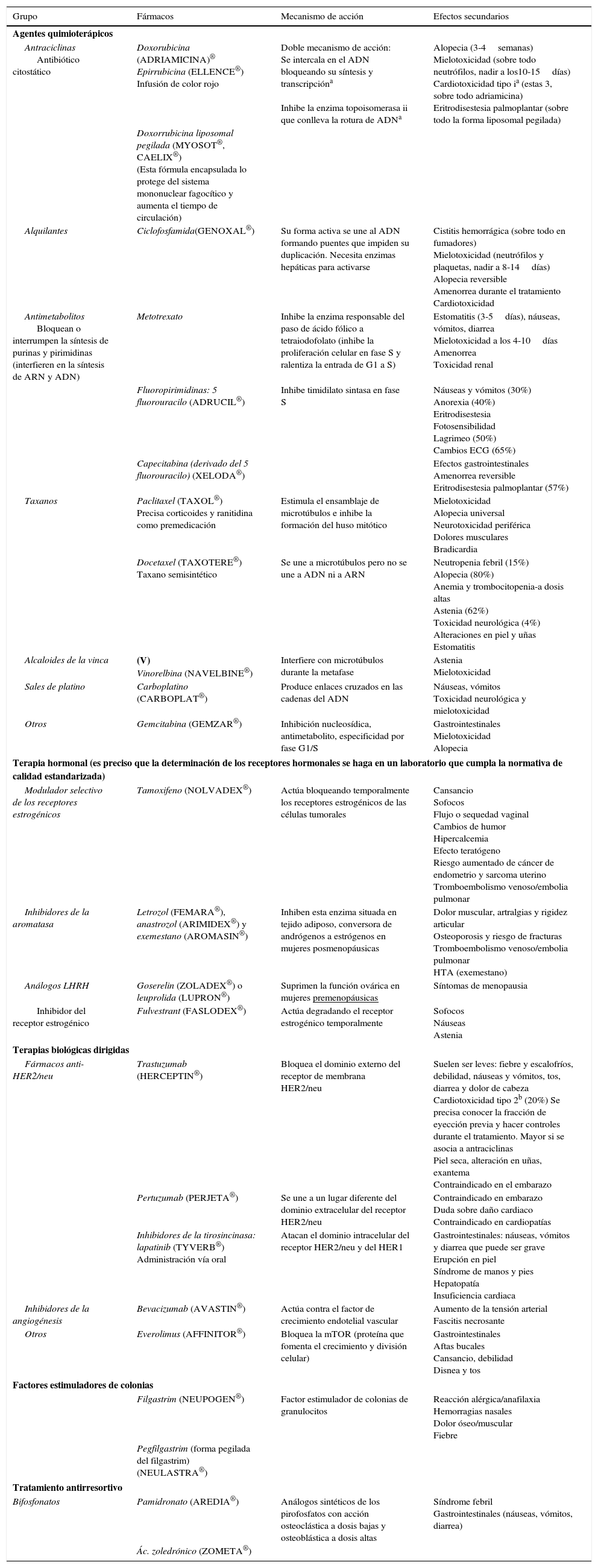
En la tabla 1 se resumen los principales fármacos que pueden emplearse en el tratamiento del cáncer de mama y sus características más importantes6.
Principales fármacos para el tratamiento del cáncer de mama y características
| Grupo | Fármacos | Mecanismo de acción | Efectos secundarios |
|---|---|---|---|
| Agentes quimioterápicos | |||
| Antraciclinas Antibiótico citostático | Doxorubicina (ADRIAMICINA)® Epirrubicina (ELLENCE®) Infusión de color rojo | Doble mecanismo de acción: Se intercala en el ADN bloqueando su síntesis y transcripcióna Inhibe la enzima topoisomerasa ii que conlleva la rotura de ADNa | Alopecia (3-4semanas) Mielotoxicidad (sobre todo neutrófilos, nadir a los10-15días) Cardiotoxicidad tipo ia (estas 3, sobre todo adriamicina) Eritrodisestesia palmoplantar (sobre todo la forma liposomal pegilada) |
| Doxorrubicina liposomal pegilada (MYOSOT®, CAELIX®) (Esta fórmula encapsulada lo protege del sistema mononuclear fagocítico y aumenta el tiempo de circulación) | |||
| Alquilantes | Ciclofosfamida(GENOXAL®) | Su forma activa se une al ADN formando puentes que impiden su duplicación. Necesita enzimas hepáticas para activarse | Cistitis hemorrágica (sobre todo en fumadores) Mielotoxicidad (neutrófilos y plaquetas, nadir a 8-14días) Alopecia reversible Amenorrea durante el tratamiento Cardiotoxicidad |
| Antimetabolitos Bloquean o interrumpen la síntesis de purinas y pirimidinas (interfieren en la síntesis de ARN y ADN) | Metotrexato | Inhibe la enzima responsable del paso de ácido fólico a tetraiodofolato (inhibe la proliferación celular en fase S y ralentiza la entrada de G1 a S) | Estomatitis (3-5días), náuseas, vómitos, diarrea Mielotoxicidad a los 4-10días Amenorrea Toxicidad renal |
| Fluoropirimidinas: 5 fluorouracilo (ADRUCIL®) | Inhibe timidilato sintasa en fase S | Náuseas y vómitos (30%) Anorexia (40%) Eritrodisestesia Fotosensibilidad Lagrimeo (50%) Cambios ECG (65%) | |
| Capecitabina (derivado del 5 fluorouracilo) (XELODA®) | Efectos gastrointestinales Amenorrea reversible Eritrodisestesia palmoplantar (57%) | ||
| Taxanos | Paclitaxel (TAXOL®) Precisa corticoides y ranitidina como premedicación | Estimula el ensamblaje de microtúbulos e inhibe la formación del huso mitótico | Mielotoxicidad Alopecia universal Neurotoxicidad periférica Dolores musculares Bradicardia |
| Docetaxel (TAXOTERE®) Taxano semisintético | Se une a microtúbulos pero no se une a ADN ni a ARN | Neutropenia febril (15%) Alopecia (80%) Anemia y trombocitopenia-a dosis altas Astenia (62%) Toxicidad neurológica (4%) Alteraciones en piel y uñas Estomatitis | |
| Alcaloides de la vinca | (V) Vinorelbina (NAVELBINE®) | Interfiere con microtúbulos durante la metafase | Astenia Mielotoxicidad |
| Sales de platino | Carboplatino (CARBOPLAT®) | Produce enlaces cruzados en las cadenas del ADN | Náuseas, vómitos Toxicidad neurológica y mielotoxicidad |
| Otros | Gemcitabina (GEMZAR®) | Inhibición nucleosídica, antimetabolito, especificidad por fase G1/S | Gastrointestinales Mielotoxicidad Alopecia |
| Terapia hormonal (es preciso que la determinación de los receptores hormonales se haga en un laboratorio que cumpla la normativa de calidad estandarizada) | |||
| Modulador selectivo de los receptores estrogénicos | Tamoxifeno (NOLVADEX®) | Actúa bloqueando temporalmente los receptores estrogénicos de las células tumorales | Cansancio Sofocos Flujo o sequedad vaginal Cambios de humor Hipercalcemia Efecto teratógeno Riesgo aumentado de cáncer de endometrio y sarcoma uterino Tromboembolismo venoso/embolia pulmonar |
| Inhibidores de la aromatasa | Letrozol (FEMARA®), anastrozol (ARIMIDEX®) y exemestano (AROMASIN®) | Inhiben esta enzima situada en tejido adiposo, conversora de andrógenos a estrógenos en mujeres posmenopáusicas | Dolor muscular, artralgias y rigidez articular Osteoporosis y riesgo de fracturas Tromboembolismo venoso/embolia pulmonar HTA (exemestano) |
| Análogos LHRH | Goserelin (ZOLADEX®) o leuprolida (LUPRON®) | Suprimen la función ovárica en mujeres premenopáusicas | Síntomas de menopausia |
| Inhibidor del receptor estrogénico | Fulvestrant (FASLODEX®) | Actúa degradando el receptor estrogénico temporalmente | Sofocos Náuseas Astenia |
| Terapias biológicas dirigidas | |||
| Fármacos anti-HER2/neu | Trastuzumab (HERCEPTIN®) | Bloquea el dominio externo del receptor de membrana HER2/neu | Suelen ser leves: fiebre y escalofríos, debilidad, náuseas y vómitos, tos, diarrea y dolor de cabeza Cardiotoxicidad tipo 2b (20%) Se precisa conocer la fracción de eyección previa y hacer controles durante el tratamiento. Mayor si se asocia a antraciclinas Piel seca, alteración en uñas, exantema Contraindicado en el embarazo |
| Pertuzumab (PERJETA®) | Se une a un lugar diferente del dominio extracelular del receptor HER2/neu | Contraindicado en embarazo Duda sobre daño cardiaco Contraindicado en cardiopatías | |
| Inhibidores de la tirosincinasa: lapatinib (TYVERB®) Administración vía oral | Atacan el dominio intracelular del receptor HER2/neu y del HER1 | Gastrointestinales: náuseas, vómitos y diarrea que puede ser grave Erupción en piel Síndrome de manos y pies Hepatopatía Insuficiencia cardiaca | |
| Inhibidores de la angiogénesis | Bevacizumab (AVASTIN®) | Actúa contra el factor de crecimiento endotelial vascular | Aumento de la tensión arterial Fascitis necrosante |
| Otros | Everolimus (AFFINITOR®) | Bloquea la mTOR (proteína que fomenta el crecimiento y división celular) | Gastrointestinales Aftas bucales Cansancio, debilidad Disnea y tos |
| Factores estimuladores de colonias | |||
| Filgastrim (NEUPOGEN®) | Factor estimulador de colonias de granulocitos | Reacción alérgica/anafilaxia Hemorragias nasales Dolor óseo/muscular Fiebre | |
| Pegfilgastrim (forma pegilada del filgastrim) (NEULASTRA®) | |||
| Tratamiento antirresortivo | |||
| Bifosfonatos | Pamidronato (AREDIA®) | Análogos sintéticos de los pirofosfatos con acción osteoclástica a dosis bajas y osteoblástica a dosis altas | Síndrome febril Gastrointestinales (náuseas, vómitos, diarrea) |
| Ác. zoledrónico (ZOMETA®) | |||
Fuente: elaboración propia.
Los regímenes de quimioterapia más comúnmente utilizados son7:
- •
CMF: ciclofosfamida, metrotrexato, y 5-fluorouracilo.
- •
CAF (FAC): ciclofosfamida, doxorrubicina o epirrubicina y 5-fluorouracilo o CEF (FEC), si se emplea epirrubicina en vez de doxorrubicina.
- •
AC, EC: doxorrubicina o epirrubicina y ciclofosfamida.
- •
TAC: docetaxel, doxorrubicina y ciclofosfamida.
- •
AC→T: doxorrubicina y ciclofosfamida seguida de paclitaxel o docetaxel. Trastuzumab se puede administrar con el paclitaxel o el docetaxel en tumores HER2/neu+.
- •
TC: docetaxel y ciclofosfamida.
En un estudio realizado por el grupo Geicam que comparaba los 2 primeros (CMF y CAF), se obtuvo una pequeña pero significativa diferencia a favor del CAF. Esta ventaja en términos de supervivencia se limitaba a mujeres con tumores HER2/neu+. En cuanto a las antraciclinas, los ensayos avalan el uso de dosis intermedias/bajas.
Al añadir taxanos a un régimen con antraciclinas (TAC o AC→T) se obtienen ventajas en cuanto a supervivencia libre de enfermedad o supervivencia general, al aplicarse en estadios tempranos. En un ensayo, la asociación TC fue significativamente superior a la asociación AC. El paclitaxel se asocia a reacciones de hipersensibilidad por lo que se puede sustituir por un nuevo taxano vehiculizado en una solución de nanopartículas de albúmina (Abraxane®) que disminuye este riesgo.
Respecto a la terapia hormonal, el tamoxifeno se usa exclusivamente en mujeres con receptores estrogénicos positivos (ER+), tanto en el contexto adyuvante como en el metastático, tanto en pre como posmenopáusicas, con o sin ganglios afectados. Aunque los estudios encuentran claras ventajas respecto al riesgo de recidiva tras 5 años de tratamiento (en el contexto adyuvante), no hay consenso sobre su continuación a 10 años.
Además del tamoxifeno, se dispone de otra familia de fármacos, los inhibidores de la aromatasa (anastrazol, letrozol y exemestano) que solo se utilizan en mujeres posmenopáusicas. Parece que esta combinación supone mejoras en la supervivencia libre de enfermedad aunque no en la supervivencia global. En mujeres premenopáusicas se comienza tratamiento con tamoxifeno8,9. El tratamiento durante 5 años con exemestano solo, o alternándolo tras 2 años de tratamiento con tamoxifeno, también presenta beneficios en términos de supervivencia libre de enfermedad aunque con más efectos secundarios9. El fulvestrant ha demostrado ser tan eficaz como el tamoxifeno y los inhibidores de la aromatasa, y está indicado en mujeres con receptores HER2/neu+ y/o tratamiento previo con inhibidores de la aromatasa.
El uso de los análogos LHRH (ablación química ovárica) es controvertido.
Tratamientos biológicos dirigidosFármacos anti-HER2/neuLa llegada de los anticuerpos monoclonales supuso una revolución. El trastuzumab ha sido el primer anticuerpo monoclonal utilizado en tumores de mama HER2/neu+. Es más eficaz que la quimioterapia sola y se utiliza de forma parenteral cada 21 días. En el año 2000 se aprobó en España para cáncer de mama metastático, solo o asociado a otros agentes quimioterápicos. De momento se recomienda su asociación con un solo agente quimioterápico (paclitaxel o docetaxel) también a vinolrebina o gemcitabina5,10,11.
En el cáncer de mama precoz se utiliza tras cirugía (como tratamiento adyuvante) asociado a quimioterapia y radioterapia y se prolonga durante un año. Todos los ensayos realizados al respecto (HERA, NSABPB31, BCIRG006) encontraron ventajas claras en cuanto a intervalo libre de enfermedad (disminución del 50% de recaídas) y casi todos en supervivencia global (mejora del 33%)12,13.
El lapatinib es un inhibidor tirosincinasa anti-HER2/neu que puede utilizarse asociado a capecitabina en cáncer de mama metastásico que ha progresado con trastuzumab14.
El pertuzumab ha sido aprobado en año 2013 por la Agencia Europea del Medicamento (EMA) para su uso en primera línea de enfermedad metastásica asociado a trastuzumab y docetaxel en cáncer metastásico con HER2/neu+ que ha progresado con trastuzumab15.
Fármacos antiangiogénicosComo desde el inicio de la carcinogénesis se produce una neovascularización que ocasiona vasos distorsionados y flujo errático, se ha propuesto el uso de inhibidores del factor de crecimiento vascular como el bevacizumab aunque existen importantes controversias al respecto, por presentar dudas sobre riesgo-beneficio11,16,17.
Otras terapias dirigidasSe ha aprobado el uso del everolimus junto al exemestano, para mujeres posmenopáusicas con ER+ y cáncer de mama avanzado6.
Los factores estimuladores de colonia6 se utilizan por vía subcutánea en el tratamiento de la neutropenia febril y para profilaxis de la neutropenia inducida por quimioterapia.
El añadir bifosfonatos a diferentes regímenes de quimioterapia no parece mejorar la supervivencia libre de enfermedad ni la general. Pero sí se conoce que disminuyen el riesgo de eventos óseos (fracturas patológicas, dolor…) y de hipercalcemia tumoral, por lo que se utilizan de forma rutinaria en pacientes con metástasis óseas. En algún estudio se ha demostrado que estos fármacos también disminuyen el riesgo de recaídas18,19.
El futuro del tratamiento farmacológico del cáncer de mama. Nuevas terapiasActualmente los esfuerzos en investigación se dirigen a conocer mejor las vías de señalización que dirigen la proliferación, mantenimiento, expansión del tumor, resistencia a la muerte celular, inestabilidad genómica, inducción de la angiogénesis tumoral, metástasis y reprogramación metabólica.
Las células cancerosas adquieren capacidades funcionales por diversos mecanismos que permiten su supervivencia y proliferación. Uno de estos mecanismos es la inestabilidad genómica que genera mutaciones o fallos en el sostenimiento del ADN, produciéndose acumulaciones de errores que conducen a la pérdida de genes supresores, y finalmente a la carcinogénesis. Un buen ejemplo de este mecanismo es la inactivación del BRCA 1 y del BRCA 2. Los inhibidores de la poli-ADP ribosa polimerasa (PARP, grupo de enzimas implicadas en procesos celulares múltiples como la reparación de ADN) como el imiparib, son un nuevo tipo de terapias dirigidas cuya finalidad es bloquear la inactivación del BRCA 1. Son fármacos actualmente en ensayo clínico.
Otro mecanismo de las células tumorales es su habilidad para producir factores de crecimiento11, que estimulan la propia proliferación de los tumores por células estromales normales. Un ejemplo de terapia contra esta característica tumoral es el tratamiento anti-EGFR, todavía en fases muy iniciales en el cáncer de mama.
Las señales mediadas por receptores de membrana se pueden alterar por incremento o por modificación estructural de los mismos. Un ejemplo de alteración de la señal de proliferación es la vía del HER2/neu.
Como casi todos los tumores HER2/neu metastásicos terminan por desarrollar resistencia a trastuzumab, se investiga la posibilidad de dianas duales del HER2 (doble bloqueo) mediante combinaciones de paclitaxel, lapatinib y trastuzumab. También la asociación entre trastuzumab y pertuzumab abre la puerta a tratamientos con terapias dirigidas sin agentes quimioterápicos14,15.
Otro de los avances en el tratamiento del cáncer de mama HER2/neu+, es el T-DM1, primer tratamiento que combina un agente antimicrotúbulo (emtansine) con trastuzumab, de modo que solo ataca a las células que sobreexpresan HER2, limitando la toxicidad sistémica11.
Otra de las posibles dianas terapéuticas se encuentra en la capacidad de las células cancerosas para reprogramar su energía metabólica11. Al respecto, la asociación de ridaforolimus y dalotuzumab muestra una prometedora actividad antitumoral en tumores ER+ de alto grado.
La vía AMPK (proteincinasa estimulada por el AMP) está envuelta en la regulación del metabolismo celular en situaciones de escasez energética. La metformina, que media la activación de AMPK ha sido testada en estudios preclínicos y se demuestra que tiene capacidad antiproliferativa y habilidad para destruir células madre en el cáncer de mama. Un estudio retrospectivo muestra la alta probabilidad de obtener respuestas completas en neoadyuvancia. Una de las lecturas de estos hallazgos es la posible explicación de la relación epidemiológica entre diabetes, obesidad y cáncer de mama ya que cuando existe obesidad, las pacientes presentan mayor riesgo de recaídas y peor supervivencia.
Los inhibidores de la farnesiltransferasa son capaces de inhibir la proliferación maligna tanto in vitro como in vivo. Son los tumores infiltrantes de mama los que presentan una actividad farnesiltransferasa mucho mayor de lo normal, y por ello podría ser una vía interesante de investigación.
Se está estudiando el papel del denosumab (Prolia®) para evitar fracturas en cáncer de mama con metástasis óseas y como prevención en mujeres en tratamiento con inhibidores de la aromatasa.
Parece que los niveles bajos de vitamina D se asocian a mayor riesgo de recurrencia, aunque este hallazgo está pendiente de confirmación así como los resultados del papel de la vitamina D en el tratamiento.
La eribulina, un nuevo fármaco antimicrotúbulo parece tener un papel en el cáncer de mama metastásico sometido a muchos tratamientos previos, presentando una discreta ventaja en cuanto a supervivencia7.
Otras asociaciones que están en estudio son:
- •
Lapatinib junto a trastuzumab, laptinib más pazopanib en cáncer de mama metastásico (pazopanib tiene acción inhibidora del factor de crecimiento vascular y contra c-KIT).
- •
Everolimus con letrozol. Parece tener efectos antiangiogénicos y puede tener una acción sinérgica con los inhibidores de la aromatasa.
- •
Sutinib o bevacizumab más docetaxel también están en estudio.
Las indicaciones de la radioterapia en el cáncer de mama son:
- 1.
El tratamiento tras cirugía conservadora de la mama para reducir recurrencias locales.
- 2.
Posmastectomía, en tumores mayores de 5cm o con afectación ganglionar axilar.
- 3.
Tratamiento de metástasis óseas y cerebrales.
Se puede realizar mediante radiación externa del área afectada por el tumor. La extensión a tratar depende de si se realizó mastectomía o cirugía conservadora y de la existencia o no de afectación ganglionar. Como tras la cirugía hay que esperar aproximadamente un mes a que el tejido se recupere, se suele retrasar hasta completar la quimioterapia en los tumores que la precisan. Se aplica generalmente durante 5-6 semanas, de forma diaria (de lunes a viernes). Se están ensayando nuevas pautas de tratamiento que incluyen: administración de mayores dosis en menos tiempo (3 semanas), radioterapia intraoperatoria con administración de una sola dosis en quirófano una vez realizada la cirugía conservadora, y radiación tridimensional (forma de radiación parcial acelerada)20.
Otra forma de administrar la radioterapia es mediante radiación interna o braquiterapia que puede ser intersticial (introducción de partículas en catéteres alrededor del área tumoral tras la cirugía) o intracavitaria. Este último sistema se realiza a través de un dispositivo que se deja durante la cirugía conservadora fijando un extremo en el lugar indicado y el otro en el exterior, administrándose la radiación mediante partículas introducidas en el catéter. Se aplica de forma ambulatoria, 2 veces al día durante 5 días. Además existe la posibilidad de fraccionar la radiación con menos efectos secundarios e iguales resultados21.
Los efectos secundarios de la radioterapia incluyen: astenia, eritema, prurito, cambios en la piel similares a los de las quemaduras solares, inflamación y sensación de pesadez en la mama, plexopatía braquial, problemas para futuras lactancias y para la reconstrucción mamaria, y tardíamente, linfedema, linfangiosarcoma y fracturas costales (estos 2 últimos son más raros).
Tratamiento del carcinoma de mama no invasivoDebido a que cada vez se diagnostica el cáncer de mama en estadios más precoces mediante las técnicas de screening, se dedica un pequeño apartado a las opciones terapéuticas en los casos de carcinoma in situ (CIS).
Tratamiento del carcinoma ductal in situEl carcinoma ductal in situ puede evolucionar a enfermedad invasiva y la probabilidad de que esto ocurra varía según los estudios. Pocos casos se presentan como masa palpable, siendo el 80% diagnosticados por mamografía. Existen varios subtipos histológicos: micropapilar, papilar, sólido, cribiforme y comedocarcinoma. Este último, por sus características más agresivas, es el que tiene más riesgo de evolucionar hacia formas invasivas1.
Hasta hace poco, el tratamiento consistía en mastectomía radical, basándose en el riesgo de un 30% de enfermedad multicéntrica y existencia de un 40% de tumor residual tras tumorectomía. Actualmente, tomando como base diversos ensayos clínicos, se puede optar en la mayoría de los casos por la cirugía conservadora, seguida de radioterapia22. Se puede recomendar la técnica del ganglio centinela si el tumor es agresivo, la paciente tiene menos de 40 años, existe microinvasión o áreas extensas de carcinoma ductal in situ.
Los factores pronósticos de recidiva en estos tumores son: el tipo comedocarcinoma con necrosis, la enfermedad palpable, las formas sólidas o cribiformes, la histología pobremente diferenciada y los márgenes indeterminados de resección.
El ensayo NSABP-B24 demostró que el empleo de tamoxifeno además de la tumorectomía y radioterapia disminuían las tasas de recurrencia y de enfermedad contralateral e ipsilateral a los 5 años, incluso en mujeres con márgenes afectados22.
Tratamiento del carcinoma lobular in situEl carcinoma lobular in situ se considera hoy un marcador de riesgo de padecer en un futuro cáncer mama que generalmente será ductal. Suele ser una enfermedad multicéntrica bilateral.
Para tratarlo, solamente es necesaria la biopsia escisional del tumor y observación, pero también se consideran otras opciones como mastectomía profiláctica bilateral en el caso de que existan mutaciones en BRCA 1/BRCA 2, o tamoxifeno para reducir la incidencia de nuevos cánceres de mama.
El ensayo NSABP-P-1 incluyó a más de 13.000 mujeres con riesgo alto de desarrollar cáncer y, con una mediana de seguimiento de casi 50 meses, demostró una disminución de riesgo del 56% en las mujeres que recibieron tamoxifeno tras la biopsia escisional22.
Tratamiento del cáncer de mama en situaciones especialesTratamiento del cáncer de mama triple negativoCon quimioterapia en neoadyuvancia, parece que estos tumores tienen una tasa más alta de respuestas completas y también parciales de larga duración.
Son esperanzadores los ensayos con inhibidores de la PARP que también se están experimentando en tumores con mutaciones BRCA por compartir muchas características con los cánceres de mama triple negativo23.
Actualmente se está estudiando el papel de las sales de platino, así como de los inhibidores de la angiogénesis tumoral y los inhibidores EGFR24,25.
Cáncer inflamatorio de mamaSupone un 5-10% de todos los cánceres de mama. La edad media al diagnóstico es menor que con otros cánceres (mediana de 57 años). Se llama así por el aspecto enrojecido e hinchado que tiene la mama. Es extremadamente agresivo. Se desarrolla con rapidez en semanas o meses y la mayoría de las mujeres se encuentran en estadio iii o iv en el momento del diagnóstico. Es más frecuente en mujeres afroamericanas y en obesas.
En la mayoría de los casos se trata de carcinomas ductales infiltrantes que invaden los vasos linfáticos de la piel. Rara vez presentan receptores para hormonas pero sí para HER2/neu26.
La mama suele estar aumentada de tamaño y eritematosa. Con frecuencia aparece dolor y pesadez y no siempre se palpa tumor. La piel puede tener aspecto de piel de naranja y el pezón estar invertido. Es muy importante que el médico de familia tenga conocimientos sobre la forma de presentación de este tipo tumoral, con el fin de evitar retrasos diagnósticos, dada la rápida evolución que presenta. Aproximadamente un tercio de las mujeres tiene metástasis a distancia en el momento del diagnóstico.
Existen síntomas de alarma que son: eritema que afecta más de un tercio de la mama y piel de naranja. Además, si tras 1-2 semanas de tratamiento antibiótico en una sospecha de mastitis no hay mejoría, se debe plantear esta posibilidad como diagnóstico diferencial.
Para el diagnóstico son necesarias: mamografía, ecografía de mama y de los ganglios axilares, resonancia magnética si la mamografía es negativa y biopsia del tejido mamario y de la piel adyacente. En caso de persistencia de síntomas, una biopsia negativa no descarta completamente el diagnóstico En estos tumores es necesaria la realización de tomografía por emisión de positrones asociada a tomografía al inicio, para descartar metástasis.
En cuanto al tratamiento, debe realizarse quimioterapia en neoadyuvancia al objeto de reducir el tamaño tumoral. Respecto a la cirugía, habitualmente se opta por mastectomía radical modificada más disección axilar completa. Se indica terapia hormonal durante 5 años si los receptores son positivos. La radioterapia debe incluir la mama, hueco axilar, supraclavicular, cadenas de mamaria interna y quimioterapia en adyuvancia posteriormente27.
Se está investigando si el cáncer inflamatorio tiene un perfil genético diferente; un 30% expresa EGFR, lo que le confiere un especial mal pronóstico. Actualmente se están realizando ensayos clínicos con panituzumab.
También existen ensayos con un inhibidor de la histona deacetilasa, entinostat, con inhibidores de los receptores del factor 3 de crecimiento fibroblástico y del factor de crecimiento endotelial vascular, como dovitinib y pazopanib. Asimismo se investiga sobre el papel de la COX2 y las estatinas.
Otra línea de ensayo es un fármaco para los casos de persistencia de células tumorales circulantes (lo que aumenta el riesgo de recurrencia).
Este tipo de tumor ofrece tasas del 40% de supervivencia a los 5 años en estadio iii y del 11% en estadio iv. En un estudio en mujeres que recibieron terapia multimodal, la tasa de supervivencia a los 15 años fue del 34%28.
Entre los factores que influyen en el pronóstico del cáncer inflamatorio destacan el estadio de la enfermedad, grado histológico, etnia, terapia recibida y estado de los receptores para estrógenos.
Papel del médico de atención primaria en el manejo de los principales efectos secundarios del tratamiento del cáncer de mamaEntre los efectos secundarios más frecuentes de la quimioterapia se encuentran:
MielosupresiónEs el efecto secundario más importante de los fármacos citotóxicos y la causa más frecuente que obliga a disminuir la dosis. Afecta a las 3 series sanguíneas y suele producirse a mitad de ciclo, unos 10-11 días tras el tratamiento con recuperación prácticamente total hacia el día 28 del ciclo. Se denomina nadir al momento de máximo efecto de la mielosupresión tras quimioterapia. La mielosupresión producida por algunos fármacos, debido a su mecanismo de acción, puede presentar una recuperación más tardía, en torno a 6 semanas29.
La neutropenia aumenta el riesgo de infección y fiebre. Existen 3 grados de neutropenia: grado 1 (entre 1.500 y 1.000neutrófilos/mm3), grado 2 (entre 1.000 y 500/mm3) y grado 3 (<500/mm3). En este último caso es necesaria la derivación hospitalaria para valorar tratamiento antibiótico y administración de factor estimulador de colonias (filgastrim). Algunos autores añaden un cuarto grado de neutropenia (<200neutrófilos/mm3).
La trombocitopenia no suele provocar sangrados espontáneos hasta que el nivel de plaquetas desciende por debajo de 50.000/mm3. Excepcionalmente se presentan complicaciones graves con niveles inferiores a 20.000/mm3. Por debajo de 10.000/mm3, se recomienda la transfusión de plaquetas.
En general, la anemia no suele precisar transfusión salvo que sea sintomática.
FiebreLa fiebre que aparece en las primeras 24-48h tras la administración del ciclo suele ser de origen medicamentoso (ácido zoledrónico) y tiende a durar unas 24h. Generalmente cede con antiinflamatorios y antipiréticos aunque si existe afectación del estado general, dura más de 24h o hay focalidad hay que derivar al hospital.
Cuando la fiebre aparece entre ciclo y ciclo, obliga a determinar la existencia de leucopenia, buscar focalidad y tratar en consecuencia. Es una urgencia oncológica y precisa derivación al hospital de referencia.
Náuseas y vómitosLas náuseas y vómitos inducidos por quimioterapia aparecen en el 70-80% de las pacientes. Su aparición depende tanto del agente quimioterápico como de su posología. Presentan alto riesgo emetógeno, la ciclofosfamida y adriamicina; riesgo medio, los taxanos y riesgo bajo el metrotrexato30.
Se producen por 2 mecanismos diferentes, bien por la estimulación de la zona gatillo central mediada por dopamina y serotonina, bien por la acción sobre receptores intestinales o vestibulares.
Se distinguen 3 formas de presentación, la emesis aguda que aparece en las 24 primeras horas, siendo la serotonina el neurotransmisor implicado; la emesis tardía, que ocurre entre el segundo y séptimo día en la cual se utiliza metoclopramida y corticoides como tratamiento; y la emesis anticipatoria, que ocurre antes del tratamiento, aproximadamente en el 30% de los casos y mejora con benzodiazepinas.
Los antagonistas de la serotonina (ondasetrón, granisetrón, dolasetrón y palonosetrón) son el tratamiento más eficaz para la emesis aguda. En el caso de ondasetrón, se emplea por vía intravenosa previo a la infusión del ciclo y a dosis de 8mg vía oral/8h, entre uno y 3 días después. La dosis de granisetrón es de 1mg/12h durante 1-3días. Su eficacia y efectos secundarios son similares y tienen doble mecanismo de acción, central y periférico. Suelen estar indicados en regímenes muy emetizantes. Tienen un coste elevado, precisando sellado por inspección. Los efectos secundarios más frecuentes son cefalea, estreñimiento, debilidad y elevación de transaminasas que pueden obligar a su retirada.
Otro grupo de fármacos antieméticos son los antagonistas de la sustancia P (bloqueador de la NK1, neurocinina).
El aprepitant se está utilizando con éxito a dosis única de 125mg vía oral, una hora antes de la quimioterapia, seguida de 80mg diarios durante 2 días más. Se emplea asociado a dosis altas de dexametasona (12mg el primer día seguidos de 8mg los 3 siguientes) y ondasetrón. Puede elevar las concentraciones de otros fármacos coadministrados al utilizar la vía CYP3A4 (corticoides, benzodiacepinas, algunos agentes quimoterápicos como etopóxido, cisaprida e imidazoles). Sus efectos secundarios más frecuentes son: cansancio, estreñimiento, diarrea, hipo y alteración de las transaminasas.
La metoclopramida, que también actúa a nivel central y periférico, es el tratamiento de elección de la emesis tardía. Recientemente, la Agencia Española de Medicamentos y Productos Sanitarios ha restringido su uso en adultos a postoperatorios y emesis inducida por quimioterapia durante cortos periodos de tiempo (máximo 5 días), por sus efectos neurológicos y cardiovasculares. Las dosis recomendadas oscilan entre 20-40mg, de 2 a 4 veces al día.
Los corticoides se utilizan en dosis única diaria, 16mg de dexametasona los 2 primeros días y 8mg/día los 2 siguientes. También puede emplearse metilprednisolona. Ambos potencian la eficacia de metoclopramida y antiserotoninérgicos.
Otros fármacos como fenotiazinas y butirofenonas no aparecen actualmente recomendados en las guías de tratamiento de la Sociedad Española de Oncología Médica (SEOM).
Los vómitos anticipatorios tienen origen psicógeno. Las benzodiacepinas, aunque no tienen actividad antiemética per se, pueden utilizarse en estos casos. Pueden emplearse alprazolam, midazolam y lorazepam, este último a dosis de 0,5-2mg. También son útiles para disminuir los efectos extrapiramidales de la metoclopramida.
MucositisPuede deberse a efecto directo del citostático sobre la mucosa o ser consecuencia de la mielosupresión. Aparece aproximadamente en el 40% de los pacientes que reciben quimioterapia y suele comenzar a la semana del tratamiento29.
Los fármacos más frecuentemente implicados son 5-fluorouracilo, metrotrexato, adriamicina y bleomicina.
Al inicio, se produce un aumento de sensibilidad a comidas ácidas o calientes y progresivamente la mucosa se inflama hasta la aparición de úlceras. Aparece dolor intenso que impide al paciente comer y predispone a la deshidratación y desnutrición.
No existe evidencia de que el uso de colutorios con antisépticos bucales o antifúngicos prevengan su aparición, si bien es verdad que son frecuentes la sobreinfecciones por Cándida, bacterias y herpes que precisarán tratamiento específico. Debe recomendarse una meticulosa higiene bucal.
El tratamiento de la mucositis establecida incluye enjuagues con infusión de manzanilla, suero salino o bicarbonato. El tratamiento del dolor se puede realizar con lidocaína al 2% en orabase (aplicación directa sobre la úlcera) o lidocaína al 2%, una ampolla en 200ml de agua para colutorio antes de las comidas. Otra fórmula magistral incluye: gentamicina 80mg, nistatina 30ml (solución 100.000 UI/ml), lidocaína al 2% (10ml), bicarbonato sódico 3g y agua c.s.p. 250ml.
En un estudio en fase iii de la ASCO 2004, la utilización de glutamina redujo la aparición de mucositis moderada-severa en un 22% durante el primer ciclo de quimioterapia, aunque las recientes guías de práctica clínica no recomiendan su uso debido a su toxicidad.
La sobreinfección por Cándida se trata con nistatina en solución, enjuagues 4 veces al día con ingestión posterior, durante 7-10días. También puede usarse fluconazol oral, 150mg en dosis única.
Se recomienda evitar los picantes y las comidas ácidas, ingerir alimentos blandos y/o troceados, usar pajitas para beber líquidos, chupar trocitos de hielo, evitar tabaco y alcohol, beber líquidos y añadir salsas para que la comida esté menos seca.
La enteritis por quimioterapia se trata con reposición hidroelectrolítica y loperamida si fuese necesario una vez descartadas otras posibilidades diagnósticas.
AlopeciaCausada fundamentalmente por ciclofosfamida, adriamicina y taxanos. Suele ser en parches y afecta más a cuero cabelludo, salvo con taxanos, que producen alopecia universal (incluidas cejas y pestañas). Su recuperación se inicia generalmente una semana después de terminar el tratamiento e inicialmente el pelo nuevo suele ser de otra textura y color. Durante una época, se utilizaron gorros fríos durante la infusión de los agentes citostáticos para aminorar la caída del pelo, pero se ha relacionado esta práctica con la aparición de metástasis tardías en cuero cabelludo29. Habrá que esperar a disponer de más estudios sobre el empleo de los nuevos gorros refrigerados.
Manejo de los efectos secundarios de la radioterapiaLos efectos sobre la piel como eritema, descamación y picor se tratan de forma sintomática y evitando el uso de lociones, colonias, polvos, jabones o desodorantes hasta finalizar el tratamiento. Se debe secar bien, evitar el rascado, los esparadrapos, gasas y temperaturas extremas. Se aconseja utilizar factores de protección solar y ropa de algodón holgada. En caso de aparición de úlceras, se realizarán curas locales y antibióticos sistémicos si fuese necesario.
Dependiendo de la zona de irradiación pueden aparecer síntomas como diarrea, disfagia, mielosupresión, mucositis y xerostomía.
La xerostomía se maneja con dieta blanda, líquidos, correcta higiene bucal y estimulando la producción de saliva mascando chicle o tomando zumo de limón y utilizando saliva artificial o solución de pilocarpina diluida (5 gotas de 1mgl/ml).
LinfedemaEs una complicación del tratamiento del cáncer de mama poco entendida e investigada, y subestimada, que sin embargo debería tenerse muy en cuenta por la frecuencia y grave repercusión en la calidad de vida del paciente.
Se trata de una inflamación en el brazo donde se ha practicado linfadenectomía, debida a la acumulación de líquido linfático rico en proteínas en el espacio intersticial. Provoca edema sin fóvea más o menos extenso, pudiendo afectar incluso a los dedos31.
La presentación es habitualmente insidiosa, pero puede ser provocada de forma súbita por una infección de la piel. Los pacientes refieren sensación de pesadez, piel tirante y disminución de la movilidad. La piel puede presentar aspecto queratósico y verrugas. A medio y largo plazo puede producir fibrosis.
Se puede presentar desde el principio y hasta 30 años después del tratamiento de un cáncer de mama. No existen datos fiables de la incidencia y prevalencia, variando del 8 al 56% a los 2 años de la cirugía.
Las mujeres sometidas a cirugía y/o radioterapia axilar tienen más riesgo; de hecho, la positividad ganglionar es un factor predisponente, existiendo una relación directamente proporcional entre la positividad ganglionar y el volumen del brazo.
Algunos estudios indican que las mujeres que se someten a extirpación axilar tienen un riesgo medio del 30% de padecer linfedema, variable en función del tipo de cirugía mamaria (0% si extirpación única del ganglio centinela, y mayor cuanto más numerosos son los ganglios extirpados). Otros estudios observan incidencias del 33-48% tras disección axilar y del 5-14% tras la biopsia del ganglio centinela.
La obesidad se asocia en algunos estudios a 3,6 veces más probabilidades de tener linfedema. Otros factores como el retraso en la cicatrización, radiación local y cirugía extensa también se han asociado.
El ejercicio físico moderado y progresivo puede resultar beneficioso32. Es importante tratar el linfedema leve porque tiene 3 veces más riesgo de evolucionar a un cuadro grave.
El diagnóstico es fundamentalmente clínico, existiendo múltiples pruebas de medición no estandarizadas, entre cuyas opciones se encuentran la impedancia bioeléctrica y la gammagrafía infrarroja.
Lo más habitual es medir la circunferencia de ambos brazos tomando referencias anatómicas en 4 puntos diferentes como las articulaciones metacarpofalángicas, muñecas, 10cm por debajo del epicóndilo lateral y 15cm por encima del mismo. La diferencia es significativa cuando es mayor de 2cm entre ambas extremidades. Es importante tener en cuenta que el brazo afectado puede presentar atrofia, o existir diferencias fisiológicas relacionadas con el dominante, por tanto no debe realizarse una sola determinación, sino varias seriadas.
A veces es necesaria la realización de pruebas de imagen como linfocentellografía (método poco invasivo, que consiste en la administración en espacio interdigital de un radiofármaco y posterior estudio de imagen [SPECT]). La linfangiografía ha sido cuestionada por su potencial riesgo de diseminación de células tumorales.
El linfedema se clasifica en 3 estadios dependiendo de la gravedad: clasificación CTCAE 7. El grado 1 (5-10% de discrepancia en volumen o circunferencia entre ambos brazos en el punto de mayor diferencia visible); es potencialmente reversible, se caracteriza por sensación de pesadez, aumento de volumen con fóvea y oscurecimiento de la piel. En el grado 2 (10-30%), el tejido adquiere una consistencia esponjosa, no deja fóvea y existe ya fibrosis, con desviación obvia del contorno anatómico. En el grado 3 (mayor del 30% de diferencia) se produce repercusión en la vida cotidiana, linforrea, elefantiasis, siendo poco frecuente en cáncer de mama. Algunos autores añaden un grado 4 que consiste en la evolución a neoplasia (linfangiosarcoma), muy poco probable en cáncer de mama.
Hay varios tratamientos seguros y beneficiosos como la terapia descongestiva compleja (TDC), el ejercicio y la fisioterapia32.
La TDC consta de 4 componentes: drenaje linfático manual, tratamiento compresivo, fisioterapia y ejercicios de brazo, hombro y respiración. En la fase 2 el paciente practica autocuidados con drenajes periódicos. No parece haber evidencia de que el drenaje y la TDC aumenten el riesgo de metástasis.
El programa de ejercicio va encaminado a mantener la amplitud de movimiento y fuerza muscular, y debe comenzar tras la intervención. El ejercicio contrarresistencia no aumenta la incidencia de linfedema ni lo empeora.
Se están desarrollando técnicas quirúrgicas para el tratamiento del linfedema pero todavía hay poca experiencia (trasplante autógeno de ganglios linfáticos o la anastomosis linfático-venular). También existen técnicas de reducción de piel y tejido celular subcutáneo. Mejoran el volumen de la extremidad y parece que disminuyen las complicaciones.
Algunos consejos generales para el linfedema son:
- •
Mantener la higiene y cuidado de la piel. Evitar productos irritantes.
- •
Elevar el brazo para favorecer el retorno venoso y mantener la hidratación de la piel.
- •
Evitar heridas, quemaduras, picaduras y pinchazos (utilizar guantes para tareas domésticas y de jardín, y dedal para coser).
- •
Evitar el frío y el calor excesivos y las exposiciones al sol.
- •
No realizar sobreesfuerzos y no llevar grandes pesos.
- •
No utilizar ropa u objetos que aprieten (retirar el reloj, pulseras y anillos del brazo con linfedema). También es recomendable no llevar cinturones.
- •
No depilarse y tener un cuidado extremo con la manicura.
- •
Evitar el sobrepeso y limitar la sal en la alimentación.
- •
No practicar deportes como el tenis, pesas, aeróbic, etc. La natación es un deporte ideal siempre que la temperatura del agua no supere los 28° C.
- •
No extraer sangre, no poner inyecciones, ni tomar la tensión en el brazo afectado por el linfedema.
- •
Consultar al médico si aparecen eritema, dolor o calor en el brazo afecto.
En una revisión Cochrane de 2010 se pretendía averiguar la idoneidad del inicio del ejercicio para los trastornos funcionales del brazo tras la cirugía del cáncer de mama. Los autores concluían que para la recuperación de la movilidad del hombro era beneficioso el inicio de ejercicios de forma precoz, pero si lo prioritario era facilitar la curación y el mejor drenaje de la herida, estos ejercicios debían retrasarse al menos una semana. Respecto al linfedema, no hubo pruebas de que el ejercicio en ningún momento tras la cirugía tuviese efecto negativo sobre el mismo.
La situación actual de la quimioprevenciónSe sigue investigando el papel del tamoxifeno y el raloxifeno en la prevención de cáncer de mama en mujeres de alto riesgo.
Diversos estudios han demostrado que el tamoxifeno (alguno de ellos, como el BCPT que se inició en los años 90) podría reducir el riesgo de cáncer de mama hasta un 50% en mujeres a partir de los 35 años pre y posmenopáusicas. Esto sucedía en tumores con ER+, pero no en los demás. También hubo una reducción de un tercio de carcinoma ductal in situ y carcinoma lobular in situ pero no de mortalidad por cáncer de mama. El metaanálisis de los 4 principales estudios encontró una reducción de cáncer de mama invasivo en un tercio de los casos a 5 años.
Estudios con el raloxifeno demostraron que funciona tan bien como el tamoxifeno al reducir el riesgo de cáncer de mama (estudios CORE, MORE Y RUTH) pero con menos efectos secundarios. EL estudio STAR comparó el tamoxifeno con el raloxifeno y parece que ofrecía ventajas con el uso del primero en reducción de riesgo de cáncer de mama. El raloxifeno solo está aprobado para mujeres posmenopáusicas.
Aunque ambos han sido aprobados por la FDA como tratamiento preventivo en mujeres de alto riesgo, su utilización preventiva no está ampliamente aceptada por sus efectos secundarios (cáncer de endometrio con tamoxifeno y eventos tromboembólicos en ambos).
El estudio ATAC demostró que el anastrazol era mejor que el tamoxifeno en términos de eficacia y seguridad en mujeres posmenopáusicas aunque con mayor riesgo de fracturas. Otro estudio, el EXCEL, comparó el exemestano frente a placebo en quimioprevención en mujeres posmenopáusicas. Parece disminuir en un 65% el riesgo de cáncer de mama con menos efectos secundarios.
Recientemente se está valorando el empleo de retinoides (fenretinida) con esta indicación, encontrando en un pequeño estudio que este medicamento fue tan eficaz como el tamoxifeno en quimioprevención.
Seguimiento de las pacientes con cáncer de mamaMarcadores tumorales en cáncer de mamaUn marcador tumoral es aquella sustancia biológica o bioquímica que es producida o inducida por las células tumorales, o por el organismo en respuesta a su presencia, y que es liberada en cantidades que se pueden detectar en sangre y que refleja el crecimiento y actividad del tumor, permitiendo conocer la presencia, evolución y respuesta al tratamiento del mismo33.
Pueden ser proteínas específicas de tumor, como el cromosoma Philadelphia, o proteínas no específicas, o marcadores relacionados con células malignas (antígeno carcinoembrionario (CEA), alfafetoproteína y también proteínas expresadas por las células tumorales. Los marcadores deberían ser útiles para detección, pronóstico y seguimiento del tratamiento, y tener alta sensibilidad, especificidad, valor predictivo positivo y ser órgano-específicos y tumor-específicos. Sin embargo, los marcadores de los que disponemos hoy no son en realidad específicos de ningún tipo de cáncer y pueden encontrarse alterados en enfermedades benignas. Por ejemplo, el CEA puede estar aumentado en varias enfermedades malignas (colón, páncreas, pulmón, vejiga, tiroides, ovario) y en enfermedades benignas (hepatopatías, bronquitis, enfisema, diverticulitis, enfermedad renal). Es preciso un control evolutivo de los mismos ya que solo el incremento sostenido orienta hacia un origen maligno.
En la actualidad la mayoría de los marcadores se utilizan para controlar de respuesta al tratamiento y para la detección de recaídas.
En el caso del cáncer de mama, ninguno de los grupos de trabajo considera que los marcadores sirvan para el screening ni para el diagnóstico de la enfermedad, debido a su baja sensibilidad y especificidad en etapas iniciales.
Existen múltiples marcadores tumorales empleados en seguimiento de cáncer de mama; los más frecuentemente utilizados son el CA 15.3, el CA 27.29 y el CEA. Otros como antígeno polipeptídico tisular (TPA)), captesina D o cifra 21.1 (componente de la citoqueratina 19) no se utilizan habitualmente34.
CA 15.3 es el marcador más utilizado en cáncer de mama. Solo un 10% de las pacientes lo tienen elevado en fases iniciales de enfermedad, pero se detectan en alrededor del 70% de aquellas con estadios avanzados. Los niveles por lo general bajan rápidamente cuando el tratamiento comienza a ser eficaz, aunque pueden subir durante las primeras semanas tras su inicio como consecuencia de las células tumorales que mueren y diseminan su contenido en sangre.
El nivel normal por lo general es menor de 25U/ml dependiendo del laboratorio, pero puede estar elevado en ausencia de cáncer (tumores benignos de mama y hepatitis) y otros tumores malignos.
CA 27.29 es un marcador de más reciente descubrimiento que el CA 15.3 y hasta ahora no ha mostrado ventajas respecto al anterior. El nivel normal es menor de 38-40U/ml, dependiendo del laboratorio.
Los niveles de CA 27.29 también pueden encontrarse elevados en cánceres de colon, estómago, riñón, pulmón, ovario, páncreas, útero e hígado., y en enfermedades benignas (trastornos mamarios, renales y hepáticos), primer trimestre del embarazo, endometriosis y quistes ováricos.
El CEA se encuentra en el embrión y el intestino fetal y se deja de producir tras el nacimiento, de manera que en el adulto resulta prácticamente indetectable. En algunos procesos tumorales se reactiva su producción. Es una proteína de función fisiológica desconocida, que podría estar implicada en procesos de reconocimiento y adhesión celular. Las concentraciones normales son inferiores a 5ng/ml y niveles menores a 10ng/ml son detectados en el 10% de los fumadores. Tampoco es un marcador específico de cáncer, pues aumenta en diversas patologías benignas, aunque su negatividad es de gran ayuda para descartar carcinomatosis meníngea.
Los niveles de los marcadores tumorales no siempre se correlacionan con la masa tumoral. Nuevas investigaciones que utilizan el análisis del ADN tumoral circulante o la mamaglobina(marcador de células tumorales circulantes) ofrecen una mejor correlación y ayudan a predecir las recaídas33, aunque estos últimos todavía no se usan de rutina en la práctica clínica.
Seguimiento clínico y pruebas complementariasPara el seguimiento se recomiendan, en general, controles clínicos trimestrales los 2 primeros años, semestrales los 3 siguientes y luego anuales de forma indefinida. En estas revisiones se debe realizar una buena anamnesis por órganos y aparatos así como examen físico. También se recomienda la realización de mamografía a los 6 meses de la intervención o radiación y luego anualmente.
Según la mayoría de las guías clínicas, no estaría indicada la realización de pruebas complementarias tales como analíticas, marcadores tumorales, pruebas de imagen de rutina, a no ser que la paciente refiera síntomas o signos que puedan estar relacionados con la enfermedad (dolor óseo tos, disnea etc.), porque no existe evidencia de que su realización aumenten la calidad de vida ni la supervivencia. La Sociedad Norteamericana de oncología médica (ASCO), la National Comprehensive Cancer Network (NCCN) y la SEOM suelen coincidir en estas recomendaciones.
En el caso de pacientes en tratamiento con tamoxifeno se recomiendan revisiones ginecológicas anuales aunque parece que la realización periódica de ecografía vaginal no mejora la supervivencia. Se debe advertir a las pacientes de la necesidad de consultar ante la presencia de sangrado vaginal por el riesgo asociado a este tratamiento de cáncer de endometrio.
También se debe realizar densitometría anual en pacientes en tratamiento con inhibidores de la aromatasa.
Alguna guía sugiere que estas revisiones podrían ser compartidas entre atención primaria y especializada, sobre la base de un estrecho contacto entre ambos niveles.
Otra cuestión son las revisiones en caso de cáncer metastásico, en las que generalmente sí está indicada la realización de pruebas complementarías.
La gammagrafía ósea es innecesaria al inicio en lesiones menores de 2cm y en estadio clínico IIA o inferior, siendo necesaria su realización en el resto de los casos.
Los marcadores tumorales no están indicados en la evaluación inicial, sino solo en el seguimiento.
La tomografía por emisión de positrones asociada a tomografía se emplea también en el seguimiento de esta enfermedad, para el control de la respuesta al tratamiento y el diagnóstico de recidivas.
Conflicto interesesLas autoras declaran no tener ningún conflicto de intereses.
Este artículo está dedicado a todas las mujeres y sus familiares que luchan cada día contra el cáncer de mama, lo harán en un futuro o lo hicieron en el pasado. En especial a ti, Lucía. También a los profesionales y asociaciones que contribuyen con su trabajo y dedicación a la mejora de la salud y calidad de vida de estas pacientes.