Comparar el valor predictivo, en el pronóstico cardiovascular, de las fórmulas más empleadas para la estimación del filtrado glomerular en pacientes hipertensos.
Material y métodosSe diseñó un estudio de cohortes retrospectivo, que incluyó los 405 pacientes diagnosticados de HTA esencial que fueron remitidos a la Unidad de Hipertensión y Riesgo Vascular, desde atención primaria, entre el 1 de enero de 1998 y el 31 de agosto de 1999 y a los que se les realizó simultáneamente un estudio de MAPA, análisis de sangre y orina y ecocardiográfico. Se realizó el seguimiento a lo largo de 12,5años (mediana [±RiQ]: 10,61 [±3,11] años) y se registraron 174 eventos.
ResultadosSe incluyeron 405 pacientes (53,8% mujeres), con una edad media de 55,5años. El filtrado glomerular estimado según las fórmulas MDRD y CKD-EPI fue de 73,9±2,6ml/min/1,73m2 y 76,9±2,2ml/min/1,73m2, respectivamente. La prevalencia de enfermedad renal crónica fue del 31,6 y del 23,9%, respectivamente. El uso de la ecuación CKD-EPI obligó a reclasificar al 22,9% de los pacientes. La RTI [IC95%] para la enfermedad renal crónica identificada por la ecuación MDRD fue de 2,4 [1,8-3,3], y para el cálculo con CKD-EPI fue de 2,5 [1,8-3,3]).
ConclusionesAmbas fórmulas estiman magnitudes semejantes de función renal, aunque la ecuación CKD-EPI evita algunos falsos positivos, y ambas tienen similar valor pronóstico en pacientes tanto de alto como bajo riesgo cardiovascular.
To assess predictive value of the cardiovascular prognosis by comparing the two most used formulas for the estimation of glomerular filtration rate in hypertensive patients.
Material and methodsA retrospective cohort study was designed that included 405 patients diagnosed with essential hypertension. The patients were referred from Primary Care to the Hypertension and Vascular Risk Unit between January 1, 1998 and August 31, 1999. Blood pressure measurements, blood and urine analysis, and echocardiography were simultaneously performed. They were followed up for 12.5years (mean [± IQR]: 10.61 [± 3.11] years) and 174 events were recorded.
ResultsThe study included 405 patients (53.8% women), with a mean age of 55.5years. The estimated glomerular filtration rate according to the MDRD and CKD-EPI equations was 73.9±2.6mL/min/1.73m2 and 76.9±2.2mL/min/1.73m2, respectively. The prevalence of chronic kidney disease was 31.6% and 23.9%, respectively. Using the CKD-EPI equation led to the re-classification of 22.9% of patients. The incidence rate ratio (IRR [95%CI] for chronic kidney disease identified by the MDRD equation was 2.4 [1.8-3.3], and for the CKD-EPI calculation it was 2.5 [1.8 to 3.3]).
ConclusionsBoth equations estimate similar magnitudes of renal function, although the CKD-EPI equation has less false positives, and both have similar prognostic values in patients at high cardiovascular risk as well those at low risk.
Las manifestaciones asintomáticas en los órganos diana (vasos arteriales periféricos, cerebro, riñón y corazón) constituyen estadios intermedios cruciales en el continuum cardiovascular1 que condicionan en los pacientes hipertensos un mayor riesgo de sufrir un evento cardiovascular mortal o no mortal1,2. Entre estas lesiones subclínicas de órganos diana incluimos la hipertrofia ventricular izquierda (HVI)3, la arteriopatía periférica asintomática4, el deterioro del filtrado glomerular estimado (DFGE)3,5 y la microalbuminuria (MAL)6.
En el caso particular de la lesión renal subclínica, en el paciente hipertenso se expresa de 2 formas diferentes, como si fuesen las 2 caras de una misma moneda: por un lado, el descenso del filtrado glomerular estimado (DFGE), que también se denomina enfermedad renal oculta (ERO), cuando la creatinina sérica es normal, o enfermedad renal crónica (ERC) de forma más genérica e independientemente de la creatinina, y por el otro, un aumento de la permeabilidad glomerular expresada como microalbuminuria (MAL). La evidencia más reciente confirma que tanto la MAL como la ERC, además de ser reflejo del daño que origina la hipertensión arterial (HTA) en el riñón, condicionan un incremento del riesgo no solo de enfermedad renal terminal sino de sufrir eventos cardiovasculares7.
El mejor índice para valorar la función renal es la medida del filtrado glomerular (FG), y habitualmente se ha empleado la creatinina sérica para poder estimarlo, pero se ve afectada a causa de distintas fuentes de variabilidad biológica, múltiples interferencias analíticas e importantes problemas de estandarización. El aclaramiento de creatinina en orina de 24h y las ecuaciones (como la fórmula de Cockcroft-Gault8 o la ecuación Modification of Diet in Renal Disease [MDRD])9 que estiman el FG son más precisas que la creatinina sérica aislada, ya que la relación de la creatinina con el FG no es lineal, tiene una baja sensibilidad a la hora de detectar la insuficiencia renal crónica y no detecta la insuficiencia renal oculta.
La ecuación MDRD se ha generalizado como la preferida para estimar el FG10. Sin embargo, a pesar de mostrar una correcta precisión en pacientes con enfermedad renal, en pacientes sin microalbuminuria ni marcadores de enfermedad renal pierde eficacia11. Frente a esto, Levey et al.12 han propuesto recientemente una nueva ecuación que permitiría estimar el FG evitando estas limitaciones.
A pesar de que en las recomendaciones de la ESH y ESC, recientemente publicadas13, se recoge el uso de las 3 ecuaciones para la estimación del FG y evaluar el daño renal, todavía no se ha evaluado el papel pronóstico de la ecuación CKD-EPI. Por ello, se planteó el presente estudio con el objetivo de comparar el valor predictivo, en el pronóstico cardiovascular, de ambas fórmulas en los pacientes hipertensos, atendiendo además a otros criterios pronósticos como la variabilidad circadiana de la presión arterial (VCPA) y de la presencia de otras lesiones de órganos diana (LOD).
Material y métodosPacientesSe diseñó un estudio longitudinal retrospectivo con una muestra no seleccionada de 405 pacientes que fueron consultados en la Unidad de Hipertensión y Riesgo Vascular del Hospital Clínico Universitario de Santiago de Compostela entre el 1 de enero de 1998 y el 31 de agosto de 1999 con el diagnóstico de HTA esencial, sin límite de edad, sin enfermedad cardiovascular y a los que se les realizó un estudio de monitorización ambulatoria de presión arterial (MAPA) y ecocardiográfico simultáneamente. Las medidas de presión arterial (PA) clínica y ambulatoria y los estudios ecocardiográficos ya han sido descritos en publicaciones previas14.
El seguimiento de los pacientes se realizó mediante la revisión de las historias clínicas hasta el 31 de mayo de 2010, registrando el tipo de evento, entendiendo como tal cuando se cumplían los criterios diagnósticos establecidos por las sociedades científicas13 (enfermedad arterial periférica, cardiopatía isquémica, insuficiencia cardíaca o ictus) y, en caso de existir, la causa de mortalidad, así como la fecha de los mismos.
Valoración de la función renalEl filtrado glomerular estimado (FGe) se ha calculado a partir de la creatinina plasmática a través de las 2 ecuaciones.
La fórmula MDRD simplificada9 se calculó empleando la ecuación: (FGe (ml/min/1,73m2)=186×[creatinina plasmática (mg/dl)−100,154×edad−000,203×(0,742 si es mujer)×(1,212 si es de raza negra)]); y la fórmula CKD-EPI se calculó empleando las diferentes ecuación según sexo y creatinina plasmática: si es mujer y creatinina plasmática (CP)≤0,70mg/dl: FG=144 (CP/0,7)−0,329(0,993)edad, si es mujer y CP>0,70mg/dl: FG=144 (CP/0,7)−100,209(0,993)edad, si es varón y CP≤0,90mg/dl: FG=144 (CP/0,9)−0.411(0,993)edad, si es varón y CP>0,90mg/dl: FG=144 (CP/0,9)−100,209(0,993)edad12.
La ERC se definió por presencia de FGe inferior a 60ml/min/1,73m2, y se clasifica, según la Clinical Practice Guidelines of Chronic Kidney Disease (K/DOQI)10,15,16, en:
- •
Estadio 1: FGe>90ml/min/1,73m2.
- •
Estadio 2: FGe=60-89ml/min/1,73m2.
- •
Estadio 3: FGe=30-59ml/min/1,73m2.
- •
Estadio 4: FGe=15-29ml/min/1,73m2.
- •
Estadio 5: FGe<15ml/min/1,73m2.
La EUA en 24h se midió a través de radioinmunoanálisis (RIA), recogida durante 24h en las que el paciente debe evitar la realización de ejercicio físico, excepto las actividades cotidianas de la vida diaria. La eliminación urinaria de albúmina (EUA) en 24h se consideró MAL en los casos con cifras comprendidas entre 30mg/24h y 300mg/24h10,15,16.
Análisis estadísticoPara el procesamiento y análisis de los datos se utilizaron los paquetes estadísticos G-STAT 2.0 para Windows y EPIDAT 3.1 (Programa de Análisis Epidemiológico de Datos Tabulados; Consellería de Sanidade-Xunta de Galicia y Organización Panamericana de la Salud). El análisis estadístico univariante y bivariante ha sido descrito en publicaciones previas14. En el seguimiento de ambas cohortes se calculó la densidad o tasa de incidencia (TI) para los eventos cardiovasculares, en función de los diferentes factores de riesgo y se obtuvo la razón de tasas de incidencia (RTI) para los mismos. Se obtuvieron las curvas de Kaplan-Meier para la existencia de ERO (empleando las 3 ecuaciones). Se consideraron diferencias estadísticamente significativas las que mostraban valores de p<0,05.
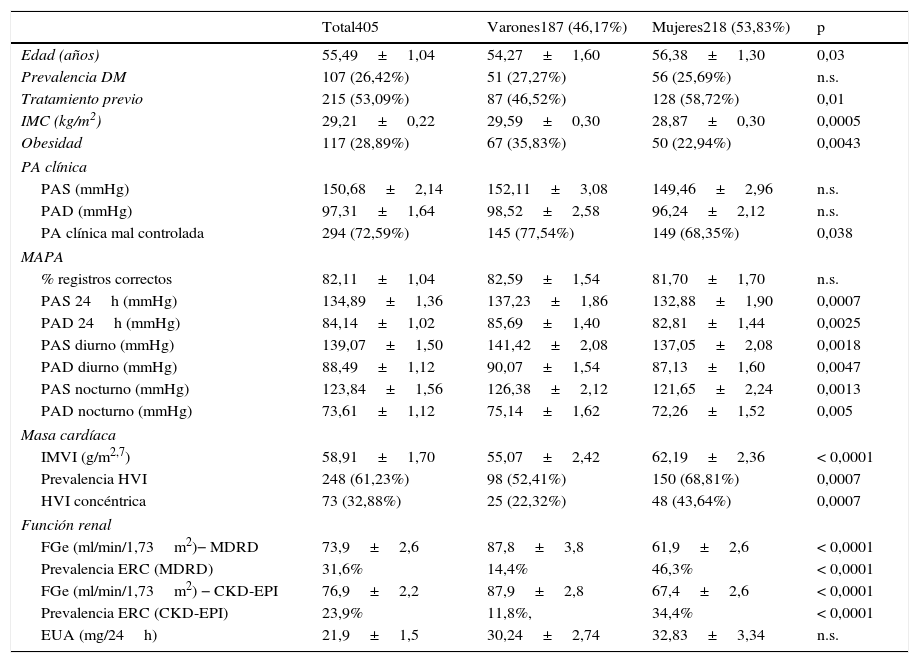
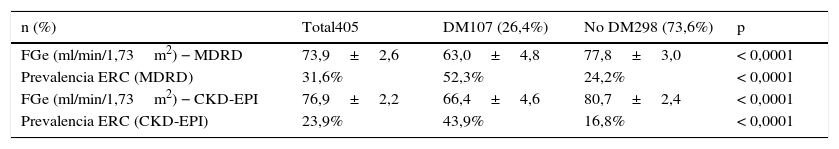
ResultadosLa muestra final incluyó 405 pacientes, con una ligera mayoría de mujeres (218, 53,8%) y una edad media de 55,5±1,1años. El resto de características clínicas y epidemiológicas, así como los datos de grado de control de PA clínica y ambulatoria se muestran en la tabla 1 y también en publicaciones anteriores de la cohorte14. En ambos métodos de medida la función renal era menor en pacientes diabéticos (tabla 2). Los FGe aportados por las fórmulas MDRD y CKD-EPI fue similar (73,9±2,6ml/min/1,73m2 y 76,9±2,2ml/min/1,73m2, respectivamente), así como la prevalencia de ERC (31,6 y 23,9%, respectivamente) (tablas 1 y 2), con un coeficiente de correlación entre ambas ecuaciones de 0,9467 (p<0,0001).
Datos clínicos y epidemiológicos de la muestra
| Total405 | Varones187 (46,17%) | Mujeres218 (53,83%) | p | |
|---|---|---|---|---|
| Edad (años) | 55,49±1,04 | 54,27±1,60 | 56,38±1,30 | 0,03 |
| Prevalencia DM | 107 (26,42%) | 51 (27,27%) | 56 (25,69%) | n.s. |
| Tratamiento previo | 215 (53,09%) | 87 (46,52%) | 128 (58,72%) | 0,01 |
| IMC (kg/m2) | 29,21±0,22 | 29,59±0,30 | 28,87±0,30 | 0,0005 |
| Obesidad | 117 (28,89%) | 67 (35,83%) | 50 (22,94%) | 0,0043 |
| PA clínica | ||||
| PAS (mmHg) | 150,68±2,14 | 152,11±3,08 | 149,46±2,96 | n.s. |
| PAD (mmHg) | 97,31±1,64 | 98,52±2,58 | 96,24±2,12 | n.s. |
| PA clínica mal controlada | 294 (72,59%) | 145 (77,54%) | 149 (68,35%) | 0,038 |
| MAPA | ||||
| % registros correctos | 82,11±1,04 | 82,59±1,54 | 81,70±1,70 | n.s. |
| PAS 24h (mmHg) | 134,89±1,36 | 137,23±1,86 | 132,88±1,90 | 0,0007 |
| PAD 24h (mmHg) | 84,14±1,02 | 85,69±1,40 | 82,81±1,44 | 0,0025 |
| PAS diurno (mmHg) | 139,07±1,50 | 141,42±2,08 | 137,05±2,08 | 0,0018 |
| PAD diurno (mmHg) | 88,49±1,12 | 90,07±1,54 | 87,13±1,60 | 0,0047 |
| PAS nocturno (mmHg) | 123,84±1,56 | 126,38±2,12 | 121,65±2,24 | 0,0013 |
| PAD nocturno (mmHg) | 73,61±1,12 | 75,14±1,62 | 72,26±1,52 | 0,005 |
| Masa cardíaca | ||||
| IMVI (g/m2,7) | 58,91±1,70 | 55,07±2,42 | 62,19±2,36 | < 0,0001 |
| Prevalencia HVI | 248 (61,23%) | 98 (52,41%) | 150 (68,81%) | 0,0007 |
| HVI concéntrica | 73 (32,88%) | 25 (22,32%) | 48 (43,64%) | 0,0007 |
| Función renal | ||||
| FGe (ml/min/1,73m2)− MDRD | 73,9±2,6 | 87,8±3,8 | 61,9±2,6 | < 0,0001 |
| Prevalencia ERC (MDRD) | 31,6% | 14,4% | 46,3% | < 0,0001 |
| FGe (ml/min/1,73m2) − CKD-EPI | 76,9±2,2 | 87,9±2,8 | 67,4±2,6 | < 0,0001 |
| Prevalencia ERC (CKD-EPI) | 23,9% | 11,8%, | 34,4% | < 0,0001 |
| EUA (mg/24h) | 21,9±1,5 | 30,24±2,74 | 32,83±3,34 | n.s. |
Función renal, por ambas fórmulas, en pacientes diabéticos
| n (%) | Total405 | DM107 (26,4%) | No DM298 (73,6%) | p |
|---|---|---|---|---|
| FGe (ml/min/1,73m2) − MDRD | 73,9±2,6 | 63,0±4,8 | 77,8±3,0 | < 0,0001 |
| Prevalencia ERC (MDRD) | 31,6% | 52,3% | 24,2% | < 0,0001 |
| FGe (ml/min/1,73m2) − CKD-EPI | 76,9±2,2 | 66,4±4,6 | 80,7±2,4 | < 0,0001 |
| Prevalencia ERC (CKD-EPI) | 23,9% | 43,9% | 16,8% | < 0,0001 |
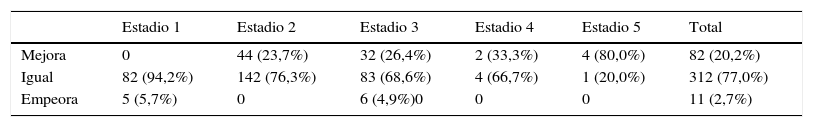
Cuando se consideran los 5 estadios de ERC, las 2 fórmulas ofrecieron resultados similares en el cálculo del FGe: 21,5, 46,9, 29,9, 1,5 y 0,2% para MDRD, y 31,4, 44,7, 22,7, 0,9 y 0,2% para CKD-EPI. Tomando como referencia el FGe calculado por la fórmula MDRD, los resultados obtenidos por la ecuación CKD-EPI obligaron a reclasificar en los 5 estadios de ERC a 93 pacientes (22,9%); mejoraron de estadio 82 pacientes (20,2%) y empeoraron 11 pacientes (2,7%) (tabla 3).
Cambio en el estadio de función renal, tomando como referencia la fórmula MDRD, y tras aplicar la ecuación CKD-EPI
| Estadio 1 | Estadio 2 | Estadio 3 | Estadio 4 | Estadio 5 | Total | |
|---|---|---|---|---|---|---|
| Mejora | 0 | 44 (23,7%) | 32 (26,4%) | 2 (33,3%) | 4 (80,0%) | 82 (20,2%) |
| Igual | 82 (94,2%) | 142 (76,3%) | 83 (68,6%) | 4 (66,7%) | 1 (20,0%) | 312 (77,0%) |
| Empeora | 5 (5,7%) | 0 | 6 (4,9%)0 | 0 | 0 | 11 (2,7%) |
El análisis de la PA, en ambas fórmulas, mostró mayor PAS nocturna en pacientes con enfermedad renal (127,7±3,0mmHg vs 122,0±1,7mmHg, p=0,0007, para MDRD; 129,9±3,5mmHg vs 121,9±1,6mmHg, p<0,0001, para CKD-EPI), y por lo tanto la profundidad de la PA nocturna fue menor (5,9±1,9% vs 12,8±0,9%, p<0,0001, para MDRD; 4,3±2,2% vs 12,6±0,8%, p<0,0001, para CKD-EPI), lo cual se traduce en una mayor prevalencia de perfiles riser y no dipper en enfermos renales (60,8 y 45,1%, respectivamente, para MDRD, y 54,9 y 35,2%, respectivamente, para CKD-EPI).
Paralelamente, ambas fórmulas demostraron mayor prevalencia de enfermedad renal en pacientes con HVI (42,3% vs 14,6%, p<0,0001, para MDRD; y 33,5% vs 8,9%, p<0,0001, para CKD-EPI) y MAL (58,7% vs 17,6%, p<0,0001, para MDRD; y 48,5% vs 11,2%, p<0,0001, para CKD-EPI).
En el análisis longitudinal, el seguimiento de los 405 pacientes aportó una observación de 3.721,67 pacientes-año. Durante los 12,5años de seguimiento (mediana [±RiQ]: 10,61 [±3,11] años) se registraron 174 eventos, lo que supone una densidad de incidencia (DI) de 4,68 eventos/100 pacientes-año, y 22 fallecimientos, de los cuales 13 fueron de causa cardiovascular. Entre los eventos se observaron 21 casos de enfermedad arterial periférica (EAP) (DI: 0,56/100 pacientes-año), 59 de cardiopatía isquémica (DI: 1,59/100 pacientes-año), 56 de insuficiencia cardíaca (DI: 1,50/100 pacientes-año) y 38 ictus (DI: 1,02/100 pacientes-año). Entre los fallecimientos se observaron 5 por cardiopatía isquémica, 5 por insuficiencia cardíaca y 3 por ictus.
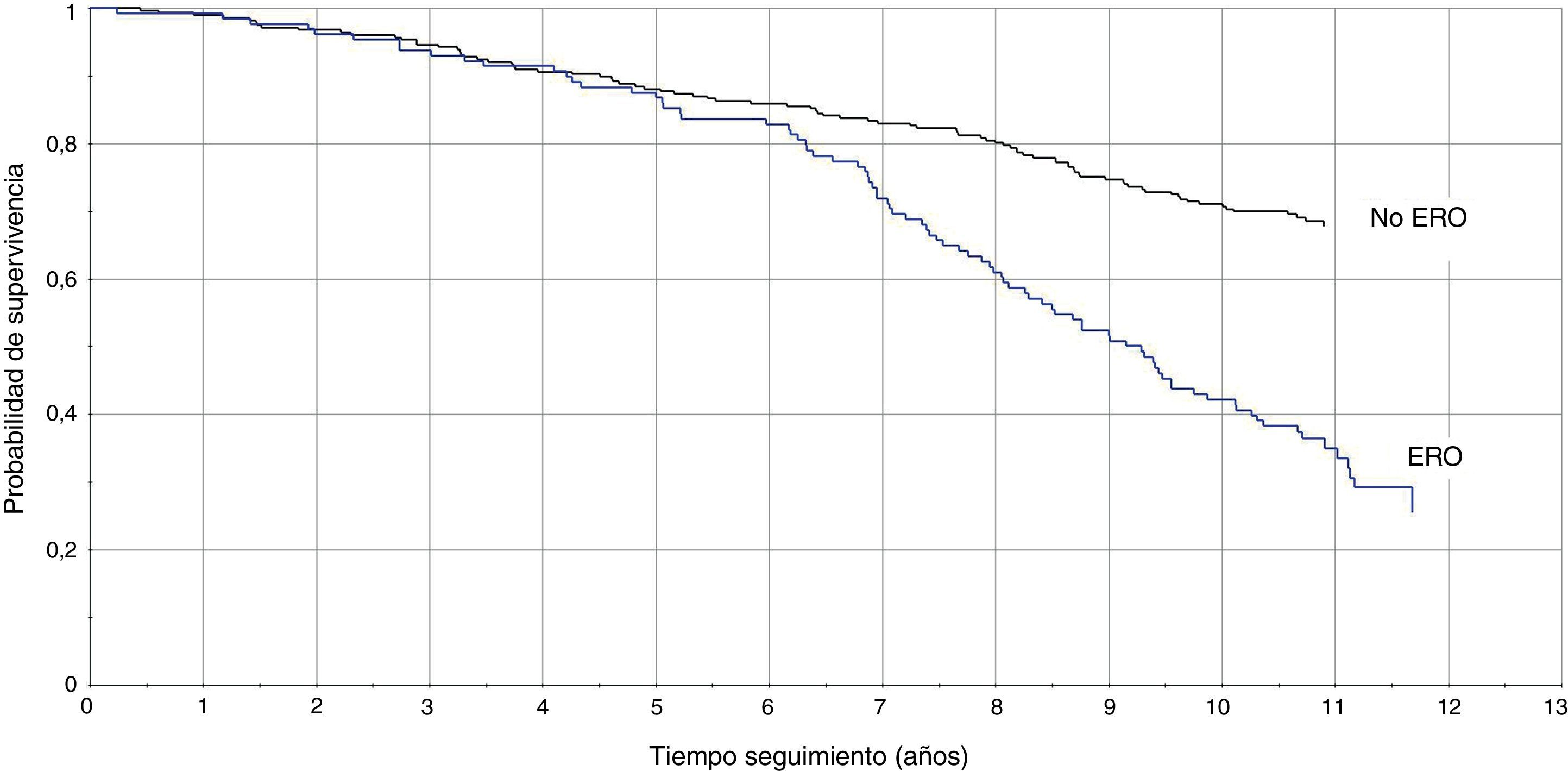
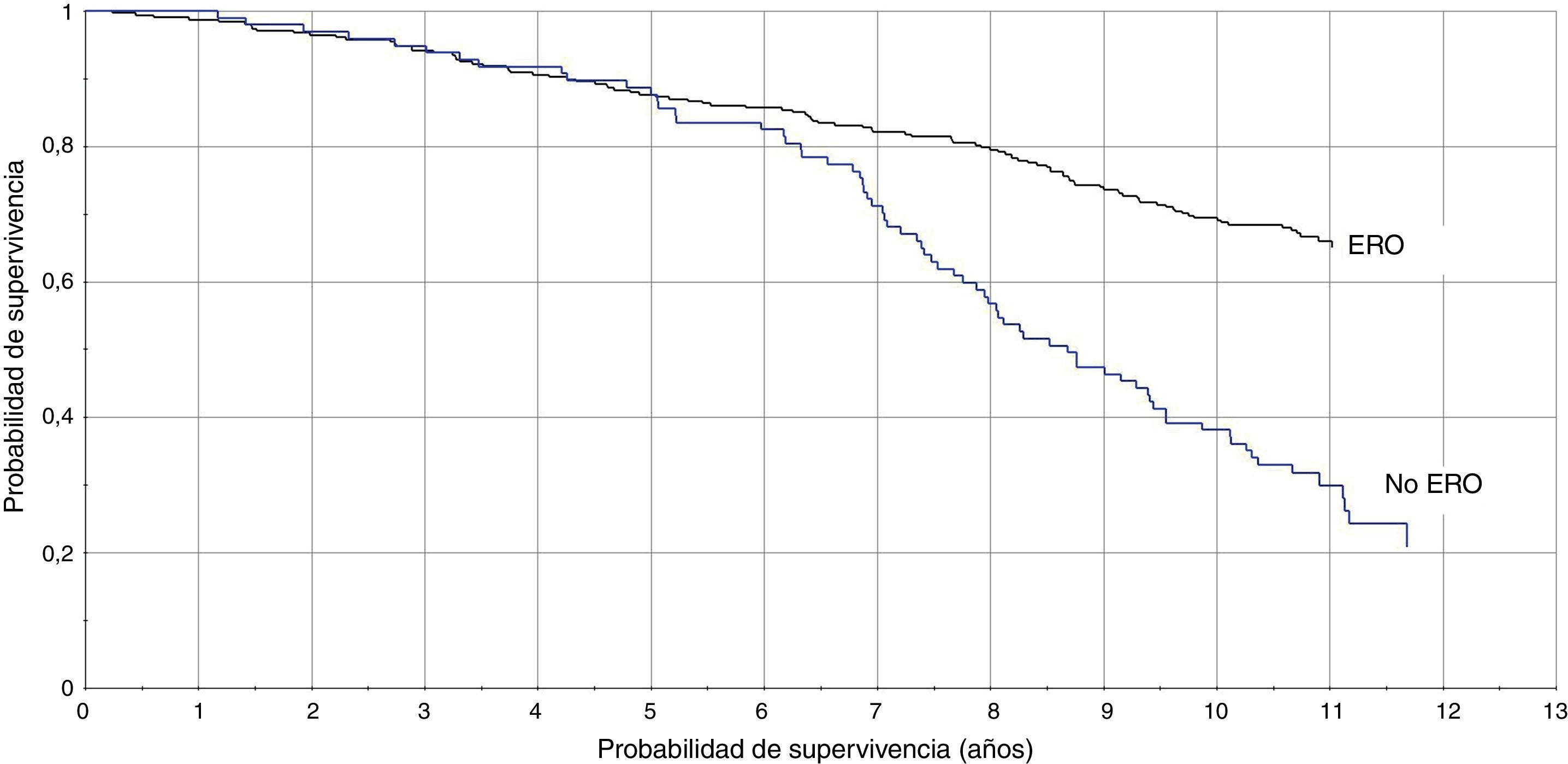
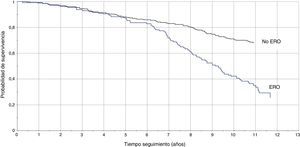
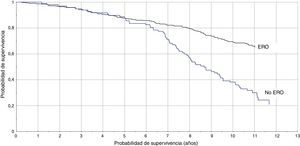
La TI en pacientes con DFGE calculado por la ecuación MDRD fue de 8,1/100 pacientes/año vs 3,3/100 pacientes/año (RTI [IC95%]: 2,4 [1,8-3,3]), y calculado con CKD-EPI fue de 8,8/100 pacientes/año vs 3,5/100 pacientes/año (RTI [IC95%]: 2,5 [1,8-3,3]). En las figuras 1 y 2 se representan las curvas de Kaplan-Meier para ambas formas de estimación. En las tablas 4 y 5 se presenta la razón de tasas para la ERC, por ambas ecuaciones, en función de la coexistencia de otras LOD, y se comprueba que la existencia de ERC se asocia a peor pronóstico cardiovascular, especialmente en los pacientes con otras LOD.
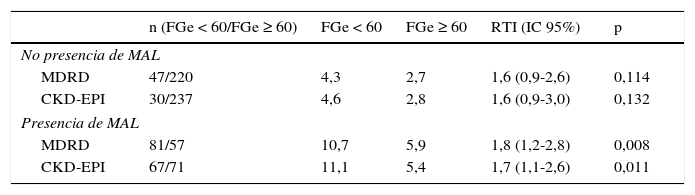
Razón de tasas en los pacientes con deterioro del FGe según las ecuaciones, en función de la existencia simultánea de microalbuminuria
| n (FGe < 60/FGe ≥ 60) | FGe < 60 | FGe ≥ 60 | RTI (IC 95%) | p | |
|---|---|---|---|---|---|
| No presencia de MAL | |||||
| MDRD | 47/220 | 4,3 | 2,7 | 1,6 (0,9-2,6) | 0,114 |
| CKD-EPI | 30/237 | 4,6 | 2,8 | 1,6 (0,9-3,0) | 0,132 |
| Presencia de MAL | |||||
| MDRD | 81/57 | 10,7 | 5,9 | 1,8 (1,2-2,8) | 0,008 |
| CKD-EPI | 67/71 | 11,1 | 5,4 | 1,7 (1,1-2,6) | 0,011 |
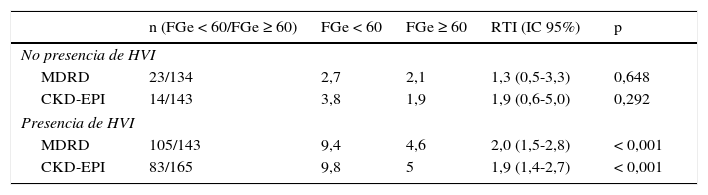
Razón de tasas en los pacientes con deterioro del FGe según ambas ecuaciones, en función de la existencia simultánea de hipertrofia ventricular izquierda
| n (FGe < 60/FGe ≥ 60) | FGe < 60 | FGe ≥ 60 | RTI (IC 95%) | p | |
|---|---|---|---|---|---|
| No presencia de HVI | |||||
| MDRD | 23/134 | 2,7 | 2,1 | 1,3 (0,5-3,3) | 0,648 |
| CKD-EPI | 14/143 | 3,8 | 1,9 | 1,9 (0,6-5,0) | 0,292 |
| Presencia de HVI | |||||
| MDRD | 105/143 | 9,4 | 4,6 | 2,0 (1,5-2,8) | < 0,001 |
| CKD-EPI | 83/165 | 9,8 | 5 | 1,9 (1,4-2,7) | < 0,001 |
El presente estudio es el primero que analiza, en una cohorte de pacientes hipertensos, el valor pronóstico de las 2 ecuaciones más recomendadas10,13 para estimar el FG, en función de la variabilidad de la PA ambulatoria y de la presencia de otras LOD como la MAL y la HVI. Los resultados muestran, en ambas formas de estimación y con una magnitud similar, que la existencia de ERC se asocia a peor pronóstico cardiovascular, especialmente en los pacientes de alto riesgo (con otras LOD o PA nocturna mayor).
Nuestro trabajo lo hemos centrado en comparar las ecuaciones MDRD y CKD-EPI, ya que la fórmula de Cockcroft-Gault está cayendo progresivamente en desuso en la práctica clínica habitual. La principal diferencia entre ambas ecuaciones radica en su validación original. MDRD fue una ecuación desarrollada a partir de una población con enfermedad renal, donde mantiene una elevada precisión, por lo que su posterior generalización al resto de población para identificar lesión renal subclínica y evaluar el riesgo cardiovascular9,17 hace que sea menos eficaz. Frente a ello, Levey et al.12 han propuesto una nueva ecuación obtenida de una población sin enfermedad renal.
Al comparar la estimación del FG obtenido por ambas ecuaciones hemos observado que es superior al calcularlo por CKD-EPI, tanto globalmente para la totalidad de la muestra como para todos los estadios de la ERC (excepto en el estadio1, que carece de importancia porque tanto el estadio1 como el2 son de normalidad), o subpoblaciones analizadas (sexo, DM, MAL e HVI). Estos resultados van en consonancia con lo publicado por la mayoría de autores18-20, aunque estudios poblaciones como el de Montañés Bermúdez21 y Esteve Poblador22 identifican valores inferiores para esta ecuación.
Como es lógico y cabría esperar, la prevalencia de ERC calculada por CKD-EPI es menor: 31,6 y 23,9%, aunque en ambos casos ligeramente superiores a las aportadas por el estudio EROCAP23. Esta diferencia se puede explicar por las diferentes muestras empleadas: el estudio EROCAP es un estudio poblacional, y nuestra muestra está obtenida de una unidad especializada y la componen hipertensos mal controlados y presumiblemente de alto riesgo cardiovascular.
Nuestro estudio avalaría el principal argumento que defiende el uso de la fórmula CKD-EPI, al calcular un mayor FG y menor tasa de falsos positivos que MDRD17, lo que permitiría una modificación del estadio de los pacientes, preferentemente desde el estadio3 hacia estadios de normalidad. En nuestra muestra se reclasificaron el 26,4% de los pacientes clasificados en estadio3 por MDRD, lo que justifica la diferencia entre prevalencias identificadas por ambas ecuaciones comentada anteriormente, cifras similares a las aportadas por otros autores21, aunque sin olvidar que no son pocos los autores que encuentran esta modificación de estadio como algo anecdótico (menos del 5% de los pacientes cambiaban de estadio)18,20,22. A pesar de estas diferencias entre ambas fórmulas, la correlación entre ambas fórmulas ha sido bastante alta (0,947) y coincide con lo publicado por otros autores20,24.
En cuanto al papel pronóstico de la ERC, se conoce el papel que presenta en un peor pronóstico cardiovascular25, y en nuestro estudio el análisis pronóstico de los pacientes con ERC calculado por ambas fórmulas mostró riesgos elevados y prácticamente idénticos para las 2 formas de estimación. Además, este mal pronóstico era especialmente destacable cuando coexistían otras LOD (como HVI y MAL), como ya han demostrado otros autores26,27, posiblemente por la existencia de un mecanismo fisiopatológico común, como es el desarrollo del proceso aterosclerótico, donde la afectación renal (nefropatía) desempeña un papel fundamental adyuvante en la evolución y continuum de la enfermedad cardiovascular1,28. Podría haber sido interesante el análisis pronóstico de cada estadio; sin embargo, el pequeño tamaño muestral de alguno de los subgrupos hace imposible hacer un estudio estadístico de garantías.
Si queremos analizar el pronóstico cardiovascular de los pacientes con ERC no debemos olvidar el papel que juega la HTA tanto en la lesión renal como en el propio pronóstico cardiovascular. Para ello decidimos emplear la MAPA, que nos permite establecer el perfil circadiano de la PA, y observamos que la ERC era más frecuente en pacientes con los perfiles circadianos que implicaban PA nocturnas superiores, no dipper y riser. Estos resultados son importantes porque señalan que el descenso o pérdida de la profundidad de la PA ambulatoria nocturna es un factor predictor pronóstico de lesión en órganos diana y de morbimortalidad cardiovascular29.
Entre las limitaciones de nuestro estudio debe tenerse en cuenta el desconocimiento del verdadero valor del FG, ya que no disponemos de una medida directa del mismo a partir de un método de referencia, aunque cualquiera de las 3 ecuaciones empleadas ha sido correctamente validada8,9,12. Nuestros resultados de prevalencia coinciden con los obtenidos por Levey et al.12 en cuanto a la reasignación de los pacientes a estadios superiores de ERC, que afecta de modo especial al grupo catalogado como ERC estadio3 por MDRD; y en cuanto a los resultados pronósticos, son biológicamente plausibles. En cuanto a la estimación del FG, también debemos comentar la falta de estandarización en la determinación de creatinina en los años en los que se ha realizado la recogida de datos, aunque este aspecto podría ser menor teniendo en cuenta que siempre se realizaron todas las determinaciones en el mismo laboratorio, por lo que ambas formas de estimar el FG pueden ser igualmente comparables. Finalmente, en cuanto a la estratificación de la enfermedad renal crónica, las guías más actuales recomiendan la estratificación atendiendo de forma simultánea al FGe y la MAL15,16. Sin embargo, el objetivo principal de nuestro estudio fue analizar el valor pronóstico de las 2 fórmulas más empleadas para estimar el FG, por lo que parece más adecuada la estratificación exclusivamente por este último parámetro aisladamente.
Otra limitación es el propio diseño retrospectivo del estudio. Por un lado condiciona que no se ha podido establecer una aleatorización estratificada, y por otro lado condiciona un posible sesgo de información al necesitar disponer de toda la información en la historia clínica. Como hemos señalado14, solamente excluimos 13 pacientes por falta de información, de los cuales solamente 3 por falta de datos para estimar el FG, obteniendo un tamaño muestral adecuado que no afecta a las conclusiones del estudio, ya que se obtuvo una muestra con características clínico-epidemiológicas similares a la práctica clínica real14. Es cierto que tanto la EUA como la creatinina se estimaron con los métodos disponibles en los años 1998 y 1999, aunque están igualmente validados que los actuales.
El empleo de la MAPA ofrece otro problema, que es la baja reproducibilidad en el tiempo del perfil circadiano de los pacientes30. En cualquier caso, la MAPA se caracteriza por una menor varianza y una mayor reproducibilidad que las medidas casuales tanto en estudios a corto como a largo plazo31. La determinación de perfil non dipper (ND) en nuestro estudio, al igual que en la mayoría de los publicados en la literatura, viene determinado por un solo MAPA de 24h.
Por todo lo anteriormente expuesto, podemos concluir que ambas fórmulas estiman magnitudes semejantes de función renal, aunque la ecuación CKD-EPI evita falsos positivos y, junto con la MAL, puede detectar más precozmente la enfermedad renal. Además, ambas ecuaciones tienen similar valor pronóstico en pacientes tanto de alto como bajo riesgo cardiovascular. Se podría plantear que la ecuación CKD-EPI puede ser una forma de estimación útil y eficiente para estratificar el riesgo cardiovascular en pacientes de alto riesgo cardiovascular.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.