INTRODUCCIÓN
La disección aórtica (DA) consiste en un desgarro de la pared aórtica con la creación de una falsa luz en la capa media arterial. Se trata de una situación clínica crítica con elevada mortalidad, cuyo pronóstico está ligado en gran parte a un diagnóstico rápido que permita instaurar de forma precoz las medidas terapéuticas.
Desde un punto de vista fisiopatológico De Bakey hace una clasificación basada en un criterio anatómico y de extensión. Diferencia entre tipo I cuando la disección es originada en la aorta ascendente y se extiende afectando a cayado y aorta descendente, el tipo II está originada y confinada en aorta ascendente y el tipo III se origina en aorta descendente, que se extiende distalmente, bien limitándose a la aorta torácica (III a), bien hasta la aorta abdominal (III b). La clasificación más aceptada hoy es la del grupo de Stanford, centrada en la presencia o no de afectación de la aorta ascendente, pues independientemente del punto de origen, es lo que determina en la mayoría de las ocasiones el comportamiento de la disección, sus complicaciones y la actitud terapéutica. Distingue entre tipo A, que siempre compromete la aorta ascendente y de manera variable cayado y porción descendente, y tipo B con afectación exclusiva de la aorta descendente.
Presentamos dos casos de DA tipo A con un inicio poco habitual.
CASO 1
Se trata de una mujer de 89 años de edad con antecedentes de hipertensión arterial (HTA) de larga evolución, diabetes mellitus, hipercolesterolemia, insuficiencia renal crónica moderada y un episodio de isquemia aguda transitoria en tratamiento con antiagregantes. Hace 8 meses le fue implantado un marcapasos por bloqueo sinoauricular.
Acude a urgencias por presentar aumento progresivo de su disnea basal, precordalgia irradiada a escápulas, tos seca y sensación de debilidad en extremidades inferiores. En la exploración física destacaba tensión arterial (TA) de 210/100 mmHg y crepitantes bibasales en la auscultación; las pruebas complementarias (hemograma, bioquímica elemental, hemostasia, sistemático de orina, enzimas cardíacas, electrocardiograma [ECG] y radiografía [Rx] de tórax) no revelaron hallazgos significativos. Permanece en observación con tratamiento diurético y analgésico y es dada de alta con diagnóstico de insuficiencia cardíaca leve y crisis hipertensiva.
Dos semanas después acude de nuevo por expectoración hemoptoica de 4 días de evolución, sin fiebre, dolor torácico, disnea ni clínica infecciosa. La exploración física era normal con una TA 150/80 mmHg. Presentaba una glucemia de 178 mg/dl, creatinina 2,43 mg/dl y urea 128 mg/dl; el resto de las determinaciones analíticas, la Rx de tórax y el ECG fueron informados como normales. Fue dada de alta para estudio ambulatorio.
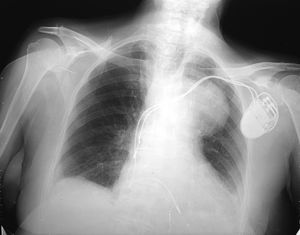
A las 24 horas la paciente vuelve a urgencias por nueva expectoración hemoptoica leve y durante su estancia presenta dorsalgia aguda y precordalgia opresiva. La Rx de tórax (fig. 1) muestra ensanchamiento mediastínico a expensas de aorta y en la tomografía axial computarizada (TAC) se observa un aneurisma del cayado aórtico, distal a la subclavia izquierda con un trombo adyacente y rotura contenida en contacto con el árbol bronco-vascular. Se descarta la opción quirúrgica y tras permanecer estable durante su ingreso es dada de alta. La paciente fallece 13 meses después por shock hipovolémico tras hemoptisis masiva por rotura del aneurisma aórtico, permaneciendo hasta ese momento asintomática.
Figura 1. Radiografía de tórax. Caso 1.
CASO 2
Presentamos el caso de un varón de 84 años de edad que consulta en urgencias por un cuadro de instauración brusca y de 2-3 horas de evolución de imposibilidad para movilizar ambas piernas, que se acompaña de sudoración profusa, náuseas y molestia epigástrica-interescapular. Tiene antecedentes de HTA de larga evolución, dislipidemia, fibrilación auricular crónica, cardiopatía isquémica crónica con un infarto agudo de miocardio (IAM) anterior hace 10 años e IAM no Q dos meses antes del episodio actual (realizándose entonces coronariografía), un accidente cerebrovascular agudo sin secuelas y resección gástrica hace 10 años por ulcus sangrante. Seguía tratamiento anticoagulante, antiagregante, nitritos, hipolipidemiantes, inhibidores de la enzima de conversión de la angiotensina (IECA) y diltiazem.
A su llegada se encuentra afectado por el dolor, con marcada palidez cutánea, mal prefundido, con TA de 85/55 mmHg en el brazo derecho y 90/70 mmHg en el brazo izquierdo, a 98 pulsaciones por minuto. En la exploración física destacan crepitantes bibasales, miembros inferiores edematosos, con pulsos distales bilaterales hasta poplíteos y no se palpan pulsos pedios. En la exploración neurológica se observa paraplejía en ambos miembros inferiores, simétrica, con reflejos miotáticos abolidos y anestesia hasta la sínfisis del pubis.
La analítica mostró hemoglobina de 11,9 g/dl, leucocitosis con desviación izquierda, creatinina 1,45 mg/dl, creatinfosfocinasa (CPK) 453 ng/ml (fracción MB y troponina I normales) y en la hemostasia un INR de 5,2, siendo el resto de las determinaciones normales. El ECG presentaba necrosis anterior antigua y la Rx torácica un ensanchamiento mediastínico con desdibujamiento del cayado aórtico.
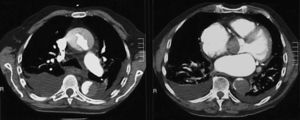
Se realizó una TAC toraco-abdominal (fig. 2), que demostró una disección aórtica tipo A desde la válvula aórtica hasta aorta abdominal infrarrenal, con alta sospecha de afectación de troncos supraaórticos. El componente que afecta a la aorta ascendente oblitera la luz verdadera en un 90% y afecta al cayado de forma casi circunferencial. En la aorta abdominal, menos dilatada, la luz verdadera se limita a la porción anterior, estando ocupada por la falsa luz y obliterada la cara posterior y la salida de las arterias medulares. El paciente falleció en situación de paraplejía establecida a las 24 horas.
Figura 2. Tomografía axial computarizada toraco-abdominal. Caso 2.
DISCUSIÓN
La incidencia de la DA se estima entre 5 y 30 casos por millón de habitantes y año1,2. Aproximadamente dos tercios presenta DA tipo A frente al tercio que presenta el tipo B. La edad de los pacientes afectados oscila entre los 50 y 60 años en las proximales (tipo A) frente a los 60 y 70 de las distales (tipo B)1,3. Predomina en varones con una razón que oscila entre 2:1 y 5:1 según las series1-4. La historia de HTA de larga evolución es, tras la edad, el factor que con mayor frecuencia se asocia a DA, encontrándose hasta en el 80% de los pacientes1,3,5; en torno al 30% tienen aterosclerosis1,2.
Presenta una elevada mortalidad, fundamentalmente en las primeras horas. Así, en la DA tipo A la mortalidad en pacientes no tratados es del 25% en la primera hora, aumentando el porcentaje entre 1 y 3 puntos por hora las primeras 24 horas, la primera semana la mortalidad asciende al 70% y al 80% en la segunda semana2. Con la instauración de tratamiento médico estas cifras disminuyen al 20% en las primeras 24 horas, al 30% a las 48 horas, al 40% a la semana y al 50% en el primer mes.
Debe sospecharse ante pacientes con historia de HTA de larga evolución y clínica típica de dolor, pues es la manifestación clínica más frecuente (95%)1. Es de comienzo brusco, de gran intensidad, localizado en tórax y migra a medida que avanza la disección. Puede irradiarse al cuello y la mandíbula en el caso de la DA tipo A, o al abdomen si se afecta la aorta descendente. Llama la atención que en el 28% de los casos el diagnóstico se realiza post-mortem y en el 38% la disección no se reconoce inicialmente1,6,7, por lo que resulta asimismo fundamental establecer el diagnóstico diferencial con cuadros con los que es frecuentemente confundida (procesos coronarios agudos, trastornos neurológicos, insuficiencia vascular periférica, insuficiencia aórtica sin DA, pericarditis aguda o tumores mediastínicos), así como conocer otras formas de comienzo atípicas, que suponen más del 15% de los casos.
En el 9,4% de los casos la DA se inicia como síncope1, sin signos de focalidad neurológica. Otra sintomatología, consecuencia de la progresión, se puede agrupar en 4 grupos:
Síndromes específicos de malperfusión al disminuir el flujo arterial hacia las diferentes ramas de la aorta. Las más frecuentes son las manifestaciones neurológicas, fundamentalmente isquemia cerebral (3-10%)2,3 por afectación de la carótida común o la innominada. También isquemia medular y afectación de los nervios periféricos. La hipoperfusión coronaria (15%) puede originar un infarto agudo de miocardio (2%)2,3. Pueden aparecer compromiso de la arteria renal (5-8%) y manifestaciones gastrointestinales (3-5%) entre otros. El déficit de pulsos es el signo más específico, hallándose entre el 20-50% de las ocasiones2,4.
La rotura aórtica, fundamentalmente en pericardio, pleura y con menor frecuencia en retroperitoneo, bronquios, esófago o incluso en ambas aurículas y en ventrículo derecho, origina taponamiento cardíaco, hemotórax, hemoptisis y hematemesis.
Insuficiencia aórtica por disección retrógrada, por dilatación de la raíz aórtica o bien por interferencia del flap intimal en el cierre valvular.
La compresión de estructuras vecinas puede causar síndrome de vena cava superior, síndrome de Horner, obstrucción bronquial, traqueal o disfagia.
Los dos casos presentados participan de los mecanismos patogénicos y fisiopatológicos invocados: el primero obedece a las consecuencias de una rotura diferida de la aorta (a través de una fístula aortobronquial), el segundo muestra cómo los primeros síntomas de flujo insuficiente pueden afectar a cualquier órgano (en este caso isquemia medular).
La DA típica (90%)4 comienza con un desgarro en la íntima aórtica, de manera que la capa media alterada queda expuesta a un flujo de sangre pulsátil a gran presión que consigue penetrar y, disecándola, crea una falsa luz entre la unión de los dos tercios externos con el tercio interno de dicha capa media. Recientemente se han descrito dos mecanismos fisiopatológicos diferentes al desgarro intimal primario que pueden conducir a una DA típica: el hematoma intramural8,9 y la úlcera aórtica ateroesclerótica penetrante10.
Los traumatismos aórticos directos o indirectos por desaceleración también pueden causar DA, aunque es más frecuente que produzcan desgarros localizados, hematomas o roturas aórticas francas2,3. Las DA de causa yatrogénica, generalmente complicaciones de cateterismos o de cirugía cardíaca, suponen un 5% del total1,2,11,12, conviene resaltar que el 15,9% de los pacientes con DA tipo A tiene antecedentes de cirugía cardíaca previa1.
En los dos casos presentados se puede identificar el antecedente de un intervencionismo endovascular (cateterismo/coronariografía), pudiendo invocarse como causa
desencadenante de un rasgado intimal, que etiopatogénicamente es el evento inicial que sucede en la DA. Mención aparte merece el tratamiento concomitante antiagregante plaquetario y anticoagulante.
En cualquier caso la sospecha clínica es la base del diagnóstico de esta entidad y cobra vital importancia en estos pacientes con formas atípicas de presentación, puesto que el tratamiento médico instaurado de forma precoz disminuye ostensiblemente la mortalidad.
Correspondencia:
C. de Burgos Lunar.
C/ Francisco de Diego, 1.
28040 Madrid. España.
Correo electrónico: carmenblunar@hotmail.com
Recibido el 26-04-05; aceptado para su publicación el 25-11-05.