Las iniciativas sobre integridad científica requieren recomendaciones específicas para ensayos clínicos aleatorizados (ECA).
ObjetivoElaborar un documento consenso internacional con recomendaciones específicas que fomenten la integridad de los ECA.
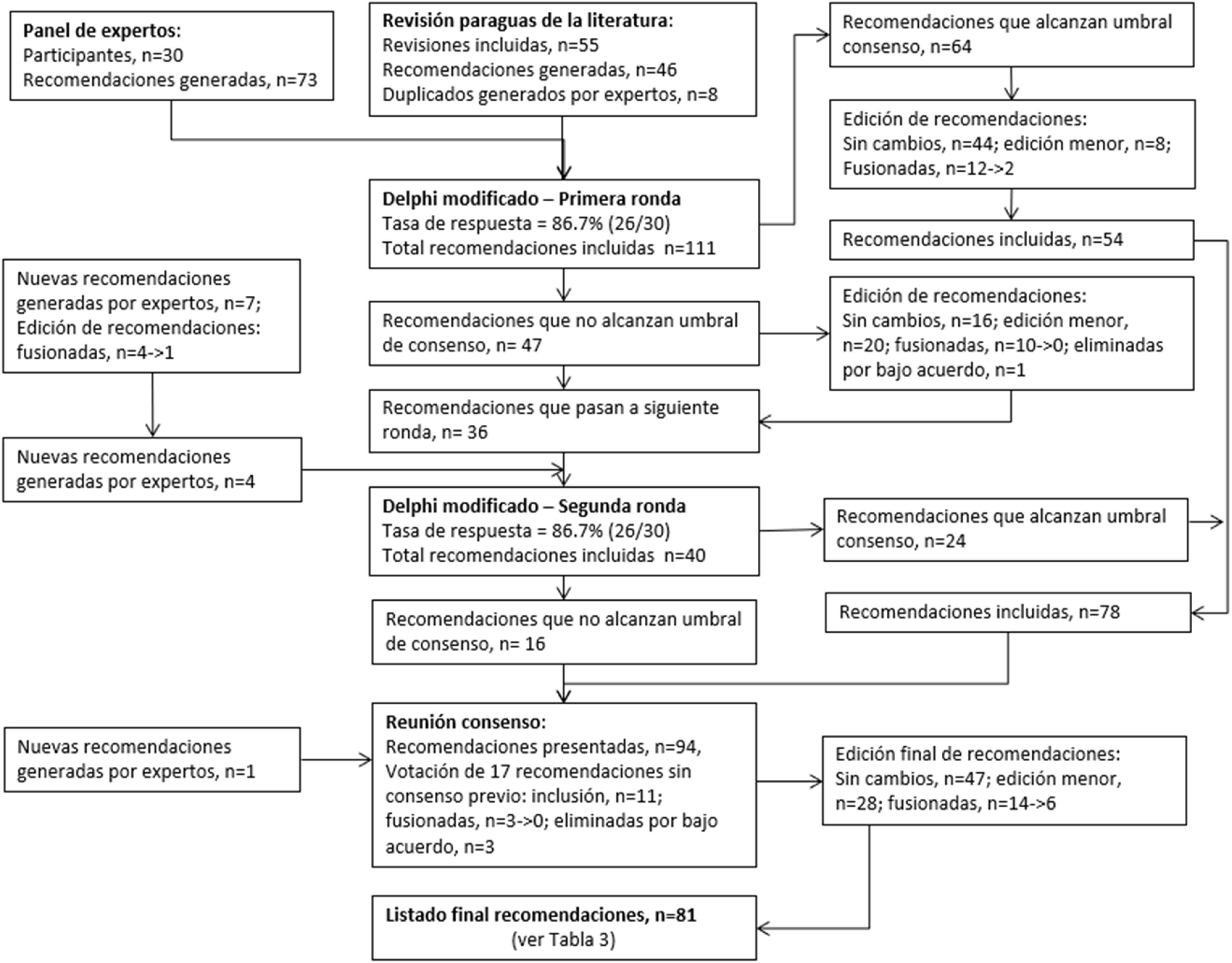
MétodosEl documento se desarrolló conforme la metodología específica en varios pasos: composición y activación de un grupo multidisciplinar e internacional de expertos; registro prospectivo de protocolo; síntesis de evidencia de 55 revisiones sistemáticas, encuestas Delphi modificada con reunión final de expertos para el desarrollo del consenso.
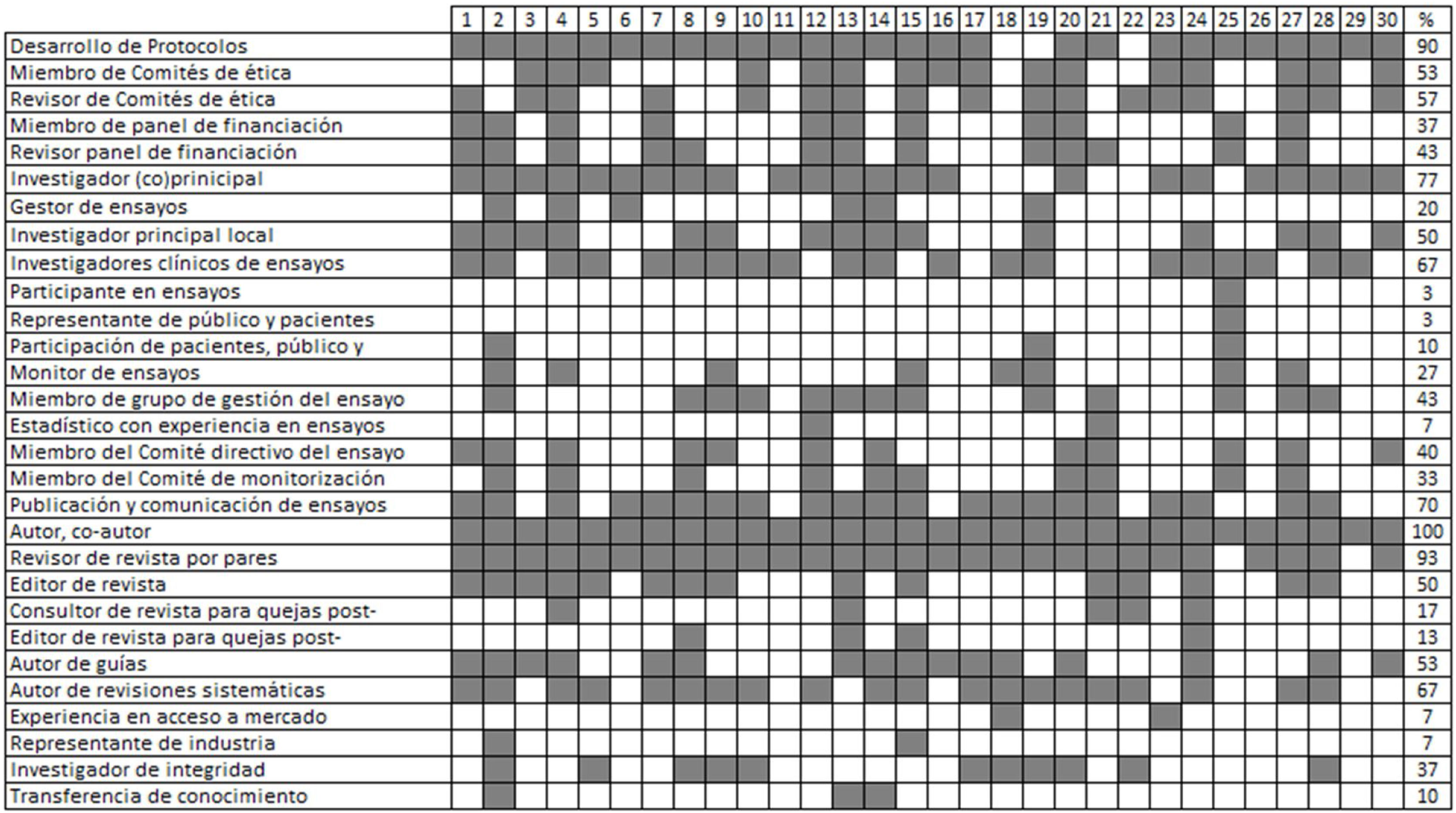
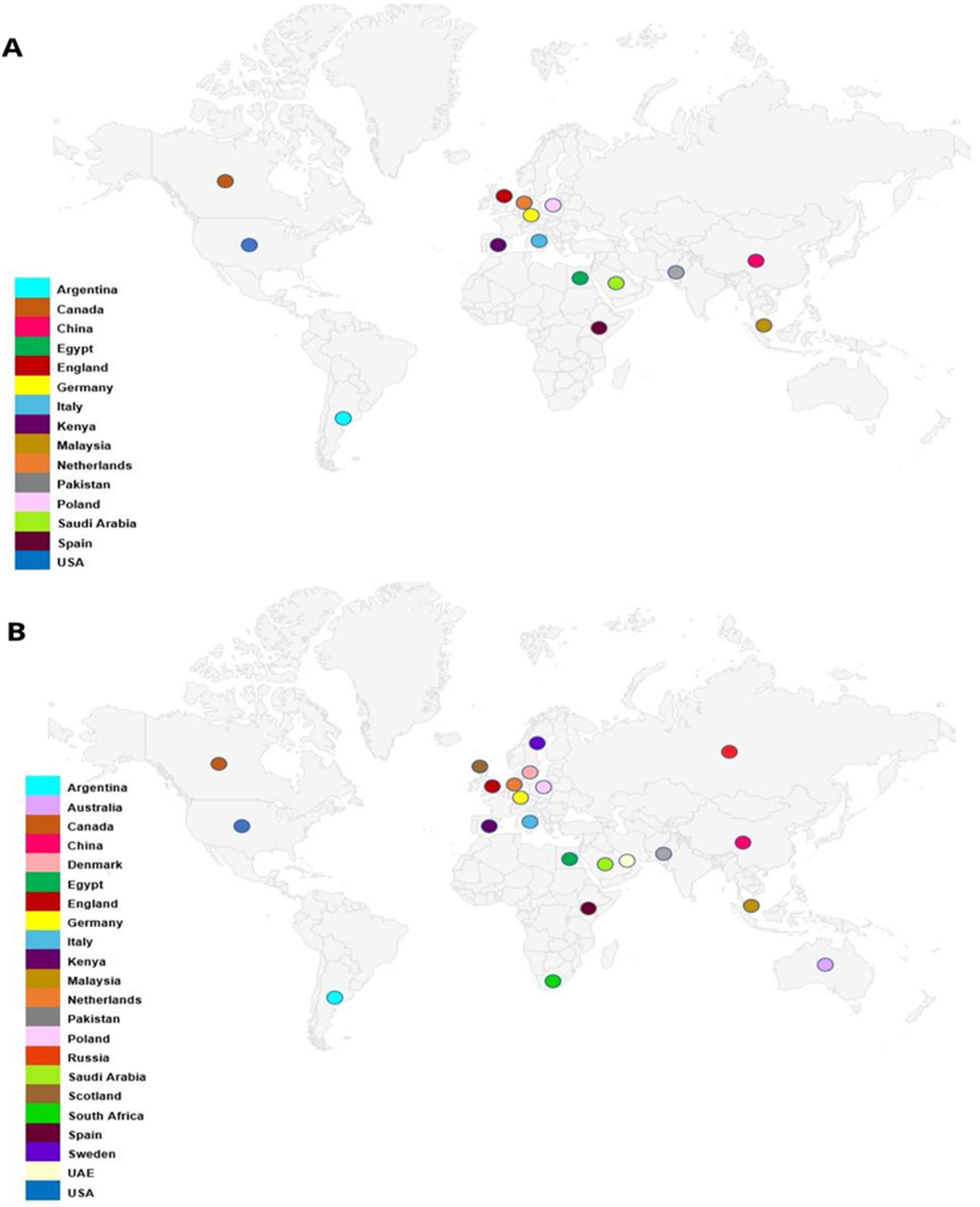
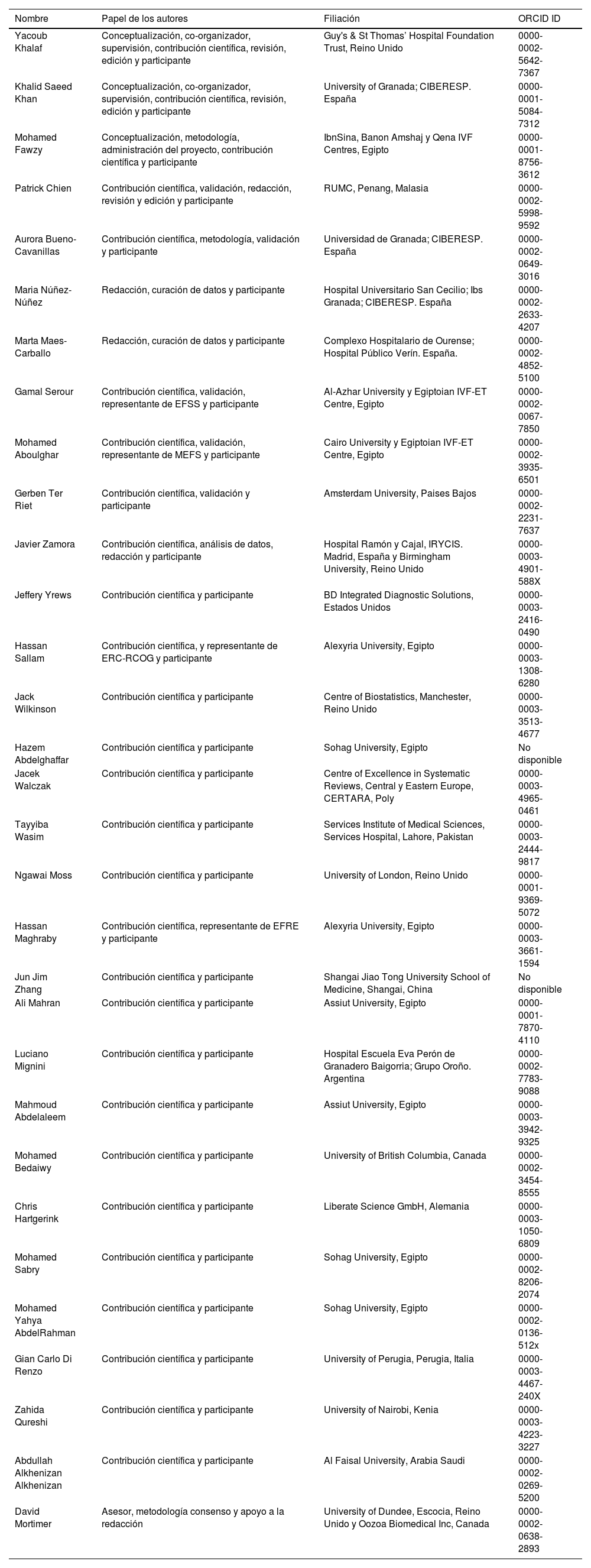
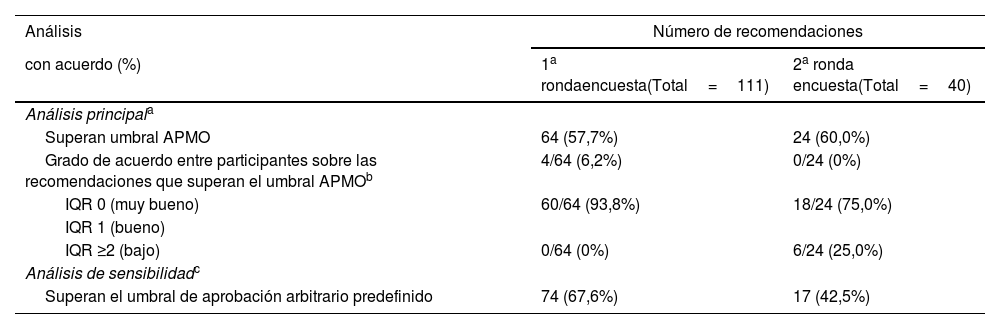
ResultadosParticiparon 30 expertos en diversas áreas (ensayos clínicos, ética, metodología, estadística, revisiones sistemáticas, legislación, representantes de pacientes y de la industria, miembros de comités de financiación, autores, editores y revisores de revistas) que representaban a 15 países de los cinco continentes. La tasa de respuesta a la encuesta Delphi fue del 86,7% (26/30 expertos). A través de la metodología de consenso aplicada, se consolidaron 81 recomendaciones (49 proporcionadas por los expertos, 41 generadas por la revisión sistemática y nueve apoyadas por ambas) abarcando todo el ciclo de vida de los ECA: aspectos generales (n=6), diseño y la aprobación (n=11), realización y seguimiento (n=19), comunicación de protocolos y resultados (n=20), fase de pospublicación (n=12) y futuras líneas de investigación y desarrollo (n=13).
ConclusiónSe espera que la aplicación de este conjunto de recomendaciones mejore la integridad de los ECA.
Science integrity initiatives require specific recommendations for randomised clinical trials (RCT).
ObjectiveTo prepare a set of statements for RCT integrity through an international multi-stakeholder consensus.
MethodsThe consensus was developed via multi-country multidisciplinary stakeholder group composition and engagement; evidence synthesis of 55 systematic reviews concerning RCT integrity; anonymised two-round modified Delphi survey with consensus threshold based on the average percent of majority opinions; and, a final consensus development meeting.
ResultsThere were 30 stakeholders representing 15 countries from 5 continents including trialists, ethicists, methodologists, statisticians, consumer representative, industry representative, systematic reviewers, funding body panel members, regulatory experts, authors, journal editors, peer-reviewers and advisors for resolving integrity concerns. Delphi survey response rate was 86.7% (26/30 stakeholders). There were 111 statements (73 stakeholder-provided, 46 systematic review-generated, 8 supported by both) in the initial long list, with 8 additional statements provided during the consensus rounds. Through consensus the final set consolidated 81 statements (49 stakeholder-provided, 41 systematic review-generated, 9 supported by both). The entire RCT life cycle was covered by the set of statements including general aspects (n=6), design and approval (n=11), conduct and monitoring (n=19), reporting of protocols and findings (n=20), post-publication concerns (n=12), and future research and development (n=13).
ConclusionImplementation of this multi-stakeholder consensus statement is expected to enhance RCT integrity.
Artículo
Diríjase al área privada de socios de la web de la SEMERGEN, (https://www.semergen.es/index.php?seccion=biblioteca&subSeccion=revistaSEMERGEN ) y autentifíquese.
Comprando el artículo el PDF del mismo podrá ser descargado
Precio 19,34 €
Comprar ahora