La diabetes mellitus tipo 3c (DM3c) es una diabetes (DM) del páncreas exocrino que habrá que sospechar siempre que existan antecedentes de pancreatitis crónica (PC), pancreatitis aguda (PA) o recidivante (PAR) (80% de los casos) o una DM de nueva aparición en individuos a partir de los 50 años sin otra justificación (pruebas de autoinmunidad negativas, anticuerpos contra la descarboxilasa del ácido glutámico).
Se trata de una entidad mal diagnosticada como diabetes tipo 2 (DM2) (90%) y, por ello, de no sospecharla puede pasar inadvertida. Para su diagnóstico son de utilidad la ecografía abdominal, la determinación del antígeno tumoral carbohydrate antigen 19-9 (CA 19.9), la resonancia magnética nuclear (RMN) o la tomografía axial computarizada (TAC). El tratamiento es el mismo de la DM2, aunque con ciertas especificaciones según el tipo de fármacos y con la particularidad de que al tratarse de una «diabetes frágil» habrá que tener mayor precaución con las hipoglucemias (monitorización). Asimismo, al ser una enfermedad del páncreas exocrino habrá que tratar específicamente esta para evitar las alteraciones metabólicas, malabsortivas y/o nutricionales.
DM3c is diabetes (DM) of the exocrine pancreas that must be suspected whenever there is a history of chronic pancreatitis (CP), acute pancreatitis (AP) or recurrence (80% of cases) or new-onset DM in individuals from over 50 years of age without any other justification (negative autoimmunity tests, Glutamic Acid Decarboxylase antibodies).
It is an entity misdiagnosed as type 2 diabetes (DM2) (90%) and therefore, if it is not suspected, it can go unnoticed. For its diagnosis, abdominal ultrasound, determination of the CA 19.9 tumor antigen (carbohydrate antigen 19-9), nuclear magnetic resonance (NMR) or computerized axial tomography (CT) are useful. The treatment is the same as DM2, although certain specifications depend on the type of drugs and with the particularity that in dealing with «fragile diabetes» greater caution must be taken with hypoglycemia (monitoring). Likewise, as it is a disease of the exocrine pancreas, it will have to be specifically treated to avoid metabolic, malabsorptive and/or nutritional alterations.
Dentro de la clasificación de la diabetes (DM) que hace la American Diabetes Association (ADA) en sus Standards of Medical Care in Diabetes (2023), en el grupo de causas específicas de DM, se incluyen: las DM monogénicas (como la neonatal y la Maturity-Onset Diabetes of the Young [MODY]), las causadas por fármacos o productos químicos (glucocorticoides, medicamentos para el tratamiento del virus de la inmunodeficiencia humana [VIH] o para el trasplante de órganos), y las relacionadas con el páncreas exocrino debidas a fibrosis quística (FQ) o a pancreatitis. Estas últimas son lo que se denomina DM tipo 3 («type 3 c diabetes» o DM3c)1.
Sin embargo, este término puede dar lugar a confusión con otras entidades también nombradas DM tipo 3, como la situación que afecta a las personas en cuyo entorno cercano hay alguien diagnosticado de DM2, o aquella que relaciona la DM con la demencia que señala la hiperinsulinemia y la resistencia a la insulina como posibles factores de riesgo de enfermedad de Alzheimer3.
En adelante, este documento se referirá a aquellas DM relacionadas con el mal funcionamiento o con la disfunción del páncreas exocrino.
Se trata de un tema amplio, difícil, escasamente estudiado y que, en muchas ocasiones, provoca confusiones con otras clases de DM: tipo 2, MODY, DM inmunológicas en adultos como Latent Autoimmune Diabetes in Adults (LADA) o la tipo 1 (DM1)4–6.
A modo de ejemplo, en una serie de 1.868 pacientes ingresados durante 24 meses con el diagnóstico de DM, 172 fueron clasificados como DM3c (9,2%)7, lo que indica que esta entidad aún desconocida o infradiagnosticada es mucho más frecuente de lo que se piensa.
Definición e importanciaComo se ha señadalo, la DM3c, reflejada por la ADA desde al menos 20148, o DM pancreatopriva está originada por una enfermedad del páncreas exocrino; se trata de lesiones estructurales de este último que influyen en su función endocrina, afectando a la secreción de la insulina.
Por regla general, en 79% de los casos son consecuencia de pancreatitis, tanto agudas (PA) como crónicas (PC)9,10: las llamadas DM post-pancreatitis, y en menor frecuencia, son provocadas por traumas, neoplasias, pancreatectomías y otras causas que se comentarán más adelante.
La característica fundamental y diferencial para el diagnóstico desde Atención Primaria (AP) es que existan pruebas de imagen con anomalías pancreáticas (tomografía axial computarizada [TAC], resonancia magnética nuclear [RMN] o ecografía endoscópica, entre otras) en ausencia de pruebas de autoinmunidad sugerentes de DM1.
El requerimiento de evidencias claras de una insuficiencia pancreática exocrina se considera más como un factor de riesgo de esta patología que como un criterio diagnóstico de la misma11.
EtiologíaLa DM3c no es una entidad única ya que engloba distintas causas con mecanismos fisiopatológicos diferentes que se agrupan en esta enfermedad con objeto de facilitar su clasificación.
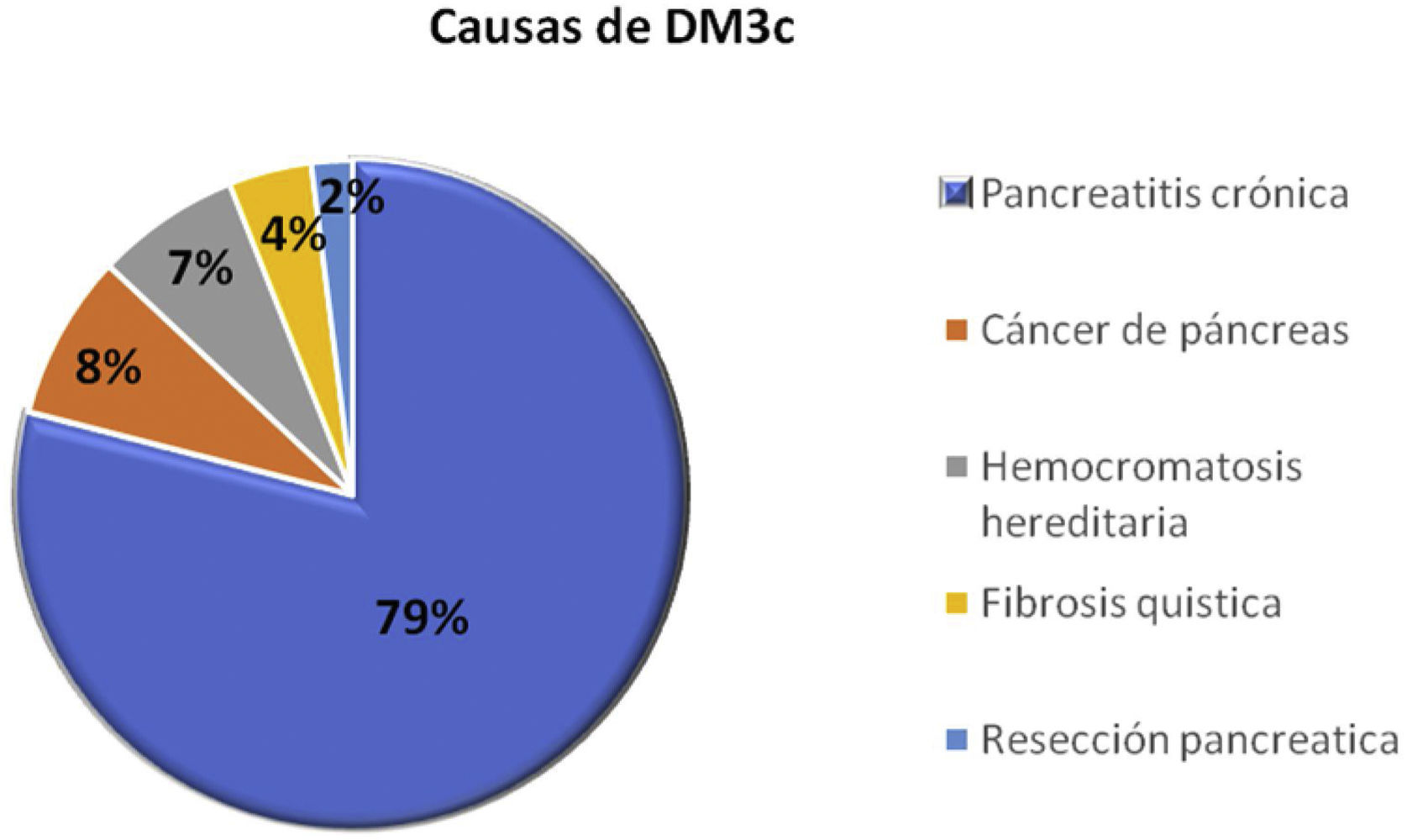
Se trata de una entidad clínica y metabólicamente distinta de las otras formas de DM, con características y prioridades de manejo especiales que requieren una terapia personalizada. Debido, en parte, a la heterogeneidad de sus causas, en muchas ocasiones puede pasar desapercibida en la práctica clínica diaria; no se diagnostica correctamente y, se confunde, hasta en 90% de los casos, con una DM2. Las causas más frecuentes de DM3c son la PC, PA y/o recidivante (de cualquier causa) (79%), el cáncer de páncreas (CP) (8%), la hemocromatosis (7%), la FQ (4%), la pancreatectomía (2%) y la muy rara agenesia pancreática, que daría lugar a una DM neonatal10,12,13 (fig. 1, tabla 1).
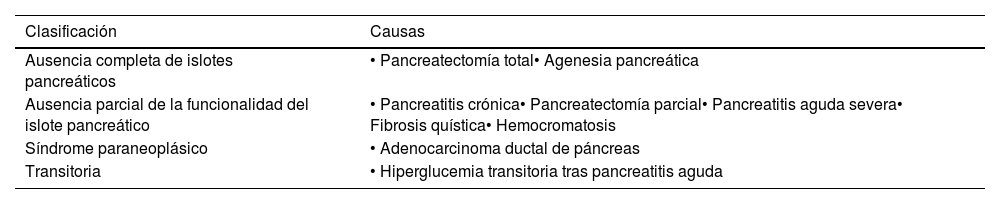
Clasificación de la diabetes secundaria a enfermedades del páncreas exocrino
| Clasificación | Causas |
|---|---|
| Ausencia completa de islotes pancreáticos | • Pancreatectomía total• Agenesia pancreática |
| Ausencia parcial de la funcionalidad del islote pancreático | • Pancreatitis crónica• Pancreatectomía parcial• Pancreatitis aguda severa• Fibrosis quística• Hemocromatosis |
| Síndrome paraneoplásico | • Adenocarcinoma ductal de páncreas |
| Transitoria | • Hiperglucemia transitoria tras pancreatitis aguda |
Adaptada de: Wynne et al.15
La PC es una enfermedad inflamatoria crónica que conduce a cambios morfológicos irreversibles (fibrosis y disminución tanto de células acinares, como de conductos e islotes de Langherhans), que provocan dolor y condicionan la pérdida de las funciones exocrina y endocrina del páncreas14 La hiperglucemia se debe al déficit de insulina, provocado por la fibrosis extensa del páncreas exocrino, ya que se destruyen los islotes pancreáticos disminuyendo así la masa de células alfa y beta. Por eso, no solo se afecta la secreción de insulina, sino que también se produce un déficit de glucagón y polipéptido pancreático (PP); por otra parte, aumenta la resistencia a la insulina y disminuye el efecto incretina15.
Entre 25 y 80% de los pacientes con PC van a desarrollar DM, aumentando esta prevalencia en relación con la duración de la enfermedad10. En cambio, solo la mitad de los individuos con PA presentan hiperglucemia transitoria y 15% desarrollan DM16.
Los episodios repetidos de PA con necrosis y fibrosis son clave en la patogenia de la PC. De los casos de este padecimiento, 60% son consecuencia de una PA o una pancreatitis aguda recidivante (PAR), mientras que aproximadamente 10% de la PA y 30% de las PAR desarrollaran PC. Si la etiología es alcohólica, la progresión hacia una PC es mucho más rápida14. Desde el inicio de los síntomas hasta el diagnóstico de PC pueden pasar más de cinco años; o incluso más si no hay historia de alcoholismo17,18.
Una gran proporción de PC son idiopáticas, pero el alcohol es su causa más frecuente (70-80%). Solo 10% de los alcohólicos desarrollan la enfermedad, aunque, por otra parte, en algunos pacientes puede producirse la pancreatitis incluso con un consumo bajo o moderado, dependiendo de la presencia de otros factores como la predisposición genética, el hábito nutricional, el tabaco, la hipertrigliceridemia severa o la acumulación de grasa en el páncreas. El tabaco no solo influye en la aparición de la PC, sino que también acelera su progresión14,15.
Otras causas de PC incluyen la pancreatitis tropical, trastornos genéticos, enfermedades sistémicas, obstrucción ductal causada por estenosis, litiasis vesicular o cáncer y algunos fármacos como la fenacetina, interferón, hidroclorotiazida, ácido valproico, anticonceptivos orales, estatinas, azatioprina e inhibidores de la angiotensina, entre otros17.
En la evaluación inicial de pacientes con PC se debe descartar la presencia de DM, mediante la determinación de glucosa en ayunas, HbA1c, y una prueba de tolerancia oral a la glucosa de 75 g si fuera necesario en los casos de prediabetes. Analizar los niveles de insulina y/o péptido C puede ser útil para distinguir entre DM2 y DM3c, mientras que una respuesta ausente del PP permite diferenciar entre la DM3c, DM1 y DM212.
Algunos estudios concluyen que los pacientes con PC tienen un riesgo 5-10 veces mayor que la población general para desarrollar CP; este aumenta en los casos de pancreatitis hereditaria17.
Cáncer de páncreasEl CP es la segunda causa más frecuente de DM3c (8% de los casos). Los principales factores de riesgo conocidos son el consumo de tabaco, dieta rica en grasas, consumo de alcohol, factores genéticos y enfermedades propias del páncreas como la PC.
La relación entre el CP y el desarrollo de la DM sigue siendo controvertida16, pero incluiría mecanismos como la destrucción tisular del tejido pancreático y factores paracrinos que aumentarían la resistencia periférica a la insulina. Pudiendo manifestarse la DM hasta dos años antes del diagnóstico de CP en 16% de los pacientes. Entre 40-85% de los sujetos con CP, en el momento del diagnóstico, presentan hiperglucemia o DM; esta relación temporal y el hecho de que la DM suele mejorar tras la resección del tumor, respalda la causalidad entre el CP y la DM3c16,19,20.
En mayores de 50 años con DM de reciente aparición, el riesgo de padecer CP es de aproximadamente 1% en tres años. El riesgo relativo de presentar CP en la DM de menos de un año de evolución es de 5,4 (intervalo de confianza [IC] 95% 3,5-8,3) y un riesgo moderado de alrededor de 1,5 a los cinco años de DM. Por tanto, la DM de larga duración aumenta modestamente el riesgo de CP, pero la DM de reciente diagnóstico parece ser un marcador de CP subyacente. Por tanto, el debut de la DM no solo podría ser un factor de riesgo de desarrollo de CP, sino un signo temprano del mismo. En este sentido, se debería identificar a los pacientes recién diagnosticados de DM con alta probabilidad de presentar CP con base en diferentes biomarcadores como cambio de peso, niveles de glucemia, la determinación del antígeno tumoral carbohydrate antigen 19-9 (CA 19.9) y la edad de inicio. El diagnóstico precoz del CP es fundamental para mejorar el pronóstico. La presencia de DM implica un peor pronóstico por riesgo de complicaciones quirúrgicas y menor supervivencia19,21,22.
Cirugía pancreáticaLas indicaciones de la cirugía pancreática son intentar mejorar el dolor, aminorar las complicaciones de una PC (obstrucción biliar, estenosis duodenal, estenosis del conducto pancreático, pseudoquistes, ascitis pancreática, compresión venosa portal de esplénica/mesentérica, trombosis venosa y hemorragia pancreática), así como la resección de tumores pancreáticos o periampulares.
La incidencia de DM después de la cirugía pancreática varía con los diferentes procedimientos quirúrgicos y la etiología subyacente de la enfermedad. La alteración metabólica es proporcional a la amplitud y la región extirpada del páncreas. La mayoría de las células beta de los islotes de Langerhans se localizan en la cola pancreática, lo que sugiere que la pancreatectomía distal podría tener un impacto diferente en el metabolismo de la glucosa en comparación con la resección de la cabeza, únicamente en términos de la masa de células beta eliminadas. Si la resección es de más de 60% de la glándula, se desarrollará DM. Tras dos años de una pancreatectomía distal, el riesgo de DM es de 46%. La conservación del bazo se relaciona con una reducción de la incidencia de DM posoperatoria16.
Fibrosis quísticaLa prevalencia de la DM relacionada con la FQ (DRFQ) aumenta con la edad y afecta, aproximadamente, a 2% de los niños, a 19% de los adolescentes y a 40-50% de los adultos. Alrededor de 80% de las personas con mutaciones graves tienen DRFQ después de los 40 años, con una prevalencia más alta en las mujeres. La FQ afecta al páncreas exocrino, se obstruyen los conductos y disminuye la secreción de enzimas pancreáticas, lo que produce malabsorción y fibrosis secundaria del páncreas. El depósito de amiloide de los islotes también puede contribuir al deterioro del sistema endocrino. Como consecuencia de la fibrosis, disminuye la secreción de insulina. Aunque también pueden darse otros factores que alteran la resistencia a la insulina y empeoran el metabolismo de la glucosa como enfermedades intercurrentes e infecciones.
Un estudio con DRFQ de más de 10 años de duración informó una prevalencia de microalbuminuria de 21% y retinopatía de 10%, todas ellas relativamente leves. La neuropatía autonómica y la gastroparesia estaban presentes en 52% de los pacientes, aunque no siempre la DM era la causa principal de las molestias digestivas. Además, las complicaciones macrovasculares fueron muy raras23.
La DRFQ es la comorbilidad más común en sujetos con FQ y se asocia con una mayor morbimortalidad, con una frecuencia elevada de exacerbaciones pulmonares, mayor deterioro de la función pulmonar y peor estado nutricional. El tratamiento con insulina mejora el estado nutricional y, al menos temporalmente, la función pulmonar en pacientes con DRFQ23.
HemocromatosisLas manifestaciones clínicas típicas de la hemocromatosis son la cirrosis hepática, la DM y la pigmentación de la piel («diabetes bronceada»)24. La prevalencia de la DM en esta enfermedad varía de 13 a 22% y la intolerancia a la glucosa de 18 a 30%.
Los mecanismos fisiopatológicos implicados serían tanto el déficit de insulina como la resistencia a esta. La DM suele debutar cuando aumenta la resistencia a la insulina por otros motivos (edad, obesidad, fármacos) y el páncreas no es capaz de responder de forma adecuada a ese incremento de las necesidades de esta hormona. El tratamiento con sangrías terapéuticas puede mejorar la secreción de insulina, pero no la sensibilidad a la misma16,24–26.
Por otro lado, los pacientes con talasemia desarrollan una sobrecarga de hierro tanto por las transfusiones requeridas para mantener niveles adecuados de hemoglobina, como por una mayor absorción del mineral. La prevalencia de DM en estos pacientes es de 6 a 14%17.
Criterios diagnósticosAunque en la actualidad, la clasificación de la DM incluye la DM3c, en la práctica clínica habitual rara vez se piensa en ella, y no hay consenso universal acerca de sus criterios diagnósticos. No obstante, conceptualmente se acepta que los pacientes deben incluir los siguientes tres criterios10:
- -
Cumplir los criterios diagnósticos de la DM.
- -
Tener una enfermedad del páncreas exocrino.
- -
Presentar una DM secundaria a la disfunción del páncreas exocrino, definida como la presencia de destrucción avanzada o extirpación quirúrgica del páncreas o aparición reciente de la DM en el contexto de un adenocarcinoma ductal pancreático.
Probablemente esta falta de unanimidad se debe a que no existe acuerdo en considerar como DM3c todas las DM concurrentes con enfermedad pancreática o si se deben utilizar unos criterios diagnósticos más estrictos15. En este sentido, Ewald et al.27 propusieron la presencia de los siguientes criterios mayores además de cumplir los criterios diagnósticos de DM3c (tabla 2):
- -
Evidencia de insuficiencia pancreática exocrina (mediante la prueba de elastasa-1 fecal monoclonal < 200 μg/g o alteraciones de pruebas de función directa).
- -
Anomalías pancreáticas diagnosticadas por imagen, recomendándose como primera opción el uso de tomografía computarizada (TC) o RMN, debiendo evitarse pruebas invasivas, según la última guía americana de gastroenterología14.
- -
Ausencia de marcadores autoinmunes relacionados con la DM1 (como los anticuerpos contra la decarboxilasa del ácido glutámico [GADA], o anticuerpos anti-células de los islotes [ICA] o anticuerpos anti-insulina).
Criterios diagnósticos de DM3 según Ewald y Bretzel
| Criterios mayores | Criterios menores |
|---|---|
| Evidencia de insuficiencia pancreática exocrina | Disfunción de células beta |
| Diagnóstico por imagen (TAC, RM) | Ausencia de resistencia a la insulina |
| Ausencia de marcadores de autoinmunidad | Alteración de la secreción de incretinas |
| Bajos niveles séricos de vitaminas liposolubles A, D, E, K |
DM3c: diabetes mellitus tipo 3c; RM: resonancia magnética; TAC: tomografía axial computarizada.
Elaborada a partir de: Ewald et al.27
Como criterios menores se incluyen27:
- -
Disfunción de las células β (medida por evaluación del modelo homeostático para la función de las células β, o medición de la concentración de péptido C o glucosa).
- -
Ausencia de resistencia a la insulina (según lo definido por la evaluación del modelo homeostático para la resistencia a dicha hormona).
- -
Alteración de la secreción de incretina (péptido-1 similar al glucagón [GLP-1] o PP, o ambos) y concentraciones séricas bajas de vitaminas liposolubles (A, D, E y K).
La principal limitación de estos criterios es la dificultad de poder acceder a dichas pruebas en la práctica clínica habitual de la AP15,27.
Para el médico del primer nivel asistencial, alcanzar evidencias claras de una insuficiencia pancreática exocrina como la única causa de la DM es una quimera; en nuestra opinión, y haciéndonos eco de otros autores11 más eclécticos que sugerirían que la presencia de estos datos pudieran considerarse más como factores de riesgo de esta patología, la demostración clínica y con pruebas de imagen debería bastar para sospechar la implicación del páncreas exocrino en la causa de la DM.
FisiopatologíaEl páncreas es un órgano retroperitoneal con dos funciones fundamentales, una endocrina y otra exocrina.
La primera está relacionada con los dos millones de islotes de Lanherhans, que producen insulina (células β), glucagón (células alfa), somatostatina y PP.
Por otra parte, la función exocrina guarda relación con las células acinares exocrinas, que producen enzimas digestivas alcalinas que drenan hacia el conducto pancreático y son principalmente el tripsinógeno, el quimotripsinógeno, la lipasa y la amilasa.
La DM del páncreas exocrino se caracteriza por diversos grados de disfunción tanto endocrina como exocrina y esto condiciona una presentación clínica muy variable, con un manejo complicado de la misma; lo que conlleva a denominarla como una «diabetes frágil»15.
La pérdida de células beta y su capacidad secretora de insulina conduce a la consiguiente hiperglucemia. La afectación de las células alfa disminuye la secreción de glucagón reduciendo así la respuesta a la hipoglucemia.
El déficit del PP da como resultado una resistencia a la insulina hepática debido a una reducción de la disponibilidad de los receptores de insulina a este nivel.
La liberación de hormonas incretinas también puede verse alterada, lo que conduce a una secreción de insulina posprandial subóptima15.
La mala digestión y la consiguiente malabsorción de nutrientes que se produce en la insuficiencia pancreática exocrina altera la secreción enteral de las hormonas incretinas, el GLP-1 y el polipéptido insulinotrópico glucosa dependiente (GIP)28.
La patogenia de la DM3c es muy compleja y se han propuesto varios mecanismos diferentes para explicar su fisiopatología.
En la PC se produce una sustitución del parénquima pancreático que contiene los acinos pancreáticos, los conductos y los haces nerviosos por tejido conjuntivo con un aumento de las fibras de colágeno en los espacios perisinusoidales con cicatrización progresiva y pérdida de la vascularización. Las lesiones de las fases iniciales suelen distribuirse de forma parcheada28.
La inflamación crónica, fibrosis intra e interlobulillar progresiva, calcificaciones parenquimatosas, pérdida acinar, atrofia glandular y fibrosis periductal provoca la distorsión de los conductos, tapones de proteínas intraductales, cálculos y estenosis ductales29.
Igualmente, la activación de los macrófagos, las citoquinas y las células estrelladas intersticiales (controladoras estas últimas de la síntesis y degradación de las proteínas de la matriz extracelular), conducen a la necrosis, inflamación y fibrosis de las células acinares29.
Objetivos glucémicosEl diagnóstico, manejo y tratamiento de la DM3c está bastante limitado debido a la falta de comprensión y desconocimiento de este cuadro, tanto por los profesionales sanitarios como por la población en general; por otra parte, no hay ninguna guía de práctica clínica que especifique de forma clara cuales son los objetivos de control para este tipo de pacientes13.
Se considera que el riesgo de complicaciones microvasculares es similar al de las otras formas de DM1, no habiendo consenso en cuanto a las complicaciones macrovasculares23,30.
El objetivo del tratamiento en la DM3c es normalizar los niveles de glucosa basal entre 3,9 y 7,2 mmol/l (70 y 130 mg/dL) y el de HbA1c en menos de 7%13. Por tanto, parece asumible considerar los mismos objetivos de control que se señalan para la DM231, individualizando el resultado con base en diferentes criterios como el riesgo de hipoglucemias, el tiempo de evolución de la DM, la esperanza de vida, comorbilidades y complicaciones y condiciones particulares del paciente como preferencia y apoyo sociofamiliar, entre otros1.
Asimismo, podemos plantearnos un grado de control respecto al resto de factores cardiovasculares: presión arterial y lípidos, semejantes a los propuestos para la DM21.
TratamientoDebido a su dificultad diagnóstica y a los frecuentes errores de clasificación, la mayoría de los pacientes con DM3c, habitualmente son considerados como DM2, lo que podría ser la causa de los malos resultados en su control.
Actualmente, no existe una guía específica para abordar la hiperglucemia u otras condiciones relacionadas con la DM3c, basándose la mayoría de las recomendaciones en opiniones de expertos. Además, la falta de estudios de eficacia y seguridad de los fármacos para este tipo de DM, limita las recomendaciones para su manejo13.
Su tratamiento no solo incluye el control de la hiperglucemia, sino también el de la insuficiencia pancreática exocrina, con el objetivo de prevenir o evitar alteraciones metabólicas, malabsorción, malnutrición y resto de comorbilidades asociadas a la DM12. En este sentido, las principales recomendaciones pueden resumirse en30:
- •
Dieta adecuada: pequeñas cantidades de forma frecuente, sin saltarse ingestas, incluyendo carbohidratos complejos (patata, arroz integral, avena, etc.) y suprimiendo azúcares simples (frutas, zumos y lácteos); evitando la posible malnutrición.
- •
Monitorización de niveles de glucosa. Debido a la disminución de la secreción de glucagón y el elevado riesgo de hipoglucemias, desde noviembre de 2020 está aprobada la financiación del sistema de monitorización intersticial de glucosa para este tipo de pacientes32.
- •
Uso de enzimas pancreáticas como «terapia de reemplazo»33.
- •
Evitar tabaco y alcohol.
Los fármacos utilizados para controlar la hiperglucemia son similares a los recomendados para la DM2, con algunos matices diferenciadores13 y, teniendo en cuenta que la insulina, en estos casos siempre puede ser una opción:
- •
La metformina es el tratamiento de elección siempre que la hiperglucemia sea leve (Hba1c < 8%)10, ya que además de mejorar la insulinoresistencia parece prevenir el desarrollo del CP, relacionado con la PC. Su principal desventaja es la aparición o agravamiento de los síntomas digestivos.
- •
Si la monoterapia no consigue un control adecuado podría valorarse añadir un segundo fármaco. La pioglitazona podría ser una muy buena opción, ya que incrementa la sensibilidad a la insulina. Sin embargo, puede aumentar el riesgo de fracturas e insuficiencia cardiaca34,35.
- •
Al haber un mayor riesgo de hipoglucemias, las sulfonilureas y glinidas deben de evitarse.
- •
Por la enfermedad pancreática de base, los «fármacos incretínicos» los inhibidores de la dipeptidilpeptidasa 4 (iDPP4) y los análogos del receptor del péptido-1 similar al glucagón tampoco son recomendables.
- •
Respecto a los inhibidores de los cotransportadores de la bomba de sodio y glucosa 2 (iSGLT2), no hemos encontrado ninguna alusión en la literatura que avale o contraindique su recomendación. Por tanto, con base solo en su mecanismo de acción, podemos considerar que su uso no estaría contraindicado y además podrían aportar los beneficios cardiovasculares descritos para del paciente con DM2.
- •
En fases más avanzadas, donde hay un claro déficit insulínico, en caso de intolerancia o contraindicación de los anteriores fármacos o falta de consecución de los objetivos de control planteados, la insulina sería el tratamiento de elección. Hay que tener en cuenta que, debido a la importante afectación de las células β-pancreáticas36, en la mayoría de los casos, la terapia final será la insulina15; de hecho, a los cinco años del diagnóstico, entre 20,9 y 45,8% de los casos de DM3c utilizarán la insulina, mientras que solo lo harán 4,1% de las personas con DM237. Sin embargo, los pacientes con DM3c pueden ser más susceptibles a las hipoglucemias debido a la mayor sensibilidad periférica de la insulina33, por tanto, las dosis de inicio de la insulina serán menores que las 0,2 U/kg o 10 U recomendadas en los casos de DM21.
La DM3c al ser una DM producida a partir de una enfermedad del páncreas exocrino y que aparece en la edad media de la vida, está infradiagnosticada, mal diagnosticada como DM2 (90%) o, se engloba con otras clases de DM, sean tipo 2 o inmunológica (DM1 o LADA), de ahí la dificultad que su diagnóstico entraña para el médico de AP.
Habrá que sospecharla siempre que existan antecedentes de PC, PA o PAR (80% de los casos) o DM de nueva aparición a partir de los 50 años sin otra justificación (pruebas de autoinmunidad negativas, Ac antiGAD) o como un síntoma inicial de CP.En todos estos casos son de utilidad aquellas pruebas disponibles desde AP como la ecografía abdominal, la determinación del antígeno tumoral CA 19.9, la RMN o la TAC.
Como hemos señalado, la evidencia clara de una insuficiencia pancreática exocrina está fuera de nuestro alcance y tampoco nos aportaría un dato que afirmara con absoluta certeza dicha etiología (diagnóstico menor).
El diagnóstico y el tratamiento de la DM3c es el mismo que el de cualquier DM con la salvedad de que al tratarse de una «diabetes frágil» habrá que tener mayor precaución con las hipoglucemias (monitorización), evitar la utilización de fármacos incretínicos y que al existir concomitantemente una enfermedad del páncreas exocrino habrá que tratar esta (suplementos pancreáticos) a efecto de evitar alteraciones metabólicas, malabsortivas y/o nutricionales.
FinanciaciónEste trabajo no ha recibido ningún tipo de financiación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.