El dolor crónico se caracteriza por tener una duración superior a tres meses y por asociarse con cambios importantes en el estado psicológico, social y funcional del paciente, pudiéndose relacionar con trastornos depresivos y ansiosos, que en ocasiones requerirán manejo específico1. En el seno de un cuadro de dolor crónico pueden aparecer además episodios agudos.
Desde la publicación, hace ya casi 20 años, de las recomendaciones generales para el tratamiento del dolor que hizo un grupo de expertos de la Organización Mundial de la Salud (OMS)2,3 han aparecido en diferentes medios de información médica múltiples revisiones y guías de manejo del dolor crónico maligno. La mayoría de estas revisiones (probablemente miles) coinciden en tres aspectos:
El dolor es muy frecuente en pacientes con cáncer, apareciendo hasta en el 75%-90% de los pacientes4.
Con las alternativas actualmente disponibles conseguir alivio o desaparición del dolor es relativamente sencillo5.
A pesar de las diferentes alternativas terapéuticas en más del 50% de los casos no se consigue un control aceptable, y el 25%-30% de los pacientes morirán con dolor intenso5.
Los profesionales que estamos inmersos en el tratamiento del dolor crónico maligno solemos reconocer y aceptar esos aspectos6.
Pero la cuestión es: si tenemos tratamientos efectivos, ¿por qué no se utilizan adecuadamente? Las respuestas son variadas, y creo, insuficientes. Es cierto que los cuidados paliativos y el tratamiento del dolor no ocupan un lugar relevante (si es que tienen alguno) en los planes de estudio y que aún no disponemos de un marco de referencia que, en la realidad asistencial, garantice unos adecuados cuidados paliativos a los pacientes que los precisen7. A partir de ahí el peso de otros problemas "históricos" es más dudoso: poca capacitación de los profesionales por falta de formación continuada, insatisfacción de los profesionales que atienden pacientes con enfermedad avanzada, mitos y miedos relacionados con la utilización de analgésicos potentes, pocos recursos asistenciales, etc.8,9. Sería conveniente definir el tipo de profesional que tiene que responsabilizarse de los cuidados paliativos y tratamiento del dolor (médico de familia, especialista, "paliatólogo"), implantar (que no elaborar) líneas generales de manejo del dolor, revisar si los actuales recursos son suficientes, etc.
¿Por donde empezar? Los principios generales de la OMS para tratamiento del dolor se mantienen plenamente vigentes3:
Hacer diagnóstico diferencial, porque el tratamiento es diferente según el tipo de dolor.
El tratamiento debe ser pautado, evitando en la medida de lo posible la toma a demanda y los placebos. El tratamiento farmacológico continua siendo la piedra angular del tratamiento.
La vía oral es de elección, reservando otras como alternativa.
Hay que hacer un tratamiento escalonado. La escalera analgésica debe continuar como pauta de referencia.
Es necesario individualizar el tratamiento y el seguimiento. Todos los apartados anteriores deberían a su vez interpretarse en clave de medicina basada en la evidencia y uso racional de los medicamentos.
VALORACIÓN DEL PACIENTE CON DOLOR
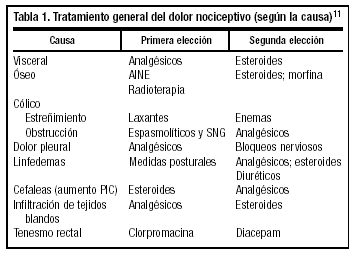
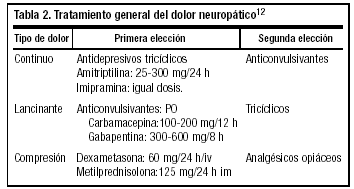
En los pacientes con dolor crónico maligno las clasificaciones más útiles son la etiológica y la fisiopatológica10, la primera porque algunas causas tienen tratamiento específico y la segunda por las implicaciones farmacoterapéuticas que tiene. Según esta última el dolor se clasifica en:
Dolor nociceptivo (somático y visceral) (tabla 1). Se produce por estimulación de receptores nociceptivos. Responde a antiinflamatorios no esteroideos (AINE), paracetamol y opiáceos.
Dolor neuropático (tabla 2). Producido por lesión en vías o centros neurológicos. Responde mejor a anticonvulsivantes o antidepresivos.
TRATAMIENTO FARMACOLÓGICO
La escalera analgésica de la OMS2,3,13 incluye tres escalones: en el primer escalón se usa un AINE y cuando éste no controle el dolor se añade un opiáceo débil (segundo escalón). Cuando esta combinación deja de ser efectiva el opiáceo débil es remplazado por uno potente (tercer escalón), manteniendo el tratamiento del primer escalón. No se recomienda utilizar dos analgésicos del mismo grupo simultáneamente.
Los analgésicos adyuvantes son medicamentos que alivian el dolor pero no se consideran analgésicos en sentido estricto (carbamacepina, gabapentina, amitriptilina, corticoides, benzodiacepinas, neurolépticos); pueden ser útiles en cualquier escalón si el tipo de dolor lo precisa.
Farmacología básica de los antiinflamatorios no esteroideos
Los AINE comparten acciones terapéuticas (analgésica, antiinflamatoria y antipirética) pero se diferencian en su eficacia y toxicidad relativas14.
Las recomendaciones generales en la utilización de AINE podrían resumirse de la siguiente forma:
El paracetamol a dosis de 1.000 mg/6 horas, es el tratamiento de elección en el dolor leve-moderado sin componente inflamatorio importante. El ibuprofeno a dosis analgésica (600 mg/6-8 horas) parece el AINE menos gastrolesivo y es una buena alternativa al paracetamol.
Es aconsejable utilizar los más conocidos y aquellos que llevan más años en el mercado ya que se conocerá mejor su perfil de seguridad (ibuprofeno, diclofenaco, naproxeno, etc.).
Producen su efecto actuando a nivel periférico, y por lo tanto, la asociación con opiáceos, que actúan a nivel central, permite un mejor control del dolor.
Los AINE tienen techo analgésico; esto implica que una vez alcanzada la dosis máxima recomendada incrementos sucesivos de la dosis no producen mayor analgesia y sí aumentan la toxicidad.
No deben utilizarse dos AINE simultáneamente; no se consigue mayor eficacia analgésica y sin embargo la probabilidad de producir efectos secundarios es mayor.
Farmacología básica de los opiáceos15-20
Opiáceos débiles
La codeína puede considerarse de elección. Ejerce su efecto analgésico al unirse a los receptores MU, aunque lo hace con baja afinidad.
El tramadol no ha demostrado ventajas evidentes frente a otros opiáceos. Todavía está por establecerse la eficacia del tramadol en el manejo del dolor crónico a largo plazo.
El dextropropoxifeno no aporta ventajas, se transforma en un metabolito activo que favorece la aparición de efectos secundarios indeseables. Su uso sólo está indicado como alternativa a la codeína y tramadol cuando éstas no se toleran bien.
Opiáceos potentes
Son los analgésicos más potentes que se conocen. Su acción farmacológica va a depender de la estimulación de receptores (MU, KAPPA, SIGMA) situados fundamentalmente en el sistema nervioso central (SNC). Los opiáceos potentes se clasifican en cuatro grupos según su acción sobre los receptores:
Agonistas puros (morfina, metadona, fentanilo, meperidina o petidina). Tienen afinidad y actividad altas sobre los receptores MU. Prácticamente no tienen techo analgésico. Son los medicamentos de elección en el tratamiento del dolor.
Agonistas parciales (buprenorfina). Menor potencia analgésica que los agonistas puros. Tienen techo analgésico.
Agonista-antagonistas (pentazocina). Gran riesgo de provocar disforia, cuadros psicomotores y alucinaciones. No indicados en el manejo del dolor crónico.
Antagonistas puros (naloxona, naltrexona). Son el tratamiento de elección en la intoxicación por opiáceos.
La vía de administración de elección (por eficacia y comodidad) es la oral, siendo la transdérmica, rectal y subcutánea las alternativas en pacientes que no tienen disponible la vía oral, Las vías intravenosa o epidural quedarían para casos especiales (menos del 10%).
La morfina es el opiáceo de referencia. La metadona tiene potente acción analgésica a dosis prácticamente equivalentes a la morfina. Parece ser más eficaz que la morfina en el manejo del dolor neuropático.
El fentanilo aporta la posibilidad de ser administrado por vía transdérmica a intervalos de hasta 72 horas. Suele precisar dosis extras para tratar "picos de dolor". No están bien definidas las equivalencias. Asimismo, necesita que la piel de los pacientes esté en buenas condiciones para su correcta administración.
La meperidina tiene un metabolito (normeperidina) que puede acumularse provocando hiperexcitabilidad del SNC. No está recomendada en el tratamiento del dolor crónico de cualquier etiología.
La buprenorfina puede ser utilizada por vía transdérmica, además puede presentar acción antagonista a dosis altas, lo que obliga a utilizarla con precaución. La utilidad de la buprenorfina en el tratamiento del dolor en el cáncer es limitada.
La pentazocina, por su acción sobre los receptores SIGMA produce disforia y alteraciones psicomiméticas. No es un fármaco indicado en el dolor crónico.
Efectos secundarios de los opiáceos
En general los efectos secundarios de todos los opiáceos son similares cuando se utilizan a dosis equivalentes; los principales efectos secundarios son:
El estreñimiento se produce en casi en todos los pacientes que toman opiáceos; es dosis dependiente y no desarrolla tolerancia. Deben pautarse siempre laxantes al mismo tiempo que se inicia el tratamiento opiáceo.
Las náuseas y vómitos son dosis dependiente y se desarrolla tolerancia. El haloperidol a dosis de 1 a 3 mg por día es el medicamento de elección.
La sedación es dosis dependiente y aparece tolerancia.
La confusión y las alucinaciones obligan a cambiar el opiáceo administrado, dado que no se conoce un tratamiento eficaz.
La depresión respiratoria es potencialmente el efecto secundario más grave, pero hay pocos casos descritos en pacientes que toman opiáceos en su indicación analgésica.
La tolerancia se soluciona subiendo la dosis hasta alcanzar nuevamente la analgesia deseada.
La dependencia física debe ser tenida en cuenta únicamente si está indicado retirar la medicación lo que sucede en raras ocasiones. Es suficiente realizar una retirada lenta para prevenir el síndrome de abstinencia.
La dependencia psíquica no debería considerarse en pacientes que sufren dolor intenso y con una esperanza de vida limitada.
Errores frecuentemente identificados en el tratamiento
del dolor
Partir, machacar, morder, etc. los comprimidos de liberación sostenida. Pegar parches de administración transdérmica en lugares inadecuados (zonas de presión, con mucho vello, etc.)..
Combinar AINE entre sí.
Combinar opiáceos débiles entre sí.
Combinar opiáceos potentes entre sí o con opiáceos débiles.
Hacer interpretaciones personales del dolor que refieren los pacientes. El dolor es subjetivo y lo define el propio paciente, no los familiares o el médico.
No hacer tratamiento profiláctico de efectos secundarios cuando son medidas de eficacia probada.
No hacer diagnóstico diferencial del dolor en el paciente con cáncer avanzado.
Utilizar pautas posológicas inadecuadas.