Determinar la persistencia, las exacerbaciones y el uso de los recursos en los pacientes que inician tratamiento inhalador con fluticasona propionato/formoterol (PF/Form) con relación a otras combinaciones de corticoide inhalado/agonista β-adrenérgico de larga duración (CI/LABA) en dosis fijas, para el tratamiento del asma en condiciones de práctica clínica habitual.
Material y métodosEstudio observacional realizado a partir de la revisión de registros médicos. Se incluyeron sujetos ≥18 años que iniciaron tratamiento con CI/LABA y que cumplieran con determinados criterios de inclusión/exclusión. El seguimiento se realizó durante un año. Grupos de estudio: a) PF/Form y b) otras-combinaciones (Otros-CI/LABA). Principales medidas: persistencia, ratio posesión del medicamento (RPM), exacerbaciones y costes (directos/indirectos). El análisis estadístico se elaboró mediante modelos de regresión, con p <0,05.
ResultadosSe seleccionó a 3.203 pacientes. Por grupos: a) PF/Form: 7,0% y b) Otros-CI/LABA: 93,0%. La edad media fue de 52,2 años y el 60,8% fueron mujeres. El 44,9% de los pacientes presentaban un asma persistente-moderado. Los pacientes en tratamiento con PF/Form se asociaron a una mayor persistencia (67,6 vs. 61,2%; p=0,043), mayor RPM (80,6 vs. 74,3%; p=0,002) y menores exacerbaciones (16,0 vs. 21,9%; p=0,021), especialmente exacerbaciones severas (4,0 vs. 7,7%; p=0,043). El promedio/unitario del coste total (ANCOVA) fue menor en los pacientes en tratamiento con PF/Form (2.033 vs. 2.486 €; p=0,012), respectivamente. El coste total se asoció a exacerbaciones (β = 0,618), severidad-asma (β = 0,214), edad (β = 0,073) y falta de adherencia (RPM: β = −0,031), con p <0,01.
ConclusionesLos pacientes en tratamiento con PF/Form se asociaron a una mayor adherencia al tratamiento (persistencia, RPM), circunstancia que repercute en menores exacerbaciones severas y costes totales para el sistema nacional de salud. Estas diferencias podrían ser debidas a las propiedades farmacológicas del fármaco o a otros factores no medidos.
To determine the persistence, exacerbations, and use of resources in patients who use inhaler treatment with fluticasone propionate/formoterol (PF/Form) in relation with other combinations of inhaled corticosteroid/long-acting β-adrenergic (ICS/LABA) at fixed doses, for the treatment of asthma in real-life practice.
Material and methodsObservational study conducted by reviewing medical records. The study included subjects ≥18 years of age who started treatment with ICS/LABA and who met certain inclusion/exclusion criteria. The follow-up was carried out for one year. Study groups: a) PF/Form and b) Other-combinations (Other-ICS/LABA). Main measurements: Persistence, medication possession ratio (MPR), exacerbations, and costs (direct/indirect). The statistical analysis was performed using regression models, with a P<.05.
ResultsA total of 3,203 patients were included in the study. By groups: a) FP/Form: 7.0% and b) Other-ICS/LABA: 93.0%. The mean age was 52.2 years, and 60.8% were women. A total of 44.9% of patients had persistent-moderate asthma. Patients under treatment with FP/Form were associated with greater persistence (67.6 vs. 61.2%, P=.043), a higher RPM (80.6 vs. 74.3%, P=.002), and less exacerbations (16.0 vs. 21.9%, P=.021), particularly severe-exacerbations (4.0 vs. 7.7%, P=.043). The mean/unit of the total cost (ANCOVA) was lower in patients under treatment with PF/Form (2,033 vs. € 2,486, P=.012), respectively. The total cost was associated with: Exacerbations (β=0.618), asthma-severity (β=0.214), age (β=0.073), and lack-adherence (RPM: β=−0.031), P<.01.
ConclusionsPatients undergoing treatment with PF/Form were associated with greater adherence to treatment (persistence, RPM), a circumstance that leads to less severe exacerbations and total costs for the national health system. These differences could be due to the pharmacological properties of the drug or other factors not measured.
El asma es una enfermedad inflamatoria crónica de las vías respiratorias que cursa con hiperrespuesta bronquial y una obstrucción variable al flujo aéreo1. Su prevalencia es variable en función de las series revisadas1-3. Las estimaciones de la prevalencia del asma varían entre el 5 y el 18% de la población adulta1,3,4. En España se estimada una prevalencia del 5%, si bien existe una cierta variación entre las diferentes áreas geográficas. La prevalencia está aumentando en las últimas décadas5. El objetivo del manejo del asma es lograr el control de los síntomas con terapia ajustada según la severidad y la disminución del riesgo de exacerbaciones2. La mayoría de los pacientes logra un adecuado control con corticosteroides inhalados (CI) y agonistas β-adrenérgicos de larga duración (LABA), aunque existe un grupo de pacientes que requiere terapia adicional con otros medicamentos, incluyendo los corticoides orales1-3.
La reducción del riesgo de exacerbaciones es un objetivo importante del tratamiento del asma2. Se estima que hasta un 36% de la población asmática puede experimentar anualmente exacerbaciones, de diferente intensidad, incluidos los pacientes con un asma persistente leve3. Las exacerbaciones previas, el mal control del asma, la limitación de la actividad, el menor volumen espiratorio forzado en el primer segundo (FEV1), la exposición a alérgenos, la dificultad en el manejo de los dispositivos de inhalación y la adherencia al tratamiento son algunos de los factores que influyen en un mayor riesgo de exacerbaciones2,6,7.
La falta de adherencia no solo tiene impacto en el control de la enfermedad (deterioro de la calidad de vida y mayor riesgo de exacerbaciones), sino que también se ha asociado con un aumento del consumo de recursos sanitarios y costes para el sistema nacional de salud8-10. La causa más frecuente de retirada del tratamiento suele ser la aparición de efectos secundarios, la mejora de los síntomas o problemas de reducción del efecto del fármaco en el tiempo, lo que aconseja su interrupción o inducen a su abandono espontáneo8. Los estudios disponibles en países desarrollados muestran unas tasas de adherencia al tratamiento antiasmático menores del 65%3,9,11. A pesar de la existencia de diferentes tratamientos con eficacia demostrada, alrededor de la mitad de los pacientes presentan un asma no controlada1-3. Recientes ensayos clínicos han puesto de manifiesto que la combinación a dosis fijas de propionato de fluticasona/formoterol (PF/Form) se asocia con un menor riesgo de exacerbaciones severas en comparación con otras combinaciones de CI/LABA. No obstante, la evidencia científica es limitada y se requerirán más estudios que confirmen la consistencia de estos resultados12,13.
En nuestro país, existen pocos estudios que evalúen la relación entre la tasa de adherencia, el riesgo de exacerbaciones y el uso de recursos o costes en pacientes asmáticos. En este sentido, la persistencia (o interrupción) del tratamiento constituye un factor clave en la progresión de la enfermedad y el riesgo de complicaciones (aumento del uso de los recursos sanitarios). Además, existe una creciente necesidad de llevar a cabo estudios representativos de las condiciones clínicas reales en las que se utilizan estos medicamentos, por lo que la realización del estudio puede ser de interés. El objetivo principal de este estudio fue analizar la persistencia en el tratamiento inhalador de PF/Form con relación a otras combinaciones de CI/LABA en dosis fijas, para el tratamiento del asma en condiciones de práctica clínica habitual. Como objetivo secundario se pretendió determinar la tasa de exacerbaciones, así como evaluar su impacto con el uso de recursos sanitarios y los costes asociados.
Pacientes y métodosDiseño y población de estudioSe efectuó un estudio observacional, multicéntrico y longitudinal (de carácter retrospectivo), realizado a partir de la revisión de los registros médicos (bases de datos informatizadas, con datos disociados). La población de estudio se obtuvo a partir de los registros informatizados de proveedores de salud de diversos centros de atención primaria de Cataluña (unificados en la base de datos disociada de la Fundación RedISS (Red de Investigación en Servicios Sanitarios; www.rediss.es). Los datos procedieron de la historia clínica informatizada OMIAPWIN y de otras bases de datos complementarias. La población asignada a los centros fue en su mayoría urbana, de nivel socioeconómico medio-bajo, con predominio industrial.
Criterios de inclusión y exclusiónSe incluyeron en el estudio los pacientes que demandaron atención y que iniciaron tratamiento con CI/LABA en combinación a dosis fija entre el 01/01/2015 y el 30/06/2016 (periodo de reclutamiento, fecha índice). Debían reunir las siguientes características: a) edad ≥ 18 años, b) diagnóstico de asma un mínimo de 12 meses previos a la fecha índice, c) estar en el programa de prescripciones para la obtención de las recetas médicas (con registro constatado de la dosis, intervalo de tiempo y duración de cada tratamiento administrado; ≥2 recetas durante el periodo de seguimiento) y d) que se pudiera garantizar el seguimiento regular de los pacientes (≥2 registros clínicos en el sistema informático). Fueron excluidos: a) los sujetos trasladados a otros centros, los desplazados o los de fuera de zona, b) los pacientes institucionalizados permanentemente; c) los que tenían antecedentes de EPOC, enfisema pulmonar, bronquiectasias, fibrosis quística y neoplasia bronquial y d) los que tuvieran fenotipo mixto asma-EPOC.
Grupos de estudio y periodo de seguimiento de los pacientesSe diferenciaron 2grupos de estudio en función del tratamiento inicial en combinación a dosis fijas (CI/LABA): a) fluticasona propionato/formoterol (R03AK11), frente a b) otras combinaciones (fluticasona propionato/salmeterol, R03AK06; budesonida/formoterol, R03AK07; beclometasona/formoterol, R03AK08, y fluticasona furoato/vilanterol, R03AK10). El periodo de seguimiento, a partir de la fecha de inclusión del paciente, fue de un año.
Pacientes asmáticos, exacerbación y otras variables de interésLos registros de los pacientes con asma se obtuvieron a partir de la Clasificación Internacional de la Atención Primaria (CIAP-2; R93)14, o de la Clasificación Internacional de Enfermedades (novena edición) Modificación Clínica (CIE-9-MC; 493.x para la enfermedad o las reagudizaciones). El diagnóstico de asma siempre fue a criterio del médico, comprobándose con los valores de la espirometría. En cuanto a la exacerbación se siguieron los criterios de la normativa ALERTA-2, que define la exacerbación como un evento en el curso natural de la enfermedad caracterizado por la agudización de la enfermedad identificada por un aumento progresivo en la dificultad para respirar, sensación de falta de aire, sibilancias, opresión torácica o una combinación de todos estos síntomas, ocasionada por la obstrucción intensa del flujo aéreo2,3. Se identificaron los pacientes que reagudizan de forma ambulatoria (Atención Primaria y servicio de urgencias hospitalario: exacerbación de asma leve-moderada) o ingresan en el hospital (exacerbación de asma grave). Se obtuvo el registro (historias informatizadas) de cada episodio de exacerbación (tasa de exacerbación previa/anterior y posterior a la fecha índice: un año) y del tiempo desde el diagnóstico (en años). Además, también se cuantificó el índice de masa corporal (IMC, kg/m2), la función pulmonar (FEV1), la gravedad/severidad del asma (intermitente, persistente leve, persistente moderado y persistente grave; criterios GINA)3 al inicio del estudio (anterior a la fecha índice). Se detallaron los fallecimientos por todas las causas (durante el periodo de seguimiento).
Variables sociodemográficas y de comorbilidadLas variables sociodemográficas y de comorbilidad fueron las siguientes: edad (continua y por rangos) y sexo, así como los antecedentes personales obtenidos a partir de la CIAP-2 de hipertensión arterial (K86, K87), diabetes mellitus (T89,T90), dislipidemia (T93), obesidad (T82), tabaquismo activo (P17), alcoholismo (P15, P16), todos los tipos de fallos orgánicos (cardiaco, hepático y renal), cardiopatía isquémica (códigos: K74, K76, K75), accidente cerebro-vascular (K90, K91, K93), síndrome depresivo (P76), neoplasias malignas (todos los tipos; A79, B72-75, D74-78, F75, H75, K72, L71, L97, N74-76, T71-73, U75-79, W72-73, X75-81, Y77-79), rinitis alérgica (R97), poliposis nasal (R99) y reflujo gastroesofágico (D99). Como variable resumen de la comorbilidad general, para cada paciente atendido, se utilizará: a) el índice de comorbilidad de Charlson15 como una aproximación a la gravedad del paciente, b) el número de comorbilidades crónicas y c) el índice de casuística individual, obtenido a partir de los Adjusted Clinical Groups, que es un sistema de clasificación de pacientes por isoconsumo de recursos16. El aplicativo de los Ajusted Clinical Groups proporciona las bandas de utilización de recursos (BUR), con lo que cada paciente en función de su morbilidad general queda agrupado en una de las 5 categorías mutuamente excluyentes (1: usuarios sanos o de morbilidad muy baja, 2: morbilidad baja, 3: morbilidad moderada, 4: morbilidad elevada y 5: morbilidad muy elevada).
Medicación administrada y persistencia/cumplimiento del tratamientoSe obtuvieron los medicamentos (principios activos) indicados para el tratamiento según la clasificación Anatomical Therapeutic Chemical Classification System17: corticoides orales/sistémicos (corticoides orales, H02AB), β-2 agonistas de corta duración (SABA, R03AC), agonistas β-2 sistémicos (xantinas, R03*), antagonistas de los receptores de los leucotrienos (R03DC) anticolinérgicos (LAMA, R03BB04: bromuro de tiotropio) y omalizumab (biológicos, R03DX05). Además, se diferenciaron aquellos pacientes que recibieron tratamiento con corticoides orales/sistémicos de larga duración (pautados, crónicos), de los que lo recibieron únicamente para la estabilidad del episodio de reagudización/exacerbación. La elección del medicamento para un paciente en concreto fue a criterio del médico (práctica clínica). La información se obtuvo de los registros procedentes de la dispensación farmacéutica de medicamentos. También se clasificó la dosis pautada del CI administrado en baja-media-alta3. La persistencia en el tratamiento se calculó desde la fecha de inicio/índice hasta la fecha de interrupción (en meses). La fecha de interrupción fue aquella en que el paciente cambió a otra medicación (CI/LABA) o la abandonó/interrumpió (≥60 días sin renovar la medicación o ≥2 recetas dispensadas). La tasa de persistencia en el tratamiento se obtuvo a los 3, 6 y 12 meses del seguimiento. El porcentaje de cumplimiento terapéutico se definió según los criterios de la Sociedad Internacional de Farmacoeconomía y Resultados en Salud y se calculó en función de la tasa/ratio de posesión del medicamento (RPM)18. Este se evaluó desde la primera hasta la última prescripción y representó el número de días de medicación dispensada entre el número de días en tratamiento (a partir de la fecha índice)18.
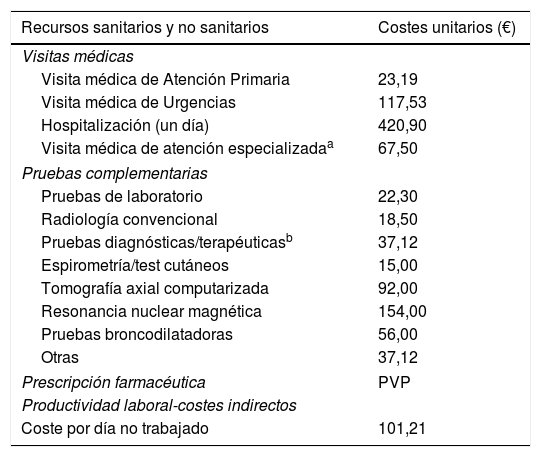
Uso de recursos y costes asociadosSe consideraron los costes sanitarios (costes directos) relacionados con la actividad asistencial (visitas médicas, días de hospitalización, urgencias, solicitudes diagnósticas o terapéuticas, etc.) y los no sanitarios (indirectos), relativos a la pérdida de productividad laboral (días de incapacidad). El coste fue expresado en coste medio por paciente (promedio/unitario) durante todo el periodo de estudio (un año). Los diferentes conceptos de estudio y su valoración económica se detallan en la tabla 1 (correspondientes al año 2016). Las tarifas se obtuvieron a partir de la contabilidad analítica de los centros, excepto la medicación y los días de baja laboral. Las prescripciones (recetas médicas) se cuantificaron según el precio de venta al público por envase en el momento de la prescripción y los días de incapacidad laboral según el salario medio interprofesional (fuente: INE)19. El uso de los recursos y los costes de los pacientes fueron únicamente por causas respiratorias. Este estudio no contempló el cómputo de los costes directos no sanitarios, es decir, los que se consideran «costes de bolsillo» o pagados por el propio paciente/familia, al no estar registrados en la base de datos y no tener acceso, por diseño del estudio, al propio paciente.
Detalle de los costes/unitarios y de las pérdidas de productividad laboral (año 2016)
| Recursos sanitarios y no sanitarios | Costes unitarios (€) |
|---|---|
| Visitas médicas | |
| Visita médica de Atención Primaria | 23,19 |
| Visita médica de Urgencias | 117,53 |
| Hospitalización (un día) | 420,90 |
| Visita médica de atención especializadaa | 67,50 |
| Pruebas complementarias | |
| Pruebas de laboratorio | 22,30 |
| Radiología convencional | 18,50 |
| Pruebas diagnósticas/terapéuticasb | 37,12 |
| Espirometría/test cutáneos | 15,00 |
| Tomografía axial computarizada | 92,00 |
| Resonancia nuclear magnética | 154,00 |
| Pruebas broncodilatadoras | 56,00 |
| Otras | 37,12 |
| Prescripción farmacéutica | PVP |
| Productividad laboral-costes indirectos | |
| Coste por día no trabajado | 101,21 |
Fuente de los recursos sanitarios: contabilidad analítica propia e INE.
Valores expresados en euros. PVP: precio de venta al público.
Se respetó la confidencialidad de los registros (anónimos y disociados) según la Ley Orgánica de Protección de Datos (Ley 15/1999 del 13 de diciembre). El estudio fue clasificado por la Agencia Española del Medicamento y Productos Sanitarios y posteriormente fue aprobado por el Comité de Ética de Investigación Clínica de la Universidad Internacional de Cataluña (Barcelona).
Análisis estadísticoSe realizó una validación de los registros para asegurar la calidad de los resultados. Se efectuó un análisis estadístico descriptivo-univariante. Para los datos cualitativos: frecuencias absolutas y relativas; y para los datos cuantitativos: media, desviación estándar (DE), mediana y percentiles 25 y 75 de la distribución (amplitud intercuartil). Los intervalos de confianza (IC) del 95% para la estimación de parámetros se basaron en el número total de sujetos con valores no perdidos. Se comprobó la normalidad de la distribución con la prueba de Kolmogorov-Smirnov. En el análisis bivariante (contrastes) se utilizaron las pruebas de ANOVA, Chi al cuadrado, correlación lineal de Pearson y comparación de medias para datos emparejados. Para obtener la mediana de persistencia al tratamiento se realizó un análisis de supervivencia de Kaplan-Meier (comparación: log-rang test). Los modelos multivariantes utilizados fueron los siguientes: a) análisis de la covarianza (ANCOVA; modelo lineal generalizado; procedimiento: estimación de medias marginales; ajuste de Bonferroni), para la corrección de los diferentes conceptos del coste (variable dependiente, en función de la clasificación de los fármacos CI/LABA [grupos de estudio]) y b) regresión lineal múltiple, para obtener las variables asociadas al coste y el número de exacerbaciones (variables dependientes; procedimiento: pasos consecutivos). Las covariables incluidas en el modelo fueron: el sexo, la edad, la comorbilidad general (BUR), el FEV1, el tiempo de duración de la enfermedad, la gravedad/severidad del asma, el RPM y la presencia de exacerbaciones (para el coste). Se utilizó el programa SPSSWIN versión 17, estableciéndose una significación estadística para valores de p <0,05.
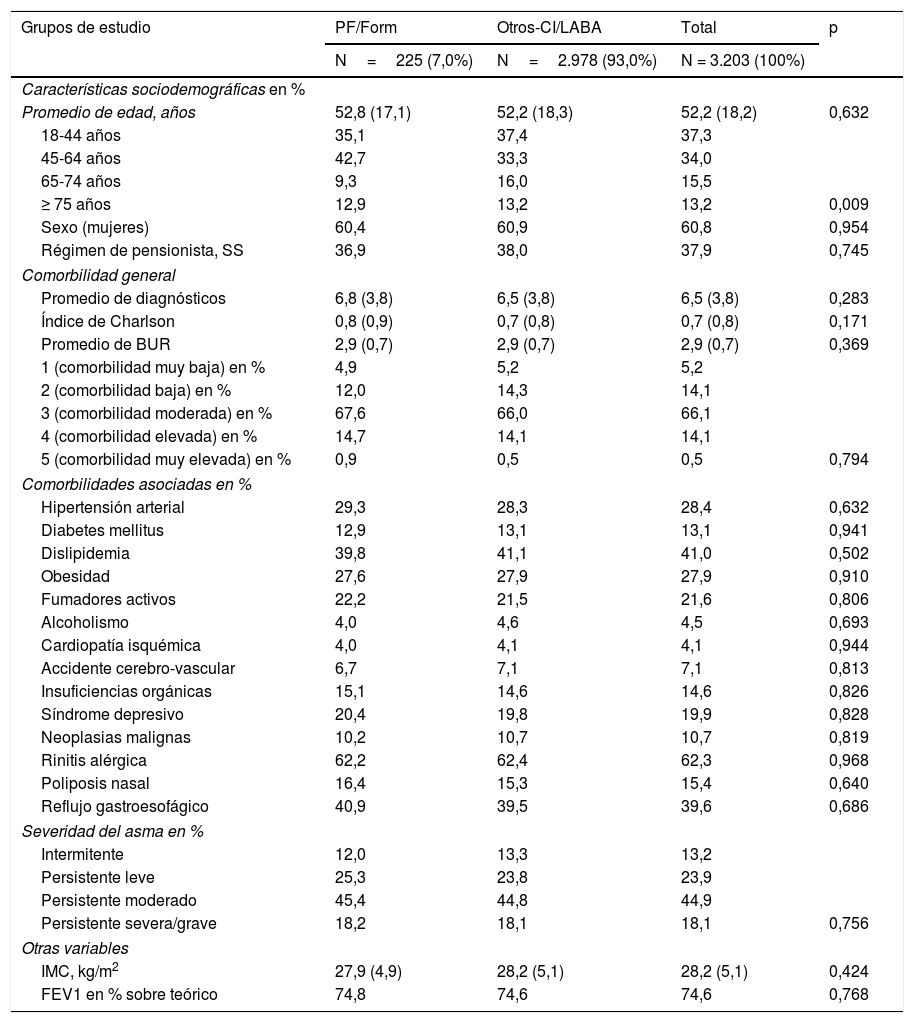
ResultadosDe una población inicial de 209.741 habitantes ≥18 años, fueron atendidos 161.590 pacientes entre el 01/01/2015 y el 30/06/2016. De estos, 8.725 sujetos estaban diagnosticados de asma (prevalencia: 5,4%; IC del 95%: 5,2-5,7%). Finalmente se analizaron 3.203 pacientes que cumplían con los criterios de inclusión/exclusión y pudieron seguirse durante el periodo de estudio (ver fig. 1). En la tabla 2 se muestran las características basales de la serie estudiada según los grupos de estudio (CI/LABA). La edad media fue de 52,2 años, el 60,8% fueron mujeres, las BUR fueron de 2,9 puntos y el promedio del índice de Charlson de 0,7 puntos por paciente. La rinitis alérgica (62,3%), la dislipidemia (41,0%), el reflujo gastroesofágico (39,6%) y la hipertensión arterial (28,4%) fueron las comorbilidades más frecuentes. El 44,9% de los pacientes presentaban un asma persistente moderado, con un FEV1 medio de 74,6%. Según el tratamiento inicial prescrito (CI/LABA), la confección de los grupos de estudio fue la siguiente: el 7,0% (N=225) PF/Form y el 93,0% (N=2.978) Otros-CI/LABA (distribución: 33,4% [N=996] fluticasona +salmeterol; 30,8% [N=917] beclometasona +formoterol; 26,9% [N=802] budesonida +formoterol y 8,8% [N=263] fluticasona +vilanterol). Hubo una aceptable comparabilidad en las características basales de los 2grupos de estudio.
Esquema general del estudio
Se efectuó un diseño observacional de carácter retrospectivo, realizado a partir de la revisión de los registros médicos (bases de datos informatizadas, con datos anonimizados y disociados) de pacientes diagnosticados de asma.
CI/LABA: corticosteroides inhalados/agonistas β-adrenérgicos de larga duración; IC: intervalo de confianza; FEV1: volumen espiratorio forzado en el primer segundo.
Características basales de la serie estudiada por grupos de estudio
| Grupos de estudio | PF/Form | Otros-CI/LABA | Total | p |
|---|---|---|---|---|
| N=225 (7,0%) | N=2.978 (93,0%) | N = 3.203 (100%) | ||
| Características sociodemográficas en % | ||||
| Promedio de edad, años | 52,8 (17,1) | 52,2 (18,3) | 52,2 (18,2) | 0,632 |
| 18-44 años | 35,1 | 37,4 | 37,3 | |
| 45-64 años | 42,7 | 33,3 | 34,0 | |
| 65-74 años | 9,3 | 16,0 | 15,5 | |
| ≥ 75 años | 12,9 | 13,2 | 13,2 | 0,009 |
| Sexo (mujeres) | 60,4 | 60,9 | 60,8 | 0,954 |
| Régimen de pensionista, SS | 36,9 | 38,0 | 37,9 | 0,745 |
| Comorbilidad general | ||||
| Promedio de diagnósticos | 6,8 (3,8) | 6,5 (3,8) | 6,5 (3,8) | 0,283 |
| Índice de Charlson | 0,8 (0,9) | 0,7 (0,8) | 0,7 (0,8) | 0,171 |
| Promedio de BUR | 2,9 (0,7) | 2,9 (0,7) | 2,9 (0,7) | 0,369 |
| 1 (comorbilidad muy baja) en % | 4,9 | 5,2 | 5,2 | |
| 2 (comorbilidad baja) en % | 12,0 | 14,3 | 14,1 | |
| 3 (comorbilidad moderada) en % | 67,6 | 66,0 | 66,1 | |
| 4 (comorbilidad elevada) en % | 14,7 | 14,1 | 14,1 | |
| 5 (comorbilidad muy elevada) en % | 0,9 | 0,5 | 0,5 | 0,794 |
| Comorbilidades asociadas en % | ||||
| Hipertensión arterial | 29,3 | 28,3 | 28,4 | 0,632 |
| Diabetes mellitus | 12,9 | 13,1 | 13,1 | 0,941 |
| Dislipidemia | 39,8 | 41,1 | 41,0 | 0,502 |
| Obesidad | 27,6 | 27,9 | 27,9 | 0,910 |
| Fumadores activos | 22,2 | 21,5 | 21,6 | 0,806 |
| Alcoholismo | 4,0 | 4,6 | 4,5 | 0,693 |
| Cardiopatía isquémica | 4,0 | 4,1 | 4,1 | 0,944 |
| Accidente cerebro-vascular | 6,7 | 7,1 | 7,1 | 0,813 |
| Insuficiencias orgánicas | 15,1 | 14,6 | 14,6 | 0,826 |
| Síndrome depresivo | 20,4 | 19,8 | 19,9 | 0,828 |
| Neoplasias malignas | 10,2 | 10,7 | 10,7 | 0,819 |
| Rinitis alérgica | 62,2 | 62,4 | 62,3 | 0,968 |
| Poliposis nasal | 16,4 | 15,3 | 15,4 | 0,640 |
| Reflujo gastroesofágico | 40,9 | 39,5 | 39,6 | 0,686 |
| Severidad del asma en % | ||||
| Intermitente | 12,0 | 13,3 | 13,2 | |
| Persistente leve | 25,3 | 23,8 | 23,9 | |
| Persistente moderado | 45,4 | 44,8 | 44,9 | |
| Persistente severa/grave | 18,2 | 18,1 | 18,1 | 0,756 |
| Otras variables | ||||
| IMC, kg/m2 | 27,9 (4,9) | 28,2 (5,1) | 28,2 (5,1) | 0,424 |
| FEV1 en % sobre teórico | 74,8 | 74,6 | 74,6 | 0,768 |
Valores expresados en porcentaje o media (desviación estándar).
BUR: bandas de utilización de recursos; FEV1: volumen espiratorio forzado en el primer segundo; IMC: índice de masa corporal, kg/m2; Otros-CI/LABA: beclometasona/formoterol, budesonida/formoterol, fluticasona/salmeterol y fluticasona/vilanterol; p: significación estadística; PF/Form: fluticasona/formoterol; SS: seguridad social.
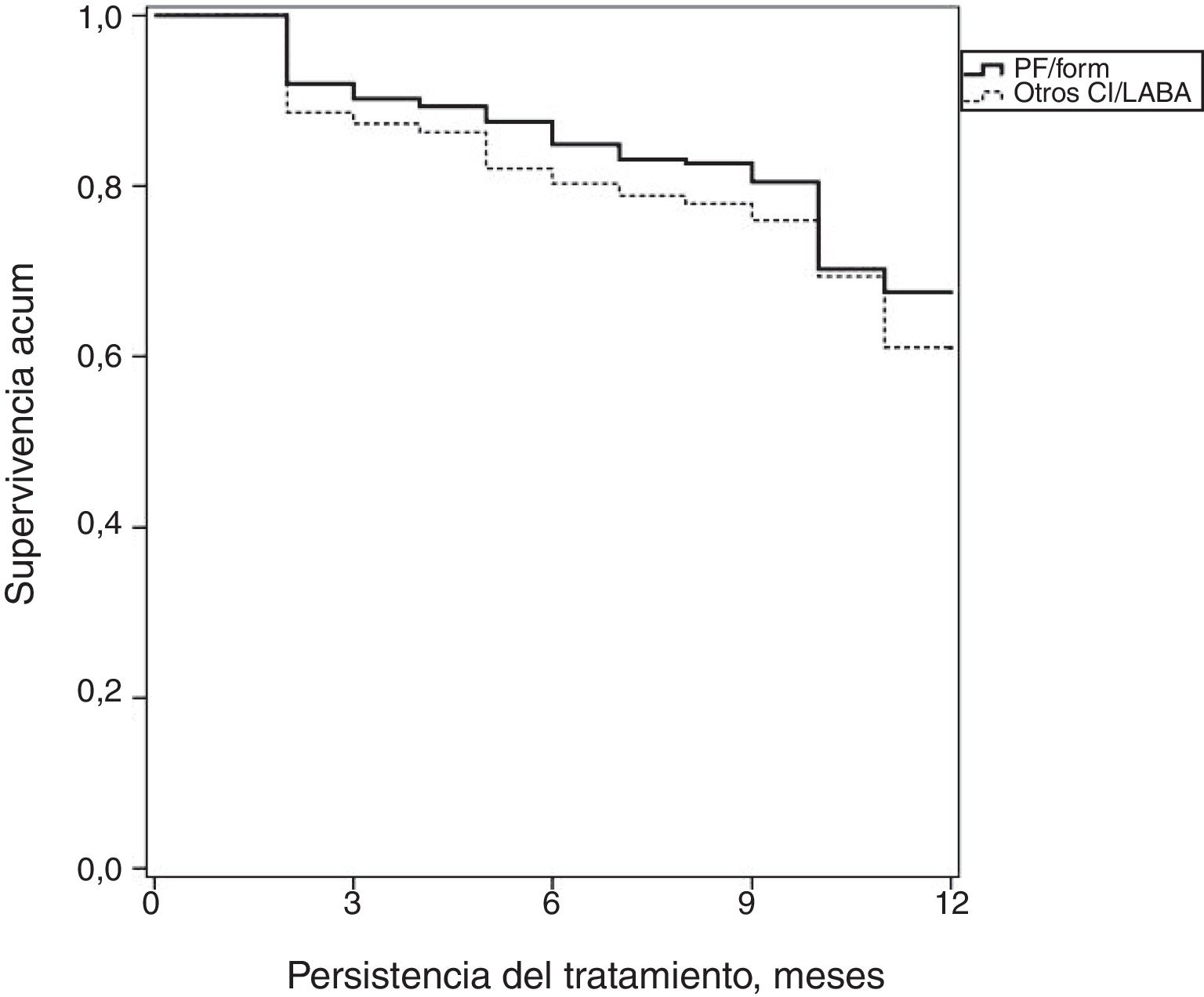
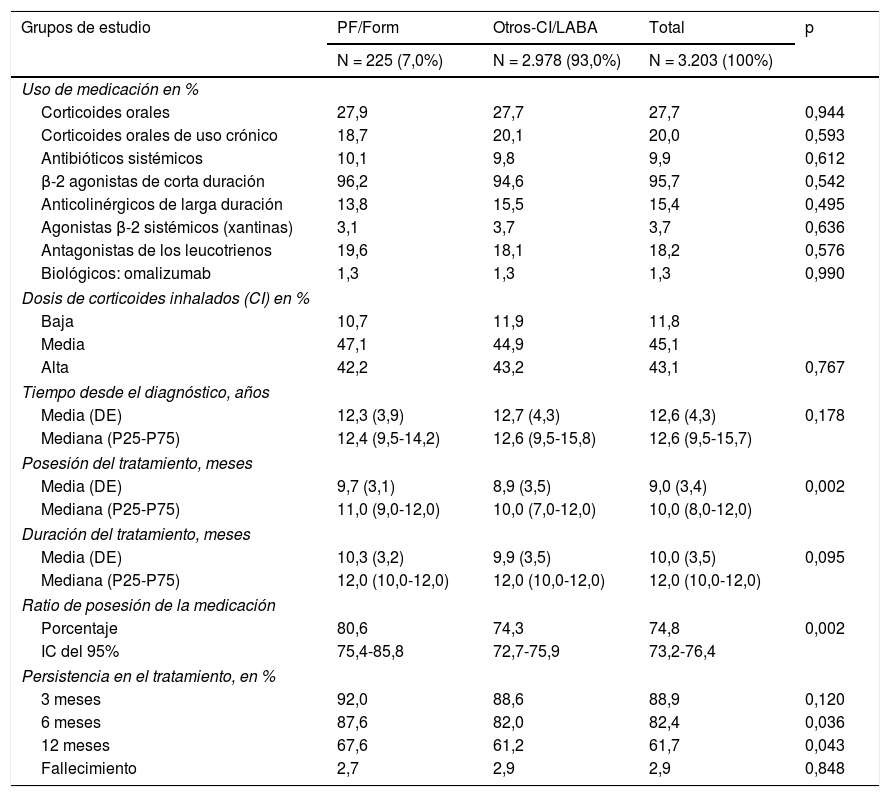
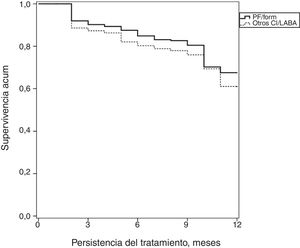
La medicación administrada y la adherencia (persistencia y RPM) al tratamiento durante el periodo de seguimiento según los grupos de estudio se detallan en la tabla 3. El 95,7% de los pacientes estaban en tratamiento con agonistas β-2 de corta duración (SABA) como tratamiento de rescate. El 27,7% utilizaron corticoides orales (20,0% de uso habitual/crónico pautado) y el 18,2% antagonistas de los leucotrienos. El 45,1% de los pacientes recibieron dosis medias de CI (47,1% PF/Form vs. 44,9% Otros-CI/LABA; p=0,382). La persistencia en el tratamiento (12 meses) fue del 61,7% (IC del 95%: 60,0-63,4%), ligeramente superior con PF/Form (67,6 vs. 61,2%; p=0,043); estos pacientes también mostraron un mayor cumplimiento del tratamiento (RPM: 80,6 vs. 74,3%; p=0,002). La curva de supervivencia (mediana de tiempo) de la persistencia se muestra en la figura 2. El porcentaje de fallecimientos fue del 2,9%.
Medicación administrada y adherencia al tratamiento durante el periodo de seguimiento
| Grupos de estudio | PF/Form | Otros-CI/LABA | Total | p |
|---|---|---|---|---|
| N = 225 (7,0%) | N = 2.978 (93,0%) | N = 3.203 (100%) | ||
| Uso de medicación en % | ||||
| Corticoides orales | 27,9 | 27,7 | 27,7 | 0,944 |
| Corticoides orales de uso crónico | 18,7 | 20,1 | 20,0 | 0,593 |
| Antibióticos sistémicos | 10,1 | 9,8 | 9,9 | 0,612 |
| β-2 agonistas de corta duración | 96,2 | 94,6 | 95,7 | 0,542 |
| Anticolinérgicos de larga duración | 13,8 | 15,5 | 15,4 | 0,495 |
| Agonistas β-2 sistémicos (xantinas) | 3,1 | 3,7 | 3,7 | 0,636 |
| Antagonistas de los leucotrienos | 19,6 | 18,1 | 18,2 | 0,576 |
| Biológicos: omalizumab | 1,3 | 1,3 | 1,3 | 0,990 |
| Dosis de corticoides inhalados (CI) en % | ||||
| Baja | 10,7 | 11,9 | 11,8 | |
| Media | 47,1 | 44,9 | 45,1 | |
| Alta | 42,2 | 43,2 | 43,1 | 0,767 |
| Tiempo desde el diagnóstico, años | ||||
| Media (DE) | 12,3 (3,9) | 12,7 (4,3) | 12,6 (4,3) | 0,178 |
| Mediana (P25-P75) | 12,4 (9,5-14,2) | 12,6 (9,5-15,8) | 12,6 (9,5-15,7) | |
| Posesión del tratamiento, meses | ||||
| Media (DE) | 9,7 (3,1) | 8,9 (3,5) | 9,0 (3,4) | 0,002 |
| Mediana (P25-P75) | 11,0 (9,0-12,0) | 10,0 (7,0-12,0) | 10,0 (8,0-12,0) | |
| Duración del tratamiento, meses | ||||
| Media (DE) | 10,3 (3,2) | 9,9 (3,5) | 10,0 (3,5) | 0,095 |
| Mediana (P25-P75) | 12,0 (10,0-12,0) | 12,0 (10,0-12,0) | 12,0 (10,0-12,0) | |
| Ratio de posesión de la medicación | ||||
| Porcentaje | 80,6 | 74,3 | 74,8 | 0,002 |
| IC del 95% | 75,4-85,8 | 72,7-75,9 | 73,2-76,4 | |
| Persistencia en el tratamiento, en % | ||||
| 3 meses | 92,0 | 88,6 | 88,9 | 0,120 |
| 6 meses | 87,6 | 82,0 | 82,4 | 0,036 |
| 12 meses | 67,6 | 61,2 | 61,7 | 0,043 |
| Fallecimiento | 2,7 | 2,9 | 2,9 | 0,848 |
Valores expresados en porcentaje o media (DE).
DE: desviación estándar; IC: intervalos de confianza; Otros-CI/LABA: beclometasona/formoterol, budesonida/formoterol, fluticasona/salmeterol y fluticasona/vilanterol; P: percentil; p: significación estadística; PF/Form: fluticasona/formoterol.
Estimación del tiempo de duración del tratamiento para el asma
Curva de Kaplan-Meier: procedimiento de log rank (Mantel-Cox): Chi-cuadrado=3,937; p=0,048.
PF/Form: fluticasona/formoterol; Otros-CI/LABA: beclometasona/formoterol, budesonida/formoterol, fluticasona/salmeterol y fluticasona/vilanterol.
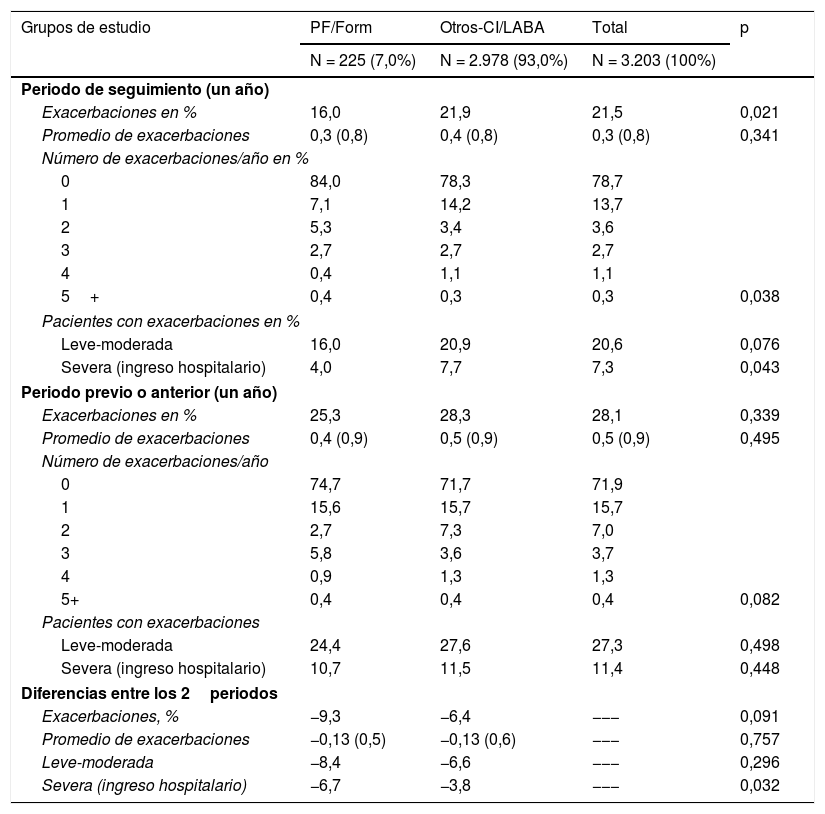
En la tabla 4 se describen las exacerbaciones (por grupos de estudio). En general, el 21,5% de los pacientes mostraron algún tipo de exacerbación, ligeramente inferior en el grupo en tratamiento con PF/Form (16,0 vs. 21,9%; p=0,021). Cabe destacar que estas diferencias fueron más evidentes en los pacientes con exacerbaciones severas (4,0 vs. 7,7%; p=0,043). Las exacerbaciones leve-moderadas, aunque también fueron menores, no alcanzaron la significación estadística (16,0 vs. 20,9%; p=0,076). Durante el periodo previo a la administración de CI/LABA, el porcentaje de exacerbaciones fue similar entre los 2grupos de estudio (25,3 vs. 28,3%; p=0,339). Las diferencias entre la reducción de las exacerbaciones durante los 2periodos analizados fueron similares (−9,3% con PF/Form vs. −6,4% con Otros-CI/LABA; p=0,091). Estas diferencias también fueron más evidentes en los pacientes con exacerbaciones severas (−6,7 vs. -3,8%; p=0,032, respectivamente). En el modelo multivariante, el número de exacerbaciones (durante el seguimiento) se asoció a los pacientes con episodios de exacerbación previa (β = 0,798), al FEV1 (β = −0,075) y a los hombres (β = 0,021), con p <0,03. El coeficiente de determinación del modelo fue del 84,2%.
Exacerbaciones por grupos de estudio
| Grupos de estudio | PF/Form | Otros-CI/LABA | Total | p |
|---|---|---|---|---|
| N = 225 (7,0%) | N = 2.978 (93,0%) | N = 3.203 (100%) | ||
| Periodo de seguimiento (un año) | ||||
| Exacerbaciones en % | 16,0 | 21,9 | 21,5 | 0,021 |
| Promedio de exacerbaciones | 0,3 (0,8) | 0,4 (0,8) | 0,3 (0,8) | 0,341 |
| Número de exacerbaciones/año en % | ||||
| 0 | 84,0 | 78,3 | 78,7 | |
| 1 | 7,1 | 14,2 | 13,7 | |
| 2 | 5,3 | 3,4 | 3,6 | |
| 3 | 2,7 | 2,7 | 2,7 | |
| 4 | 0,4 | 1,1 | 1,1 | |
| 5+ | 0,4 | 0,3 | 0,3 | 0,038 |
| Pacientes con exacerbaciones en % | ||||
| Leve-moderada | 16,0 | 20,9 | 20,6 | 0,076 |
| Severa (ingreso hospitalario) | 4,0 | 7,7 | 7,3 | 0,043 |
| Periodo previo o anterior (un año) | ||||
| Exacerbaciones en % | 25,3 | 28,3 | 28,1 | 0,339 |
| Promedio de exacerbaciones | 0,4 (0,9) | 0,5 (0,9) | 0,5 (0,9) | 0,495 |
| Número de exacerbaciones/año | ||||
| 0 | 74,7 | 71,7 | 71,9 | |
| 1 | 15,6 | 15,7 | 15,7 | |
| 2 | 2,7 | 7,3 | 7,0 | |
| 3 | 5,8 | 3,6 | 3,7 | |
| 4 | 0,9 | 1,3 | 1,3 | |
| 5+ | 0,4 | 0,4 | 0,4 | 0,082 |
| Pacientes con exacerbaciones | ||||
| Leve-moderada | 24,4 | 27,6 | 27,3 | 0,498 |
| Severa (ingreso hospitalario) | 10,7 | 11,5 | 11,4 | 0,448 |
| Diferencias entre los 2periodos | ||||
| Exacerbaciones, % | −9,3 | −6,4 | −−− | 0,091 |
| Promedio de exacerbaciones | −0,13 (0,5) | −0,13 (0,6) | −−− | 0,757 |
| Leve-moderada | −8,4 | −6,6 | −−− | 0,296 |
| Severa (ingreso hospitalario) | −6,7 | −3,8 | −−− | 0,032 |
Valores expresados en porcentaje o media (DE: desviación estándar).
DE: desviación estándar; Otros-CI/LABA: beclometasona/formoterol, budesonida/formoterol, fluticasona/salmeterol y fluticasona/vilanterol; P: percentil; p: significación estadística; PF/Form: fluticasona/formoterol.
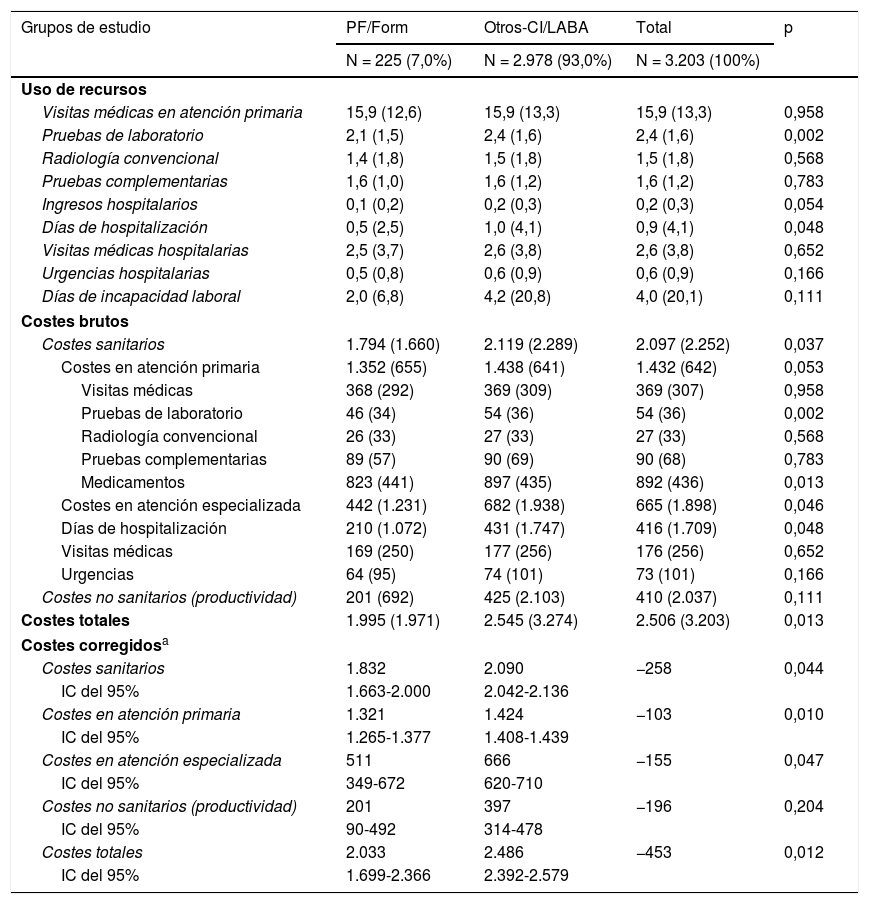
Durante el seguimiento (12 meses), los pacientes en tratamiento con PF/Form utilizaron menos recursos sanitarios, específicamente, en pruebas de laboratorio (2,1 vs. 2,4; p=0,002) y días de hospitalización (0,5 vs. 1,0; p=0,048). Las diferencias en días de incapacidad laboral (costes indirectos), aunque menores, no fueron concluyentes (2,0 vs. 4,2; p=0,111) (tabla 5). El coste total de los pacientes incluidos en el estudio (N=3.203) ascendió a 8,0 millones de euros (tabla 5), de los cuales el 83,7% correspondieron a costes sanitarios (directos) y el 16,3% a costes no sanitarios (pérdidas de productividad), con un promedio/unitario total anual de 2.506 €. El 57,1% de los costes totales se produjeron en Atención Primaria y el 26,5% en atención especializada. Los mayores componentes del coste fueron los ingresos hospitalarios (16,6%) y la medicación (35,6%). El promedio/unitario del coste total anual de los sujetos en tratamiento con PF/Form u Otros-CI/LABA corregido por las covariables (ANCOVA) fue de 2.033 vs. 2.486 € (p=0,012), diferencia de −453 €. Estas diferencias se mantuvieron para el coste sanitario (1.832 vs. 2.090€; p=0,044). Los costes no sanitarios (pérdidas de productividad laboral), aunque destacables, no mostraron diferencias estadísticamente significativas (201 vs. 397 €; p=0,204). La estancia media total de los pacientes hospitalizados fue de 6,5 días (DE: 3,5).
Uso de recursos y costes asociados (en EUR) por grupos de estudio
| Grupos de estudio | PF/Form | Otros-CI/LABA | Total | p |
|---|---|---|---|---|
| N = 225 (7,0%) | N = 2.978 (93,0%) | N = 3.203 (100%) | ||
| Uso de recursos | ||||
| Visitas médicas en atención primaria | 15,9 (12,6) | 15,9 (13,3) | 15,9 (13,3) | 0,958 |
| Pruebas de laboratorio | 2,1 (1,5) | 2,4 (1,6) | 2,4 (1,6) | 0,002 |
| Radiología convencional | 1,4 (1,8) | 1,5 (1,8) | 1,5 (1,8) | 0,568 |
| Pruebas complementarias | 1,6 (1,0) | 1,6 (1,2) | 1,6 (1,2) | 0,783 |
| Ingresos hospitalarios | 0,1 (0,2) | 0,2 (0,3) | 0,2 (0,3) | 0,054 |
| Días de hospitalización | 0,5 (2,5) | 1,0 (4,1) | 0,9 (4,1) | 0,048 |
| Visitas médicas hospitalarias | 2,5 (3,7) | 2,6 (3,8) | 2,6 (3,8) | 0,652 |
| Urgencias hospitalarias | 0,5 (0,8) | 0,6 (0,9) | 0,6 (0,9) | 0,166 |
| Días de incapacidad laboral | 2,0 (6,8) | 4,2 (20,8) | 4,0 (20,1) | 0,111 |
| Costes brutos | ||||
| Costes sanitarios | 1.794 (1.660) | 2.119 (2.289) | 2.097 (2.252) | 0,037 |
| Costes en atención primaria | 1.352 (655) | 1.438 (641) | 1.432 (642) | 0,053 |
| Visitas médicas | 368 (292) | 369 (309) | 369 (307) | 0,958 |
| Pruebas de laboratorio | 46 (34) | 54 (36) | 54 (36) | 0,002 |
| Radiología convencional | 26 (33) | 27 (33) | 27 (33) | 0,568 |
| Pruebas complementarias | 89 (57) | 90 (69) | 90 (68) | 0,783 |
| Medicamentos | 823 (441) | 897 (435) | 892 (436) | 0,013 |
| Costes en atención especializada | 442 (1.231) | 682 (1.938) | 665 (1.898) | 0,046 |
| Días de hospitalización | 210 (1.072) | 431 (1.747) | 416 (1.709) | 0,048 |
| Visitas médicas | 169 (250) | 177 (256) | 176 (256) | 0,652 |
| Urgencias | 64 (95) | 74 (101) | 73 (101) | 0,166 |
| Costes no sanitarios (productividad) | 201 (692) | 425 (2.103) | 410 (2.037) | 0,111 |
| Costes totales | 1.995 (1.971) | 2.545 (3.274) | 2.506 (3.203) | 0,013 |
| Costes corregidosa | ||||
| Costes sanitarios | 1.832 | 2.090 | −258 | 0,044 |
| IC del 95% | 1.663-2.000 | 2.042-2.136 | ||
| Costes en atención primaria | 1.321 | 1.424 | −103 | 0,010 |
| IC del 95% | 1.265-1.377 | 1.408-1.439 | ||
| Costes en atención especializada | 511 | 666 | −155 | 0,047 |
| IC del 95% | 349-672 | 620-710 | ||
| Costes no sanitarios (productividad) | 201 | 397 | −196 | 0,204 |
| IC del 95% | 90-492 | 314-478 | ||
| Costes totales | 2.033 | 2.486 | −453 | 0,012 |
| IC del 95% | 1.699-2.366 | 2.392-2.579 | ||
Valores expresados en media (DE).
DE: desviación estándar; IC: intervalo de confianza; Otros-CI/LABA: beclometasona/formoterol, budesonida/formoterol, fluticasona/salmeterol y fluticasona/vilanterol; p: significación estadística; PF/Form: fluticasona/formoterol.
Modelo de ANCOVA: los contrastes se basan en las comparaciones por pares, linealmente independientes, entre las medias marginales estimadas. Covariables: sexo, edad, comorbilidad general (bandas de utilización de recursos), ratio de posesión de la medicación, tiempo desde el diagnóstico, exacerbaciones y severidad del asma. Procedimiento: estimación de medias marginales; ajuste de Bonferroni.
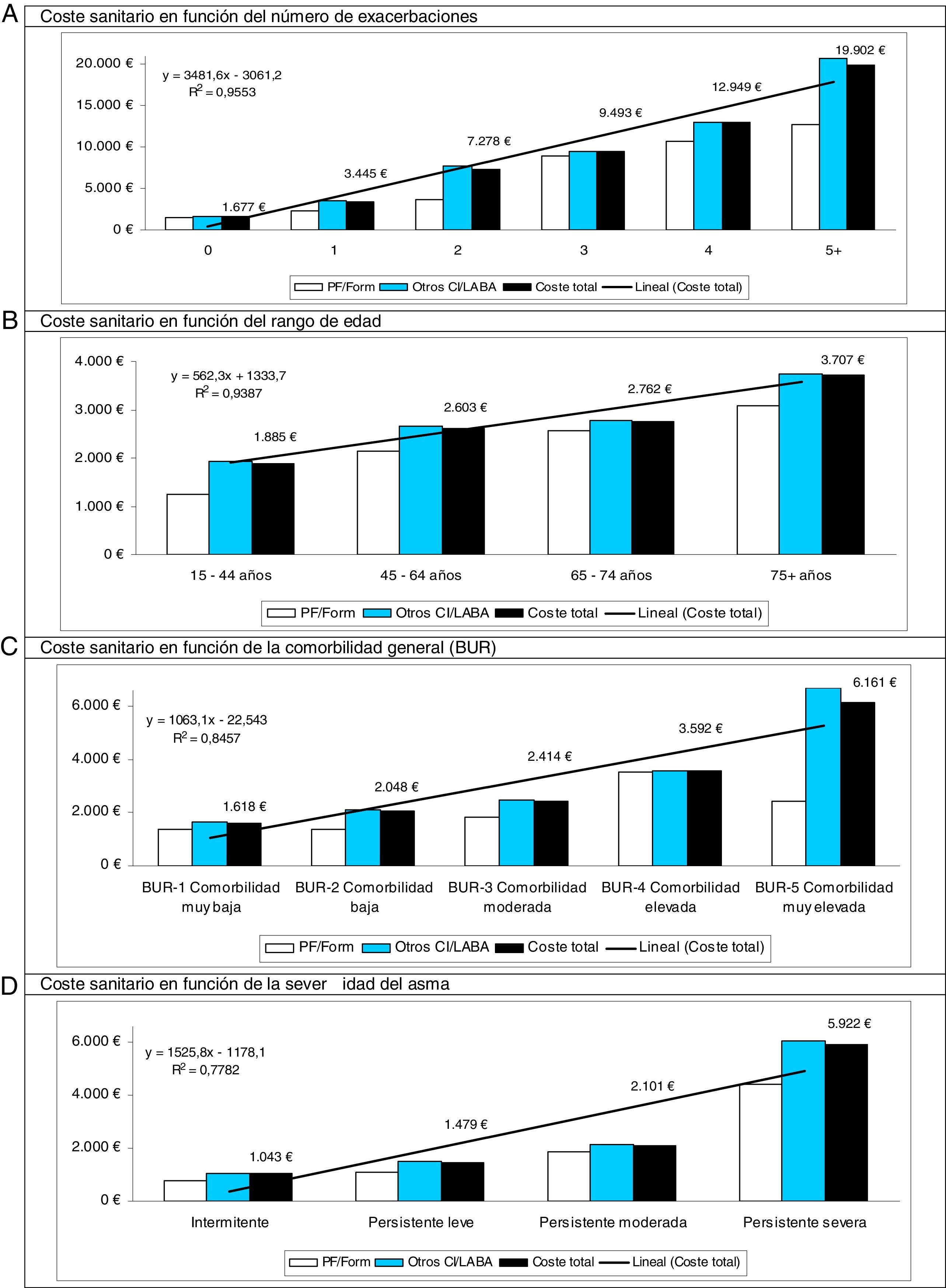
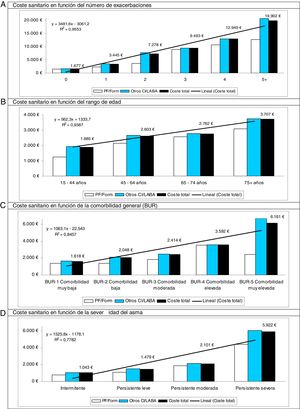
En el modelo de correlaciones binarias el RPM tuvo una elevada correlación con la persistencia en el tratamiento (r=0,815), mientras que el coste sanitario se asoció con la exacerbación (r=0,679; p <0,001). En el análisis de regresión lineal múltiple (método: pasos consecutivos), el coste total se asoció al número de exacerbaciones (β = 0,618; t=41,7), a la severidad del asma (β = 0,214; t=7,4), a la edad (β = 0,073; t=5,3), al FEV1 (β = −0,078; t=−2,5) y a la falta de adherencia al tratamiento (RPM: β = −0,031; t=−2,3), con p <0,01 en todos los casos. En la figura 3 se muestran los costes totales (desglosados por los 2grupos de estudio y en total) según el número de exacerbaciones, el rango de edad de los pacientes, la comorbilidad general y la severidad del asma durante el periodo de seguimiento. Destaca, en todos los casos, un menor coste total en los pacientes en tratamiento con PF/Form en comparación con Otros-CI/LABA.
DiscusiónLos resultados del estudio ponen de manifiesto que los pacientes que inician tratamiento con PF/Form a dosis fijas en comparación con otros CI/LABA se asociaron a una mayor persistencia y RPM, circunstancia que ocasiona menos exacerbaciones (especialmente severas) y costes totales para el sistema nacional de salud. Cabe destacar la existencia de pocos estudios observacionales en condiciones de vida real en la bibliografía consultada, circunstancia que dificulta la comparación de los resultados.
Al finalizar el periodo de seguimiento, los pacientes en tratamiento con PF/Form se asociaron a una mayor persistencia (67,6 vs. 61,2%) y RPM (80,6 vs. 74,3%). Los CI/LABA son la base del tratamiento del asma persistente; no obstante, en la bibliografía consultada destaca la baja tasa de adherencia a la medicación (<65% al año)9,11,20. La revisión efectuada por Bårnes21 sobre la base de 19 estudios muestra una adherencia al tratamiento que osciló entre el 22 y el 63%. El autor detalla que el 24% de las exacerbaciones y el 60% de las hospitalizaciones relacionadas con el asma podrían atribuirse a una mala adherencia. Los resultados obtenidos por Zhang22 detallan una persistencia en monoterapia (en niños con asma persistente) del 33,6%. Nuestros resultados son similares o quizás ligeramente superiores a los reportados (aunque siguen siendo bajos). Esta circunstancia podría explicarse por varias razones: a) el método de medida de la persistencia/RPM, b) se consideró la dosis indicada por el médico al inicio del estudio, c) es un estudio más reciente, d) son pacientes que demandaron atención (acuden regularmente a los controles) o e) están sujetos a un seguimiento específico de enfermería. Además, en los estudios revisados el incumplimiento terapéutico se asoció a pacientes jóvenes y con asma leve, mientras que una prescripción con terapias de combinación fija mejora la adherencia. Nuestros resultados son consistentes con estas observaciones13,21.
En el estudio, el 21,5% de los pacientes mostraron algún tipo de exacerbación, ligeramente inferior en el grupo en tratamiento con PF/Form (16,0 vs. 21,9%; p=0,021). Estas diferencias fueron más evidentes en los pacientes con exacerbaciones severas (4,0 vs. 7,7%; p=0,043), que requirieron ingreso hospitalario. El riesgo para presentarlas se relaciona con el nivel de gravedad clínico (FEV1), exacerbaciones previas, limitación de la actividad, presencia de rinitis alérgica, insuficiente tratamiento preventivo antiinflamatorio o mal cumplimiento del paciente del tratamiento prescrito13. Schmidt23, en un estudio observacional prospectivo (datos de vida real) de un año de duración, observó que el tratamiento con PF/Form se asoció con mejoras clínicas del asma (grado de control, exacerbación grave, calidad de vida y función pulmonar). Usmani24, en pacientes con asma controlado, detalla que el descenso de dosis de PF/Form no comprometió su control (exacerbaciones) y fue bien tolerado. Papi13, en una revisión comparativa de la tasa de exacerbaciones asmáticas graves, observada en los ensayos clínicos de diferentes combinaciones a dosis fijas de CI/LABA, detalla que la incidencia de exacerbaciones con PF/Form fue menor que con otras combinaciones de CI/LABA (especialmente las que generan ingreso hospitalario). El autor refiere que esta diferencia no puede explicarse únicamente por las características de los estudios (diseño, población, etc.), y sí podría estar relacionada con las características farmacológicas (molecular) de la asociación. Con las limitaciones del diseño, nuestros datos están en consonancia con la bibliografía consultada13,23,25. En nuestro estudio la definición de exacerbación fue a criterio clínico y en función del uso de los recursos sanitarios. La sintomatología que caracteriza la exacerbación es inespecífica, de tal manera que otras enfermedades originan síntomas que pueden simular una exacerbación e incluso complicarla. En nuestro estudio esta definición se puede aproximar a la de Anthonisen26 de exacerbaciones infecciosas, en que la causa más frecuente de exacerbación son los cambios en la medicación (antibióticos y corticoides). No obstante, con base en la demanda de asistencia médica influyen numerosos factores ajenos a la propia enfermedad, como el acceso a los recursos sanitarios, la comorbilidad o la naturaleza del paciente, que podrían ocasionar que el interesado no comunique los episodios de empeoramiento y, por tanto, no sean tratados.
En el estudio, los pacientes en tratamiento con PF/Form mostraron un menor promedio/unitario del coste total (ANCOVA; 2.033 vs. 2.486€, respectivamente). En general, los costes sanitarios fueron del 83,7% y las pérdidas de productividad del 16,3%. Además, en el modelo de regresión lineal múltiple, el coste se asoció a las exacerbaciones, la severidad del asma, el FEV1, la edad y al incumplimiento terapéutico. Cabe destacar que en la bibliografía disponible la comparación de los costes puede variar en función de la metodología empleada. Existen evidencias en cuanto al coste del asma en adultos, y su relación con las exacerbaciones y el grado de severidad, pero los relativos a la falta de adherencia son limitados. La revisión efectuada por Gadenne27 destaca una gran variabilidad metodológica de los estudios analizados; concluye que, aunque los datos de la literatura son consistentes en mostrar una reducción de costes si mejora el control de la enfermedad, hay una creciente necesidad de estudios económicos basados en las últimas definiciones de control del asma. En este aspecto, Bender28 obtiene un coste medio de 5.440 dólares en EE. UU. y concluye que la falta de adherencia al tratamiento compromete la efectividad clínica y hace aumentar el coste sanitario del asma y otras enfermedades crónicas. Mattke11 en un estudio observacional (N=41.234) demuestra que la falta de adherencia al tratamiento repercute en mayores tasas de visitas y hospitalizaciones. Piecoro et al.29 en un estudio transversal realizado en beneficiarios de Medicaid detalla un coste medio para el asma de 616 dólares; también detalla que la falta de adherencia al tratamiento fue notoria y se asoció con un aumento de las exacerbaciones que repercutió en mayores tasas de hospitalización. En nuestro país, el estudio AsmaCost30 asume que el coste anual de un paciente asmático es de 1.726 €, con un incremento en mayores de 65 años y en asma grave (2.635 €). En todos ellos el coste de la medicación y los ingresos hospitalarios son relevantes, mientras que los que cuantificaron los costes no sanitarios fueron de poca magnitud. La mayoría de estos estudios y las guías de práctica clínica concluyen lo siguiente: a) al mal control del asma se le atribuye un 70% del coste (hospitalización, visitas a urgencias), b) una política ahorrativa eficaz debería contemplar una mayor utilización de la medicación preventiva, especialmente esteroides inhalados y c) es necesario incrementar la educación a los pacientes sobre su enfermedad.
El estudio no está exento de limitaciones. Estas inciden en la categorización de la enfermedad (severidad del asma), el posible sesgo de clasificación de los pacientes y en la medida operativa de los costes, atribuibles al sistema de información desarrollado. Por tanto, en el artículo se muestran las limitaciones propias de los estudios retrospectivos, como por ejemplo, el infrarregistro de los datos (exacerbaciones, FEV1, etc.). En este aspecto, la posible inexactitud de la codificación diagnóstica en cuanto al diagnóstico de asma y otras comorbilidades, en la propia definición de la exacerbación, el uso de los recursos fuera de los centros de interés o bien la falta de alguna variable que pudiera influir en los resultados finales (nivel socioeconómico de los pacientes, exposición ambiental/laboral, evolución de la dosis farmacológica prescrita, la comprobación de la técnica inhalatoria, incluso la terapia broncoconstrictora o la diferenciación de fenotipos), deben considerarse como limitaciones del estudio. Además, la validez externa de los resultados (representatividad de la población) y el escaso número de pacientes en tratamiento con PF/Form deben considerarse las principales limitaciones del estudio. Es importante detallar que entre los factores que más pueden influir en el cumplimiento y, por lo tanto, en los resultados clínicos y en la utilización de recursos, destacan el tipo de dispositivo31, la técnica empleada32 y las instrucciones recibidas33 por el paciente (educación sanitaria), entre otras, a la hora de utilizar una terapia inhaladora eficiente.
Las perspectivas futuras que nos ofrece este estudio se centran en replicarlo en otras instituciones sanitarias y en promover estrategias de intervención orientadas a fomentar el autocuidado de los pacientes (programas educativos estructurados e individualizados). La combinación de PF/Form a dosis fija tiene un perfil demostrado de eficacia y seguridad en ensayos clínicos en comparación con otras combinaciones de CI/LABA, está indicada para el tratamiento del asma persistente y se muestra como una adecuada terapia para el asma12. En conclusión, los pacientes en tratamiento con PF/Form se asociaron a una mayor adherencia al tratamiento (persistencia, RPM), circunstancia que repercute en menores exacerbaciones severas y costes totales para el sistema nacional de salud. Estas diferencias podrían ser debidas a las propiedades farmacológicas del fármaco o a otros factores no medidos. No obstante, se necesitarán más estudios que refuercen la consistencia de los resultados.
Autoría/colaboracionesLa concepción y el diseño del manuscrito fueron realizados por A. Sicras y T. Fernández; la recogida de los datos y el análisis estadístico por A. Sicras y la interpretación de los datos, redacción, revisión y aprobación del manuscrito remitido, por todos los autores.
Conflicto de interesesEl estudio fue patrocinado por Mundipharma. A. Sicras es un consultor independiente financiado por Mundipharma en relación con el desarrollo de este manuscrito.