Las personas con diabetes mellitus tipo 2 tienen un riesgo de desarrollar enfermedad cardiovascular de 2 a 4 veces superior al observado en la población general de similar edad y sexo. Este riesgo se mantiene después de ajustar para otros factores clásicos de riesgo cardiovascular. La dislipidemia asociada a la diabetes mellitus tipo 2 se encuentra presente en hasta un 60% de las personas con diabetes y contribuye en gran medida al incremento de riesgo cardiovascular y de morbimortalidad que presentan estos pacientes. La dislipidemia diabética es una alteración del metabolismo lipídico que se caracteriza por un exceso de triglicéridos, un déficit del colesterol HDL y una alteración de la composición de las lipoproteínas que consiste sobre todo en un exceso de partículas LDL pequeñas y densas. Múltiples ensayos clínicos han demostrado los beneficios del tratamiento farmacológico de la dislipidemia (principalmente estatinas), para prevenir eventos cardiovasculares y mortalidad en personas con diabetes tanto en prevención primaria como secundaria. El presente documento de consenso elaborado por médicos de familia, integrantes del Grupo de Diabetes de la Sociedad Española de Médicos de Atención Primaria (SEMERGEN), pretende servir de ayuda en el manejo de las personas con diabetes y dislipidemia a la vista de las recomendaciones más actualizadas.
People with type 2 diabetes mellitus have a 2 to 4 times higher risk of developing cardiovascular diseases when compared to general population of similar age and sex. This risk remains after adjustment of other traditional cardiovascular risk factors. The dyslipidemia associated with type 2 diabetes mellitus is present in up to 60% of people with diabetes and contributes greatly to increased cardiovascular, morbidity and mortality risk in these patients. Diabetic dyslipidemia is a disorder of lipid metabolism characterized by an excess of triglycerides, a decrease in HDL-cholesterol and altered lipoprotein composition, consisting mainly in an excess of small, dense LDL particles. Multiple clinical trials have demonstrated the benefits of drug treatment of dyslipidemia (mainly statins) to prevent cardiovascular events and mortality in people with diabetes, both in primary and secondary prevention. This consensus document, developed by general practitioners, members of the Diabetes Group of the Spanish Society of Primary Care Physicians (SEMERGEN), aims to assist in the management of patients with diabetes and dyslipidemia in accordance with the most recent recommendations.
En la actualidad la diabetes mellitus tipo 2 (DM2) ha adquirido un carácter pandémico, debido al envejecimiento de la población, la obesidad y la modificación en los hábitos de vida1 (el sedentarismo y la mala alimentación). La prevalencia de DM2 en España se ha estimado cercana al 14% de la población adulta2.
La enfermedad cardiovascular (ECV) es la causa más común de muerte y discapacidad entre las personas con diabetes. Una parte importante de los diabéticos fallecerán por esta y las complicaciones cardiovasculares suponen el motivo más común de hospitalización en la diabetes.
El papel de la dislipidemia diabética quedó demostrada en el United Kingdom Prospective Diabetes Study (UKPDS 23), donde el factor de riesgo de más peso para sufrir enfermedad coronaria era el colesterol LDL (c-LDL), seguido de las cifras de colesterol HDL (c-HDL)3.
Diferentes estudios y metaanálisis4 han hecho hincapié en la importancia del c-LDL para la reducción del riesgo cardiovascular (RCV) en la DM2. Las partículas lipoproteicas de baja densidad (LDL) contienen aproximadamente el 70% de todo el colesterol circulante, y su función es transportar el colesterol procedente del hígado a los tejidos periféricos. El poder aterogénico del c-LDL y su utilidad como objetivo terapéutico se basan en estudios experimentales, epidemiológicos y de intervención. El c-LDL está considerado el mejor predictor de enfermedad coronaria en pacientes con diabetes. Además existen medidas eficaces que reducen el c-LDL en más de un 50%, y la disminución de episodios coronarios que se obtiene en los estudios de intervención es proporcional a la reducción de colesterol, independientemente del fármaco o medida no farmacológica utilizada.
La prevalencia de la dislipidemia en personas con DM2 es elevada. En un estudio realizado en Suecia que incluía a 75.048 personas con DM25, el 49% no recibían tratamiento hipolipidemiante, y de los tratados, solo el 55% conseguían los objetivos de control para triglicéridos (TG) y dos tercios para el c-HDL y c-LDL.
En nuestro entorno, en un estudio realizado en Cataluña que incluía a 286.791 personas con DM2, el 61,3% presentaban un colesterol total (CT)<200mg/dl; el 37,9% un c-LDL<100mg/dl y el 39,6% TG<150mg/dl6.
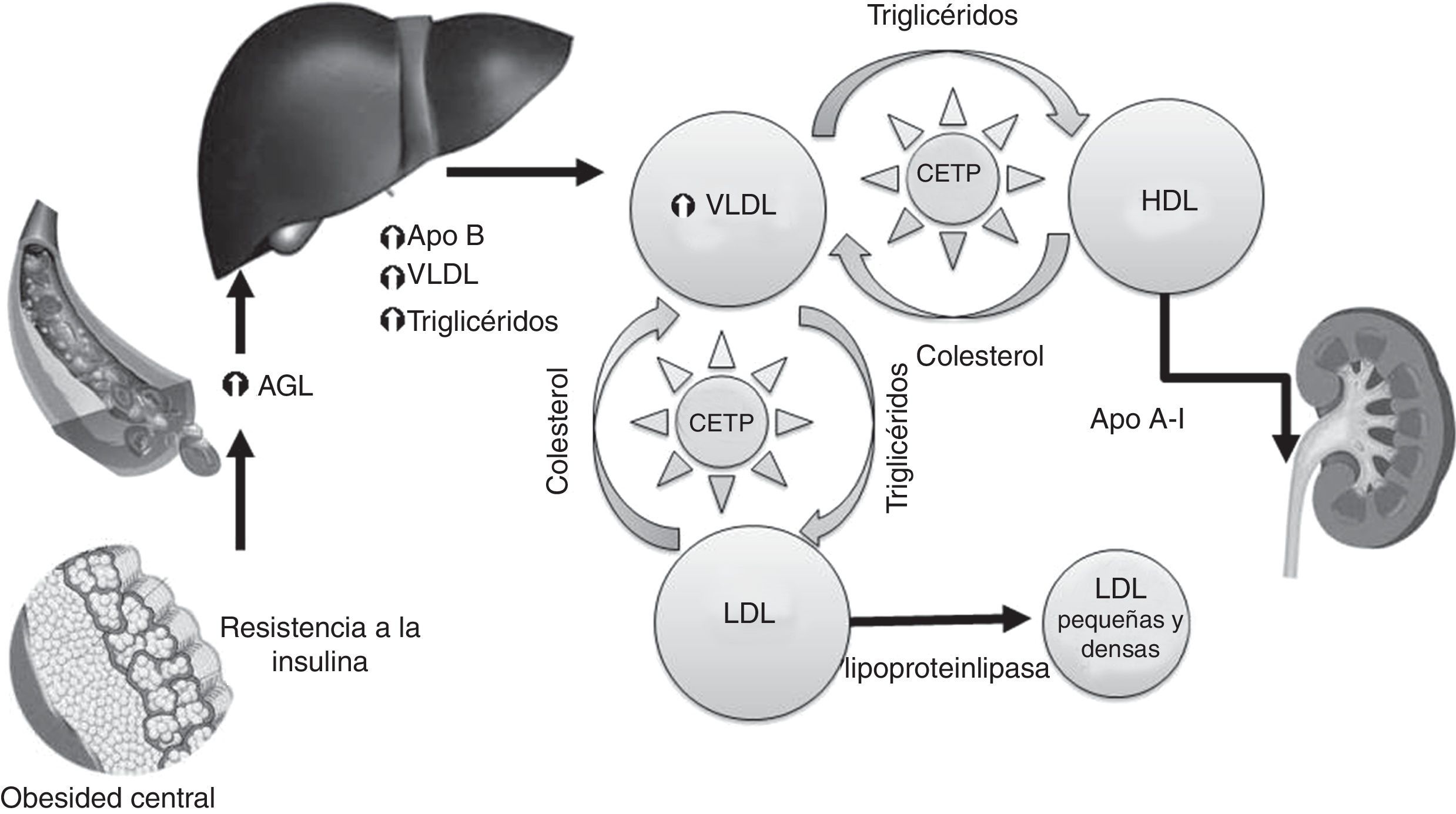
Fisiopatología de la dislipidemia diabéticaLa dislipidemia diabética hace referencia a las alteraciones lipídicas características de los pacientes con DM2 y que están relacionadas con la insulinorresistencia. Está presente en el 60% de los pacientes, siendo uno de los principales factores de riesgo que contribuyen al aumento del RCV total, por lo que requiere una evaluación precisa para establecer objetivos terapéuticos adecuados y seleccionar el tratamiento más apropiado.
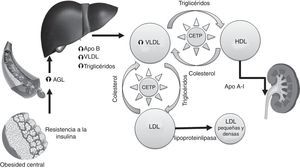
La fisiopatología de la dislipidemia en los pacientes con DM2 es multifactorial. La resistencia a la insulina desempeña un papel fundamental en los cambios que se producen en el metabolismo de las lipoproteínas, modificando el perfil lipídico de estos pacientes. La obesidad visceral y la grasa intraabdominal preceden al desarrollo de resistencia a la insulina. La hiperglucemia, que a través de la glucación y peroxidación de las lipoproteínas y sus receptores modifica su funcionalidad o bien las consecuencias derivadas de la aparición de complicaciones específicas de la diabetes, como la nefropatía sin olvidar, por supuesto, una alimentación inadecuada que contribuye a empeorar el perfil lipídico, forman parte del abanico fisiopatológico de la dislipidemia diabética7,8
Las características de la dislipidemia diabética son (tabla 1):
- •
Perfil lipídico básico. CT normal o alto y la denominada tríada aterogénica: TG elevados (≥150mg/dl), c-LDL normal o levemente aumentado pero con predominio de partículas LDL pequeñas y densas y descenso del c-HDL (hombres<40mg/dl; mujeres<50mg/dl).
- •
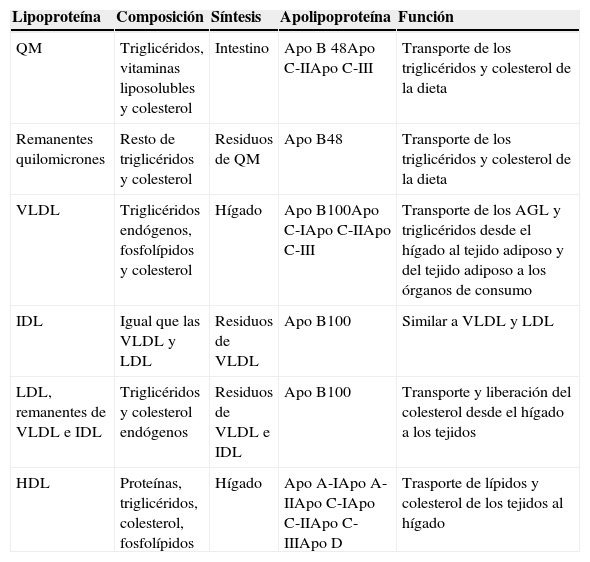
Lipoproteínas (tabla 2). Aumento del número de partículas aterogénicas: remanentes de quilomicrones (QM), lipoproteínas de muy baja densidad (VLDL) y lipoproteínas de densidad intermedia (IDL), con niveles normales o reducidos de LDL pero con predominio de partículas LDL pequeñas y densas (patrón tipo B) cuya característica es su mayor aterogenicidad y disminución de las HDL. Esto se traduce en un aumento en las concentraciones de apolipoproteína B (Apo B) y del colesterol no HDL (c-no HDL)9.
Tabla 2.Lipoproteínas
Lipoproteína Composición Síntesis Apolipoproteína Función QM Triglicéridos, vitaminas liposolubles y colesterol Intestino Apo B 48Apo C-IIApo C-III Transporte de los triglicéridos y colesterol de la dieta Remanentes quilomicrones Resto de triglicéridos y colesterol Residuos de QM Apo B48 Transporte de los triglicéridos y colesterol de la dieta VLDL Triglicéridos endógenos, fosfolípidos y colesterol Hígado Apo B100Apo C-IApo C-IIApo C-III Transporte de los AGL y triglicéridos desde el hígado al tejido adiposo y del tejido adiposo a los órganos de consumo IDL Igual que las VLDL y LDL Residuos de VLDL Apo B100 Similar a VLDL y LDL LDL, remanentes de VLDL e IDL Triglicéridos y colesterol endógenos Residuos de VLDL e IDL Apo B100 Transporte y liberación del colesterol desde el hígado a los tejidos HDL Proteínas, triglicéridos, colesterol, fosfolípidos Hígado Apo A-IApo A-IIApo C-IApo C-IIApo C-IIIApo D Trasporte de lípidos y colesterol de los tejidos al hígado AGL: ácidos grasos libres; Apo: apolipoproteína; HDL: lipoproteína de alta densidad; IDL: lipoproteína de densidad intermedia; LDL: lipoproteína de baja densidad; QM: quilomicrones; VLDL, lipoproteínas de muy baja densidad.
Alteraciones lipídicas en la dislipidemia diabética
| Principales |
| HipertrigliceridemiaHDL bajasLDL pequeñas y densas |
| Otras |
| Aumento del colesterol no HDLAumento de la Apo BDescenso de la Apo A-IAumento de la Apo C3Aumento del cociente Apo B/colesterol totalAumento del cociente Apo B/colesterol totalAumento de remanentes de triglicéridosAumento de la actividad CETPAumento de la actividad LHDescenso de la actividad LPL |
Apo: apolipoproteína; CETP: proteína transferidora de ésteres de colesterol; HDL: lipoproteínas de alta densidad; LDL: lipoproteína de baja densidad; LH: lipasa hepática; LPL: lipoproteinlipasa.
Modificada de Krauss RM. Dietary and genetic probes of atherogenic dyslipidemia. Arterioscler Thromb Vasc Biol. 2005;25:2265-72.
La resistencia a la insulina, por una parte, favorece el flujo de ácidos grasos libres (AGL) y aumenta la síntesis hepática de VLDL, y por otra, condiciona una menor degradación de los QM, VLDL e IDL por disminución de la función de la lipoproteinlipasa (LPL) aumentando así los niveles de TG.
La resistencia a la insulina y el exceso de grasa abdominal favorecen el flujo de AGL hacia el hígado. La insulina no es capaz de suprimir la actividad de la lipasa del tejido adiposo y aumenta la lipólisis, se liberan AGL y glicerol a la circulación que son captados a nivel hepático, estimulando la esterificación y la secreción de Apo B, de este modo, aumenta la síntesis de las VLDL y los niveles de TG. A su vez, estos AGL aumentados producen lipotoxicidad y se altera aún más la secreción de insulina estimulada por la glucemia, empeorando la resistencia a la insulina.
Otro mecanismo implicado en el aumento de los niveles de TG sería el déficit funcional de LPL que condiciona una menor degradación de las lipoproteínas ricas en TG, es decir QM, VLDL e IDL. La actividad de la LPL en la DM2 es objeto de controversia. Si bien la insulina es clave para la síntesis celular y translocación de LPL hacia el endotelio y los pacientes con DM tipo 1 presentan déficit de LPL, no existen evidencias de una menor expresión de la LPL en la DM2, aunque sí disminuye su actividad10.
En la dislipidemia diabética también se produce una elevación de la lipidemia posprandial al disminuir la captación hepática de los QM, aumentando los niveles plasmáticos de colesterol y TG procedentes de la dieta11.
Concentraciones bajas de lipoproteínas de alta densidadEl descenso de las HDL es secundario a la elevación de los TG. Las HDL enriquecidas en TG pero sin ésteres de colesterol son catabolizadas. La consecuencia de las HDL bajas es la disminución de sus propiedades antioxidantes y antiinflamatorias y del transporte reverso de colesterol.
Las concentraciones séricas de las lipoproteínas ricas en TG (QM, VLDL, IDL) están aumentadas lo que provoca un mayor tiempo de exposición de las HDL al intercambio de lípidos. La proteína transportadora de ésteres de colesterol media el intercambio de ésteres de colesterol entre LDL y VLDL, y entre VLDL y HDL. En estas condiciones se produce una mayor transferencia de TG lo que altera las características cuali- y cuantitativas de las HDL y LDL.
El contenido en colesterol de las HDL disminuye pero quedan enriquecidas en TG, lo que aumenta la afinidad de las lipasas. La lipasa hepática hidroliza los TG de las HDL generando Apo A1 libre que es rápidamente catabolizada por el riñón, disminuyendo así los niveles de HDL.
Por otra parte, la disminución de la síntesis hepática de la Apo A1 es otro de los mecanismos propuestos que contribuiría a las bajas concentraciones de HDL en la dislipidemia diabética12. En estos pacientes la insulina resulta ineficaz para regular la producción de Apo A1, en especial en individuos obesos.
Lipoproteínas de baja densidad pequeñas y densasEn la dislipidemia diabética los valores de LDL son normales o ligeramente aumentados pero se alteran las características cualitativas de las LDL. Estas se hacen más pequeñas y densas, y están asociadas a un elevado RCV. El exceso de TG es la principal razón de que esto ocurra.
Debido al aumento de los TG, las LDL también se exponen a un excesivo intercambio de colesterol, la proteína transportadora de ésteres de colesterol reemplaza los ésteres de colesterol de las LDL por TG. Los TG son buenos sustratos para la lipasa hepática. La acción de la lipasa hepática ocasiona cambios estructurales y de composición de las LDL, que se transforman, siendo más pequeñas y densas, con mayor susceptibilidad a la oxidación y menor afinidad al receptor de LDL por lo que no se unen correctamente a los receptores de LDL y permanecen más tiempo en la circulación, con un enorme potencial aterogénico y asociadas a un elevado RCV13.
La hiperglucemia acentúa la glucación de las apolipoproteínas y de las proteínas estructurales de los receptores, lo que contribuye básicamente a reducir el catabolismo tanto de las LDL como de las lipoproteínas ricas en TG11.
El tejido adiposo es una fuente de proteína transportadora de ésteres de colesterol y funciona como un órgano endocrino que produce adipocitocinas como la leptina, angiotensinógeno, factor de necrosis tumoral alfa, interleucina 6, inhibidor del activador de plasminógeno 1, factor transformador de crecimiento beta, adipsina, adiponectina y resistina que favorecerían la resistencia a la insulina en los pacientes con exceso de grasa visceral y obesidad central12.
En resumen, la característica principal de la dislipidemia diabética son las concentraciones elevadas de TG, acompañadas de una disminución de la concentración de HDL y del incremento de las partículas de LDL pequeñas y densas. En los pacientes con DM2, la dislipidemia es ocasionada por la mayor disponibilidad de los AGL, secundaria a la resistencia a la insulina y exacerbada por el incremento en las adipocinas inflamatorias (fig. 1)
Fisiopatología de la dislipidemia diabética. AGL: ácidos grasos libres; Apo: apolipoproteína; CETP: proteína transferidora de ésteres de colesterol; HDL: lipoproteínas alta densidad; LDL: lipoproteína de baja densidad; VLDL, lipoproteínas de muy baja densidad.
Modificada de Pedro-Botet et al.13.
Las condiciones para establecer el diagnóstico de dislipidemia en general son las siguientes: comprobar la alteración en al menos 2 ocasiones, tras un ayuno de 12-14h, sin cambios de peso, siguiendo la dieta habitual durante las 3 semanas previas, en ausencia de enfermedades intercurrentes y sin administración de fármacos que alteren el metabolismo lipídico. Las guías internacionales recomiendan la realización de un perfil lipídico completo, que incluya: CT, TG, c-HDL y c-LDL, este último se calcula por estimación mediante la fórmula de Friedewald, siendo un método inexacto cuando los TG están elevados (≥400mg/dl). La guía NICE de evaluación del RCV14 recomienda la determinación de CT, c-HDL, TG y c-no HDL, no precisando realizar la analítica en ayunas, excepto si hay antecedentes de TG elevados.
Existen estudios que sugieren que la Apo B es mejor factor pronóstico de episodios vasculares que el c-LDL y una proporción importante de los pacientes alcanzan los objetivos terapéuticos de c-LDL, pero no de Apo B. Ello indica que la Apo B permite valorar de forma más precisa el riesgo residual en los pacientes tratados. En un estudio15 se ha demostrado que el c-no HDL y la Apo B, por separado, presentaron una asociación similar con la enfermedad coronaria independientemente de la presencia de DM. El hecho de que la cuantificación de la Apo B es cara y no existen objetivos terapéuticos internacionalmente establecidos y que la estimación del c-no HDL es fácil y económica, sin determinaciones adicionales a las habituales, ha contribuido a la inclusión del mismo en algunas guías de práctica clínica (GPC)14.
Parece existir unanimidad en que la determinación del perfil lipídico se ha de realizar al hacer el diagnostico de DM2 y anualmente. Cuando se presentan alteraciones del mismo, se debería descartar la existencia de hipercolesterolemia familiar, así como el exceso del consumo de alcohol, la diabetes no controlada, hipotiroidismo, enfermedad hepática y el síndrome nefrótico. Si se ha iniciado tratamiento con estatinas, se ha de realizar un perfil lípido a los 3 meses, para valorar la consecución de los objetivos fijados.
Se debe realizar determinación de transaminasas, antes de iniciar tratamiento con estatinas, a los 3 meses y al año de tratamiento, no recomendándose la determinación posterior al menos que esté clínicamente indicado. No se debería excluir del tratamiento con estatinas a las personas con cifras menores a 3 veces el límite superior de la normalidad.
Asimismo se debería preguntar a la persona, antes de indicar el tratamiento con estatinas, si ha tenido dolores musculares inexplicables generalizados y persistentes, asociados o no, con tratamientos hipolipidemiantes previos. Si es así, se debe realizar una determinación de creatina cinasa, pudiéndose iniciar estatinas si las cifras son menos de 5 veces el límite superior de la normalidad. No se recomienda realizar determinación de las mismas en pacientes asintomáticas que están siendo tratadas con estatinas14.
Objetivos de control lipídico en la persona con diabetesComo se ha comentado anteriormente, la elevación de c-LDL es el principal factor predictor de RCV en la diabetes, y en la práctica clínica es el objetivo terapéutico primordial. El beneficio de la terapia con estatinas en la reducción del c-LDL y en la prevención de eventos cardiovasculares en pacientes con DM216 apoya la idea de que el objetivo en las intervenciones sobre la hiperlipidemia es reducir el nivel de c-LDL.
El RCV es la probabilidad de presentar un evento cardiovascular en un periodo de tiempo determinado y su cálculo se aplica únicamente en prevención primaria. Existe disparidad de opiniones sobre la necesidad de estimar este riesgo en las personas con diabetes.
Tanto la GPC de diabetes y ECV elaborada por la Asociación Europea para el Estudio de la Diabetes y la Sociedad Europea de Cardiología17 como la GPC sobre prevención de ECV de la Joint European Society18 recomiendan, basándose en la opinión de expertos, que las personas con DM2 sean clasificadas directamente en 2 grupos: las que ya tuvieron algún evento cardiovascular o las que tienen otros factores de riesgo concomitantes o lesión de órgano diana serían consideradas de muy alto riesgo. El resto debe considerarse de alto RCV.
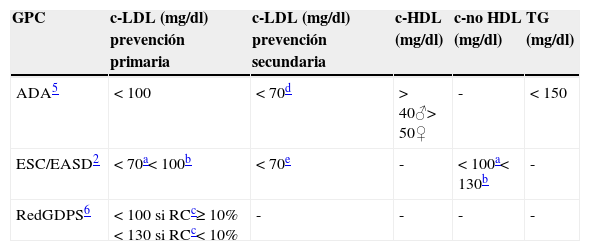
La Canadian Diabetes Association19, sin marcar una cifra objetivo, recomienda tratar con estatinas, en prevención primaria, a pacientes con DM240 años y a los menores de esta edad si presentan complicaciones microvasculares o la diabetes tiene una evolución superior a 15 años. La American Diabetes Association20 define los objetivos del perfil lipídico (tabla 3) pero advierte que la estrategia prioritaria es la reducción del c-LDL con estatinas.
Objetivos de control lipídico en diabetes mellitus tipo 2 (DM2)
| GPC | c-LDL (mg/dl) prevención primaria | c-LDL (mg/dl) prevención secundaria | c-HDL (mg/dl) | c-no HDL (mg/dl) | TG (mg/dl) |
|---|---|---|---|---|---|
| ADA5 | <100 | <70d | >40♂>50♀ | - | <150 |
| ESC/EASD2 | <70a<100b | <70e | - | <100a<130b | - |
| RedGDPS6 | <100 si RCc≥10%<130 si RCc<10% | - | - | - | - |
ADA: American Diabetes Association; c-HDL: colesterol HDL; c-LDL: colesterol LDL; DM2: diabetes mellitus tipo 2; EASD: Asociación Europea para el Estudio de la Diabetes; ECV: enfermedad cardiovascular; ESC: Sociedad Europea de Cardiología; FRCV: factores de riesgo cardiovascular; GPC: guía de práctica clínica; HDL: lipoproteínas de alta densidad; LDL: lipoproteínas de baja densidad; RC: riesgo cardiovascular.
En 2013 la American Heart Association/American College of Cardiology presenta cambios relevantes respecto a lo publicado anteriormente y no establece un objetivo fijo de c-LDL, pues considera que no hay suficiente evidencia que apoye dicha estrategia. En su lugar identifica 4 grupos de riesgo distintos a los considerados por las guías europeas:
- 1.
ECV establecida
- 2.
Prevención primaria en pacientes con c-LDL>190mg/dl
- 3.
Pacientes con diabetes de 40 a 75 años de edad y c-LDL70-189mg/dl
- 4.
Riesgo calculado a 10 años>7,5%, indicando el uso de estatinas de potencia moderada o elevada que valorará el clínico según el paciente21.
Otros autores22 aconsejan estratificar el RCV argumentando la heterogeneidad de la población con DM2: el tiempo de evolución de la enfermedad, edad, presencia de nefropatía u otras lesiones arterioscleróticas subclínicas así como el control de otros factores de RCV, confieren distinto riesgo a cada paciente.
Otra cuestión debatida es el método a emplear para el cálculo del riesgo. No se aconseja su evaluación basándose en puntuaciones de riesgo desarrolladas para la población general, y aunque existen tablas específicas para población con DM2, no están exentas de sesgos. Un metaanálisis23 que valora 17 indicadores señala la escasa evidencia de que el uso de índices específicos para la diabetes aporte una estimación más precisa del riesgo pues los buenos resultados que proporcionan en las poblaciones en que se han desarrollado precisan ser validados en aquellas donde se pretenden aplicar.
La función de Framingham calibrada por el grupo REGICOR, validada en población española (estudio VERIFICA)24 y que dispone de una tabla para sujetos con diabetes sería la recomendada en nuestro medio.
En ausencia de ensayos clínicos que señalen específicamente la cifra objetivo de c-LDL, la evidencia del nivel que se debe alcanzar se basa en los datos obtenidos de estudios en los que la intervención clínica realizada fue la administración de estatinas en prevención primaria con el fin de conseguir una reducción absoluta del c-LDL (sin fijar objetivos predeterminados) y en los que se observó la asociación entre descenso de c-LDL y reducción del riesgo de ECV.
Así pues, mientras que en prevención secundaria no existe duda sobre el empleo de estatinas con el objetivo de alcanzar, si es posible, una cifra de c-LDL<70mg/dl, en prevención primaria las GPC, en general, se recomienda tratar con estatinas a la mayoría de los sujetos con DM2 al asumir que casi todos tienen un elevado riesgo de ECV. En la tabla 3 se recogen los objetivos de control lipídico recomendados por distintas GPC o grupos de trabajo.
En definitiva, si bien es cierto que el RCV de la persona con DM2 es superior al de la población general, no todos los diabéticos son iguales. La estratificación del riesgo es útil en los sujetos diagnosticados recientemente de DM2 o con pocos años de evolución y sin otros FRCV mientras que su cálculo no sería necesario si la diabetes presenta más de 10 años de evolución o existen otros factores de riesgo concomitantes. El objetivo general del tratamiento es reducir el RCV, y la intensidad de la terapia para lograrlo debe relacionarse con el riesgo pretratamiento.
Tratamiento de la dislipidemia en la diabetes mellitus tipo 2La publicación en 2008 del Cholesterol Treatment Trialists’ (CTT) Collaborators demostró que el tratamiento intensivo de la dislipidemia en los pacientes diabéticos con estatinas reducía la mortalidad vascular un 13%, los episodios coronarios un 22% y el ictus un 21% y que el control de los lípidos cuanto mayor es la reducción de c-LDL mayor es el beneficio clínico que se obtiene4, a diferencia de la hipertensión o de la propia diabetes, en las que un descenso excesivo de las cifras de presión arterial o de glucemia se asocian a un aumento de la morbimortalidad, lo que se ha denominado curva en J18,25.
Medidas para modificar estilos de vidaEn nuestro medio la dieta más apropiada es la denominada mediterránea que ha demostrado mejorar el control glucémico y disminuir los FRCV (tabla 4)26. El estudio Prevención con dieta mediterránea (PREDIMED) constata que la dieta mediterránea enriquecida con frutos secos y aceite de oliva virgen extra reduce en un 30% el riesgo de infarto de miocardio, de accidente vascular cerebral o de muerte por causa cardiovascular27.
Recomendaciones para una alimentación saludable
| - Utilizar el aceite de oliva como principal grasa de adicción- Consumo de alimentos de origen vegetal (frutas, verduras, legumbres, champiñones y frutos secos)- Pan y alimentos procedentes de cereales (pasta, arroz y especialmente sus productos integrales),- Alimentos frescos y de temporada poco procesados- Consumir diariamente lácteos- La carne roja se consumirá con moderación y formando parte de guisos u otras recetas- Consumir pescado en abundancia y huevos con moderación- El postre habitual debe ser fruta fresca- El agua debe ser la bebida por excelencia- El vino tinto debe tomarse con moderación y durante las comidas- Realizar actividad física |
Las revisiones sistemáticas han descrito que el ejercicio aeróbico estructurado o el ejercicio de resistencia reducen la HbA1c en, aproximadamente, un 0,6% en la DM2. Puesto que la disminución de la HbA1c se asocia a una reducción a largo plazo de los eventos cardiovasculares y de las complicaciones microvasculares, los programas de ejercicio a largo plazo que conducen a un mejor control glucémico pueden reducir la aparición de complicaciones vasculares.
El entrenamiento combinado aeróbico y de resistencia tiene un impacto en la HbA1c mayor que el entrenamiento aeróbico o de resistencia por separado. En un metaanálisis reciente de 23 estudios, el entrenamiento estructurado se asoció a una reducción de HbA1c del 0,7% respecto a los controles. El ejercicio estructurado>150min/semana se ha asociado a una reducción de la HbA1c del 0,9% y del 0,4% practicado menos de150min/semana. En conjunto, las intervenciones dirigidas a aconsejar la práctica de actividad física se han asociado a menor concentración de HbA1c solo cuando se combinan con recomendaciones dietéticas.
La actividad física más recomendada es el ejercicio aeróbico (de baja intensidad y larga duración), principalmente caminar, bailar, nadar, ciclismo, etc. La frecuencia y duración aconsejadas son 30-60min un mínimo de 5 veces a la semana20,28.
Medidas farmacológicasEl c-LDL es el objetivo primario de tratamiento a conseguir en el paciente diabético, al igual que en la población general.
Muchos estudios han puesto de manifiesto el beneficio de las estatinas en la prevención cardiovascular, utilizando estatinas diferentes, a distintas dosis y en situaciones variadas, llegando a la conclusión de que las estatinas y ezetimibe son fármacos eficaces y seguros4,29.
Fármacos disponiblesDisponemos en la actualidad de 5 grupos de fármacos, con mecanismos de actuación diferentes, que han demostrado reducir los niveles plasmáticos de las diferentes fracciones lipídicas.
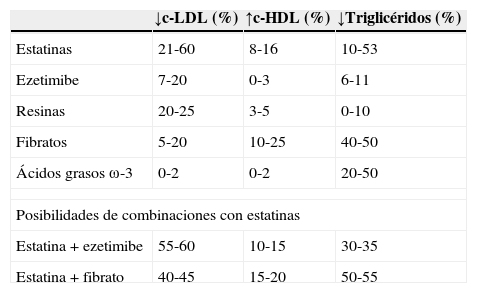
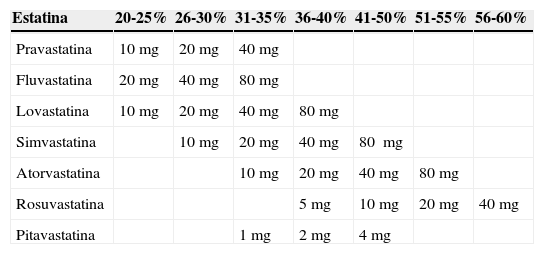
En la tabla 5 se presentan de manera esquemática los efectos de los diferentes fármacos hipolipidemiantes y sus combinaciones sobre el perfil lipídico30, y en la tabla 6 se pueden ver las distintas estatinas comercializadas en España, mostrando la potencia de reducción del c-LDL dependiendo de la dosis administrada30.
Fármacos hipolipidemiantes y efectos sobre el perfil lipídico
| ↓c-LDL (%) | ↑c-HDL (%) | ↓Triglicéridos (%) | |
|---|---|---|---|
| Estatinas | 21-60 | 8-16 | 10-53 |
| Ezetimibe | 7-20 | 0-3 | 6-11 |
| Resinas | 20-25 | 3-5 | 0-10 |
| Fibratos | 5-20 | 10-25 | 40-50 |
| Ácidos grasos ω-3 | 0-2 | 0-2 | 20-50 |
| Posibilidades de combinaciones con estatinas | |||
| Estatina+ezetimibe | 55-60 | 10-15 | 30-35 |
| Estatina+fibrato | 40-45 | 15-20 | 50-55 |
c-HDL: colesterol HDL; c-LDL: colesterol LDL; HDL: lipoproteínas de alta densidad; LDL: lipoproteínas de baja densidad.
Fuente: Díaz Rodríguez31.
Estatinas comercializadas en España y potencia en la reducción de c-LDL según dosis
| Estatina | 20-25% | 26-30% | 31-35% | 36-40% | 41-50% | 51-55% | 56-60% |
|---|---|---|---|---|---|---|---|
| Pravastatina | 10mg | 20mg | 40mg | ||||
| Fluvastatina | 20mg | 40mg | 80mg | ||||
| Lovastatina | 10mg | 20mg | 40mg | 80mg | |||
| Simvastatina | 10mg | 20mg | 40mg | 80 mg | |||
| Atorvastatina | 10mg | 20mg | 40mg | 80mg | |||
| Rosuvastatina | 5mg | 10mg | 20mg | 40mg | |||
| Pitavastatina | 1mg | 2mg | 4mg |
c-LDL: colesterol LDL; LDL: lipoproteínas de baja densidad.
Fuente: Díaz Rodríguez31.
Con las estatinas por cada titulación (doblar la dosis) solo se obtiene una reducción añadida del c-LDL entre 6-7%. Esto es una limitación de las estatinas debido a su acción inhibitoria sobre la enzima HMG-CoA reductasa que no es lineal, saturándose progresivamente hasta llegar a una determinada cantidad de fármaco, a partir de la cual ya no se consiguen reducciones añadidas en la concentración plasmática de c-LDL.
Las estatinas, además de en su potencia, se diferencian en sus estructuras moleculares que les confieren distintas características en su forma de actuación, metabolismo, efectos adversos, interacciones farmacológicas, etc.
Tratamiento combinadoCuando con la estatina a dosis máxima tolerada no se consigue el objetivo propuesto de c-LDL, se recomienda la administración de una combinación de fármacos18.
El ezetimibe logra una reducción de un 25% aditiva a la conseguida con estatinas. Los secuestradores de ácidos biliares (resinas) suelen tener peor tolerancia, y en el caso de una dislipidemia mixta no están indicados ya que pueden incrementar los TG. La combinación de una estatina de menor capacidad hipocolesterolemiante con secuestradores de ácidos biliares o ezetimibe puede ser una alternativa a la monoterapia con estatinas de mayor potencia entre los pacientes de alto riesgo que presenten intolerancia a las dosis más elevadas o que tengan una respuesta inferior a la prevista en la reducción del c-LDL31. En este sentido, la estrategia de terapia combinada de estatinas a dosis máxima tolerada y ezetimibe, como se postula en la estrategia denominada «LDL en 2 pasos»32, puede ayudar a conseguir el objetivo de c-LDL<70mg/dl marcado por las GPC.
Estas estrategias deben utilizarse con precaución porque no hay ensayos que demuestren beneficios de reducción del RCV de la terapia combinada frente a la monoterapia con estatinas. Estudios en marcha deben evaluar la seguridad y los beneficios de la combinación estatina/ezetimibe a largo plazo.*
Con relación al empleo de ezetimibe en diabéticos, un metaanálisis reciente muestra que la eficacia hipocolesterolemiante del ezetimibe es mayor entre los diabéticos que entre los no diabéticos33. La guía europea Sociedad Europea de Cardiología/EAS34 aconseja que si en el paciente diabético no se consigue el objetivo de c-LDL a la máxima dosis de estatinas toleradas, se puede valorar la asociación con ezetimibe. Por otra parte, la adición de ezetimibe contribuye a mejorar el porcentaje de pacientes que alcanzan el adecuado control del c-LDL35.
Cuando el tratamiento con estatinas no logra el control de la dislipidemia aterogénica, el tratamiento combinado de estatinas-fenofibrato puede aportar beneficios adicionales en la reducción del riesgo residual. Se recomienda añadir un fenofibrato al tratamiento con estatina en pacientes con DM2, TG elevados y c-HDL reducido.
InteraccionesLas vías metabólicas de degradación de las estatinas son los citocromos P450 y P2C9.
Una serie de fármacos de uso habitual utilizan estas vías, por lo que deben ser tenidos en cuenta como inhibidores de la potencia de las estatinas: ketoconazol, itraconazol, fluconazol, eritromicina, claritromicina, warfarina, antidipresivos tricíclicos, venlafaxina, fluoxetina, sertralina, amiodarona, diltiazen, verapamilo, midazolán, corticoides, tamoxifeno y zumo de pomelo. Como inductores: fenitoína, fenobarbital, rifampicina, dexametosona, ciclofosfamida, carbamazepina, omeprazol y hierba de San Juan.
Efectos adversosLos resultados publicados de los principales estudios clínicos controlados y aleatorizados demuestran que las estatinas son seguras y se toleran bien36. La frecuencia de efectos adversos, excepto en el caso de síntomas musculares, es rara. En la mayor parte de los casos de miopatía o rabdomiólisis, hay interacciones farmacológicas y administración de dosis de estatinas superiores a las estándares. Se debe evitar la combinación de gemfibrozilo y estatinas debido a la interacción farmacológica, pero no hay problemas de seguridad con el fenofibrato y las estatinas.
Los más habituales son síntomas gastrointestinales, cansancio, insomnio, cefaleas, mialgias y erupción cutánea; aunque rara vez harán necesario suspender el tratamiento y, a veces, el cambio por otra estatina resuelve el problema.
Las pesadillas, la pérdida de memoria, la depresión, la disfunción sexual y la enfermedad pulmonar intersticial se han descrito también como reacciones adversas.
Será necesario vigilar las enzimas hepáticas a las 8-12 semanas tras iniciar el tratamiento y cada vez que se modifique la dosis o se asocie otro hipolipidemiante.
Se deberán solicitar las enzimas musculares (CPK) si el paciente presenta dolores musculares. Si se supera en 5 veces el valor basal hay que suspender el tratamiento.
El tratamiento con dosis altas de estatinas se ha asociado a un aumento del riesgo de diabetes de nuevo diagnóstico si lo comparamos con la terapia basada en dosis más bajas de estatinas37; pero el análisis riesgo-beneficio aconseja seguir tratando con estatinas, ya que por cada nuevo caso de diabetes de nueva aparición se evitan 3 eventos cardiovasculares38.
Nuevos fármacosActualmente se encuentran en fase experimental nuevas moléculas para el tratamiento del c-LDL con mecanismos de acción distintos a los existentes, entre los que se encuentran: anticuerpos frente a la proproteína convertasa subtilisina/kesina tipo 9, agonistas de los receptores activados de proliferación de los peroxisomas alfa y gamma, y el mipomersem.
Causas de ausencia de control colesterol LDLSe puede atribuir a múltiples factores dependientes de los pacientes: adherencia y cumplimentación; dependientes de los profesionales: inercia clínica y terapéutica; y dependientes de la administración facilitando el acceso a determinados tratamientos39,40.
La insuficiente adherencia al tratamiento tras el primer año de indicación con una permanencia solo del 28,9% en el caso de las estatinas se puede relacionar con los efectos adversos del fármaco, las posibles interacciones y el coste del fármaco.
La inercia terapéutica no modificando los tratamientos aunque no se hayan alcanzado los objetivos viene determinada por la falta de formación, la sobrestimación del control de la dislipidemia y la complejidad y rigidez de implementación de las GPC.
Las soluciones que se plantean para mejorar el cumplimiento de los pacientes pasa por la simplificación de la administración diaria reduciendo el número de dosis y seleccionando las alternativas más coste-efectivas y el manejo de estrategias conductuales y de refuerzo del tratamiento que mejoren el cumplimiento del mismo. En el caso de la inercia terapéutica la principal acción debe ir encaminada al conocimiento de los profesionales de los fármacos hipolipidemiantes, principalmente las estatinas, y su capacidad de disminución del RCV tanto en prevención primaria como secundaria mediante el control de los niveles de c-LDL. En pacientes tratados por primera vez con estatinas se consigue en 4 semanas de tratamiento más del 90% de su acción reductora de c-LDL y se mantendrá en el tiempo; cuando doblamos la dosis de estatina conseguiremos un incremento adicional en el descenso de c-LDL del 6% respecto al valor basal. La utilización de las estatinas más potentes comercializadas en España (atorvastatina 80 y rosuvastatina 20) no llegan a superar el 50% de reducción de c-LDL, pero se incrementan los efectos secundarios (miopatía o aumento de transaminasas) y en algunas series se ha asociado a un aumento de insuficiencia renal aguda, por tanto en los pacientes de muy alto riesgo en los que administrando la estatina más potente no permita conseguir el objetivo de c-LDL<70mg/dl será necesario el uso de terapia combinada.
Durante el proceso de revisión de este manuscrito se presentaron los resultados iniciales del estudio IMPROVE IT (IMProved Reduction of Outcomes: Vytorin Efficacy International Trial), en las sesiones científicas de la American Heart Association, celebradas en Chicago (EE. UU.) del año 2014. Se obtuvo una reducción significativa de colesterol LDL de 95mg/dL a 54mg/dL en el grupo ezetimibe, y de 95mg/dL a 70mg/dL con simvastatina sin ezetimibe. También descendieron la proteína C reactiva y los triglicéridos. El objetivo principal del estudio, compuesto por muerte cardiovascular, infarto de miocardio, angina inestable, revascularización coronaria e ictus, se redujo un 2,0% absoluto (reducción relativa del 6,4%, p=0,016).
J.C. Aguirre Rodríguez (Granada), M. Alonso Fernández (Oviedo), E. Arranz Martínez (Madrid), A. Barquilla García (Cáceres), I. Candelario Moreno (Cáceres), FC. Carramiñana Barrera (Badajoz), C. Cols Sagarra (Barcelona), J.M. Comas Samper (Toledo), A.M. de Santiago Nocito (Madrid), J. Escribano Serrano (Cádiz), M.J. Frías Vargas (Madrid), T. Fuster Bellido (Valencia), V. Gasulll Molinera (Valencia), F. García Gallego (Badajoz), L. Homedes Celma (Zaragoza), A. Hormigo Pozo (Málaga), C. Huidobro Dosal (Santander), J. Iturralde Iriso (Vitoria), R. López-Sidro Ibáñez (Granada), F. López Simarro (Barcelona), C. Lozano Suárez (Ciudad Real), F. Malo García (La Coruña), J. Mancera Romero (Málaga), J.J. Mediavilla Bravo (Burgos), L. Mendo Giner (Navarra), S. Miravet Jiménez (Barcelona), F J. Morales Escobar (Las Palmas de Gran Canaria), M. A. Muñoa Moratinos (León), A. Moreno Moreno (Badajoz), M. P. Pérez Unanua (Madrid), M. Ruiz Peña (Cádiz), L. Sánchez Iñigo (Navarra), M. Segui Díaz (Menorca), T. Soriano Llora (Madrid)
Los nombres de los miembros del Grupo de Trabajo de Diabetes de la Sociedad Española de Médicos de Atención Primaria (SEMERGEN) están relacionados en el anexo 1.
Se obtuvo una reducción significativa de colesterol LDL de 95mg/dL a 54mg/dL en el grupo ezetimibe, y de 95mg/dL a 70mg/dL con simvastatina sin ezetimibe. También se reduce la proteína C reactiva y los triglicéridos. El objetivo principal del estudio, compuesto por muerte cardiovascular, infarto de miocardio, angina inestable, revascularización coronaria, AVC se redujo un 2,0% absoluto (reducción relativa del 6,4%, p=0,016), NNT 50, con unas curvas que se separan alrededor del año.