En el tratamiento de la diabetes mellitus tipo 2 se han introducido nuevos fármacos que han supuesto un avance en el abordaje fsiopatológico, con la posibilidad de actuar sobre los diferentes mecanismos implicados en la elevación de la glucemia y que permiten la individualización del tratamiento, como se recomienda en las guías y consensos al respecto.
Al arsenal terapéutico de la diabetes se incorporó el grupo de las incretinas (2006), al que pertenecen los agonistas del receptor del péptido similar al glucagón 1 y los inhibidores de la enzima dipeptidil peptidasa 4, comercializados estos últimos en España en 2007, que actúan en el sistema incretínico del intestino reduciendo la glucemia, con efecto reductor o neutro en el peso y con bajo riesgo de hipoglucemias. Su introducción coincidió con la publicación de los controvertidos resultados de los estudios de control intensivo de la glucemia, que originó la normativa de la Food and Drug Administration (2008) que obliga a los nuevos fármacos hipoglucemiantes a demostrar su seguridad cardiovascular. La publicación de estos estudios ha evidenciado la seguridad cardiovascular y, en algunos de ellos, benefcios cardiovasculares y en la mortalidad, que están modifcando las guías y consensos sobre el tratamiento de la diabetes tipo 2.
En este artículo se recogen las principales características sobre la seguridad y tolerancia de los inhibidores de la enzima dipeptidil peptidasa 4, a nivel farmacológico y cardiovascular, que es necesario conocer y actualizar en atención primaria, por su amplio uso y para un correcto abordaje de la terapia farmacológica en la diabetes tipo
New drugs have been added to the treatment of type 2 diabetes mellitus. These drugs have represented an advance in the physiopathological approach to the disease, with the possibility of acting on the different mechanisms involved in raised blood glucose levels and allowing treatment to be individualised, as recommended in clinical practice guide-lines and consensus documents.
The incretins were added to the therapeutic arsenal of diabetes in 2006. This group in-cludes glucagon-like peptide-1 receptor antagonists and dipeptidyl peptidase-4 inhibitors (marketed in Spain in 2007), which act on the incretin system in the gut, reducing glycae-mia, with a decreasing or neutral effect on weight and with a low risk of hypoglycaemic episodes. Their introduction coincided with the publication of the controversial results of studies on intensive glycemic control, leading the Food and Drug Administration (2008) to require demonstration of the cardiovascular safety of new glucose-lowering drugs. The publication of subsequent studies has demonstrated cardiovascular safety and some have shown cardiovascular and survival benefits. These results are modifying the recommenda-tions of the clinical practice guidelines and consensus documents on the treatment of type 2 diabetes.
The present article describes the main pharmacological and cardiovascular characteristics of the safety and tolerability of dipeptidyl peptidase-4 inhibitors, which need to be known and updated in primary care, given their wide prescription and the need for correct use of drug therapy in type 2 diabetes.
Las características fisiopatológicas de la diabetes mellitus (DM) tipo 2 (DM2) con diferentes mecanismos implicados en la hiperglucemia, la frecuente asociación con otros factores de riesgo cardiovascular —CV— (hipertensión arterial, disli-pemia, etc.) y otras comorbilidades (obesidad, insuficiencia cardíaca [IC], insuficiencia renal, artrosis, etc.), hacen que sea preciso un abordaje terapéutico con un enfoque integral y multidisciplinar1.
Las actuales recomendaciones en el tratamiento con fármacos para la DM2 aconsejan individualizar en función de las características específicas de los individuos y los fármacos hipoglucemiantes en sí1. Con respecto a la persona con DM, se debe considerar la edad, los años de evolución de la DM, la expectativa de vida, la presencia de comorbilidades y/o complicaciones, los factores socioeconómicos, la motivación y la adherencia al tratamiento. Y con respecto a los fármacos, se considerará la eficacia antihiperglucémica, el mecanismo de acción, el riesgo de causar hipoglucemia, el riesgo de aumento de peso, los posibles efectos adversos, la tolerabilidad, la facilidad de uso, la adherencia, el coste y su seguridad CV, renal o hepática2,3.
En 2006 se incorporó a la terapia farmacológica de la DM2 el grupo de las incretinas, al que pertenecen los agonistas del receptor del péptido similar al glucagón 1 (arGLP1) y los inhibidores de la enzima dipeptidil peptidasa 4 (iDPP4)2. Dentro de estos últimos, que fueron comercializados en España en 2007, el primer fármaco introducido fue la sitagliptina y, posteriormente, se han ido incorporando la vildagliptina, la sa-xagliptina, la linaglitptina y la aloglip tina.
Los iDPP4 se administran por vía oral y reducen los valores de glucosa en sangre, tanto en ayunas como posprandiales, con una potencia similar al resto de fármacos hipogluce-miantes orales (ADO), cifrada en un descenso medio de la HbA1c (hemoglobina glucosilada) de entre el 0,5 y el 0,79%2,3, con la ventaja de no inducir hipoglucemias, no modificar el peso corporal, presentar buena tolerancia, carecer prácticamente de efectos gastrointestinales y considerarse como fármacos seguros con pocos problemas de toxicidad4.
A su vez, las recomendaciones del tratamiento con fármacos hipoglucemiantes en pacientes con DM2 se han modificado para reflejar los resultados de los estudios de seguridad CV (ESCV)4, que se requirió por la Food and Drug Administra-tion (FDA) en 2008 y, posteriormente, por la European Medicines Agency (EMA), para aprobar un nuevo tratamiento hipoglucemiante5,6. Estos estudios han proporcionado datos sobre seguridad CV en pacientes con DM2 y alto riesgo de enfermedad CV (ECV), en unos casos sin evidencias de beneficios CV en relación con el placebo7-10, aunque en otros muestran una combinación de resultados con beneficios CV y en la mortalidad11-14.
En este artículo se tratará de reflejar los principales efectos secundarios conocidos por los ensayos clínicos controlados (ECC) y los datos publicados poscomercialización, así como los resultados de los ESCV referidos a los iDPP4, con sus principales conclusiones, en espera de que sea útil para los médicos de atención primaria que abordan el tratamiento farmacológico con ADO del paciente con DM2.
Tolerancia y efectos adversos de los iDPP4En los estudios realizados con iDPP4, el perfil de tolerancia se ha mostrado muy bueno, con bajo riesgo de efectos adversos frente a placebo, y no presentan un mayor riesgo de sufrir alteraciones gastrointestinales, como náuseas, vómitos, diarrea o dolor abdominal, ni reacciones cutáneas o síntomas gripales15. Tampoco mostraron incremento de peso ni mayor riesgo de hipoglucemia16.
Varios metaanálisis señalan que el riesgo de infección, como nasofaringitis e infecciones del tracto urinario, es mayor en los pacientes que toman iDPP417, mientras que en otros no se observaron asociaciones significativas o eran contradictorias; así, el aumento del riesgo de nasofaringitis era significativo con sitagliptina, pero no con vildagliptina. En este último metaanálisis, la incidencia real de otras infecciones era inferior que en los grupos de comparación18.
Con el objetivo de no ser exhaustivo en la enumeración de los efectos adversos identificados en los ECC y en la vigilancia poscomercialización de los iDPP4, en la tabla 1 se resumen los principales efectos adversos conocidos de los diferentes iDPP4, en función de la ficha técnica (FT), que se considera que son los que más habitualmente se presentan con estos fármacos. Se pueden consultar todas las reacciones adversas y su frecuencia en la FT de cada iDPP419-23. La incidencia de estos efectos adversos es muy baja, aunque ligeramente superior a placebo, y en ningún caso motivó la supresión del fármaco18.
Resumen de los efectos adversos (EA) más comunes* de los inhibidores de la dipeptidil peptidasa 4 (iDPP4), en monoterapia y asociados a metformina, según fichas técnicas autorizadas en función de los ensayos clínicos controlados y en la experiencia poscomercialización
| Fármaco | EA en monoterapia |
|---|---|
| Sitagliptina19 | Cefalea, estreñimiento, prurito, mareo e hipoglucemia |
| Saxagliptina20 | Mareo, fatiga y reducción del recuento absoluto de linfocitos sin repercusión clínica |
| Vildagliptina21 | Náuseas, temblor, cefalea, mareo, astenia y edema periférico |
| Linagliptina22 | Tolerancia similar a placebo. Estreñimiento, mareo e hipoglucemia |
| Alogliptina23 | Cefalea, infecciones del tracto respiratorio superior, prurito, erupción cutánea y dolor abdominal |
En cuanto a las interacciones de los iDPP4, según las F T, en el caso de la sitagliptina hay que vigilar a los pacientes con riesgo de toxicidad por digoxina cuando se administran ambos conjuntamente17. Para la saxagliptina se pueden presentar interacciones con fármacos inductores e inhibidores potentes del CYP3A4/518 (p. ej., rifampicina, claritromicina, metronidazol, fenitoína, carbamazepina, fenobarbital, etc.). Para vildagliptina, linagliptina y alogliptina no se han descrito en sus fichas técnicas interacciones medicamentosas clínicamente significativas, presentando un potencial bajo para interacciones en la coadministración de otros me-dicamentos21-23.
La principal contraindicación de los iDPP4, según la F T, es la hipersensibilidad a los principios activos o a alguno de los excipientes19-23. Estas reacciones de hipersensibilidad incluyen anafilaxia, angioedema y enfermedades exfoliativas de la piel (pénfigo bulloso), incluido el síndrome de Stevens-Johnson.
Seguridad cardiovascular de los iDPP-4El control del metabolismo glucémico es fundamental en el abordaje global del paciente con DM, junto con el control de los factores de riesgo C V, para reducir el riesgo de presentar complicaciones macrovasculares y microvascula-res24,25. Por otra parte, estudios de control intensivo de la glucemia frente a control habitual con rosiglitazona, indicaron un aumento del riesgo de infarto agudo de miocardio (IAM) y mortalidad de causa CV26. Los metaanálisis de estudios previos sobre el control intensivo de la glucosa también ofrecían controversias respecto a la seguridad CV de los diferentes ADO27.
La publicación de estos resultados en 2008 fue el motivo por el que la FDA y la EMA crearon una normativa5 en la que exigen que cualquier fármaco hipoglucemiante demuestre su seguridad C V, especialmente en poblaciones con mayor riesgo de ECV, sujetos ancianos y con algún grado de insuficiencia renal, ya que estas poblaciones son subsidiarias de recibir estos fármacos y no se suelen incluir en los ensayos clínicos. En esta normativa se estableció un período mínimo de seguimiento de 2 años y 3 niveles de seguridad para un intervalo de confianza del 95% (IC95%), > 1,8, entre 1,3 y 1,8 e inferior a 1,3, que han originado un amplio programa de ESCV, cuyos resultados se están publicando desde 2013.
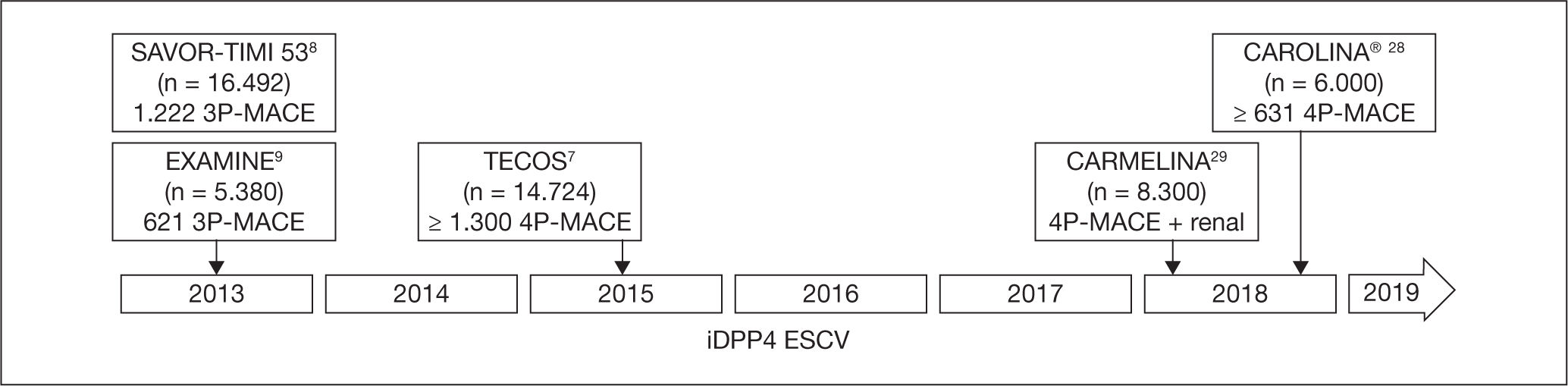
De los ESCV realizados con fármacos hipoglucemiantes iDPP4, que engloban a más de 36.500 sujetos aleatorizados en una proporción 1:1 a un iDPP4 frente a placebo en un contexto de atención habitual, ya se han publicado los resultados de saxagliptina (Saxagliptin Assesment of Vascular Outcomes Recorded in patients with Diabetes Mellitus-Thrombolysis in Myocardial Infarction [SAVOR-TIMI 53])8, alogliptina (Examination of Cardiovascular Outcomes Study of Alogliptin in Patients with Type 2 Diabetes and Acute Co-ronary Syndrome [EXAMINE])9 y sitagliptina (Trial to Evalua-te Cardiovascular Outcomes after Treatment with Sitagliptin [TECOS])7; quedan por publicar los ECC que se están realizando con linagliptina28,29 y omaragliptina (no comercializada en España) (fig. 1).
Respecto a la vildagliptina, se ha publicado un metaanáli-sis30 para informar sobre el perfil de seguridad CV y de IC, en el que se incluyeron 17.000 pacientes de 40 estudios de vil-dagliptina a doble ciego, con el objetivo primario de medir los eventos CV adjudicados retrospectivamente (major adverse cardiovascular event [MACE], IAM, accidente cardiovascular agudo [ACVA] y muerte CV) y los eventos de IC, sin encontrar mayor riesgo de MACE adjudicado en relación con los comparadores, ni un aumento significativo del riesgo de IC. También se ha realizado un ECC sobre el efecto de vilda-gliptina en la función del ventrículo izquierdo (VI) en pacientes con IC congestiva y fracción de eyección del VI (FEVI) disminuida (Effect of Vildaglitin on Left Ventricular Function in Patiensts With Type 2 Diabetes and Congestive Hearth Failure [VIVIDD])31 frente a placebo, en el que no se encontró un efecto importante sobre la FEVI, aunque hubo un aumento en los volúmenes del VI, sin hallar la causa ni el significado clínico de este hallazgo.
En los 3 estudios con iDPP4 comunicados hasta ahora, no se observa incremento de riesgo de MACE comparado con placebo7-9 en el objetivo primario, con las estimaciones puntuales de las hazard ratios (HR) de aproximadamente 1,0, al tiempo que en el análisis de los objetivos secundarios se sugería un mayor riesgo de hospitalización por IC con saxa-gliptina y alogliptina32, que se comentará más adelante.
En un metaanálisis de 70 ensayos clínicos publicado por Monami et al.4, que agrupaba a 41.959 sujetos con un seguimiento medio de 44,1 semanas, se confirmó que el tratamiento con iDPP4 no incrementa el riesgo de MACE (HR: 0,71; IC95%, 0,59-0,86), especialmente el IAM (HR: 0,64; IC95%, 0,44-0,94) y la mortalidad por cualquier causa (HR: 0,60; IC95%, 0,41-0,88), en los pacientes con DM2, aunque no se encontraron evidencias en la reducción de la muerte CV (MCV) a largo plazo. En ese mismo año, 2 artículos, publicados por Scheen33 y Nauck34, se pronuncian en el mismo sentido.
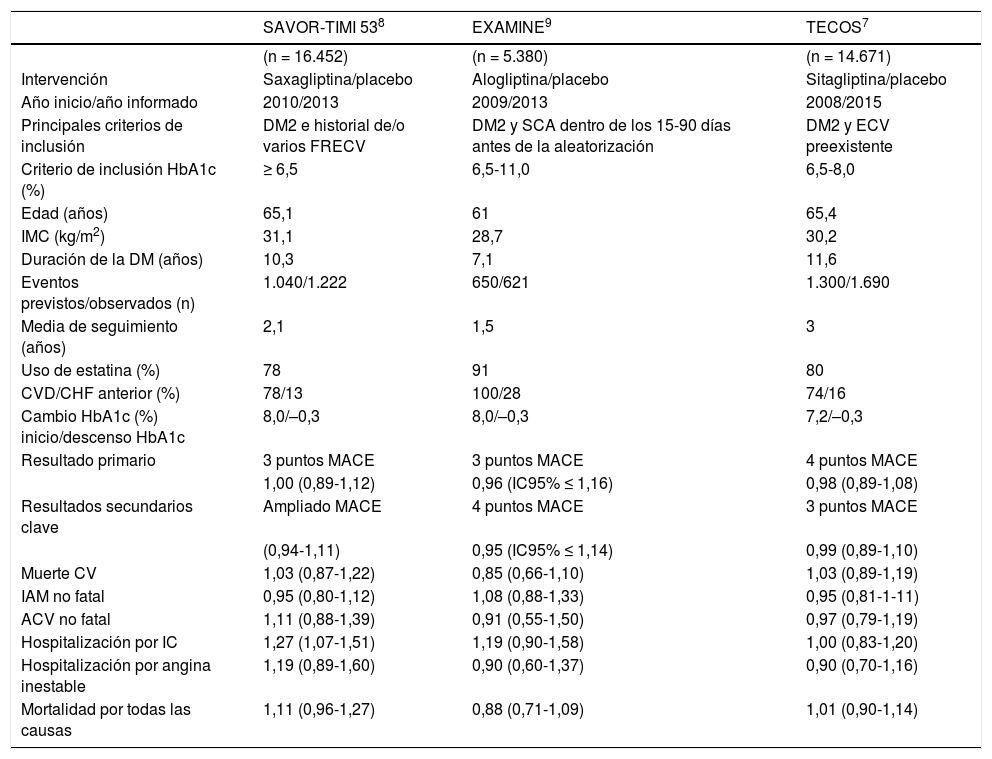
En la tabla 2 se refieren los principales resultados de estos 3 estudios con iDPP4 extraídos de la tabla publicada en las recomendaciones clínicas de la American Diabetes Asso-ciation (ADA) en 201835.
Principales resultados de los estudios de seguridad cardiovascular con inhibidores de la dipeptidil peptidasa 4 (iDPP4)
| SAVOR-TIMI 538 | EXAMINE9 | TECOS7 | |
|---|---|---|---|
| (n = 16.452) | (n = 5.380) | (n = 14.671) | |
| Intervención | Saxagliptina/placebo | Alogliptina/placebo | Sitagliptina/placebo |
| Año inicio/año informado | 2010/2013 | 2009/2013 | 2008/2015 |
| Principales criterios de inclusión | DM2 e historial de/o varios FRECV | DM2 y SCA dentro de los 15-90 días antes de la aleatorización | DM2 y ECV preexistente |
| Criterio de inclusión HbA1c (%) | ≥ 6,5 | 6,5-11,0 | 6,5-8,0 |
| Edad (años) | 65,1 | 61 | 65,4 |
| IMC (kg/m2) | 31,1 | 28,7 | 30,2 |
| Duración de la DM (años) | 10,3 | 7,1 | 11,6 |
| Eventos previstos/observados (n) | 1.040/1.222 | 650/621 | 1.300/1.690 |
| Media de seguimiento (años) | 2,1 | 1,5 | 3 |
| Uso de estatina (%) | 78 | 91 | 80 |
| CVD/CHF anterior (%) | 78/13 | 100/28 | 74/16 |
| Cambio HbA1c (%) inicio/descenso HbA1c | 8,0/–0,3 | 8,0/–0,3 | 7,2/–0,3 |
| Resultado primario | 3 puntos MACE | 3 puntos MACE | 4 puntos MACE |
| 1,00 (0,89-1,12) | 0,96 (IC95% ≤ 1,16) | 0,98 (0,89-1,08) | |
| Resultados secundarios clave | Ampliado MACE | 4 puntos MACE | 3 puntos MACE |
| (0,94-1,11) | 0,95 (IC95% ≤ 1,14) | 0,99 (0,89-1,10) | |
| Muerte CV | 1,03 (0,87-1,22) | 0,85 (0,66-1,10) | 1,03 (0,89-1,19) |
| IAM no fatal | 0,95 (0,80-1,12) | 1,08 (0,88-1,33) | 0,95 (0,81-1-11) |
| ACV no fatal | 1,11 (0,88-1,39) | 0,91 (0,55-1,50) | 0,97 (0,79-1,19) |
| Hospitalización por IC | 1,27 (1,07-1,51) | 1,19 (0,90-1,58) | 1,00 (0,83-1,20) |
| Hospitalización por angina inestable | 1,19 (0,89-1,60) | 0,90 (0,60-1,37) | 0,90 (0,70-1,16) |
| Mortalidad por todas las causas | 1,11 (0,96-1,27) | 0,88 (0,71-1,09) | 1,01 (0,90-1,14) |
ACV: accidente cerebrovascular; CHF: congestive heart failure; CV: cardiovascular; CVD: cardiovascular disease; DM: diabetes mellitus; ECV: enfermedad cardiovascular; FRECV: factores de riesgo de enfermedad cardiovascular; HbA1c: hemoglobina glucosilada; IAM: infarto agudo de miocardio; IC: insufciencia cardíaca; IC95%: intervalo de confanza del 95%; IMC: índice de masa corporal; MACE: major adverse cardiovascular event; SCA: síndrome coronario agudo. Modifcada de referencia 35 con permiso de la American Diabetes Association. © 2018 by the American Diabetes Association.
En el estudio con el iDPP4 saxagliptina, SAVOR-TIMI 538, se aleatorizaron 16.500 personas con DM2 y antecedentes o con riesgo de presentar ECV, frente al tratamiento hipoglu-cemiante habitual. La saxagliptina no aumentó el riesgo de presentar la variable primaria compuesta por MCV, IAM o ACVA en comparación con placebo. Como se ha comentado previamente, sí se describieron más casos de hospitalización por IC, sin que aún se sepa bien los motivos de esta asociación o si simplemente se trata de un falso positivo.
En el EXAMINE9, un ensayo clínico doble ciego de no inferioridad para comprobar la eficacia y seguridad de aloglipti-na, se aleatorizó a 5.380 pacientes con DM2 que habían padecido IAM o angina inestable recientemente, frente a placebo añadido al tratamiento hipoglucemiante previo. En los resultados finales, este fármaco no se asoció con un aumento en el riesgo de la variable primaria (MCV, IAM no mortal o ACVA no mortal) en comparación con placebo.
El estudio TECOS7 evaluó la seguridad CV de sitagliptina añadida al tratamiento frente a placebo en el tratamiento habitual de pacientes con DM2 y ECV establecida (IAM, ACV o enfermedad arterial periférica). En los resultados, no se apreciaron diferencias significativas en el objetivo primario compuesto CV (MCV, IAM no mortal, ACV no mortal, hospitalización por angina inestable) (HR: 0,98; IC95%, 0,89-1,08), ni en el objetivo secundario (MCV, IAM no mortal o ACV no mortal) (HR: 0,99; IC95%, 0,89-1,10), ni en la hospitalización por IC (hIC).
En definitiva, los estudios SAVOR-TIMI 53, EXAMINE y TECOS han confirmado la seguridad CV de estos 3 iDPP4, sa-xagliptina, alogliptina y sitagliptina, respectivamente, aunque en los 2 primeros se encontró un riesgo aumentado de hIC en pacientes con IC; con la vildagliptina, en el me-taanálisis realizado y en el ensayo controlado VIVIDD, no se ha encontrado mayor riesgo de MACE adjudicado en relación con los comparadores, ni un aumento significativo del riesgo de IC; y respecto a la linagliptina, falta por publicar sus ESCV (CAROLINA Y CARMELINA)28,29.
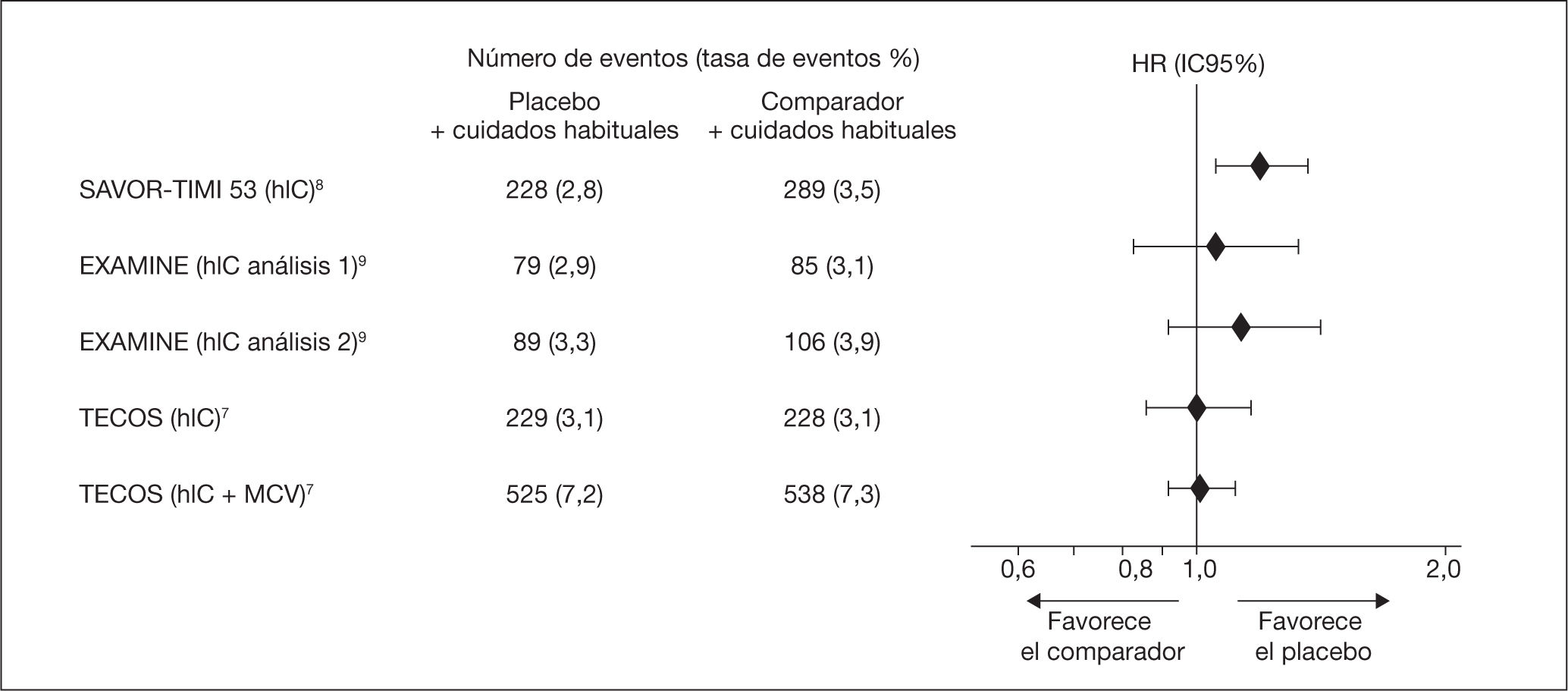
Otros datos de seguridad de los iDPP4Con la publicación de los ESCV realizados con los iDPP4, se puso de manifiesto un aumento de hIC (fig. 2). En los estudios realizados con saxagliptina frente a placebo se encontró en el 3,5 frente al 2,8%, respectivamente (HR: 1,27; IC95%, 1,07-1,51; p = 0,007)20,36, aunque no estaba clara la causa ni si era un efecto de clase para los iDPP47,19. Sin embargo se observó que estos eventos se presentaban en las personas con factores que le conferían mayor riesgo de IC (historia previa de IC, filtrado glomerular < 60 ml/min/1,73 m2 o valores elevados de propéptido natriurético cerebral N-terminal), así como también se piensa que podría estar en relación con el uso de inhibidores de la enzima de conversión de la angiotensina e iDPP4, por una posible interacción medicamentosa en pacientes susceptibles.
Con la alogliptina en pacientes con síndrome coronario agudo, no se encontró un aumento significativo de la tasa de hIC (el 3,9 frente al 3,3% de alogliptina frente a placebo; HR: 1,19; IC95%, 0,90-1,58; p = 0,220)9,20. En el análisis post-hoc de los datos realizado por Zannad et al.37, se encontró una mayor incidencia de hIC en personas sin historia previa de IC al inicio del estudio (HR: 1,76; IC95%, 1,07-2,90; p = 0,026). Sin embargo, al unir los datos de pacientes con historia previa de IC y sin IC al inicio, se demostró que no había aumento del riesgo de hIC con alogliptina (HR: 1,00; IC95%, 0,82-1,21), por lo que en pacientes con DM2 y riesgo de desarrollar IC se debe tener en cuenta37.
La publicación del TECOS con sitagliptina sin incremento de la hIC frente a placebo, y un análisis posterior en el que tampoco se observaron diferencias en la tasa de IC en sujetos que ya tenían diagnosticada la IC (3,1%; 1,07 por 100 personas/años) en comparación con el grupo placebo (3,1%; 1,09 por 100 personas/años)7,19,38, ayudó a despejar el interrogante de que no era un efecto de clase.
Con estos datos, la FDA en 2016 publicó una alerta que indicaba que “los fármacos que contienen saxagliptina y alogliptina pueden aumentar el riesgo de IC, especialmente en pacientes con IC o enfermedad renal crónica”39, que queda reflejado en sus FT20,23.
Se han planteado diversos argumentos para explicar la diferencia de resultados en la tasa de hIC en estos estudios, como las diferentes poblaciones incluidas, la diferente duración de cada estudio o el uso de bloqueadores beta, mayor en el EXAMINE, que puede conferir cierta protección frente al desarrollo de IC.
Con respecto al riesgo de afectación pancreática de las terapias con incretinas, en el análisis de los resultados de ESCV no se encontró un aumento del riesgo con evidencias controvertidas40,41. Por parte de los respectivos estudios SAVOR-TIMI 53, EXAMINE y TECOS, no se encontró incremento del riesgo de pancreatitis aguda, crónica o cáncer de páncreas. Un metaanálisis posterior sugirió un aumento del riesgo de pancreatitis aguda con los tratamientos con iDPP4 (riesgo relativo [RR]: 1,79; IC95%, 1,13-2,81; p = 0,01), mientras que para el cáncer de páncreas el riesgo fue menor (RR: 0,55; IC95%, 0,29-1,03; p = 0,07)42.
Las actuales recomendaciones de las principales guías de práctica clínica y las FT sobre la prescripción de los iDPP4 indican que se utilicen con precaución en personas con DM2 y antecedentes de pancreatitis, y suspender la medicación si aparece dolor abdominal intenso o pancreatitis1,19-24.
Otro punto de seguridad que se ha evaluado en los ESCV con iDPP4 es la asociación con la aparición de tumores sobre la base de las diversas funciones de los iDPP4 en el sistema inmune, que implica funciones antitumorales y antiinfecciosas. Aunque hubo un incremento de cáncer de páncreas en las terapias incretínicas, especialmente con sitagliptina y exenatida, en comparación con otras terapias, la evaluación de las bases de datos de los efectos adversos por la FDA y de la base de datos de estudios germánicos, no mostró una asociación significativa entre los iDPP4 y el cáncer de páncreas ni otros tipos de tumores40,41.
En la individualización del tratamiento de la DM2 se deben considerar los efectos de los diferentes fármacos sobre el hueso, teniendo en cuenta que la DM supone, por sí misma, un aumento del riesgo de fracturas, al que se pueden sumar otros factores de riesgo de osteoporosis y fracturas, como la edad avanzada, las complicaciones micro y macro-vasculares o la menopausia en la mujer43.
También es conocida la relación inversa entre la actividad de los iDPP4 y la concentración de vitamina D en la población general, que consiste en una asociación positiva entre la concentración de esta vitamina y la duración del tratamiento con iDPP4, la terapia con sitagliptina y linagliptina, aunque no en el caso de la vildagliptina.
Por último, en la enfermedad renal crónica, los iDPP4 han demostrado ser eficaces y seguros y todos ellos se pueden utilizar en este caso, aunque en todos es necesario realizar un ajuste de dosis dependiendo del filtrado glomerular, menos con linagliptina44. En presencia de insuficiencia renal terminal que requiere hemodiálisis, la sitagliptina y la lina-gliptina están calificadas como de uso seguro, el uso de sa-xagliptina no se recomienda y respecto a vildagliptina y alogliptina, la experiencia es limitada.
Perspectiva de los estudios de seguridad cardiovascular de los iDPP4Los ESCV publicados son ECC con placebo, de no inferioridad, que no han realizado comparaciones directas, aunque falta por publicar los resultados del CAROLINA27 (linaglipti-na), en el que existe un grupo frente a placebo y un grupo con comparación directa con una sulfonilurea (SU), glime-pirida, realizado en el marco de la atención estándar, que aportarán mayor conocimiento a la realidad de los tratamientos hipoglucemiantes combinados29, como ya se ha realizado con otros fármacos incretínicos que han comprobado la seguridad CV de un arGLP1 con iDPP4, SU o insulina, con o sin metformina asociada, y en condiciones del mundo real.
Los estudios realizados sobre seguridad de los iDPP4 no tienen una duración que permita extraer conclusiones sobre la influencia en la evolución de las complicaciones micro y macrovasculares de la diabetes, por lo que es necesario seguir evaluando la efectividad y el perfil de seguridad con su utilización a largo plazo.
ConclusionesEn atención primaria, la individualización del tratamiento de la DM2 es fundamental, por lo que conocer las principales características de los fármacos hipoglucemiantes es esencial.
Los iDPP4 son fármacos orales de la familia de las increti-nas, con una eficacia similar a la de los otros antidiabéticos, con un buen perfil de seguridad, bajo riesgo de hipogluce-mia, son neutros respecto al peso, tienen buena tolerancia y efectos secundarios similares al placebo.
Respecto a la seguridad CV, no incrementan el riesgo de eventos CV en estudios realizados con sitaglitptina, saxa-gliptina y alogliptina en pacientes con enfermedad CV establecida, con respecto a placebo. La vildagliptina, al no estar comercializada en Estados Unidos, no dispone de ESCV marcados por la FDA, aunque, como se ha comentado anteriormente, dispone de un metaanálisis que analiza la seguridad CV del fármaco.
Existe un aumento del riesgo de IC y de hIC con saxaglipti-na y alogliptina.
Los iDPP4 se consideran seguros respecto al páncreas, a los tumores, a la producción de fracturas y a la enfermedad renal crónica.
Son necesarios estudios de mayor duración para evaluar los efectos secundarios de los iDPP4 en la evolución de las complicaciones micro y macrovasculares de la DM2, así como el perfil de seguridad con el uso a largo plazo.
Conflicto de interesesF.C. Carramiñana Barrera ha realizado trabajos de asesora-miento, ha asistido a cursos y congresos, y/o ha realizado trabajos de investigación e impartido formación para alguno de los siguientes laboratorios farmacéuticos: Abbot, Almi-rall, AstraZeneca, Bayer, Boehringer Ingelheim, Esteve, FAES, Ferrer, Glaxo, Janssen, Lilly, Menarini, MSD, Novartis, Novo Nordisk, Rubio y Sanofi.