Los inhibidores de la dipeptidil peptidasa 4 pertenecen al grupo de los derivados incretí-nicos y, por ello, presentan un mecanismo de acción específco. El efecto incretina permite evitar efectos secundarios de los fármacos clásicos (sulfonilureas) y aportar ventajas específcas para utilizarse en asociación y en situaciones especiales. Su escaso riesgo en la producción de hipoglucemia y de ganancia ponderal los hace útiles en asociación con otros antidiabéticos orales, incluso con insulinas, aunque con ello se pueda aumentar el riesgo de hipoglucemia de estas. Los grandes estudios de no inferioridad cardiovascular han señalado que su comportamiento no es inferior al placebo, aunque en algún fármaco (saxagliptina) haya aumentado el riesgo de hospitalización por insufciencia cardíaca. Estas ventajas cardiovasculares, incluso en la arteriopatía periférica, su buen comportamiento en la retinopatía diabética, junto con su escaso riesgo de hipoglucemia en la insu-fciencia renal, han hecho que sean fármacos de elección en el paciente anciano.
Como factor limitante en su uso, dado el riesgo, aún no del todo valorado, no se recomiendan en pacientes con antecedentes de enfermedad pancreática o riesgo de tenerla, ni en niños, en la diabetes tipo 1, en adolescentes, en embarazadas o en mujeres lactantes. Cada una de estas situaciones especiales se desarrolla en el texto.
Dipeptidyl peptidase-4 inhibitors form part of the group of incretin derivatives and conse-quently have a specific mechanism of action. The incretin effect avoids the adverse ef-fects of classic drugs (sulphonylureas) and provides specific benefits for their use in as-sociation with other drugs and in special situations. Because they have a low risk of pro-ducing hypoglycaemia or weight gain, these inhibitors are useful in combination with other oral antidiabetic drugs and even with insulin, although this latter combination may increase the risk of hypoglycaemia. Large studies of cardiovascular non-inferiority have reported that dipeptidyl peptidase-4 inhibitors are non-inferior to placebo, although one drug (saxagliptin) may increase the risk of hospital admission for heart failure. Because of these cardiovascular advantages, even in peripheral arterial disease, their usefulness in diabetic retinopathy, and their low risk of hypoglycaemia in renal insufficiency, dipeptidyl peptidase-4 inhibitors are the drugs of choice in elderly patients.
Given the risk, although still not well defined, these drugs are not recommended in pa-tients with a history or risk of pancreatic disease, in children, in patients with type 1 diabetes, in adolescents, or in pregnant or breastfeeding women. Each of these special situ-ations is discussed in the present article.
Los inhibidores de la dipeptidil peptidasa 4 (iDPP4), como se ha comentado en otros capítulos, inhiben la enzima que bloquea el péptido similar al glucagón tipo 1 (GLP1) haciendo que este se acumule y se mantenga más tiempo en el organismo. Con ello estimulan la secreción de insulina (INS) tras la ingesta (el llamado efecto incretínico), haciendo que al mismo tiempo se reduzca la hormona contrarreguladora, el glucagón, y así disminuye la producción de glucosa por el hígado. Los iDPP4 comercializados en nuestro país son la si-tagliptina, la vildagliptina (solo en Europa, desde 2007), la saxagliptina, la alogliptina y la linagliptina1. Son fármacos que, según las principales guías de práctica clínica (GPC), sean la American Diabetes Association (ADA)2, la European Association for the Study of Diabetes (EASD), la National Ins-titute for Health and Clinical Excellence (NICE)3, la American Association of Clinical Endocrinologists/American College of Endocrinology (AACE/ACE)4, o la Scottish Interco-llegiate Guidelines5,6, se utilizan preferentemente en el segundo o tercer escalón terapéutico en asociación con la metformina (Met), pues mejoran su efectividad haciendo que esta combinación tenga una potencia parecida a la de la Met con las sulfonilureas (SU). A modo de ejemplo, el ensayo clínico aleatorizado (ECA) realizado por Gallwitz et al.7, que asoció Met con iDPP4 y que se evaluó a los 2 años en 777 pacientes en tratamiento con linagliptina (5 mg) y en 775 pacientes con glimepirida (1-4 mg) vía oral, mostró reducciones de hemoglobina glucosilada (HbA1c) equivalentes, linagliptina -0,16% (desviación estándar [DE]: 0,03) y glime-pirida -0,36% (DE: 0,03) (diferencia de 0,20, margen de no inferioridad definido de 0,35%). Los estudios y metaanálisis realizados antes de los ECA de no inferioridad cardiovascular (ENICV), que se comentan más adelante, ya mostraron que esta familia se diferenciaba de las SU en que tenían un efecto neutro en el peso, en el riesgo de hipoglucemias y en el riesgo cardiovascular (CV), de modo que sus indicaciones se postulaban más amplias que las antiguas SU.
En este sentido, solo a modo de ejemplo, algún metaaná-lisis8,9 de los varios publicados antes de los ENICV, salvando la gran heterogeneidad de los ECA publicados hasta ese momento, 2011 (metaanálisis de Park et al.), tras el análisis de 62 ECA y 30.563 pacientes con diabetes mellitus tipo 2 (DM2), mostró que los iDPP4 producían, en general, una reducción de la HbA1c de un -0,79% (intervalo de confianza [IC] del 95%, -0,83 a -0,68). Con esto se señalaba que los iDPP4 eran levemente menos potentes que otros fármacos antidiabéticos no insulínicos (ADNI), pero no “inferiores” a las glitazonas, las SU o la acarbosa. Algo que no ocurría cuando se los comparaba con la Met. Según este, producían un sutil aumento del peso frente a placebo, 0,21 kg (IC95%, 0,15-0,27), y un riesgo de hipoglucemias en solitario no diferente al del placebo, con una odds ratio (OR) de 1,04 (IC 95%, 0,68-1,58). A partir de aquí, conociendo su eficacia y efectos secundarios, se valora la utilización de este grupo de fármacos en diversas situaciones clínicas.
¿Se pueden asociar a otros fármacos antidiabéticos no insulínicos?Los iDPP4, dada su eficacia y su perfil de seguridad, están recomendados en cualquiera de los escalones terapéuticos de la DM2 en las principales GPC2-6. Sin embargo, si bien su eficacia en combinación con Met (como se ha visto) está bien documentada, no lo está con otros ADNI. No se han descrito efectos secundarios en combinación con otros ADNI, salvo, como muestran Mearns et al., aumentar el riesgo de hipoglucemia de ADNI como las SU10. Por otro lado, sí que podrían variar las propiedades que tienen en ciertas áreas como la CV. En este sentido, un metaanálisis reciente de Crowley et al.11, que utiliza los datos de los principales ENICV publicados, que se verán más adelante, apunta que la asociación de los iDPP4 con Met mejoraría los resultados CV, con una diferencia estadísticamente significativa. Este me-taanálisis lleva a pensar que las combinaciones con este tipo de sustancias pueden modificar, en general para bien, algunas de las propiedades de los iDPP4. Por ello, los iDPP4 pueden asociarse en doble o triple terapia con prácticamente todos los fármacos antidiabéticos no incretínicos.
¿Pueden asociarse a las insulinas?En cuanto a la asociación de los derivados incretínicos con la INS, está bien documentado con los agonistas del receptor del GLP1 (arGLP1); diversos metaanálisis12 dan cuenta de los efectos positivos de la combinación de la INS basal (INSB) y de los arGLP1 (acción posprandial) en la reducción de las necesidades de INS, de la hipoglucemia y del incremento ponderal inducido por la insulinoterapia. Sin embargo, en los iDPP4, al no tener ni la potencia ni la acción de los arGLP1, estos efectos no han sido tan destacados. Sí que es cierto que la prescripción de la Met (asociación frecuente con los iDPP4) con la INS podría aumentar el riesgo de hipo-glucemias13, y en caso de la asociación de iDPP4 en exclusividad con INS se recomienda reducción de dosis de esta última, para evitar dicha complicación.
¿Pueden prescribirse en la diabetes tipo 1?La única terapia admitida en la diabetes tipo 1 (DM1) es la INS. Ningún otro fármaco ADNI se ha admitido hasta el momento. Sí que existen resultados prometedores con una nueva familia de fármacos inhibidores de los cotransporta-dores de la bomba de sodio-glucosa tipo 2 (iSGLT2) al respecto, debido a que su acción no es sobre la célula b-pancreática, sino sobre el riñón14. No es el caso de los iDPP4. Un trabajo con sitagliptina en pacientes diagnosticados de diabetes LADA (latent autoimmune diabetes in adults)15 aleatorizados 1/1 durante 12 meses, no mostró diferencias en los valores de glucemia ni de HbA1c. A los 12 meses hubo diferencias en el péptido C posprandial en el grupo de la sitagliptina, y concluye que la sitagliptina añadida a la INS en pacientes con LADA ayuda a mantener la función b-pancreática frente a la INS sola. El metaanálisis de Guo et al.16 de hace 2 años, sobre 6 ECA y 228 individuos, mostró cómo los iDPP4 producen reducción de la dosis de INS diaria significativa, -2,41 U/día (IC95%, -3,87 a -0,94; p = 0,001), pero no de los valores de HbA1c. En estos, tampoco los iDPP4 modificaron la incidencia de hipoglucemia grave, con un riesgo relativo (RR) de 0,81 (IC95%, 0,34-1,93; p = 0,64). Con todo, en la actualidad no se tienen suficientes evidencias para recomendarlos en los pacientes con DM1.
¿Cuál es su comportamiento en la cardiopatía isquémica o en el paciente con alto riesgo cardiovascular?Ciertas acciones fisiopatológicas que se han observado en modelos animales de los fármacos incretínicos, y en concreto de los iDPP4, sugerían que este tipo de sustancias podrían retrasar o inhibir la arteriosclerosis al actuar sobre la disfunción endotelial y la inflamación (efecto “pleiotrópico”), y podrían actuar sobre la presión arterial (PA). Por esto se intuía a priori que podían ser beneficiosos a nivel C V.
Metaanálisis anteriores a los ENICV ya mostraban reducciones significativas de los episodios CV sin explicación plausible, fuera influencia en la PA, los lípidos, sobre el miocardio, etc. Un análisis de Monami et al. en 201217, sobre todos los ECA publicados hasta la fecha y los no publicados pero en poder de la U.S. Food and Drug Administration (FDA) y de la European Medicines Agency (EMA), mostró, sobre 70 ECA y 41.959 pacientes y un seguimiento de 44,1 semanas, una OR de 0,71 (IC95%, 0,59-0,86) en enfermedad CV (ECV), de 0,64 (IC95%, 0,44-0,94) para infarto agudo de miocardio, de 0,77 (IC95%, 0,48-1,24) para accidente cere-brovascular y de 0,60 (IC95%, 0,41-0,88) para mortalidad por cualquier causa.
Sin embargo, los primeros datos procedentes de los primeros ENICV que se iban publicando, el Saxagliptin As-sessment of Vascular Outcomes Recorded in Patients with Diabetes Mellitus (SAVOR-TIMI 53)18 y el Examination of Cardiovascular Outcomes with Alogliptin versus Standard of Care (EXAMINE)19, mostraban que, al margen de su no inferioridad CV en ECV con respecto al placebo, podían aumentar los casos de hospitalización por insuficiencia cardíaca. Los primeros datos hicieron que la FDA20 obligara a las compañías fabricantes de la saxagliptina y la alogliptina en Estados Unidos a poner dicha advertencia en el etiquetado de estos fármacos. El SAVOR-TIMI 53, en 16.492 pacientes con DM2 con alto riesgo CV (RCV), demostró que la saxagliptina no era inferior al placebo en la génesis de ECV, pero generó más ingresos por insuficiencia cardíaca (el 3,5 frente al 2,8%), con una HR de 1,27 (IC95%, 1,07-1,51; p = 0,007). La FDA mostró en el EXAMINE, con alogliptina, que de los pacientes con DM2 y un síndrome coronario agudo reciente, el 3,9% de los que recibieron alogliptina fueron ingresados por insuficiencia cardíaca, frente al 3,3% del grupo placebo, con una HR de 1,19 (IC95%, 0,90-1,58), pero sin llegar con ello a la significación estadística. En este aspecto, un nuevo metaanálisis de Monami et al.21 en 2014 sobre estas sustancias con relación al riesgo de insuficiencia cardíaca, mostró que en 84 ECA, 69.615 pacientes y 448 casos de insuficiencia cardíaca hubo mayor riesgo de esta complicación en los iDPP4 que en los controles, con una OR de 1,19 (IC95%, 1,03-1,37; p = 0,015). En cualquier caso, la mayoría de los casos de insuficiencia cardíaca incluidos provenían del SAVOR-TIMI 53 y del EXAMINE, y al retirar el estudio SAVOR-TIMI 53 ya no se llegó a la significación estadística. La publicación del estudio Trial to Evaluating Cardiovascular Outcomes with Sitagliptin (TECOS)22 vino a cambiar esta situación. El TECOS es un ECA realizado en 14.671 pacientes con DM2 con ECV previa y aleatorizados a recibir sitaglipti-na o placebo. Al margen de demostrar que esta sustancia no era inferior al placebo en el objetivo primario CV, con una HR de 0,98 (IC95%, 0,88-1,09; p < 0,001), las tasas de hospitalización por insuficiencia cardíaca no fueron distintas entre ambos grupos, con una HR de 1,00 (IC95%, 0,83-1,20; p = 0,98). En este aspecto falta por conocer los datos del estudio Cardiovascular Outcome Study of Linagliptin Versus Glimepiride in Patients With Type 2 Diabetes (CAROLINA) con linagliptina, aún por finalizar, para conocer si estos resultados son exclusivos de la sitagliptina o son compartidos con otros fármacos del grupo. Faltaba conocer si los iDPP4 tenían mayor o menor riesgo de insuficiencia cardíaca que otros fármacos ADNI, como las SU. En este sentido hay datos de bases de datos retrospectivas, como la de Fadini et al.23 según datos de registros que incluyen 127.555 pacientes (de 18 millones de habitantes) de la población italiana, que intentó determinar la relación entre los ADNI y el riesgo de hospitalización por insuficiencia cardíaca a los 6 meses de haberse iniciado el tratamiento. Según este, tras ajustar por factores confusores, los iDPP4 tuvieron menor riesgo de insuficiencia cardíaca que las SU, con una HR de 0,78 (IC95%, 0,62-0,97; p < 0,026). Con ello queremos decir que son fármacos seguros a nivel CV y siempre más seguros que las SU en el riesgo de insuficiencia cardíaca, con la salvedad de la saxagliptina, que debería evitarse en estas situaciones.
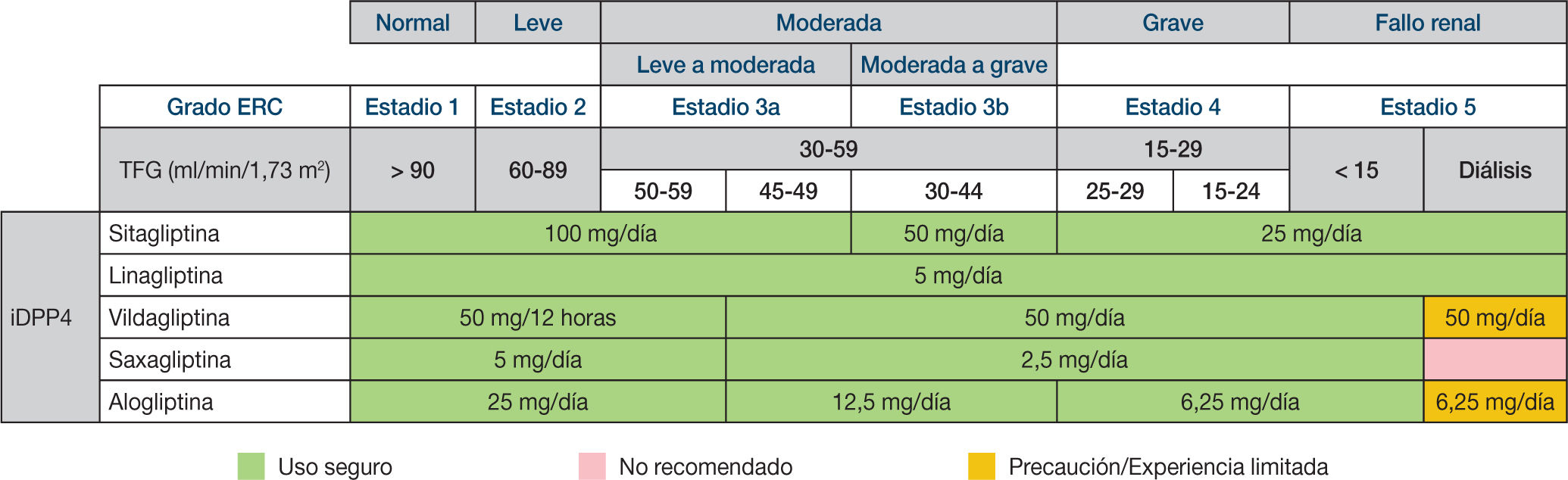
¿Su comportamiento es correcto en el paciente con insuficiencia renal?Existen diferencias entre los derivados incretínicos en la enfermedad renal crónica (ERC). En general, tanto la ADA5 como la American Society of Nephrology (ASN) y la National Kidney Foundation (NKF) entienden que, dado el bajo riesgo de hipoglucemias de los iDPP4, pueden utilizarse en la ERC. Sin embargo, tanto la sitagliptina como la saxagliptina, la alogliptina y la vildagliptina deben ajustar la dosis a las tasas de filtración glomerular estimada (FGe). No así la lina-gliptina, que sería la única que no debería ajustar su dosis a la FGe. En el caso de la enfermedad renal terminal (diálisis), la vildagliptina y la alogliptina deben prescribirse con precaución, y la saxagliptina debe evitarse, según señalan las fichas técnicas (fig. 1). Los arGLP1 son capítulo aparte y aún hoy existe una cierta controversia al respecto según la FGe y el tipo de fármaco utilizado (sea exenatida o liraglu-tida). Un metaanálisis reciente de Howse et al.24 sobre ECA publicados hasta marzo de 2016 en pacientes con DM2 con ERC moderada, grave o terminal y tratamiento con iDPP4 o arGLP1 o placebo o comparador activo, mostró, del análisis de 13 ECA, que los derivados incretínicos en general en estas situaciones reducen la HbA1c de manera significativa, y que también en estas situaciones incrementan el riesgo de hipoglucemia de manera significativa, con un RR de 1,38 (IC95%, 1,01-1,89), frente a placebo, pero no frente a comparadores activos. Tanto el SAVOR-TIMI como el EXAMINE, aun teniendo subgrupos con ERC, no permitieron extraer conclusiones frente a la posibilidad de episodios C V. El post hoc del estudio TECOS realizado por Engel et al.25 en 3.324 pacientes (el 23% de la población estudiada) con ERC, mostró cómo los eventos adversos graves fueron más frecuentes (fracturas óseas, hipoglucemias graves, etc.) en esta cohorte que en aquella sin ERC, si bien es cierto que en un seguimiento medio de 2,8 años el grupo de ERC con sitagliptina (80% eliminación por vía renal) tuvo tasas de enfermedad retiniana, neuropatía diabética, insuficiencia renal, cáncer, fracturas óseas, pancreatitis o hipoglucemia grave parecidas al grupo asignado a placebo. Se esperan las conclusiones del CAROLINA con linagliptina, pues en su diseño se introdujo este objetivo desde el inicio del estudio. Acerca de la enfermedad renal terminal no hay mucho publicado. En un trabajo de Arjona Ferreira et al.26 en un ECA con 129 pacientes con ERC en diálisis, que comparó a doble ciego la sita-gliptina (25 mg) con la gliplizida (2,5 mg) durante 54 semanas, hubo reducciones de HbA1c semejantes (-0,72 frente a -0,87) y las hipoglucemias sintomáticas fueron del 6,3% con la sitagliptina y del 10,8% con la glipizida, y en graves del 0 al 7,7%. Por ello, y como regla general, los iDPP4 son buenas alternativas en la ERC, eso sí, ajustando la dosis según el fármaco utilizado (fig. 1).
Dosifcación de antidiabéticos en función de la tasa de fltración glomerular (TFG). Antes de iniciar el tratamiento, consulte las fchas técnicas completas disponibles en: www.aemps.gob.es/cima. Figura elaborada a partir de los datos de las fchas técnicas de los diferentes productos a fecha de mayo de 201844-48.
Como se ha visto, los iDPP4 tienen la ventaja de que se adaptan bastante bien a los posibles riesgos micro y ma-croangiopáticos del paciente con DM2 anciano, que son neutros y que no empeoran la mayoría de las situaciones.
No empeoran el riesgo CV de los pacientes con episodios CV previos, y al menos uno del grupo (sitagliptina) es neutro con respecto al riesgo de insuficiencia cardíaca. Su comportamiento en la ERC es correcto y solo se precisa ajustar la dosis en la mayoría de ellos, salvo en uno, en que pueden manejarse dosis plenas (linagliptina). Dentro de los subgrupos de personas mayores en los ENICV, mostramos las conclusiones del TECOS27 en 2.004 (14%) pacientes mayores de 75 años (media de 78,3 años, DE: 3,1), con una duración media de su DM2 de 12 años. En los 2,9 años de seguimiento tuvieron mayores tasas de ECV, mortalidad, hipoglucemias graves y fracturas que el resto de la población estudiada. Si bien es cierto que la sitagliptina tuvo una influencia neutra pero significativa en el objetivo primario, con una HR de 1,10 (IC95%, 0,89-1,36), en la mortalidad por cualquier causa, HR de 1,05 (IC95%, 0,83-1,32), en la hospitalización por insuficiencia cardíaca, HR de 0,99 (IC95%, 0,65-1,49), en las hipoglucemias graves, HR de 1,03 (IC95%, 0,62-1,71), así como en los casos de pancreatitis. De la misma forma, en el estudio de Schweizer et al. la vildagliptina fue efectiva y bien tolerada en personas con diabetes de edad ≥ 75 años28.
Todo ello hace que sean buenos fármacos en el paciente anciano con DM2.
¿Tienen algún efecto sobre la retinopatía diabética y otras afectaciones oculares?Es este un tema aún en ciernes, en el que los resultados son preliminares. Como muestran Gonçalves et al.29, existen buenas perspectivas en la prevención de la permeabilidad de la barrera retinovascular, en la inmunorreactividad y a nivel endotelial, ya que, en modelos animales e independientemente de la glucemia, la sitagliptina reduce la inflamación y la apoptosis neuronal. Esto sugiere que estas sustancias podrían prevenir o retrasar las alteraciones reti-nianas ligadas a la evolución de la DM. En cuanto a nivel tópico (gotas oculares), ya existen trabajos experimentales30 en la prevención de la neurodegeneración y de la permeabilidad vascular, atribuidos a la prevención de la degradación de la acción de los arGLP1 en la retina. Con todo, aún no se recomiendan en esta indicación.
¿Cuál es el comportamiento de los iDPP4 en el paciente con diabetes mellitus tipo 2 que presenta síntomas de pie diabético?Desde las alertas de la FDA31 a partir de 2016 sobre los datos preliminares de los estudios CANVAS (CANagliflozin cardioVascular Assessment Study) y CANVAS-R (A Study of the Effects of Canagliflozin on Renal Endpoints in Adult Partici-pants With Type 2 Diabetes Mellitus) con iSGLT2, canagliflo-zina32, sobre el riesgo de amputaciones de extremidades inferiores, esta familia de fármacos y los ADNI han cobrado cada vez más interés en este tema de seguridad. En esta familia, si bien el riesgo con estas sustancias es pequeño, es decir, un riesgo de amputaciones de 6,3 en el grupo de la canagliflozina frente a 3,4 del grupo placebo por 1.000 pacientes y año, HR de 1,97 (IC95%, 1,41-2,75), la realidad es que la repercusión en la vida real, según algún estudio pu-blicado33, es mínima33. Sin embargo, en los iDPP-4, algún trabajo reciente34 apunta que estos se relacionarían con un menor riesgo de arteriopatía periférica y amputación de extremidades inferiores. Y es que es un tema que preocupa, pues la arteriopatía periférica es una complicación frecuente en el paciente con DM2, al tiempo que es causa subyacente de las úlceras diabéticas y de las amputaciones de extremidades inferiores en pacientes con DM2. A nivel teórico, como se ha señalado antes, los iDPP4 en modelos animales serían capaces de reducir o retrasar la arteriosclerosis, al mejorar la disfunción endotelial y la inflamación (efecto “pleiotrópico”) y, si bien es cierto que sus acciones a nivel cardíaco son más bien neutrales, a nivel periférico podrían resultar beneficiosas. El estudio de Chang et al.34 se realizó según la base de datos Taiwan's National Health Insurance Research Database (NHIRD) y tuvo como objetivo analizar la incidencia de arteriopatía periférica entre los pacientes con DM2 que utilizaban los iDPP4 y los que no. En total se analizaron 82.169 parejas de pacientes con DM2, con o sin iDPP4 en su tratamiento, entre 2009 y 2011 sobre un seguimiento medio de 3 años. En este tiempo se identificó a 3.369 pacientes con arteriopatía periférica en tratamiento con iDPP4 y a 3.880 que utilizaban otros ADNI. El riesgo de arteriopatía periférica según la HR fue de 0,84 (IC95%, 0,80-0,88), una HR que se mantuvo en los distintos subgrupos. Las amputaciones de extremidades inferiores en el grupo que utilizaba iDPP4 se redujeron frente al grupo que utilizaba otros ADNI a una HR de 0,65 (IC95%, 0,54-0,79). Faltan más estudios para confirmar estas conclusiones, pero irían en la línea de su comportamiento fisiopatológico. Por todo ello, se puede decir que el comportamiento de los iDPP4 en el paciente con riesgo de pie diabético es neutro o favorable.
¿Se puede recetar iDPP4 a los pacientes que han sufrido o que padecen alguna enfermedad pancreática?Sea por su fisiopatología sobre las vías biliares y pancreáticas, los derivados incretínicos arrastran el efecto secundario de que son capaces de generar o de precipitar alteraciones en el páncreas y en el sistema biliar. En concreto, los estudios en modelos animales ya mostraron cómo estas sustancias eran capaces a nivel anatomopatológico de generar cierta inflamación de las células pancreáticas acinares y una metaplasia ductal, lo que sugería un mecanismo explicativo de enfermedades pancreáticas. A su vez, los arGLP1 in vitro indujeron la proliferación y la actividad de los colangiocitos, lo que incrementó la preocupación sobre el riesgo de presentar enfermedades relacionadas con las vías biliares, fuera litiasis biliar, colecistitis o colangitis35. Esta explicación causal dio pie a que la FDA, a partir de 2008, prestara una atención epidemiológica a los casos que fueran surgiendo al respecto, sin que se llegara a demostrar de una manera fehaciente y estadísticamente significativa que los derivados incretínicos aumentaban el riesgo de pancreatitis e incluso de cáncer pancreático. Y es que existe un efecto confusional en que el paciente con DM2 por el mismo mecanismo fisiopa-tológico tiene mayor propensión a este tipo de complicaciones, a la obesidad (causa de afectación biliar y pancreática) y a la litiasis biliar en sí (causa de pancreatitis).
Un metaanálisis de Li et al.36 de 2014 sobre ECA y ensayos clínicos no aleatorizados y en 353.639 pacientes, no encontró mayor riesgo, y la OR de los iDPP4 frente a los controles fue de 1,06 (IC95%, 0,46-2,45), lo que indicaba una ausencia de riesgo o un riesgo extremadamente bajo. Los estudios de seguridad C V, sean el SAVOR-TIMI 53, el EXAMINE o el TECOS, realizados hasta el momento no han mostrado mayor riesgo en este sentido. Así, el SAVOR-TIMI 5318, con saxagliptina, señaló un 0,21% de pancreatitis en el grupo de iDPP4 frente al 0,11% del grupo placebo; en el estudio EXAMINE19, con alogliptina, fue del 0,44% en el grupo de iDPP4 y del 0,30% en el grupo placebo, y en el estudio TECOS22, con sitaglipti-na, del 0,32% en el grupo de iDPP4 frente al 0,17% en el grupo control. Tanto en este como en el resto de ENICV no se encontraron diferencias en las tasas de pancreatitis aguda ni de cáncer pancreático entre el grupo de intervención y el de control.
Sin embargo, algún metaanálisis de estos estudios, como el aportado por Tkáč= et al.37 sobre 18.238 pacientes con iDPP4 y 18.238 con placebo, ha mostrado cómo la incidencia total de pancreatitis es superior en el grupo de iDPP4, con una OR de 1,79 (IC95%, 1,13-2,82; p = 0,013), es decir, un 79% de mayor RR de padecer pancreatitis que con placebo. Sin embargo, en términos de riesgos absolutos esto sería insignificante, aunque representativo (incremento del riesgo de un 0,13%). Todo ello nos hace ser cautos, y si bien el riesgo es mínimo, podría no ser despreciable si se administran en pacientes con antecedentes pancreáticos, por lo que no estarían indicados.
En cuanto a las enfermedades de las vías biliares, como se ha comentado, una complicación más frecuente en los pacientes con DM2, también se ha sugerido que están incrementadas en los pacientes en tratamiento con derivados incretínicos. Sí que es cierto que, desde 2007, los servicios de vigilancia de la Organización Mundial de la Salud (OMS) han relacionado los derivados incretínicos con 1.069 casos de enfermedad de las vías biliares (incluida la litiasis biliar) y 79 casos de neoplasia maligna de las vías biliares o de la vesícula biliar a nivel mundial38. En este sentido, un trabajo de Faillie et al.38 recientemente publicado pone el acento en los arGLP1 más que en los iDPP4 en el incremento del riesgo de enfermedad de las vías biliares y de la vesícula biliar. Y tal vez sea por los datos aportados recientemente por el estudio LEADER (Liraglutide Effect and Action in Diabetes: Evalua-tion of cardiovascular Outcome Results)39, con liraglutida, que hayan cobrado más importancia. Así, en este estudio, en la rama de liraglutida hubo más casos que en la de placebo (61 de 2.481 frente a 12 de 1.242) y más colecistectomías (40 de 2.481 para liraglutida y 6 de 1.242 para placebo). Sin embargo, en este sentido, ambas familias de derivados in-cretínicos no tienen los mismos resultados. Faillie et al.38 identificaron y analizaron en una cohorte retrospectiva del United Kingdom (UK) Clinical Practice Research Datalink (CPRD) y la base de datos hospitalaria Hospital Episodes Sta-tistics (HES) a aquellos pacientes mayores de 18 años que empezaron un tratamiento con ADNI entre enero de 2007 y marzo de 2014. En total recabaron información de 71.369 pacientes, en los que realizaron un seguimiento medio de 3,2 años comparando la utilización de derivados incretínicos con otros ADNI. En este tiempo, 853 pacientes tuvieron alguna complicación biliar (3,7/1.000 personas/año). En este seguimiento, los pacientes en tratamiento con iDPP4 no presentaron mayor riesgo de enfermedad de las vías biliares cuando se comparaban con otros ADNI (3,6 frente a 3,3 por 1.000 personas/año; HR: 0,99; IC95%, 0,75-1,32). No así, sin embargo, los arGLP1, que sí aumentarían el riesgo de presentar este tipo de enfermedades (6,1 frente a 3,3 por 1.000 personas/año; HR: 1,79; IC95%, 1,21-2,67). En principio, los iDPP4 no supondrían un riesgo de enfermedad biliar. Por todo esto, los iDPP4 no estarían recomendados en pacientes con pancreatitis aguda, antecedentes de enfermedad pancreática o con riesgo de padecerla.
¿Se pueden recetar los iDPP4 en pacientes con riesgo de fracturas, producen osteoporosis o pueden afectan al sistema osteomuscular?La preocupación sobre el riesgo de fracturas de los nuevos ADNI surgió a partir de los ECA sobre las glitazonas. En ambas moléculas, sea la rosiglitazona o la pioglitazona, se observó un aumento del riesgo de fracturas; sin embargo, de la misma forma que en el riesgo de enfermedades pancreáticas, el paciente con DM2 tiene mayor riesgo de fracturas que la población general. Las fracturas no son un tema solo de densidad ósea, sino de riesgo de caída y, en este sentido, en los fármacos con mayor riesgo de hipoglucemia (INS, SU) estaría aumentado. Por otro lado, hay mecanismos intrínsecos o propios de los fármacos que pueden influir en la susceptibilidad a presentar mayor o menor riesgo de fracturas. Así, las glitazonas producen una reducción de la densidad ósea mientras que los arGLP1, por ejemplo, en modelos animales aumentan la diferenciación de los osteoblastos inhibiendo la actividad osteoclástica, estimulando la formación ósea. Esta explicación podría llevarnos a pensar que los derivados in-cretínicos, sean los iDPP4 o los arGLP1, tendrían efectos protectores a nivel óseo. Un metaanálisis de Monami et al.40 sobre ECA publicados hasta 2011 que destacaban esta variable en 28 ECA y 11.880 individuos con iDPP4 frente a 9.175 controles, durante 35 semanas de seguimiento medio y sobre 63 fracturas identificadas, concluyó que la OR era de 0,6 (IC95%, 0,37-0,99; p = 0,045). Las evidencias son pocas, y escaso el tiempo estudiado, para pronunciarse al respecto, pero a priori parece que al menos no perjudican, o pudieran tener un efecto protector. Por otra parte, no hace mucho que la FDA alertó sobre si los iDPP4 podían causar dolores articulares, que podían llegar a ser graves e incluso llegar a incapacitar. El tema provenía de las declaraciones directas de sanitarios por su sistema de recogida de efectos adversos, el FDA Adverse Event Reporting System (FAERS)41, y por ello se ha instado a recoger este efecto secundario en las fichas técnicas de los iDPP4. Este efecto adverso ya se había observado y publicado en 2013 por Tarapués et al.42. Al parecer es un efecto leve que se soluciona con la interrupción de la ingesta del fármaco en menos de 1 mes, pero que recurre con su reintroducción. Otro aspecto es el efecto a nivel muscular de los iDPP4, como causante de daño muscular al modo de los efectos secundarios provocados por las estatinas. Así, la EMA ha advertido sobre el posible riesgo de miopatía y de rabdomiólisis debido a los iDPP4; sin embargo, los casos registrados también estaban tratados con estatinas. Se apunta la posible interacción entre ambos fármacos. Un estudio de Labat et al.43, que evalúa los iDPP4 en solitario o asociados con estatinas según comunicaciones espontáneas a 2 bases de datos de farmacovigilancia francesa y de la OMS entre 2009 y 2015, mostró que el tratamiento con iDPP4, aun sin estatinas o fibratos, se asoció significativamente a casos de miopatía. Hay que señalar que el tipo de estudio está sometido a los sesgos de información de los sistemas de farmaco-vigilancia. Se puede resumir que la influencia de los iDPP4 en el sistema musculoesquelético es correcta, salvo algún efecto secundario (dolores articulares o miopatía), por lo general leves y poco frecuentes.
Niños, adolescentes, mujeres embarazadas y lactantesEn la actualidad, no se recomienda recetar esta familia de fármacos en estos colectivos, dada su falta de experiencia clínica y evidencias de seguridad. En general, no se tienen datos por debajo de los 18 años de edad y en mujeres embarazadas44,45.
ConclusiónLos iDPP4 son fármacos antidiabéticos orales útiles en múltiples situaciones específicas del paciente con DM2. Sus ventajas tienen que ver con su bajo riesgo de hipoglucemias y la falta de repercusión en el peso corporal. Por su buena tolerancia y su buen comportamiento a nivel renal y CV, están indicados en pacientes ancianos, renales y con comorbi-lidad acompañante.
Conflicto de interesesM. Seguí Díaz ha participado en reuniones científicas y publicaciones patrocinadas por MSD, Lilly y Almirall, entre otros.