Conocer las reacciones adversas medicamentosas (RAM) producidas por los inhibidores del co-transportador sodio-glucosa tipo 2 (iSGLT-2) notificadas en España desde su comercialización.
Material y métodosEstudio de todas las notificaciones existentes en la base de datos del Sistema Español de Farmacovigilancia de medicamentos de uso humano derivadas del uso de iSGLT-2.
ResultadosSe recopilaron 311 notificaciones: 169 relacionadas con dapagliflozina (54,34%), 81 con empagliflozina (26,05%) y 61 con canagliflozina (19,61%). El 52,1% de los pacientes fueron mujeres y el 47,6%, hombres. La edad media fue de 62,07±12,176años. Un total de 167 notificaciones (53,7%) fueron clasificadas como no-graves y 144 (46,3%), como graves. Se notificaron 534 RAM, siendo las más frecuentes las infecciones del tracto urinario (37 casos; 6,9%), cetoacidosis diabética (30; 5,6%), balanopostitis (24; 4,5%), cetoacidosis (16; 3%), candidiasis vulvovaginal (16; 3%), mareo (11; 2,1%) y disuria, balanitis candidiásica y prurito vulvovaginal (10; 1,9%). El desenlace de las 534 RAM fue: recuperado sin secuelas, 55,6%; todavía no recuperado, 14%; no recuperado, 4,9%; mortal, 1,1%, y desconocido, 24,3%.
ConclusionesLa mayoría de las RAM notificadas son infecciones del tracto urogenital, cetoacidosis y daño renal, y aunque las primeras en su mayoría no fueron graves, la cetoacidosis y el daño renal sí lo fueron, generando ingresos y haciendo peligrar la vida de los pacientes, por lo que creemos que ello nos obliga a hacer una prescripción cuidadosa, a consultar las advertencias publicadas por las autoridades sanitarias y notificar cualquier RAM que se sospeche de esta familia terapéutica para su mejor y más completo conocimiento.
To analyse the adverse drug reactions (ADRs) caused by Sodium-glucose Cotransporter-2 Inhibitors (SGLT2i) notified in Spain since they have been on the market.
Material and methodsAn analysis was made of all the notifications registered in the Spanish Pharmacovigilance System of drugs for human use, arising from the use of SGLT2i.
ResultsA total of 311 notifications were recorded, of which 169 (54.34%) were related to dapagliflozin, 81 (26.05%) to empagliflozin, and 61 (19.61%) to canagliflozin. There was a ratio of 52.1% women to 47.9% men. The mean age was 62.07±12.17years. There were 167 (53.7%) notifications were classified as non-serious and 144 (46.3%) as serious. A total of 534 ADRs were notified, with the most common being urinary tract infections in 37 (6.9%) cases, diabetic ketoacidosis in 30 (5.6%), balanoposthitis in 24 (4.5%), ketoacidosis in 16 (3%), vulvovaginal candidiasis in 16 (3%), dizzy spells in 11 (2.1%), and 10 (1.9%) with dysuria, Candida balanitis, and vulvovaginal pruritus. As regards the outcomes of the 534 ADRs, 55.6% recovered with no sequelae, with 14% still recovering, 4.9% not recovered, fatal in 1.1%, and unknown in 24.3%.
ConclusionsThe majority of the ADRs notified are infections of the urogenital tract, ketoacidosis, and kidney damage. Although the majority of the former were not serious, the ketoacidosis and kidney damage were, leading to hospital admission and being life threatening in some patients. For these reasons, it is recommended that they are, prescribed with caution, the warnings published by the health authorities consulted, as well as notify any ADR that is suspected in this therapeutic group, in order to improve and provide us with further knowledge.
La diabetes mellitus tipo 2 (DM2) es una enfermedad crónica que a largo plazo se asocia a complicaciones micro y macrovasculares, las cuales afectan a múltiples órganos, y su prevalencia está en aumento durante las últimas décadas1. El mal control metabólico se asocia a un aumento de las complicaciones y a mortalidad prematura, siendo además la primera causa de ceguera, tratamiento sustitutivo renal (diálisis/trasplante) y amputación no traumática en los países occidentales. El tratamiento precoz y multifactorial retrasa la aparición de complicaciones y mejora la calidad y la esperanza de vida. El abordaje terapéutico de la enfermedad es multidisciplinar e incluye tanto estrategias farmacológicas y no farmacológicas como medidas para la prevención de las comorbilidades y complicaciones a largo plazo.
Desde diciembre de 2013 se encuentra disponible para el tratamiento de la DM2 un nuevo grupo terapéutico, los inhibidores del co-transportador sodio-glucosa tipo2 (iSGLT-2), formado por dapagliflozina2, canagliflozina3 y empagliflozina4. El mecanismo de acción es la inhibición selectiva y reversible del co-transportador sodio-glucosa tipo2 a nivel de túbulo contorneado proximal, lo cual reduce la reabsorción de glucosa a nivel renal, aumentando su eliminación en orina y reduciendo de esta forma la glucemia. La eliminación aumentada de glucosa renal produce una diuresis osmótica y resulta además en una pérdida de calorías, contribuyendo a la reducción de peso corporal, siendo la eficacia dependiente del grado de conservación de la función renal.
Este grupo terapéutico está sujeto por normativa europea a seguimiento adicional (triángulo negro) durante 5años, dado que son nuevos principios activos5.
En los ensayos clínicos participa un número relativamente pequeño de pacientes durante un periodo de tiempo limitado. Los pacientes incluidos en los ensayos clínicos son cuidadosamente seleccionados y son objeto de un seguimiento muy riguroso en condiciones controladas.
En la vida real, el medicamento será utilizado por un grupo de pacientes mucho más amplio y más diverso, que pueden sufrir otras enfermedades y estar tomando otros medicamentos. Ciertas reacciones adversas a medicamentos (RAM) poco frecuentes pueden observarse únicamente cuando un gran número de personas ha utilizado un medicamento durante un tiempo prolongado. Por lo tanto, es vital continuar el seguimiento de la seguridad de todos los medicamentos una vez comercializados.
Cuando un medicamento se comercializa se sigue recogiendo permanentemente información con el fin de vigilar la experiencia real de su uso. Las autoridades sanitarias europeas efectúan un seguimiento riguroso de esta información con el fin de garantizar que los beneficios de los medicamentos siguen siendo superiores a sus riesgos.
La notificación de sospechas de efectos adversos es un instrumento importante para recabar mayor información sobre los medicamentos disponibles en el mercado. Las autoridades sanitarias estudian las notificaciones de efectos adversos junto con toda la información de la que ya disponen para asegurarse de que los beneficios de los medicamentos siguen siendo superiores a sus riesgos y tomar las medidas necesarias en caso necesario.
El presente trabajo tiene como objetivo describir las notificaciones de las reacciones adversas que el grupo terapéutico de los iSGLT-2 ha producido desde su comercialización.
MétodoEstudio de todas las notificaciones que constan en la base de datos del Sistema Español de Farmacovigilancia de medicamentos de uso humano (SEFV-H), denominada FEDRA (Farmacovigilancia Española, Datos de Reacciones Adversas), desde diciembre de 2013 hasta marzo de 2017 derivadas del uso de iSGLT-2.
Se registraron las siguientes variables: edad, sexo, origen de la notificación, signos y síntomas asociados a la RAM, criterios de gravedad, desenlace, tratamiento de la RAM, medicación concomitante, análisis de la secuencia temporal, valoración de la existencia de conocimiento previo de la RAM, efecto de la retirada del medicamento sospechoso, si existió reexposición al medicamento sospechoso y valoración de la existencia de causas alternativas.
ResultadosEn la base de datos FEDRA se han identificado 311 notificaciones en las que constaban 537 sospechas de reacciones adversas a medicamentos (RAM) relacionadas con el consumo de gliflozinas, 307 espontáneas y 4 pertenecientes a algún estudio. De ellas, 169 se relacionaban con el uso de dapagliflozina (54,34%) generando 301 RAM, 81 con empagliflozina (26,05%) generando 132 RAM, y 61 con canagliflozina (19,61%) que contenían 104 RAM.
Las notificaciones fueron realizadas por un médico en 263 casos (79,5%), por un farmacéutico en 59 (17,8%), por otro profesional sanitario en un caso (0,3%) y por usuarios en 8 casos (2,4%).
El rango de edad de los 287 pacientes en los que consta la edad oscila entre 20 y 89años, con una edad media de 62,07±12,176años. En 127 ocasiones (40,8%) el iSGLT-2 se pautó en pacientes con una edad superior a 65años.
En cuanto al sexo, 162 eran mujeres (52,1%), 148 hombres (47,6%) y en un caso no había información (0,3%).
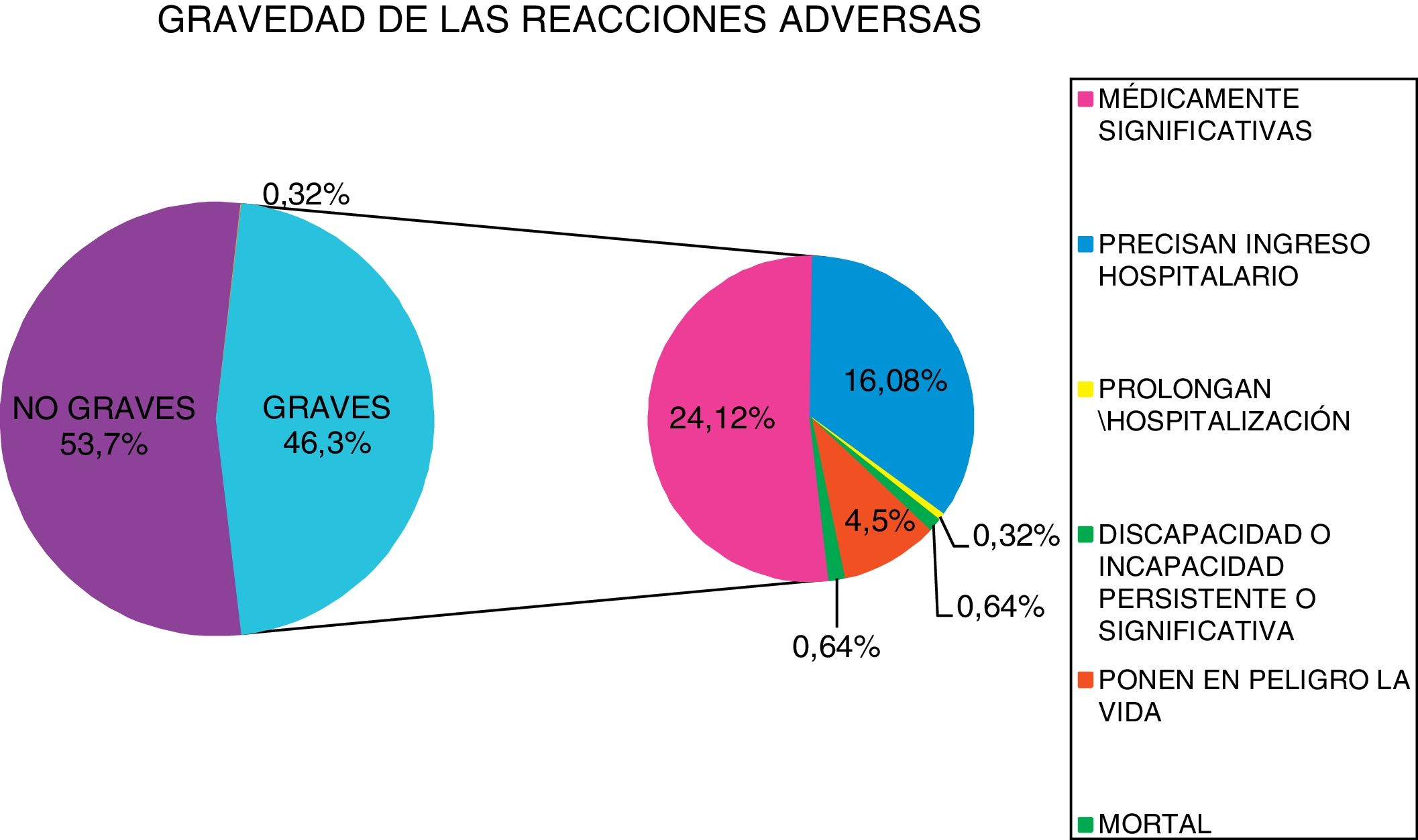
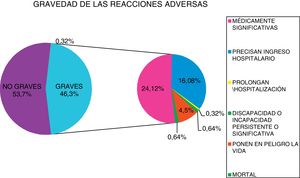
La clasificación de los niveles de gravedad de las 311 notificaciones analizadas se expone en la figura 1.
El análisis pormenorizado de las RAM clasificadas como graves es el siguiente:
- •
Dos casos fueron mortales. El primero fue por una cetoacidosis complicada con encefalopatía y el segundo caso fue por una infección urinaria; en ambos casos el fármaco sospechoso fue dapagliflozina.
- •
Dos casos de incapacidad o lesión irreversible. El primero es una amputación de un pie en un paciente con claudicación intermitente con revascularización previa, en la que el fármaco sospechoso es canagliflozina; el segundo es una pérdida de peso evidente (14kg en 4meses) por empagliflozina que, debido a la falta de masa muscular perdida, le impedía la deambulación. Ambos pacientes presentaban una edad superior a 65años.
- •
Hubo 14 casos en los que la RAM supuso un riesgo para la vida del paciente. Ocho de ellos fueron cetoacidosis (4 por empagliflozina, 3 dapagliflozina y uno canagliflozina), 5 por daño renal tipo insuficiencia renal aguda o necrosis tubular (2 canagliflozina, 2 dapagliflozina y uno empagliflozina) y un edema de lengua por empagliflozina. El 50% de los casos ocurrieron en pacientes mayores de 65años.
- •
RAM graves que provocaron el ingreso del paciente (62 notificaciones). De ellas, en 38 constaba la cetoacidosis como causa de ingreso, en 13 por daño-insuficiencia renal y en 11, notificaciones por infección urinaria. Por sexo fueron 37 en mujeres y 25 en hombres. La edad media de los pacientes ingresados fue de 60,54años, mientras que la edad media de los pacientes cuya RAM no supuso ingreso fue de 62,43años, no encontrándose diferencias estadísticamente significativas mediante la prueba de t de Student (p=0,29).
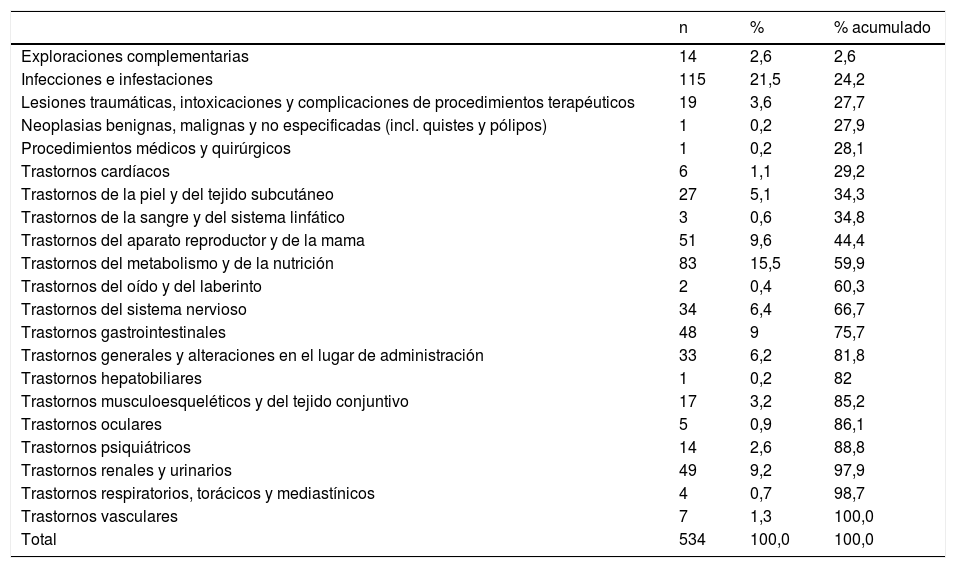
Los 534 signos y síntomas asociados a las 311 notificaciones de reacciones adversas por el consumo de gliflozinas se detallan agrupados por órganos afectados en la tabla 1, y los signos y síntomas más frecuentes, en la tabla 2.
Clasificación de las reacciones adversas medicamentosas por órganos afectados
| n | % | % acumulado | |
|---|---|---|---|
| Exploraciones complementarias | 14 | 2,6 | 2,6 |
| Infecciones e infestaciones | 115 | 21,5 | 24,2 |
| Lesiones traumáticas, intoxicaciones y complicaciones de procedimientos terapéuticos | 19 | 3,6 | 27,7 |
| Neoplasias benignas, malignas y no especificadas (incl. quistes y pólipos) | 1 | 0,2 | 27,9 |
| Procedimientos médicos y quirúrgicos | 1 | 0,2 | 28,1 |
| Trastornos cardíacos | 6 | 1,1 | 29,2 |
| Trastornos de la piel y del tejido subcutáneo | 27 | 5,1 | 34,3 |
| Trastornos de la sangre y del sistema linfático | 3 | 0,6 | 34,8 |
| Trastornos del aparato reproductor y de la mama | 51 | 9,6 | 44,4 |
| Trastornos del metabolismo y de la nutrición | 83 | 15,5 | 59,9 |
| Trastornos del oído y del laberinto | 2 | 0,4 | 60,3 |
| Trastornos del sistema nervioso | 34 | 6,4 | 66,7 |
| Trastornos gastrointestinales | 48 | 9 | 75,7 |
| Trastornos generales y alteraciones en el lugar de administración | 33 | 6,2 | 81,8 |
| Trastornos hepatobiliares | 1 | 0,2 | 82 |
| Trastornos musculoesqueléticos y del tejido conjuntivo | 17 | 3,2 | 85,2 |
| Trastornos oculares | 5 | 0,9 | 86,1 |
| Trastornos psiquiátricos | 14 | 2,6 | 88,8 |
| Trastornos renales y urinarios | 49 | 9,2 | 97,9 |
| Trastornos respiratorios, torácicos y mediastínicos | 4 | 0,7 | 98,7 |
| Trastornos vasculares | 7 | 1,3 | 100,0 |
| Total | 534 | 100,0 | 100,0 |
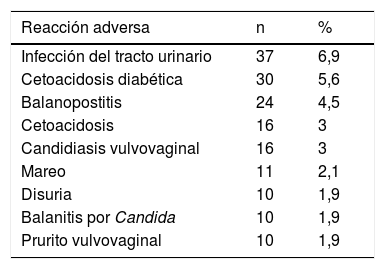
Principales signos y síntomas notificados como reacción adversa
| Reacción adversa | n | % |
|---|---|---|
| Infección del tracto urinario | 37 | 6,9 |
| Cetoacidosis diabética | 30 | 5,6 |
| Balanopostitis | 24 | 4,5 |
| Cetoacidosis | 16 | 3 |
| Candidiasis vulvovaginal | 16 | 3 |
| Mareo | 11 | 2,1 |
| Disuria | 10 | 1,9 |
| Balanitis por Candida | 10 | 1,9 |
| Prurito vulvovaginal | 10 | 1,9 |
Agrupando los 534 signos y síntomas por cuadro clínico, encontramos que las infecciones micóticas suman 110 RAM, los cuadros cetoacidóticos 52 RAM, las infecciones urinarias/renales no micóticas 49 RAM y los trastornos renales, que incluyen alteraciones urinarias no infecciosas y daño renal, 49 RAM.
El desenlace de las 534 reacciones notificadas fue recuperado sin secuelas un 55,6%, todavía no recuperado un 14%, no recuperado un 4,9%, mortal un 1,1% y desconocido en un 24,3%. De las 130 reacciones adversas con desenlace desconocido en el momento de la notificación, 65 (50%) fueron consideradas graves según criterio de gravedad de la Unión Europea, correspondientes 45 de ellas a sintomatología asociada a infecciones, signos o síntomas del tracto urogenital, 10 casos de síntomas o signos relaciones con cuadros de urticaria, 4 casos de hipoglucemia, 3 casos de cetoacidosis, 2 pielonefritis y un cuadro de sepsis de origen urinario.
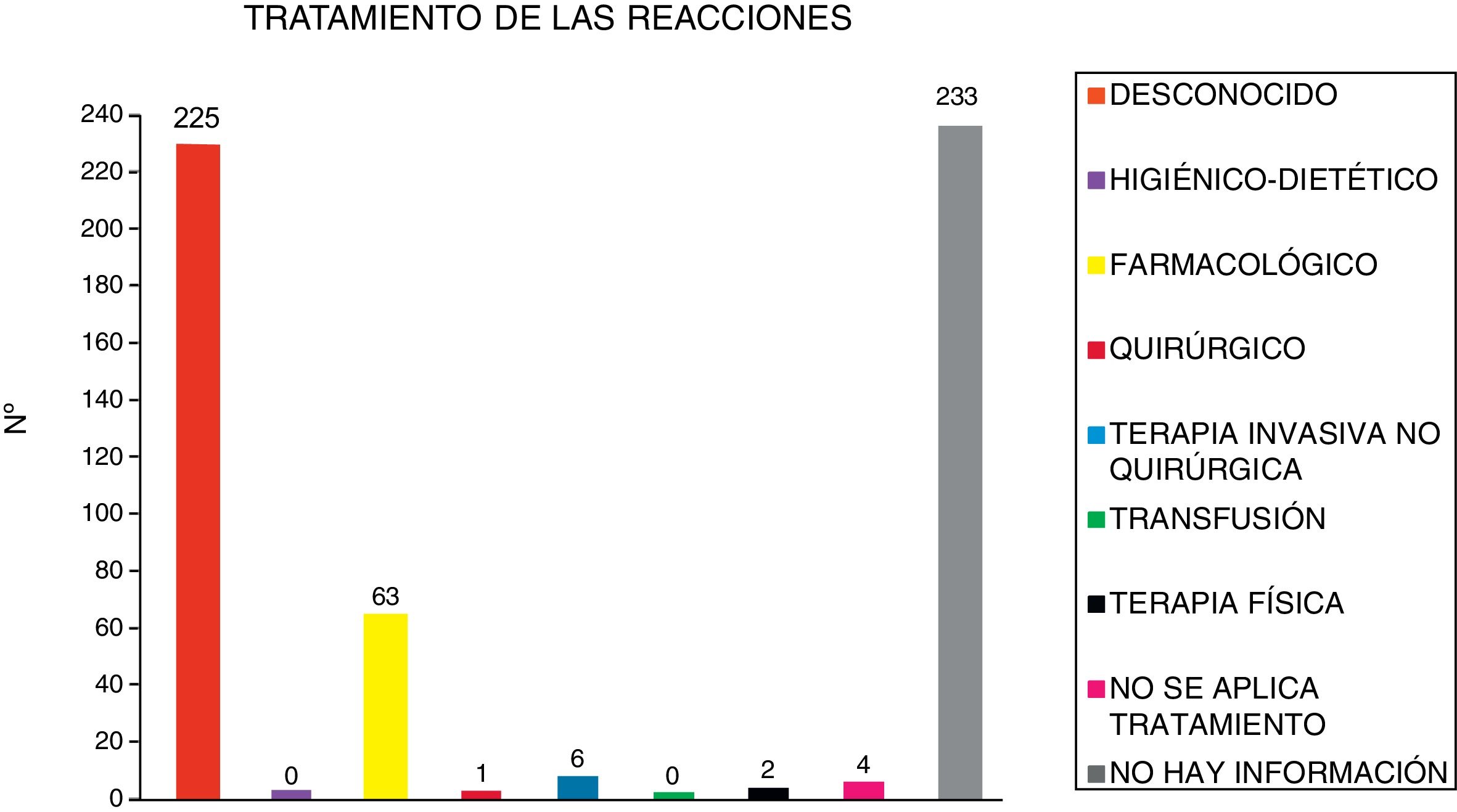
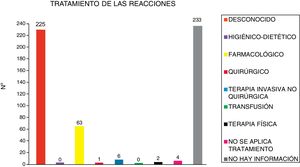
El tratamiento de las 534 reacciones adversas notificadas se expone en la figura 2.
De las 417 RAM notificadas, 414 (99,3%) presentaron una secuencia temporal compatible y 3 (0,7%) fueron compatibles pero no coherentes.
En cuanto al conocimiento previo de las RAM notificadas, 325 (77,9%) eran bien conocidas, 26 (6,2%) eran conocidas en base a referencias ocasionales y 66 (15,8%) eran desconocidas hasta ese momento.
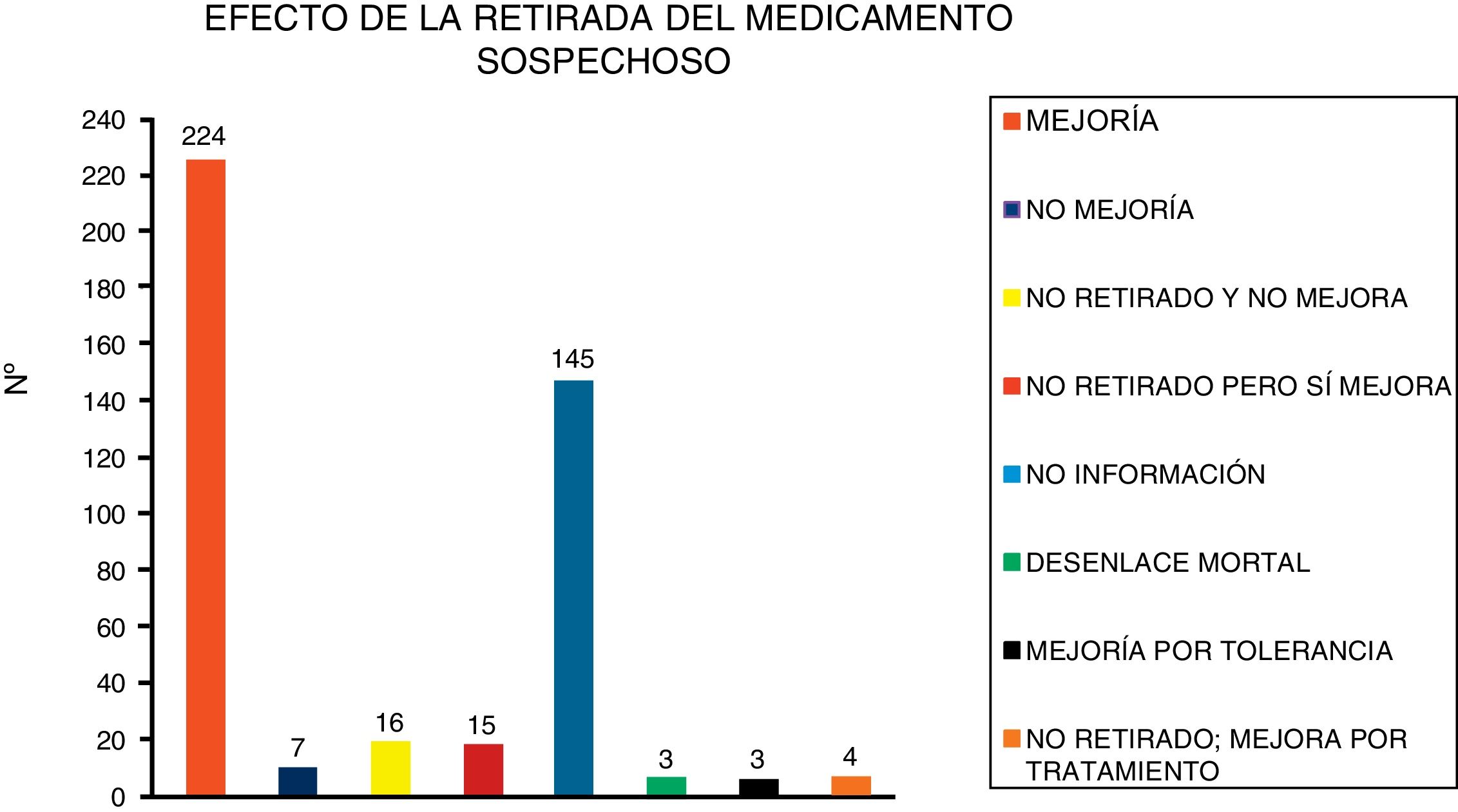
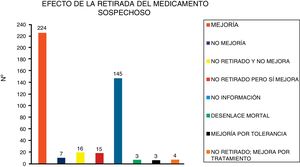
El efecto de la retirada del medicamento sospechoso se muestra en la figura 3.
En cuanto al efecto de la reexposición al medicamento sospechoso, fue positiva en 9 casos (2,2%) —es decir, se repitió la RAM que había sufrido anteriormente—, negativa en un caso (0,2%), no hubo reexposición o no hay información en 402 (96,4%) RAM, en 3 ocasiones la RAM fue mortal o irreversible (0,7%), en un caso (0,2%) hubo una RAM previa similar con un fármaco de otra especialidad y en otro caso (0,2%) hubo una RAM similar pero con un fármaco de las mismas características.
En cuanto a la valoración de causas alternativas, en 4 RAM (1%) existía una explicación alternativa más verosímil, en 45 RAM (10,8%) la explicación alternativa era igual o menos verosímil, en 229 casos (54,9%) no había información disponible y en 139 casos (33,3%) había información suficiente para descartar las causas alternativas.
DiscusiónLos iSGLT-2 tienen un efecto reductor de la glucemia independiente de la insulina, de la resistencia a esta o del nivel de función de la célula beta, por lo que serán eficaces en cualquier etapa de la DM2, desde el inicio de la enfermedad hasta las fases finales. Sin embargo, esta eficacia sí depende de la función renal y, por tanto, se verá reducida en los pacientes con enfermedad renal crónica, y en concreto en los que presenten un filtrado glomerular renal inferior a 60ml/min/1,73m2.
La redGDPS6 recomienda un manejo individualizado de la DM2 guiándose por dos opciones de entrada, bien según el grado de control glucémico, bien según el condicionante clínico predominante, y en base a ellos recomienda el uso de los iSGLT-2 como segundo escalón terapéutico en pacientes con grado2 de obesidad o bien en pacientes con inadecuado control glucémico <8% y 8-10% HbA1C. La guía7 de la American Diabetes Association (ADA) y la European Association for the Study of Diabetes (EASD), tras la prescripción de metformina, recomienda un segundo hipoglucemiante según las características clínicas del pacientes, y la guía8 de la American Association of Clinical Endocrinologists (AACE) y el American College of Endocrinology (ACE) prioriza el uso de uno u otro hipoglucemiante en relación con su eficacia y seguridad. Dado que los iSGLT-2 aparecen muy bien posicionados en las guías y que, a raíz de los resultados de los estudios EMPA-REG OUTCOME9 y del CVD-REAL STUDY10, la prescripción de los iSGLT-2 probablemente aumente, creemos que se hace especialmente importante y necesario garantizar que su uso se acompañe de un grado suficiente de seguridad farmacológica.
En nuestro estudio hemos comprobado que los tres tipos de RAM más frecuentes han sido las infecciones del tracto genitourinario inferior, la cetoacidosis y el daño renal.
Las infecciones del tracto genitourinario inferior, con predominio de las de origen micótico, están descritas en la ficha técnica2-4 y en los ensayos clínicos. En nuestro estudio, de los 159 que sufrieron infección de algún tipo, un paciente falleció por una complicación de una infección urinaria del tracto inferior y 10 pacientes tuvieron que ser ingresados; el resto fueron infecciones no graves con desenlace recuperado. Es cierto que este tipo de infecciones son más frecuentes en pacientes con DM2, en mujeres y principalmente en pre y perimenopáusicas, así como en pacientes obesos y con antecedentes previos de infecciones, por lo que, aunque respondan a antibióticos convencionales y no suelan obligar a suspender el tratamiento11, este hecho debería ser tenido en cuenta, al menos en estos grupos poblacionales, a la hora de prescribir esta familia terapéutica.
Aunque el mecanismo por el que los iSGLT-2 producirían cetoacidosis diabética no está establecido, los datos disponibles sugieren que podría favorecer la aparición de cetosis en situaciones en las que existe una baja reserva insulínica como en la DM1, la DM2 de larga evolución, pacientes con latent autoimmune diabetes in adults (LADA) o bien que coexistan precipitantes de la cetoacidosis como cirugía, ejercicio excesivo, infarto agudo de miocardio, infecciones graves, ayuno prolongado y otras situaciones de estrés físico.
El Comité Europeo de Farmacovigilancia (PRAC)12 ha revisado los datos disponibles sobre el riesgo de cetoacidosis diabética asociada al tratamiento con los iSGLT-2 tras las alertas de 2015 de la U.S. Food and Drug Administration (FDA), de la EMA y de la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) y los posteriores anuncios de la AACE/ACE13. De acuerdo con lo anterior, la AEMPS puntualiza lo ya conocido, que en el caso de detectar acidosis o síntomas relacionados con cetoacidosis se debe suspender el iSGLT-2 y tratar en consecuencia. Es interesante destacar que la preocupación de esta complicación no proviene de los ensayos propios de los laboratorios sino de los casos notificados a Farmacovigilancia. Un cuadro de cetoacidosis generalmente obliga al ingreso del paciente; como hemos visto en nuestro estudio, más del 50% de los ingresos han sido por este motivo, y por lo tanto tendría que ser notificada a priori más que otras RAM más leves. Sin embargo, teniendo en cuenta la notable y conocida infranotificación de reacciones adversas14, los cuadros registrados de cetoacidosis podrían ser solo la punta del iceberg de un problema más frecuente y que creemos que debería ser estudiado más cuidadosamente.
La tercera RAM más frecuente ha sido la afectación renal. Debido al mecanismo de acción de los iSGLT-2 bloqueando la reabsorción tubular de glucosa, se produce secundariamente glucosuria, diuresis osmótica y disminución de la reabsorción proximal de Na+ ligada a glucosa, lo que genera natriuresis y disminución del volumen plasmático. Es decir, al inicio del tratamiento se genera un descenso del filtrado glomerular que se atenúa con el tiempo15,16. Por lo tanto, creemos que hay que ser prudentes en su prescripción en pacientes con enfermedad renal crónica, con insuficiencia cardíaca, cuando se utiliza concomitantemente con diuréticos, IECA, ARA2, antiinflamatorios no esteroideos (AINE) o contrastes yodados. Una vez prescrito, recomendamos evaluar la función renal al iniciar el tratamiento y realizar un seguimiento del mismo, asegurándose además de que existe una hidratación adecuada, fundamentalmente en ancianos frágiles. Estas recomendaciones, hechas igualmente por la FDA17 en junio de 2016 y por Heyman et al.18 en 2017, evitarían el riesgo de daño renal mediante hipoxia o bien por deshidratación, por lo que deberían igualmente ser tenidas en cuenta, y más viendo que más del 40% de los pacientes que han sufrido una RAM en este estudio presentan una edad superior a 65años, que uno de cada 3 pacientes que ha sufrido daño renal que ha motivado ingreso y un 40% de los que peligró su vida por el daño renal presentaban concomitantemente un diurético o un antihipertensivo tipo IECA/ARA2.
Cuantificar el riesgo real o la incidencia de RAM asociadas a la toma de este o de cualquier otro principio activo resulta muy difícil mediante el estudio de las notificaciones de las sospechas de RAM, ya que la infranotificación, según algunos autores19, supera el 90% en diversas series, además de que sería preciso conocer el volumen de envases prescritos en ese intervalo de tiempo.
Casi la mitad de las RAM producidas por el grupo de los iSGLT-2 son de tal gravedad como para generar ingresos, poner en peligro la vida del paciente e incluso ser mortales, como mostramos en este estudio de los casos notificados. La relevancia de estos datos nos obliga a hacer una prescripción cuidadosa, haciendo caso a los consejos que las autoridades sanitarias publican y notificando cualquier RAM que se sospeche de estos nuevos principios activos, de tal forma que así aumente el volumen de información y realizar de este modo un adecuado balance beneficio-riesgo de los iSGLT-2.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo.
Este documento obra en poder del autor de correspondencia.
FinanciaciónNo ha existido financiación para la realización de este trabajo.
Conflicto de interesesEl Dr. Óscar Esteban Jiménez ha realizado talleres docentes sobre el uso de dapagliflozina, empaglifozina y canaglifozina para los laboratorios AstraZeneca, Boehringer y Janssen-Cilag. No existe conflicto de intereses en ninguno de los otros dos firmantes.