En el prólogo de la edición 2008 de este documento de consenso de las sociedades científicas españolas (CESC) se apuntaban para la iniciativa 2 objetivos básicos relacionados entre sí: en primer lugar articular una voz única de todas ellas relativa a toda la evidencia de calidad que sustentaba al «mundo del virus del papiloma humano (VPH)» y, en segundo lugar, dotar a los profesionales de la salud y a las autoridades sanitarias de un instrumento que les ayudara en el proceso asistencial y en el de toma de decisiones. El objetivo final era conseguir que en España se dispusiera de programas preventivos integrales –primarios (vacunación) y secundarios (cribado)– frente al cáncer de cuello de útero (CCU) diseñados adecuadamente y que estos programas alcanzaran coberturas poblacionales lo más amplias posibles, fomentando la equidad y la eficiencia.
El primer documento de consenso fue publicado y difundido en la comunidad científica y médica española1 y fue muy bien acogido internacionalmente. El consenso español obtuvo en cierta manera el rango de «modelo». No obstante, después de transcurridos 3 años, estimamos que la repercusión local no ha sido la esperada. Una discusión de esta afirmación también fue publicada2. En este trabajo se destacaban, entre otras, 2 circunstancias que a nuestro juicio estaban en la raíz de la deficiente aplicación en España de nuestras recomendaciones: apoyo tibio o inexistente por parte de las autoridades sanitarias a las nuevas estrategias, con incorporación muy tímida de ellas a los programas públicos, y persistencia en los profesionales sanitarios de dudas sobre la utilidad real de las nuevas recomendaciones de cribado y de los aspectos capitales de las vacunas frente al VPH (eficacia, seguridad), con una sorprendente gran penetración en sus bases de juicio de las posiciones de los grupos antivacunas. Todo en su conjunto ha generado la situación actual: niveles poco satisfactorios –con algunas excepciones– de coberturas vacunales frente al VPH en las cohortes financiadas por la Sanidad Pública3, muy escasa vacunación en la población diana fuera de la cohorte de niñas adolescentes y persistencia muy mayoritaria de programas oportunistas obsoletos de prevención secundaria del CCU que, además, no han incorporado de forma reglada las nuevas tecnologías basadas en la determinación del ADN del VPH4.
Por todas estas razones y porque desde la publicación del último CESC hemos conocido numerosos nuevos datos que dan un soporte cada vez más sólido a las nuevas estrategias preventivas, hemos considerado oportuno convocar un nuevo CESC, centrarlo en la vacunación frente al VPH y publicar sus conclusiones.
El grupo se ha reunido en 2 sesiones de información y debate, inicial y de cierre, y durante casi un año ha mantenido en la red una intensa circulación de opiniones y aportaciones. Se decidió inicialmente dividir el trabajo en 3 áreas, creándose 3 grupos de trabajo, con composición referenciada en el encabezamiento de cada capítulo de este CESC. Cada uno de los 3 grupos elaboró una propuesta de texto que fue puesta en común en la reunión de cierre y discutida y finalmente aprobada por todo el grupo.
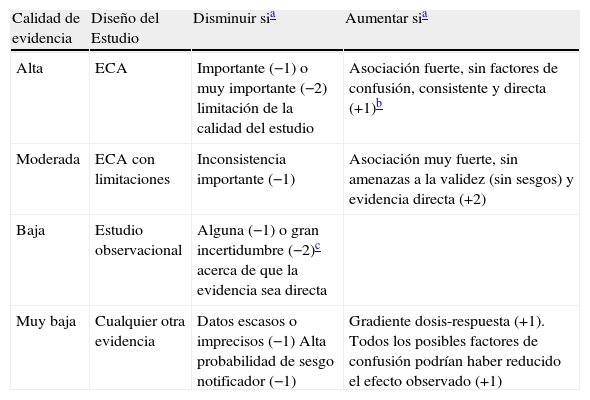
Los datos recogidos en las recientemente actualizadas fichas técnicas (FT) de ambas vacunas han sido la primera fuente de información. Además se ha añadido alguna referencia histórica capital y todas aquellas novedades relevantes que han sido comunicadas y/o publicadas en los últimos tiempos, lógicamente aún no incorporadas por razones temporales a las FT. En el tercer capítulo de «Recomendaciones» se ha usado el sistema GRADE5 (tabla 1) para calificar de forma objetiva la potencia de las recomendaciones formuladas. El nivel de consenso interno alcanzado por el grupo para estas recomendaciones ha sido cualificado utilizando los 3 niveles descritos en la tabla 2 y que se ha tomado de la metodología que usamos en la discusión y publicación de la Oncoguía de la Sociedad Española de Ginecología y Obstetricia (SEGO) para el tratamiento del cáncer de cuello de útero6.
Criterios GRADE para valorar la calidad de la evidencia
| Calidad de evidencia | Diseño del Estudio | Disminuir sia | Aumentar sia |
| Alta | ECA | Importante (−1) o muy importante (−2) limitación de la calidad del estudio | Asociación fuerte, sin factores de confusión, consistente y directa (+1)b |
| Moderada | ECA con limitaciones | Inconsistencia importante (−1) | Asociación muy fuerte, sin amenazas a la validez (sin sesgos) y evidencia directa (+2) |
| Baja | Estudio observacional | Alguna (−1) o gran incertidumbre (−2)c acerca de que la evidencia sea directa | |
| Muy baja | Cualquier otra evidencia | Datos escasos o imprecisos (−1) Alta probabilidad de sesgo notificador (−1) | Gradiente dosis-respuesta (+1). Todos los posibles factores de confusión podrían haber reducido el efecto observado (+1) |
ECA: estudio controlado aleatorizado.
Un riesgo relativo estadísticamente significativo y > 2 (< 0,5), basados en evidencias consistentes en 2 o más estudios observacionales sin factores de confusión plausibles.
Un riesgo relativo estadísticamente significativo > 5 (< 0,2) basado en evidencias directas y sin amenazas importantes de validez.
Tomada de Atkins et al.5.
Metodología para la asignación del consenso interno del grupo
| Categoría E | Estándar | Todo el grupo está de acuerdo |
| Categoría OC | Opción de consenso | La mayoría (90%) está de acuerdo |
| Categoría O | Opción | Discrepancias mayores en la recomendación. |
| Se expresa opción mayoritaria |
Tomada de Cortés6.
Estas han sido las causas y el sistema de trabajo que han conducido a la publicación de este CESC 2011. Todos los que hemos participado en su redacción deseamos que nuestro trabajo sea de verdadera utilidad para nuestros compañeros y para los responsables sanitarios. Las sociedades científicas españolas solo persiguen un objetivo: que la atención médica que reciben los ciudadanos españoles tenga la máxima calidad posible y a ello dedican todo su trabajo. El objetivo final persiste: buenos programas preventivos que alcancen a la mayoría de la población.
Personalmente, como coordinador de este esfuerzo multidisciplinario, quisiera hacer pública mi deuda con todos los compañeros con los que he tenido el privilegio de trabajar en esta iniciativa. Todos han sido un ejemplo de compromiso, de buen hacer, de máximo rigor científico y de impagable amistad. Gracias.
Javier Cortés
Coordinador en representación de la Sociedad Española de Ginecología y Obstetricia
Epidemiología del virus del papiloma humano y volumen de enfermedad relacionadaDr. X. Bosch (ICO) (coordinador), Dr. A. González Martín (SEOM), Dr. L. Olmos (AEDV), Dres. J. Salinas y M. Esteban (AEU).
La etiología tumoral por virus del papiloma humano: un espectro creciente para ambos sexosAlgunos tipos de VPH, particularmente el VPH 16, constituyen un potente grupo de carcinógenos humanos. Cuantitativamente podría tratarse del segundo en frecuencia, después del tabaco. El desarrollo de técnicas sensibles de detección viral y los estudios etiológicos están ampliando el espectro de tumores asociados a estas infecciones.
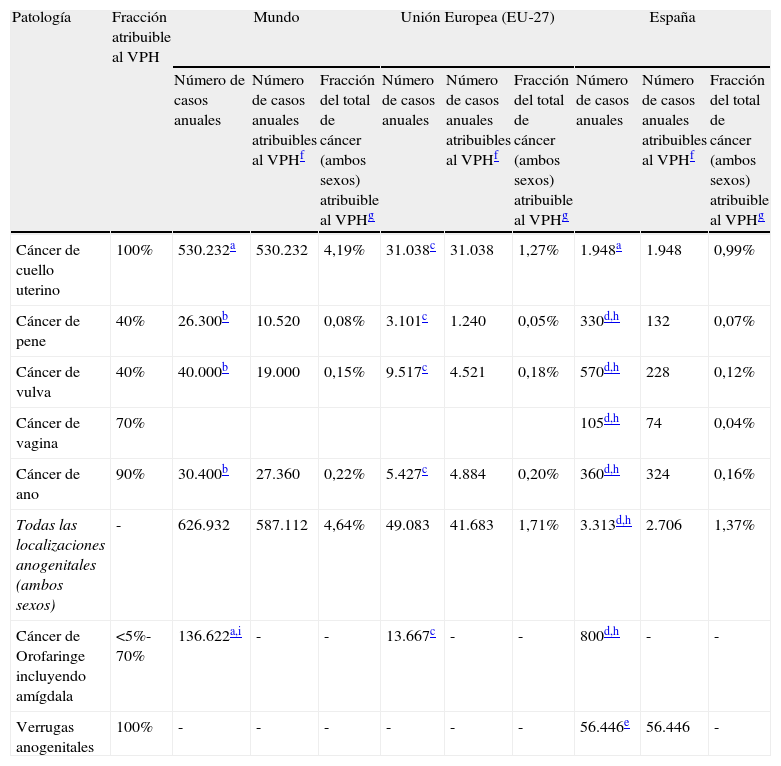
La tabla 3 presenta una estimación del espectro de tumores asociados al VPH para ambos sexos y una estimación del número de casos anuales diagnosticados a escala mundial, europea y española.
Tumores asociados al virus del papiloma humano y estimación cuantitativa para ambos sexos
| Patología | Fracción atribuible al VPH | Mundo | Unión Europea (EU-27) | España | ||||||
| Número de casos anuales | Número de casos anuales atribuibles al VPHf | Fracción del total de cáncer (ambos sexos) atribuible al VPHg | Número de casos anuales | Número de casos anuales atribuibles al VPHf | Fracción del total de cáncer (ambos sexos) atribuible al VPHg | Número de casos anuales | Número de casos anuales atribuibles al VPHf | Fracción del total de cáncer (ambos sexos) atribuible al VPHg | ||
| Cáncer de cuello uterino | 100% | 530.232a | 530.232 | 4,19% | 31.038c | 31.038 | 1,27% | 1.948a | 1.948 | 0,99% |
| Cáncer de pene | 40% | 26.300b | 10.520 | 0,08% | 3.101c | 1.240 | 0,05% | 330d,h | 132 | 0,07% |
| Cáncer de vulva | 40% | 40.000b | 19.000 | 0,15% | 9.517c | 4.521 | 0,18% | 570d,h | 228 | 0,12% |
| Cáncer de vagina | 70% | 105d,h | 74 | 0,04% | ||||||
| Cáncer de ano | 90% | 30.400b | 27.360 | 0,22% | 5.427c | 4.884 | 0,20% | 360d,h | 324 | 0,16% |
| Todas las localizaciones anogenitales (ambos sexos) | - | 626.932 | 587.112 | 4,64% | 49.083 | 41.683 | 1,71% | 3.313d,h | 2.706 | 1,37% |
| Cáncer de Orofaringe incluyendo amígdala | <5%-70% | 136.622a,i | - | - | 13.667c | - | - | 800d,h | - | - |
| Verrugas anogenitales | 100% | - | - | - | - | - | - | 56.446e | 56.446 | - |
Fuentes:
El número de casos anuales atribuibles al VPH es el resultado de aplicar la fracción atribuible al VPH al número de casos anuales. En el caso de agrupar las localizaciones de vulva y vagina, se aplica al 75% de los casos la fracción atribuible al VPH vulvar y al 25% la vaginal.
Porcentaje sobre el total de casos de cáncer (excluyendo cáncer cutáneo no melanomacítico) a partir de las estimaciones de IARC, GLOBOCAN 2008a: 12.662.554 casos nuevos anuales en 2008 en el mundo, 2.444.597 en la Unión Europea y 196.902 en España.
Aproximación basada en el cálculo agrupado de la tasa de incidencia a partir datos procedentes de los registros españoles de Albacete (1998-2001), Asturias (1996-2000), País Vasco (1998-2001), Islas Canarias (1997-2001), Cuenca (1998-2002), Girona (1998-2002), Granada (1998-2002), Murcia (1997-2001), Navarra (1998-2002), Tarragona (1998-2001), Zaragoza (1996-2000) y aplicado a la población española de 2008.
En síntesis, y según esta estimación, el VPH (algunos tipos de VPH pero especialmente el 16) sería responsable de un 5% de todos los tumores humanos. Esta fracción aumentaría a un 10% de todos los tumores de la mujer y a un 15% de todos los tumores de la mujer en países en desarrollo.
Cáncer cervical y virus del papiloma humano: el único modelo de causa necesaria en cánceres humanosLa detección de tipos oncogénicos o de alto riesgo de VPH en muestras de calidad se produce prácticamente en el 100% de los cánceres cervicales. Formalmente ha llegado a cuestionarse la presencia de cánceres cervicales no asociados a VPH. Igualmente, el ADN viral se detecta en la mayoría (70-90%) de las lesiones precursoras o lesiones intraepiteliales de alto grado y, en una menor proporción (20-50%), en las lesiones de bajo grado. La prevalencia en mujeres con citología normal es del 10-12% con una gran variabilidad geográfica y en función de la edad. Los países con mayor riesgo se correlacionan con las áreas de bajo nivel socioeconómico con escasa cobertura de los programas de cribado y las prevalencias de ADN viral en edades jóvenes (hasta 30 años) a menudo duplican o triplican la prevalencia en las edades medias y avanzadas de la vida. La tabla 47,8 muestra los factores epidemiológicos de riesgo para el cáncer cervical.
Factores de riesgo del cáncer cervical
| Medidas indirectas de probabilidad de exposición al VPH | Acción de promotores en la transición de infección por VPH a neoplasia | Sinergia para la infección y progresión |
| Edad precoz de inicio de relaciones | Paridad | VIHInmunodepresión |
| Tipo de pareja/s sexual/es | Tabaco | |
| • Promiscuidad | Contraconceptivos hormonales | |
| Número de parejas | Otras ETS (?) | |
| • Falta de circuncisión |
| Factores de protección |
| Circuncisión masculina en la pareja |
| Utilización de DIU |
| Participación en programas de cribado |
| Participación en programas de vacunación VPH |
La evidencia epidemiológica sobre la causalidad y el carácter de causa necesaria (fracción atribuible del cáncer cervical al VPH cercana al 100%) es generalizada, consistente y universal desde hace prácticamente 2 décadas. La investigación incluye estudios de prevalencia del VPH en cerca de 20.000 casos de carcinoma invasivo en todos los continentes, más de 15 grandes estudios de casos y controles, más de 8 estudios de seguimiento de 5 a 15 años de duración y estudios de intervención tanto secundaria (utilización de la prueba de detección viral en el cribado) como primaria (estudios controlados de vacunación frente a los VPH 16 y 18)9–11.
La observación histórica de la baja incidencia de cáncer cervical en poblaciones donde la circuncisión es generalizada (Israel, Países Árabes) es consistente con la protección frente a la transmisión de VPH en varones circuncidados. Observaciones más recientes han descrito y confirmado el rol protector de la circuncisión masculina en la transmisión del VPH. El efecto protector se extiende a la incidencia de cáncer cervical en parejas de varones circuncidados. El efecto sería más evidente en mujeres casadas con varones promiscuos. En estudios de casos y controles la protección de la mujer asociada a la circuncisión masculina está bien establecida12,13. Esta información, sumada al efecto protector de la circuncisión en la transmisión de VIH en 2 grandes estudios en África, sugiere el interés de la promoción de la circuncisión masculina en las sociedades donde culturalmente la práctica es común o aceptable14,15.
La utilización del dispositivo intrauterino (DIU) como método contraconceptivo ha mostrado también un efecto protector frente al cáncer invasivo (reducción del riesgo cercana al 50%), aunque no frente a la infección por VPH. El análisis incluye una larga serie de estudios de casos y controles y de estudios de prevalencia en más de 20 países. Una posible interpretación del fenómeno sería el impacto inflamatorio local del DIU que estimularía la reacción inmunitaria local aumentando su eficacia en la resolución de las infecciones por VPH16.
Virus del papiloma humano y cáncer de peneEl cáncer de pene muestra marcadores virales en un 40-50% de los casos. Estas estimaciones están en general basadas en estudios con pocos casos, con tecnología de detección viral variable y con frecuente ausencia de controles adecuados. Dada la naturaleza elusiva de las lesiones preneoplásicas de pene, su baja frecuencia y las dificultades para sistematizar las técnicas de recogida de muestras, es poco probable que se organicen en el futuro estudios de tamaño suficiente para evaluar cuantitativamente la implicación del VPH, el rol de los posibles cofactores y los efectos de la vacunación en la prevención de estas lesiones. Buena parte de la evidencia se basará en estudios de prevalencia y de actividad biológica del VPH en lesiones preneoplásicas y en cáncer invasivo17.
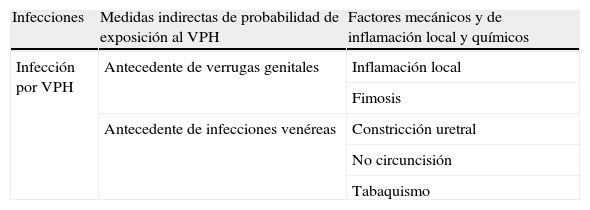
La tabla 518,19 presenta los principales factores de riesgo para el cáncer de pene.
Factores de riesgo para cáncer de pene
| Infecciones | Medidas indirectas de probabilidad de exposición al VPH | Factores mecánicos y de inflamación local y químicos |
| Infección por VPH | Antecedente de verrugas genitales | Inflamación local |
| Fimosis | ||
| Antecedente de infecciones venéreas | Constricción uretral | |
| No circuncisión | ||
| Tabaquismo |
Los agentes etiológicos implicados y el rol exacto de la inflamación persistente, de la fimosis y de la falta de circuncisión no están establecidos. El papel protector de la circuncisión es consistente con los estudios ecológicos que correlacionan incidencias bajas de cáncer de pene y de cuello uterino en países y en subpoblaciones con alta prevalencia de circuncisión masculina (Israel, Países Árabes y otros).
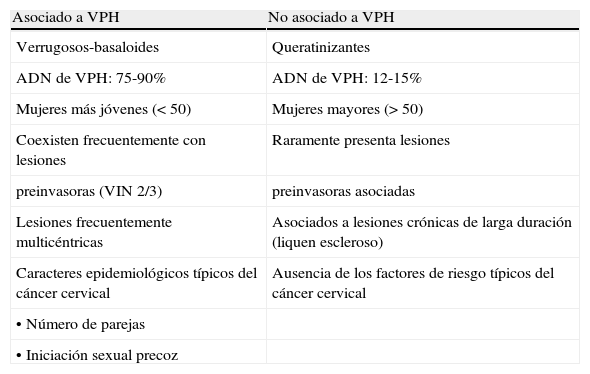
Virus del papiloma humano y cáncer de vulvaLos cánceres de vulva parecen responder a 2 modelos etiológicos con características clínicas, histológicas y epidemiológicas bien diferenciadas según presenten o no marcadores de exposición a VPH (tabla 6). El cáncer de vulva etiológicamente ligado al VPH tiende a presentarse en la mujer menor de 50 años, presenta morfología basaloide o verrugosa, cursa con lesiones coexistentes de neoplasia vulvar intraepitelial (VIN) de alto grado y presentaría los factores de riesgo epidemiológicos característicos del cáncer cervical (promiscuidad sexual, inicio de relaciones sexuales en edades tempranas, antecedentes de otras enfermedades de transmisión sexual y antecedentes de citología anormal). Por el contrario, el cáncer de vulva, independientemente de la infección viral, tiende a presentarse en la mujer mayor de 50 años, está asociado a mutaciones de p53 y cursa con antecedentes de lesiones degenerativas crónicas de larga evolución como el liquen escleroso. Las lesiones de este tipo rara vez coexisten con lesiones VIN. La histología de estos casos corresponde predominantemente al carcinoma escamoso queratinizante. La fracción de casos de cáncer de vulva atribuible al VPH está entre un 30 y un 70% de los casos, con estimaciones recientes del 40-50%20.
Modelos etiológicos en cáncer vulvar
| Asociado a VPH | No asociado a VPH |
| Verrugosos-basaloides | Queratinizantes |
| ADN de VPH: 75-90% | ADN de VPH: 12-15% |
| Mujeres más jóvenes (< 50) | Mujeres mayores (> 50) |
| Coexisten frecuentemente con lesiones | Raramente presenta lesiones |
| preinvasoras (VIN 2/3) | preinvasoras asociadas |
| Lesiones frecuentemente multicéntricas | Asociados a lesiones crónicas de larga duración (liquen escleroso) |
| Caracteres epidemiológicos típicos del cáncer cervical | Ausencia de los factores de riesgo típicos del cáncer cervical |
| • Número de parejas | |
| • Iniciación sexual precoz |
La tabla 611,20 presenta las características de los modelos etiológicos y epidemiológicos del cáncer vulvar.
Virus del papiloma humano y cáncer de vaginaEl cáncer de vagina muestra marcadores virales en un 65-75% de los casos. En general, las lesiones precursoras del cáncer vaginal y vulvar (VIN, VaIN 3) son positivas para el VPH en proporciones mayores que en las lesiones cancerosas (60-80%) lo cual parece indicar que existe regresión espontánea de algunas de las lesiones asociadas a VPH, con o sin apariencias morfológicas de preneoplasia. A pesar de no existir protocolos sistemáticos de prevención del cáncer vulvar y vaginal y por tanto disponer de información muy limitada sobre la incidencia y el pronóstico de estas lesiones, es probable que pueda reproducirse en su manejo el problema de sobrediagnóstico y sobretratamiento que se ha descrito para las neoplasias cervicales de bajo grado (CIN 1) y para una fracción de las de alto grado (CIN 2)20.
Virus del papiloma humano y cáncer de anoEL cáncer anal es una enfermedad poco frecuente pero la incidencia está aumentando en ambos sexos en la población general de algunos países. En los Estados Unidos, el crecimiento estimado es de un 2% anual21.
La presencia de ADN de los tipos fuertemente asociados al desarrollo del cáncer de cuello uterino (VPH 16 y 18) se calcula en cifras superiores al 85% en los tumores del canal anal y las lesiones preneoplásicas (AIN). Esta localización anatómica incluye una región de transición epitelial semejante a la observada en el cuello uterino. La evidencia etiológica es muy importante y tiene unos grupos de estudio muy específicos en la población de varones homosexuales y en pacientes inmunodeprimidos en los que la prevalencia de infecciones, de infecciones por múltiples tipos y de lesiones preneoplásicas del canal anal son muy importantes. Algunas comparaciones basadas en registros de tumores han estimado que la incidencia del cáncer de canal anal en varones homosexuales es semejante a la incidencia estimada para el cáncer de cuello uterino en poblaciones de mujeres no protegidas por programas de cribado establecidos22.
La evidencia del rol del VPH en la génesis de las lesiones anales intraepiteliales ha generado 2 tipos de nuevas opciones preventivas: por un lado, la vacunación y, por otro, el cribado de la lesión en grupos de alto riesgo: varones homosexuales, mujeres con antecedentes de lesiones preneoplásicas atribuidas al VPH (CIN 2 [+]) y en cohortes de pacientes inmunodeprimidos, en particular pacientes con infecciones por el virus de la inmunodeficiencia humana (VIH) y en pacientes con sida.
Inicialmente el cribado se propuso en protocolos de investigación clínica con citología convencional en clínicas específicas para el diagnóstico de lesiones anales. El cribado con detección de VPH parece responder a los mismos parámetros observados en la enfermedad cervical, con sensibilidad significativamente superior y especificidad moderadamente inferior al compararlos con la citología23. Existen pocos estudios en esta dirección y buena parte de estos protocolos corresponden a poblaciones masculinas de alto riesgo, poco extrapolables a la población general.
Virus del papiloma humano y cáncer de cabeza y cuelloEl VPH está también implicado en la etiología de una fracción (entre un 10 y un 35%) de los casos de cáncer de cavidad oral, laringe y orofaringe. La evidencia es cada vez más sólida con respecto a la implicación viral que estaría predominantemente focalizada en los tumores de la amígdala y de la base de la lengua y en general en la región del anillo de Waldeyer en la orofaringe y con menor implicación en los tumores escamosos del resto de la cavidad oral (revisado en Cortés Bordoy et al.1). Estudios de casos y controles han identificado 2 modelos etiológicos en el cáncer de la cavidad oral. El cáncer asociado a VPH que aparecería en individuos más jóvenes estaría ligado al comportamiento sexual y la incidencia estaría equilibrada entre sexos. A este respecto es interesante notar que algunos registros de tumores poblacionales en Estados Unidos y en el norte de Europa están identificando tendencias temporales crecientes en la incidencia de tumores de orofaringe y en la fracción de los casos de orofaringe que incluyen marcadores de exposición al VPH (tabla 724).
Factores de riesgo para el cáncer orofaríngeo asociado al virus del papiloma humano (n = casos 100/controles 200)
| Conductuales | Biomarcadores VPH |
| Número de parejas | Seropositividad a VPH 16 L1 |
| Número de parejas con práctica de sexo oral | Seropositividad a VPH 16 E6 y E7 |
| Parejas ocasionales | Positividad a VPH 16 en cavidad oral |
| Utilización esporádica de condones | Prevalencia de ADN de VPH 16 en tejido tumoral |
En estudios de casos y controles, el cáncer oral asociado a VPH está fuertemente asociado a patrones de comportamiento sexual que incluyan múltiples parejas sexuales y prácticas de sexo oral. De la misma manera, los casos presentan frecuentemente marcadores genéticos y serológicos de exposición al ADN de VPH.
El cáncer de cavidad oral no asociado a VPH aparece típicamente en individuos varones de edades más avanzadas y está fuertemente ligado al consumo de tabaco y alcohol25.
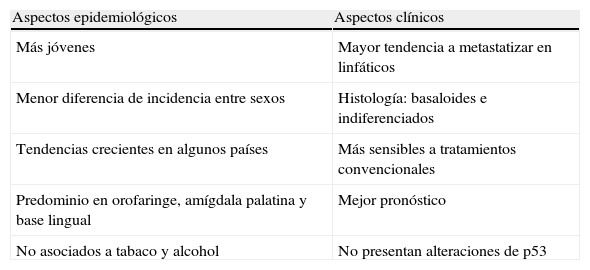
Clínicamente, los tumores de orofaringe asociados al VPH presentan mayor tendencia a la metastatización ganglionar pero responden mejor al tratamiento con quimioterapia/radioterapia y tienen mejor tasa de supervivencia en estudios controlados. Por el contrario, los tumores característicos del consumo de alcohol y tabaco no están asociados al VPH y son típicamente más resistentes a los tratamientos con quimioterapia o radioterapia y a menudo requieren cirugía en primera instancia (tabla 826).
Características de los tumores de cabeza y cuello positivos para virus del papiloma humano comparados con los no asociados a virus del papiloma humano
| Aspectos epidemiológicos | Aspectos clínicos |
| Más jóvenes | Mayor tendencia a metastatizar en linfáticos |
| Menor diferencia de incidencia entre sexos | Histología: basaloides e indiferenciados |
| Tendencias crecientes en algunos países | Más sensibles a tratamientos convencionales |
| Predominio en orofaringe, amígdala palatina y base lingual | Mejor pronóstico |
| No asociados a tabaco y alcohol | No presentan alteraciones de p53 |
La interpretación de esta observación clínica es todavía incierta. La ausencia de alteraciones de p53 en los tumores asociados a VPH indica que la acción de VPH 16 sobre la expresión de p53 es reversible y que la acción de quimioterapia o radioterapia conseguiría limitar la población celular tumoral permitiendo el restablecimiento de la población con p53 intacto. En los tumores inducidos por tabaco y alcohol, las mutaciones inducidas en p53 mantendrían la proliferación celular neoplásica.
Pocos estudios han investigado la interacción entre estos 2 modelos de carcinogénesis (VPH, alcohol y tabaco). Las dificultades para estudiar esta interesante posible interacción radican en la ausencia de conocimiento detallado de la historia natural de la infección oral y en las lesiones preneoplásicas, la baja incidencia de los tumores de la orofaringe y la necesidad de identificar diferentes marcadores de exposición para confirmar la etiología del caso. La presencia de ADN viral sin marcadores asociados de actividad biológica (ARN mensajero y otros) es poco convincente para algunos autores.
Tipos virales y rol preponderante del virus del papiloma humano 16 y del 18 en todos los modelos de carcinogénesisLa historia natural del VPH 16 y 18 y su capacidad oncogénica por encima de los demás tipos de alto riesgo están bien establecidas por, al menos, 4 tipos de estudios:
- 1)
En estudios de prevalencia en población con citología normal, los tipos predominantes son el 16 y el 18 (con algunas excepciones regionales), traduciendo una capacidad superior de transmisión y de persistencia.
- 2)
Los estudios seccionales de prevalencia por tipos a través de los estadios de citología normal (prevalencia de VPH 16: 2-3%), lesiones de alto grado (prevalencia de VPH 16: 20-30%) y cáncer invasivo (prevalencia de VPH 16: 50-55%) muestran el incremento en la frecuencia relativa y traducen la superioridad para persistir y para progresar.
- 3)
Los estudios de seguimiento muestran que la progresión a lesión de alto grado en todos los grupos de edad es muy superior para las infecciones por VPH 16 o 18 que para los demás tipos de alto riesgo. Un caso especial lo constituye el tipo 45, que es raro en población general o en mujeres con citología normal y es todavía raro en las lesiones preneoplásicas pero es el tercero en frecuencia en el carcinoma y en el adenocarcinoma invasivos, lo cual indica que la carcinogénesis por VPH 45 podría presentarse, por lo menos, en algunas ocasiones, sin transitar por los estadios preneoplásicos convencionales o transitando a un ritmo de progresión más acelerado. Esta interpretación es consistente con datos recientes que señalan que los casos asociados al VPH 16, 18 y 45 son más jóvenes (entre 3 y 5 años) que los casos atribuidos a los demás tipos de alto riesgo27.
- 4)
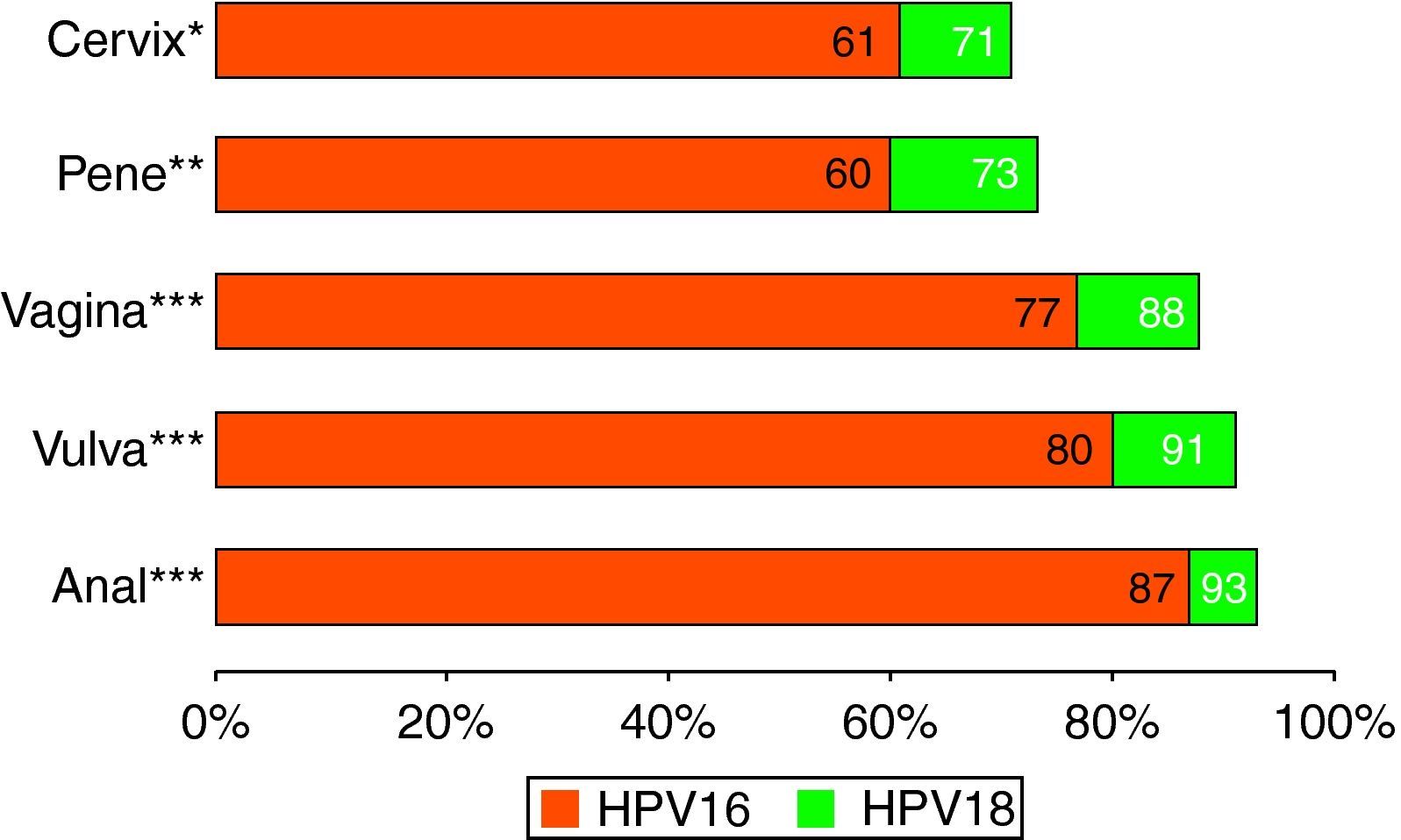
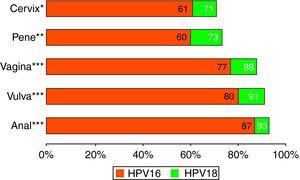
Los tipos virales descritos en las lesiones neoplásicas de órganos menos susceptibles que el cuello uterino muestran frecuencias relativas de VPH 16 muy superiores a las del cérvix. La figura 113,27,28 muestra las contribuciones relativas de 16 y 18 a los casos VPH positivos de diferentes localizaciones tumorales. Claramente, en estos órganos la superioridad oncogénica del VPH 16 y 18 queda bien reflejada. De la misma manera, el impacto potencial relativo de las vacunas en estas lesiones sería más importante.
El 90% de las verrugas genitales (VG) y el 100% de la papilomatosis respiratoria recurrente (PRR) están causados por el virus del papiloma humano (VPH). Los tipos 6 y 11 del VPH causan el 95% de las VG VPH relacionadas y todos los casos de PRR.
El riesgo de aparición de las VG está fuertemente relacionado con la conducta sexual de riesgo. Son muy infecciosas, con una tasa de transmisibilidad de alrededor del 65% entre compañeros sexuales. El periodo de incubación oscila entre 3 semanas y 8 meses, con una media de progresión después de infección de 2,0 meses (0-5,7 años), lo que convierte a las VG en el primer marcador clínico de infección por VPH. En España (tabla 3) se diagnostican alrededor de 57.000 casos al año en la población entre 14 y 64 años, 32.000 en varones y 25.000 en mujeres, con pico entre los 20 y los 29 años29,30. La infección por VPH 6/11 es frecuentemente recidivante y particularmente agresiva en pacientes immunodeprimidos e infectados por el VIH.
La PRR es una enfermedad de prevalencia mal registrada, aunque está establecido un riesgo relativo 200 veces superior en hijos de madres con VG y que 1 de cada 500 recién nacidos de madre con infección VPH del canal del parto la presentará. Puede regresar espontáneamente o ser subclínica durante años (forma juvenil/adulta). Su curso clínico suele ser tórpido, con frecuentes recaídas, que obligan a tratamientos repetidos. Los casos por VPH 11 suelen evolucionar peor31.
ConclusionesEl impacto oncogénico del VPH en ambos sexos continúa creciendo e incluye a todos los tumores del tracto anal, genital y a una fracción, todavía mal cuantificada, de los tumores de la cavidad oral, faringe y laringe. En todos los casos, los tipos virales centrales son el VPH 16 y el 18. El impacto potencial en las cohortes vacunadas podría teóricamente extenderse a todos los cánceres etiológicamente ligados a estas infecciones.
Inmunogenicidad, seguridad, eficacia, efectividad y eficiencia de las vacunas del virus del papiloma humanoDr. R. Cisterna (AMYS) (coordinador), Dra. I. Jimeno (SEMG), Dr. M. Quer (SEORL)
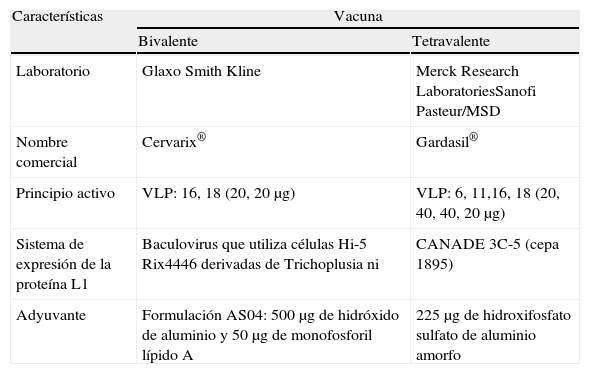
Disponemos de 2 vacunas profilácticas frente al VPH (tabla 9). Estas vacunas están compuestas por partículas semejantes a los virus nativos (VLP). Se trata de estructuras esféricas conformadas a partir de la propiedad de autoensamblaje de la proteína L1, gen estructural inmunógeno mayor de la cápside viral, obtenida por recombinación génica en el laboratorio. Las VLP son morfológica e inmunogénicamente similares a los viriones nativos, pero carecen de capacidad infectiva, replicativa y oncogénica al no poseer ADN viral. Cada VLP está constituido por 72 pentámeros de L132.
Composición de las vacunas frente a virus del papiloma humano
| Características | Vacuna | |
| Bivalente | Tetravalente | |
| Laboratorio | Glaxo Smith Kline | Merck Research LaboratoriesSanofi Pasteur/MSD |
| Nombre comercial | Cervarix® | Gardasil® |
| Principio activo | VLP: 16, 18 (20, 20μg) | VLP: 6, 11,16, 18 (20, 40, 40, 20μg) |
| Sistema de expresión de la proteína L1 | Baculovirus que utiliza células Hi-5 Rix4446 derivadas de Trichoplusia ni | CANADE 3C-5 (cepa 1895) |
| Adyuvante | Formulación AS04: 500μg de hidróxido de aluminio y 50μg de monofosforil lípido A | 225μg de hidroxifosfato sulfato de aluminio amorfo |
No se ha establecido ninguna correlación inmunitaria de eficacia clínica33–35.
La inmunogenicidad de Gardasil® fue evaluada de forma satisfactoria en 20.132 chicas y mujeres de 9 a 26 años de edad, en 5.417 chicos y hombres de 9 a 26 años de edad y en 3.819 mujeres de 24 a 45 años de edad35. Se emplearon inmunoanálisis específicos de tipo, inmunoanálisis competitivo basado en Luminex (cLIA)35.
La inmunogenicidad inducida por 3 dosis de Cervarix® se ha evaluado de forma satisfactoria en 5.303 mujeres de 10 a 55 años de edad34. La respuesta de anticuerpos frente a los VPH 16 VPH fue determinada utilizando un enzimoinmunoanálisis (ELISA) tipo directo específico (versión 2, metodología MedInmune, modificada por GSK) que mostró correlación con ensayos de neutralización de seudovirión (PBNA)34.
En relación con la persistencia de la respuesta inmunitaria, las fichas técnicas de ambas vacunas34,35 recogen los siguientes datos:
- ∘
Gardasil®:
- ∘
En los ensayos de fase III en mujeres de 16 a 26 años, el 90, 95, 98 y 60% de los individuos que recibieron Gardasil® en la población por protocolo de inmunogenicidad fueron seropositivos en el cLIA frente a los VPH 6, 11, 16 y 18, respectivamente, al final del ensayo.
- ∘
En el ensayo de fase III en mujeres de 24 a 45 años, después de un seguimiento medio de 4,0 años, el 91,5; 92,0; 97,4, y 47,9% de los individuos que recibieron Gardasil® en la población por protocolo de inmunogenicidad fueron seropositivos en el cLIA frente a VPH 6, 11, 16 y 18, respectivamente.
- ∘
En el ensayo de fase III en hombres de 16 a 26 años, después de un seguimiento medio de 2,9 años, el 88,9; 94,0; 97,9, y 57,1% de los individuos que recibieron Gardasil® en la población por protocolo de inmunogenicidad fueron seropositivos en el cLIA frente a VPH 6, 11, 16 y 18, respectivamente.
- ∘
- ∘
Cervarix®:
- ∘
En el estudio 023 la respuesta inmunitaria continuó siendo evaluada hasta los 101 meses. Presentaron datos de inmunogenicidad 87 sujetos en el grupo vacunado, con una media de 7,9 años de seguimiento después de la primera dosis. De estos sujetos, el 100% (IC 95%: 95,8-100) permanecían seropositivos para los VPH 16 y 18 por la técnica ELISA, con un valor geométrico medio (geometric mean titers, GMT) de anticuerpos al menos 10 veces mayor que el GMT medido por ELISA observado en mujeres que ya habían aclarado una infección natural por VPH.
- ∘
Ambas vacunas han demostrado generar una elevación rápida e intensa de los valores de anticuerpos (respuesta anamnésica, memoria inmunitaria) después de una dosis adicional intramuscular administrada a los 5 años del inicio de la vacunación en el caso de Gardasil®35 y a los 6,8 años después de la administración de la primera dosis en el caso de Cervarix®34. La memoria inmunitaria es el marcador principal de protección a medio/largo plazo según criterio de la Organización Mundial de la Salud (OMS)5. Gardasil® la genera para los tipos vacunales37 y Cervarix® además para los no vacunales, 31 y 4538.
Existe un ensayo comparativo directo de inmunogenicidad entre ambas vacunas utilizando un mismo sistema de medición de anticuerpos, el test PBNA. Cervarix® ha demostrado generar concentraciones superiores de anticuerpos frente a Gardasil® para los tipos vacunales 16 y 18 en los 3 grupos de edad estudiados, 18-25, 27-35 y 36-45 años en el mes siguiente a la última dosis del esquema vacunal y en el mes 36 postercera dosis. Ambas vacunas muestran similar respuesta inmunitaria celular. El impacto clínico que esta diferencia pueda significar no ha sido aclarado39,40.
Se determinaron en 828 sujetos vacunados con Gardasil® anticuerpos frente a tipos vacunales simultáneamente con cLIA y PBNA en los meses 7/18/24 y 36 posvacunación. Todos los casos negativos por cLIA para anti-VPH18 fueron positivos para PBNA41. Esto explicaría que en las mujeres previamente informadas por cLIA como «negativas» para anticuerpos VPH 1835 (véase el párrafo previo de persistencia de respuesta inmunitaria) se mantuviera a los 4 años de seguimiento la eficacia al 100% frente a la CIN 2 (+)/adenocarcinoma in situ (AIS)42.
Ambas vacunas43,44 están aportando información inicial relativa a posibles esquemas de vacunación alternativos con menor número de dosis. Hasta que los ensayos específicos al respecto que se están iniciando ofrezcan resultados definitivos, la administración de ambas vacunas debe respetar escrupulosamente la pauta establecida de 3 dosis.
EficaciaCervarix®- ∘
Fase III. Fin del estudio.
- ∘
Mujeres de 15 a 25 años.
- •
Población TVC no tratada previamente (incluye a todos los sujetos vacunados, que recibieron al menos 1 dosis de la vacuna, que basalmente tuvieron citología normal, fueron ADN negativos para 14 tipos oncogénicos de VPH y seronegativos para VPH 16 y 18).
- •
Eficacia frente a CIN 3 (+) por tipos vacunales: 100% (IC 95%: 85,5-100).
- •
Eficacia frente a AIS por tipos vacunales: 100% (IC 95%: 31,0-100).
- •
- •
Población TVC (incluye a todos los sujetos vacunados, que recibieron al menos una dosis de la vacuna, recuento de casos a partir del primer día posprimera dosis, cualquier citología en la selección).
- •
Eficacia frente a CIN 3 (+) por tipos vacunales: 45,7% (IC 95%: 22,9-62,2)
- •
Eficacia frente a AIS por tipos vacunales: 76,9% (IC 95%: 16,0-95,8)45
- •
- •
Mujeres ADN (-)/seropositivas para tipos vacunales:
- ∘
Eficacia frente a CIN 2 (+): 88,5% (IC 96,1%: 10,8-99,8)46.
- ∘
- •
Eficacia frente a CIN 2 (+) por tipos no vacunales, población ATP-E (población sin evidencia en el inicio de infección por el tipo de VPH analizado y que ha recibido las 3 dosis de vacuna)
- •
Casos con o sin coinfección por tipos 16 y 18 de VPH:
- ∘
VPH 31: 87,5% (IC 95%: 68,3-96,1).
- ∘
VPH 33: 68,3% (IC 95%: 39,7-84,4).
- ∘
VPH 39: 74,9% (IC 95%: 22,3-93,9).
- ∘
VPH 45: 81,9% (IC 95%: 17,0-98,1).
- ∘
- •
Excluyendo casos coinfectados por tipos 16 y 18 de VPH:
- ∘
VPH 31: 84,3% (IC 95%: 59,5-95,2).
- ∘
VPH 33: 59,4% (IC 95%: 20,5-80,4)47.
- ∘
- •
- •
- ∘
- ∘
Extensión fase II. Cohorte brasileña, 1.113 mujeres de 15-25 años, VPH tipos 16 y 18 ADN (-)/seronegativos y citología normal en el momento de la selección. Seguimiento de 9,4 años. Eficacia frente a:
- •
Infección persistente 12 meses: 100% (IC 95%: 61,4-100).
- •
CIN 1 (+): 100% (IC 95%: 45,2-100),
- •
CIN 2 (+): 100% (IC 95%: −12,8-100)48.
- •
- ∘
Mujeres de 15 a 25 años. En un seguimiento de al menos 60 días, la odds ratio (OR) de presentar CIN 2 (+) (CIN 2, CIN 3, AIS o cáncer invasivo) poscirugía por CIN 2 (+) fue de 0,24 (0,01-1,32) en las mujeres vacunadas (190) y de 2,01 (0,92-3,81) en las no vacunadas (264), lo que representa una eficacia frente a CIN 2 (+) independientemente del tipo de VPH del 88,2% (IC 95%: 14,8-99,7)49.
- ∘
Mujeres mayores de 26 años. 4 años de seguimiento. Población ATP.
- •
Eficacia frente a CIN1 (+) independientemente del estado serológico basal: 91,1% (IC 95%: 25,4-99,9).
- •
Eficacia en análisis combinado frente a infección persistente a 6 meses/CIN 1 (+): 81,1% (IC 97,7%: 52,1-94,0).
- •
Protección cruzada: eficacia frente a infección persistente a 6 meses por VPH 31/45: 77,6% (IC 95%: 45,4-92,3)50.
- •
- ∘
Mujeres 15-25 años. Seguimiento medio 47,4 meses para TVC (incluye a todos los sujetos vacunados que recibieron al menos una dosis de vacuna independientemente de su estado de ADN para VPH, citología y estado serológico basal).
- •
Eficacia frente a neoplasia intraepitelial de vagina (VaIN)/neoplasia intraepitelial de vulva (VIN) 1 (+) por tipos vacunales:
- •
Población ATP: 75,1% (IC 95%: 22,9-94,0).
- •
Población TVC: 73,1% (IC 95%: 36,3-90,1)51.
- •
- •
- ∘
Cohorte de Guanacaste. Eficacia frente a infección persistente anal VPH 16 y 18 determinada por una toma de ADN/VPH anal al final del seguimiento en mujeres de 15-25 años. Cuatro años de seguimiento postercera dosis.
- •
Mujeres VPH no tratadas previamente: 83,6% (IC 95%: 66,7-92,8)
- •
Todas las mujeres: 62,0% (IC 95%: 47,1-73,1)52.
- •
- ∘
Fase III. Fin del estudio
- ∘
Mujeres de 16 a 26 años, población por protocolo (PP) (3 vacunaciones en un año desde la selección, ninguna desviación mayor del protocolo y sin haber recibido tratamiento previamente al/los tipo(s) del VPH relevante(s) antes de la dosis 1 y durante un mes después de la dosis 3 (mes 7). La eficacia se midió a partir de la visita del mes 7). Eficacia por tipos vacunales frente a:
- •
CIN 2:100% (IC 95%: 94,7-100).
- •
CIN 3:96,8% (IC 95%: 88,1-99,6).
- •
AIS:100% (IC 95%: 30,9-100).
- •
VaIN 2/3:100% (IC 95%: 55,4-100).
- •
VIN 2/3:100% (IC 95%: 67,2-100).
- •
VG:99% (IC 95%: 96-100)53,54.
- •
- ∘
Mujeres 16-26 años ADN–/seropositivo para tipos vacunales. Eficacia:
- •
CIN 2/3, VIN-VaIN y VG: 100% (IC 95%: 62,8-100)35.
- •
- ∘
Mujeres de 16-26 años. Análisis en mujeres ADN (–) a 14 tipos de VPH/AR el día 0. Eficacia frente a CIN 2 (+) por tipos no vacunales:
- •
VPH 31:70% (IC 95%: 32-88).
- •
VPH 31,45:59% (IC 95%: 14-82).
- •
VPH 31, 33, 45, 52, 58: 33% (IC 95%: 0,3-55)55.
- •
- ∘
- ∘
En la extensión del seguimiento de la fase III a 7 años no aparece en las cohortes vacunadas ningún caso de CIN, VIN o VaIN asociado a los tipos vacunales 6, 11, 16, 1856.
- ∘
Después del tratamiento.
- ∘
Después del tratamiento cervical definitivo: reducción del riesgo de recidiva y/o segunda lesión:
- •
Por cualquier tipo de VPH:47% (IC 95%: 17-66).
- •
Por tipos vacunales de VPH:74% (IC 95%: < 0-97).
- •
- ∘
Después de tratamiento por VIN/VaIN/VG: reducción del riesgo de recidiva y/o segunda lesión:
- •
Por cualquier tipo de VPH:44% (IC 95%: 14-64).
- •
Por tipos vacunales de VPH: 79% (IC 95%: 53-92)57.
- •
- ∘
- ∘
Mujeres de 24-45 años con una media de seguimiento de 4 años. Fin del estudio. Eficacia frente a incidencia combinada de infección persistente, CIN y LGE (incluye verrugas, VIN y VaIN) relacionados con tipos vacunales.
- •
PP:88,7% (IC 95%: 78.1, 94.8).
- •
Población ITT (mujeres independientemente de su estado basal de VPH en el día 1, que recibieron al menos una dosis de la vacuna y en las cuales el recuento de casos comenzó un mes después de la primera dosis):66,9% (IC 95%: 4,3, y 90,6)58.
- •
- •
Hombres heterosexuales de 16-26 años. Seguimiento de 2,5 años. Resultados en PP:
- ∘
Eficacia frente a lesiones genitales externas (incluye VG y neoplasia intraepitelial de pene): 90,4% (IC 95%: 69,2-98,1)59.
- ∘
- •
Hombres homosexuales de 16-26 años. Tres años de seguimiento. Resultados en PP:
- ∘
Eficacia frente a VG: 100% (IC 95%: 8,2-100).
- ∘
Eficacia frente a neoplasia intraepitelial del ano (AIN) tipo 1 (+): 77,5% (IC 95%: 39,6-93,3).
- ∘
Reducción del riesgo de infección persistente por tipos vacunales: 94,9 (IC 95%: 80,4-99,4)60.
- ∘
- •
Eficacia en prevenir el riesgo de recidiva en hombres homosexuales tratados de AIN 3: 46,3% (IC 95%: 19,1-64,4), con un riesgo equivalente de recidiva en vacunados de 0,53 (0,36-0,81). Edad media: 38 años. Seguimiento medio: 489 días61.
- ∘
En 1.781 hombres y mujeres con VPH no tratados previamente de 16-19 años no se ha diagnosticado ningún caso de enfermedad por VPH asociada a los 4 tipos vacunales a los 6 años de seguimiento posvacunación con Gardasil®62.
- ∘
Indicios consistentes de eficacia en la reducción de recidivas y/o segundas cirugías (73%) en un número limitado de pacientes operados por papilomatosis respiratoria recurrente y vacunados con Gardasil®63,64.
El programa público australiano de vacunación con Gardasil® iniciado en abril de 2007 y financiado en mujeres hasta los 26 años, que ha alcanzado en una tercera dosis una cobertura del 70%, ha publicado datos muy relevantes de impacto en la población general, en especial en lo relativo a VG, con predicción de «desaparición» en la población vacunada65. Comparando los datos de 2007/2008 con los de 2010/2011, las consultas por VG se redujeron en mujeres menores de 21 años desde un 18,6% a un 1,9% y en hombres heterosexuales menores de 21 años de un 22,9% a un 2,9% (inmunidad de grupo). No se registró descenso significativo en mujeres de 30 años o más (OR 0,97; IC 95%: 0,84-1,12), hombres heterosexuales de 30 años o más (OR 0,97; IC 95%: 0,89-1,06) u hombres homosexuales (OR 0,95; IC 95%: 0,85-1,07). Además, se observó un descenso significativo, 0,38 (IC 95%: 0,61-0,16) de resultados citológicos de lesión de alto grado en mujeres de menos de 18 años e indicios de reducción en mujeres hasta 20 años66.
SeguridadDespués de que las vacunas frente al VPH superaran en las fases I, II y III de sus ensayos clínicos los controles de seguridad planteados por la OMS, los más altos nunca exigidos a una vacuna36, el control de seguridad sigue siendo muy riguroso en la fase actual de aplicación clínica, con alrededor de 120 millones de dosis distribuidas en todo el mundo de ambas vacunas, con mecanismos de farmacovigilancia permanentes muy activos tutelados por las principales agencias reguladoras internacionales y por las autoridades sanitarias de cada país donde la vacuna es utilizada. Un seguimiento online de este proceso puede hacerse entre otras en las siguientes páginas web:
- •
Agencia Española de Medicamentos y Productos Sanitarios.
- •
National Health Service.
http://www.nhs.uk/conditions/hpv-vaccination/pages/safety.aspx
- •
Agencia Europea del Medicamento (EMEA).
- •
CDC & FDA.
http://www.fda.gov/BiologicalsBloodVaccines/SafetyAvailability/VaccineSafety
- •
World Health Organization. http://www.who.int/immunization/documents/positionpapers/en/index.html
Las reacciones adversas más frecuentes se dieron en el lugar de inyección y fueron transitorias y de intensidad leve o moderada. Ningún acontecimiento adverso sistémico grave ha sido relacionado causalmente con la vacunación. Este perfil de seguridad se ha observado también en mujeres hasta 45 años58 y en hombres59 vacunados con Gardasil®. Se ha publicado una estimación de alta seguridad para Cervarix® en mujeres hasta 55 años67. El detalle exhaustivo de los acontecimientos adversos registrados durante los ensayos clínicos y el seguimiento poscomercialización de ambas vacunas puede ser consultado en las respectivas fichas técnicas (FT)34,35.
En las mujeres vacunadas con Gardasil® y con Cervarix® que quedaron embarazadas durante el desarrollo clínico de la vacuna, no se observó una mayor proporción de resultados adversos en comparación con los observados en las embarazadas del grupo control68,69. Sin embargo, no se dispone de suficientes datos para indicar la vacunación durante el embarazo, y es recomendable evitar el embarazo hasta un mes después de la tercera dosis. Además, en caso de resultar embarazada con la vacunación ya iniciada, es aconsejable retrasar las dosis siguientes hasta la finalización del embarazo si el esquema global de vacunación a 3 dosis en un año puede ser respetado, o reiniciar la vacunación después del parto68,69.
La administración durante el periodo de lactancia se ha evaluado específicamente para Gardasil®35, no observándose reacciones adversas ni en la madre ni en el lactante, ni interferencias en su inmunogenicidad, por lo que puede ser administrada durante la lactancia. Los beneficios de aplicación de Cervarix® durante la lactancia deben superar los posibles riesgos34.
Una revisión exhaustiva de todos los informes de seguridad emitidos por las principales agencias nacionales e internacionales concluye que la vacunación del VPH ofrece un óptimo perfil de seguridad70.
El seguimiento a largo plazo de las cohortes vacunadas48,56 ha confirmado la ausencia de acontecimientos adversos graves relacionados causalmente con la vacunación.
La OMS no ha modificado su criterio ya expresado de apoyar estas conclusiones71.
Una actualización de todo lo relativo a seguridad de las vacunas en general, incluyendo vacunas VPH, ha sido publicada muy recientemente por integrantes del Observatorio Español para el Estudio de las Vacunas72.
EficienciaLa OMS ha establecido que la vacunación VPH combinada con un cribado rediseñado es la estrategia más eficiente, en cualquier escenario, para la prevención del cáncer de cuello de útero73. La discusión actual se centra en cómo la nueva carga de enfermedad asociada a VPH va a modificar la metodología de los modelos de eficiencia y sus conclusiones, especialmente cuando se estudia la incorporación de varones a los programas de la vacunación del VPH, teniendo en cuenta que el precio de la vacuna sigue siendo la principal variable vinculada al coste/beneficio. La información más actual, que no considera la nueva carga de enfermedad asociada al VPH en varones, confirma el criterio establecido de que con coberturas altas en mujeres (> 70%) y dada la inmunidad de rebaño previsible −ya demostrada inicialmente en Australia65− vacunar a varones aportaría pequeños beneficios74,75. Pero, por otro lado, asunciones bien basadas en las nuevas evidencias de causalidad del VPH para algunos tumores, fundamentalmente de ano y boca/faringe/laringe, indican que la vacunación a varones podría llegar a ser eficiente76–78.
Indicaciones y recomendaciones de la vacunación frente al virus del papiloma humanoDr. Javier Cortés (SEGO) (coordinador), Dr. Javier Cerdán (AECP), Dr. David Moreno-Pérez (AEP), Dra. Esther Redondo (SEMERGEN).
IndicacionesLas indicaciones de ambas vacunas están recogidas en sus respectivas fichas técnicas (FT), actualizadas ambas por la Agencia Europea del Medicamento (EMA) en el mes de agosto del año 201179,80.
Las indicaciones son las siguientes:
Vacuna bivalente (Cervarix®, Glaxo Smith Kline):
- •
Es una vacuna indicada79 para la prevención de lesiones premalignas y del cáncer del cuello uterino relacionadas causalmente con ciertos tipos oncogénicos del VPH.
- •
La indicación está basada en la demostración de la eficacia en mujeres de 15 a 25 años de edad después de la vacunación con Cervarix® y de la inmunogenicidad de la vacuna en niñas y mujeres de 10 a 25 años de edad.
Vacuna tetravalente (Gardasil®, Sanofi Pasteur MSD):
- •
Es una vacuna indicada80 en mujeres y hombres a partir de los 9 años de edad para la prevención de:
- -
Lesiones genitales precancerosas (cervicales, vulvares y vaginales) y cáncer cervical relacionados causalmente con ciertos tipos oncogénicos del VPH.
- -
VG (condiloma acuminado) relacionadas causalmente con tipos específicos del VPH.
- -
- •
La indicación está basada en la demostración de la eficacia de Gardasil® en mujeres de 16 a 45 años de edad y en hombres de 16 a 26 años de edad y en la demostración de la inmunogenicidad de Gardasil® en niños/niñas y adolescentes de 9 a 15 años de edad.
En Estados Unidos (EE. UU.), el 22 de diciembre de 2010, la Food and Drug Administration (FDA) amplió la indicación de Gardasil®81 para la prevención de cáncer anal causado por los VPH 16 y 18, así como la prevención de AIN de cualquier grado causada por los VPH 6, 11, 16 y 18 en hombres y mujeres de 9 a 26 años de edad. El 27 de octubre de 2011 el Advisory Committee for Immunization Practices (ACIP) del Center for Disease Control and Prevention (CDC) de EE. UU. ha establecido la recomendación del uso de Gardasil® para la prevención de VG, lesiones precancerosas anales y cáncer anal de forma sistemática en varones de 11-12 años y ha recomendado su administración en varones de 13 a 21 años no vacunados previamente o que no hubieran completado la pauta de 3 dosis. Se recuerda que la vacunación está autorizada en varones a partir de los 9 años de edad y hasta los 26, según criterio médico82.
La EMA en la actualización de la FT de Gardasil® de agosto 201180 ha aprobado su indicación para la prevención de VG en varones de 9 a 26 años y ha incluido los resultados de los estudios de eficacia en la prevención del cáncer anal.
Debe recordarse que:
- •
Ambas vacunas tienen una indicación exclusivamente profiláctica, sin efecto terapéutico sobre cualquier enfermedad causada por VPH.
- •
Es necesario que el esquema de vacunación con 3 dosis (meses 0, 1 y 6 para Cervarix®, meses 0, 2 y 6 para Gardasil®) sea respetado para garantizar la máxima eficacia vacunal, con estas particularidades:
- ∘
Cervarix®: en el caso de que se requiera flexibilidad en el esquema de vacunación, se puede administrar la segunda dosis entre 1 y 2,5 meses después de la primera dosis y la tercera dosis entre 5 y 12 meses después de la primera dosis79.
- ∘
Gardasil®: si es necesario un régimen de vacunación alternativo, la segunda dosis debe ser administrada al menos un mes después de la primera dosis y la tercera dosis debe ser administrada al menos 3 meses después de la segunda dosis. Las 3 dosis deben ser administradas dentro de un periodo de un año80.
- ∘
- •
Ambas vacunas han demostrado su compatibilidad, es decir, ausencia de interferencias en el perfil de inmunogenicidad y seguridad vacunal, cuando son coadministradas en un lugar de inyección diferente con las vacunas de hepatitis A y B, poliomielitis, difteria, tétanos y tos ferina79,80. También se ha demostrado compatibilidad de ambas vacunas con la vacuna tetravalente antimeningocócica y con la vacuna Tdpa de baja carga antigénica83–86.
- •
No se recomienda su administración en embarazadas.
- •
Como en todo acto de vacunación, debe mantenerse un periodo de observación de al menos 15 min después de la administración de la vacuna.
- •
No hay datos que documenten la intercambiabilidad entre ambas vacunas, por lo que no se recomienda esta práctica.
- •
Otras limitaciones de su administración (individuos inmunodeprimidos) pueden ser consultadas en las FT79,80.
- •
Las mujeres vacunadas deben continuar con su programa de prevención secundaria del cáncer de cuello de útero, rediseñado según recomendaciones específicas87.
Dos escenarios de aplicación clínica de la vacunación frente al VPH, y de las vacunas en general, son posibles:
- 1.
Práctica asistencial. La atención en la consulta de un profesional sanitario está dirigida prioritariamente a ofrecer una asistencia eficaz a la persona que es asistida y que garantice, a nivel individual, la mejor oferta de salud, dentro de los límites que las evidencias disponibles delimitan y la buena práctica aconseja.
- 2.
Salud pública. Desde esta perspectiva, los criterios de eficiencia, entre otros, presiden las actuaciones. El coste/beneficio de una vacunación debe estar garantizado para que su inclusión en un programa público de vacunación pueda ser justificado y sostenido.
Puede concluirse que en el ejercicio diario de la asistencia médica, la eficacia es el objetivo y en la planificación de las estrategias de salud pública lo es la eficiencia. Las vacunas pueden contar con recomendaciones diferentes a tener en cuenta según el nivel en el que se esté trabajando: que una vacuna no esté en las recomendaciones públicas no significa que no pueda ser recomendada en la práctica clínica diaria.
La sólida recomendación del profesional sanitario88, centrada en la seguridad y la eficacia de las vacunas −las dos cuestiones de máximo interés por parte de las personas que recaban información vacunal89−, es la variable que más influye, con diferencia notable, en la decisión de estás personas para ser vacunadas. Además es necesario que mejoren los niveles de información y conocimiento sobre la carga de enfermedad relacionada con el VPH, en especial en varones90. Es probable que toda está actuación proactiva de recomendación no se realice en España de forma muy adecuada, perfil asistencial que debería ser corregido91.
Tomando todo esto en consideración, este grupo español de consenso, habiendo analizado la calidad de la evidencia de los estudios existentes hasta la fecha (noviembre de 2011) y la fuerza de la recomendación derivada (metodología GRADE)5, establece, con el grado de consenso interno expresado según niveles, las siguientes recomendaciones acerca de la vacunación frente al VPH en nuestro medio:
- 1.
Mujeres:
- •
Vacunación sistemática de todas las mujeres preadolescentes o adolescentes entre 9 y 14 años, independientemente de su actividad sexual (calidad de la evidencia A, recomendación fuerte a favor, consenso interno E).
- •
Recomendación de vacunación para todas las mujeres hasta los 26 años, independientemente de su actividad sexual (calidad de la evidencia A, recomendación fuerte a favor, consenso interno E).
- •
Valoración individualizada de vacunación a mujeres de más de 26 años (calidad de la evidencia B, recomendación débil a favor, consenso interno E).
- •
Recomendación de vacunación a mujeres después de tratamiento de lesiones intraepiteliales de cuello de útero, vagina y vulva o de verrugas genitales (calidad de la evidencia B, recomendación fuerte a favor, consenso interno E).
El cribado citológico y/o virológico no es una condición previa para la decisión de vacunar. No obstante, debe garantizarse que la mujer está siguiendo adecuadamente su protocolo de cribado (calidad de la evidencia A, recomendación fuerte a favor, consenso interno E).
La vacunación de mujeres hasta 26 años, con máxima prioridad en el grupo etario de 9 a 14 años, combinada con un cribado rediseñado, es muy eficiente en cualquier escenario epidemiológico6,92 y debe ser considerada una estrategia prioritaria de prevención oncológica. De su alta cobertura dependerá decisivamente que puedan conseguirse a medio plazo disminuciones de la incidencia, la morbilidad y la mortalidad provocadas por las enfermedades relacionadas con el VPH.
- •
- 2.
Hombres:
- •
Valoración individualizada de vacunación con Gardasil® de varones de 9 a 26 años de edad para la prevención de verrugas genitales (calidad de la evidencia B, recomendación débil a favor, consenso interno O).
- •
Recomendación de vacunación con Gardasil® de varones de 9 a 26 años de edad para la prevención de neoplasia anal (calidad de la evidencia D, recomendación débil a favor, consenso interno E).
- •
XB ha recibido de GSK y SPMSD honorarios por conferencias y asesorías, bolsas de viaje y becas de investigación.
RC ha recibido de GSK y SPMSD honorarios por conferencias, bolsas de viaje y becas de investigación y honorarios por asesorías de SPMSD.
DM-P ha recibido de GSK y SPMSD honorarios por conferencias y bolsas de viaje y becas de investigación de GSK.
ER ha recibido bolsas de viaje de GSK y SPMSD, honorarios por conferencias de SPMSD y becas de investigación de GSK.
JCO ha recibido honorarios por conferencias y bolsas de viaje de GSK y SPMSD y honorarios por asesorías de SPMSD.
- •
El Grupo de Consenso agradece a Sanofi Pasteur MSD el apoyo logístico brindado que ha hecho posible la redacción de este Documento. Sanofi Pasteur MSD no ha intervenido en su redacción.
- •
Ningún miembro del Grupo ha recibido honorarios por su participación en el trabajo de discusión y redacción de este Consenso 2011.
Asociación Española de Coloproctología (AECP): Dr. Javier Cerdán.
Asociación de Microbiología y Salud (AMYS): Dr. Ramón Cisterna.
Asociación Española de Pediatría (AEP), Comité Asesor de Vacunas: Dr. David Moreno-Pérez.
Asociación Española de Urología (AEU): Dres. Manuel Esteban y Jesús Salinas.
Sociedad Española de Ginecología y Obstetricia (SEGO): Dr. Javier Cortés.
Sociedad Española de Médicos de Atención Primaria (SEMERGEN): Dra. Esther Redondo.
Sociedad Española de Médicos Generales y de Familia (SEMG): Dra. Isabel Jimeno Sanz.
Sociedad Española de Oncología Médica (SEOM): Dr. Antonio González Martín.
Sociedad Española de Otorrinolaringología y Patología Cérvicofacial (SEORL): Dr. Miquel Quer.
Con la participación y la adhesión de:
Servicio de Epidemiología. Institut Català d’Oncologia (ICO): Dr. Xavier Bosch.
Información sobre el grupo de consenso y las sociedades participantes en el anexo al final del artículo.