A pesar de los grandes avances que durante los últimos 20años se han ido produciendo en los tratamientos de reproducción asistida, y en especial en los laboratorios de fecundación in vitro (FIV), pocos aspectos han cambiado en cuanto a la técnica de transferencia embrionaria y en cuanto al tratamiento de soporte de fase lútea, donde siguen existiendo algunos aspectos controvertidos. Como bien sabemos, el objetivo de la transferencia embrionaria es depositar los embriones en el fondo del útero de la manera menos traumática posible. Por otro lado, la progesterona es necesaria para la implantación y el mantenimiento de la gestación en los ciclos de FIV. Sabemos que niveles suprafisiológicos de estradiol (por la estimulación ovárica en ciclos de FIV) ejercen un efecto feed-back negativo sobre el eje hipotálamo-hipofisario, disminuyendo los niveles de LH y produciendo una luteólisis precoz del endometrio que obligará a realizar un tratamiento de soporte de fase lútea que nos permita mantener las mejores condiciones posibles para que se produzca la implantación y el mantenimiento del embrión.
Esta revisión tiene como objetivo, presentar una guía práctica para la correcta realización de la técnica de transferencia y el manejo de la fase lútea basada en la evidencia científica publicada hasta el momento. Hemos realizado la búsqueda en bases de datos electrónicos (PubMed, Cochrane, EMBASE) usando diferentes palabras clave. La búsqueda se ha realizado entre los años 1985 y 2014. En base a la información obtenida, nuestro grupo de trabajo ha realizado unas recomendaciones siguiendo los parámetros de los niveles de evidencia establecidos por la Sociedad Española de Fertilidad (SEF). Las recomendaciones sin grado de evidencia se han establecido como puntos de buena práctica clínica.
Despite the advances made in the treatment of assisted reproduction and particularly in in vitro fertilisation (IVF) laboratories for the past 20 years, little has changed as far as embryo transfer techniques and the treatment of the luteal phase support, where there are still some controversial aspects. It is well known that the purpose of embryo transfer is to place the embryos in the fundus of the uterus the least traumatic way possible. On the other hand, progesterone is required for implantation and maintenance of pregnancy for IVF cycles. Furthermore, supra-physiological levels of oestradiol (used for ovarian stimulation in IVF cycles) have a negative feedback effect on the hypothalamic-pituitary axis, decreasing the levels of LH and producing early endometrial luteolysis, forcing clinicians to use a luteal phase support. This support helps maintain the best conditions possible for the implantation and maintenance of the embryo transferred.
The aim of this review is to present a practical guideline for the correct implementation of the embryo transfer technique and the management of the luteal phase, based on the scientific evidence published so far. The search was conducted using several electronic databases (such as PubMed, Cochrane, and EMBASE) and using different keywords. The search included reports from 1980 up to 2014. Based on all the information obtained, our working group has made some recommendations according to the levels of evidence established by the Spanish Fertility Society (SEF). The recommendations without much evidence have been established as good clinical practice points.
La transferencia embrionaria es a menudo vista como el proceso menos importante dentro del complejo tratamiento de la fecundación in vitro (FIV). A pesar de su simplicidad, la transferencia embrionaria requiere el esfuerzo colectivo del embriólogo y del clínico para su correcta realización, ya que el trabajo del embriólogo para mantener la viabilidad del embrión puede resultar inútil ante una transferencia traumática.
El éxito de una buena transferencia embrionaria se basa fundamentalmente en 3 aspectos: la calidad embrionaria, la receptividad endometrial y una buena técnica de transferencia que permita depositar los embriones dentro de la cavidad uterina con las mejores condiciones posibles. La ausencia de contracciones uterinas, sangre o moco en la punta del catéter, la contaminación bacteriana o la retención de embriones en el catéter, etc., son algunos de los factores que pueden condicionar una buena técnica de transferencia. Como es sabido, la progesterona es necesaria para la implantación y el mantenimiento de la gestación. Tras la transferencia embrionaria, pero igual de importante para llegar a conseguir el éxito del tratamiento en los ciclos de FIV, será necesario un buen soporte de fase lútea para que se produzca la correcta implantación y el mantenimiento del embrión.
Los primeros datos que aparecen en la literatura científica sobre la técnica de la transferencia fueron publicados por Edwards hace más de 20años. Posteriormente han aparecido otros trabajos sobre la importancia de una buena técnica de transferencia.
El tratamiento de elección para el soporte de fase lútea sigue siendo la progesterona. Constituye el gold standard de la fase lútea, aunque sigue habiendo debate y aspectos controvertidos en cuanto a la posibilidad de usar otros fármacos, a las vías de administración y a la duración del tratamiento.
MetodologíaSe ha realizado una búsqueda bibliográfica sistemática de artículos publicados entre los años 1985 y 2014 en las principales bases de datos de publicaciones científicas (PubMed, Crohcane, EMBASE).
Criterios de búsquedaPara la búsqueda se utilizaron como palabras clave: transferencia embrionaria, catéter blando, embriones, progesterona, soporte de fase lútea, progesterona intramuscular, progesterona vaginal, progesterona subcutánea. Se seleccionaron estudios que cumpliesen los parámetros de: estudio clínico prospectivo aleatorizado, estudios observacionales, revisiones, metaanálisis y estudios retrospectivos de cohortes. Se descartaron estudios epidemiológicos o revisiones de historias.
Tras la selección de artículos, se revisaron un total de 26 estudios prospectivos aleatorizados, 14 metaanálisis, 5 revisiones Cochrane, 4 artículos de revisión, 5 estudios retrospectivos de cohortes, 2 estudios observacionales y 3 capítulos de libro.
Transferencia embrionaria. «La clave del éxito»: preparación previa al transferEdwards escribió: «El 85% de los embriones no implantan» (Edwards, 1995). A día de hoy, porcentajes de implantación entre el 20 y el 30% son considerados como normales (Fauser, 2009). En el proceso de la implantación influyen diferentes factores, tanto embrionarios como uterinos y, cómo no, la propia técnica de transferencia embrionaria, a la que se le está dando cada vez más importancia. A pesar de que está considerada universalmente como un procedimiento simple y sencillo, la gran mayoría de los embriones que se transfieren al útero no implantan a pesar de las continuas mejoras en la calidad del laboratorio de FIV que permiten obtener embriones de buena morfología. En este sentido, existe cada vez más evidencia que habla a favor de que una técnica de transferencia depurada contribuya a maximizar los resultados del ciclo de FIV-ICSI.
El objetivo de la transferencia embrionaria es depositar los embriones de forma suave y atraumática en aquella localización uterina donde se maximicen sus probabilidades de implantación (Mains y van Voorhis, 2010). Se han estudiado los distintos aspectos técnicos de la transferencia embrionaria para determinar su efecto en los resultados del ciclo. Aunque muchos de los datos que evalúan esos factores arrojan resultados confusos o conflictivos, existe evidencia consistente que apoya que ciertas intervenciones mejorarían los resultados, como el hecho de conseguir que una transferencia sea sencilla, realizarla bajo control ecográfico (Buckett, 2003; Sallam y Sadek, 2003), el empleo de catéteres blandos frente a rígidos (Abou-Setta et al., 2005, Buckett, 2006) y la elección del lugar para el depósito embrionario (Waterstone et al., 1991; Coroleu et al., 2002). Todos estos factores contribuyen a la mejora de los resultados. Sin embargo, la evidencia científica que apoya la realización de otras intervenciones es mucho más limitada, como en el caso de la realización de una transferencia de prueba en el ciclo previo, ya que la posición del útero y el ángulo cervicouterino pueden modificarse de un ciclo normal al ciclo estimulado (Yang et al., 2007; Henne y Milkt, 2004), o la preparación previa del cérvix. Un trabajo publicado recientemente (Craciunas et al., 2014), que incluía 12 estudios, no pudo demostrar ningún beneficio. En general, y como se confirmó en una revisión Cochrane publicada en el año 2007, no se pudo demostrar que ninguna de las técnicas de preparación previa a la transferencia incremente las probabilidades de éxito (Derks et al., 2009).
Dificultad de la transferenciaDe forma casi intuitiva, puede decirse que la dificultad de ejecución de la transferencia influye de forma negativa en los resultados. Existe evidencia científica acerca de la influencia del grado de dificultad de la transferencia en los resultados del ciclo. En un metaanálisis publicado por Sallam (2005) la probabilidad de embarazo se redujo de forma significativa, con una OR de 0,73 (0,63-0,85), en los casos en que la transferencia embrionaria resultó difícil. En una revisión posterior de Phillips et al. (2013), que incluyó 5 trabajos, también se vio que el riesgo relativo de embarazo era significativamente inferior cuando la transferencia resultaba complicada (RR=0,75; IC95%: 0,66-0,86). En este metaanálisis, en 3 trabajos la clasificación del nivel de dificultad de la transferencia se realizaba en base a criterios subjetivos, con un RR=0,67 (IC95%: 0,51-0,87), y en 2 trabajos se definía transferencia difícil cuando se requería la realización de maniobras adicionales, fase lútea, para conseguir la entrada del catéter (RR=0,78; IC95%: 0,67-0,91). Los autores concluyeron que una transferencia dificultosa disminuía las posibilidades de embarazo.
Diversos autores han estudiado a través de qué mecanismos una transferencia en la que exista una excesiva manipulación o en la que se toque el fondo uterino disminuye las probabilidades de embarazo. Las contracciones uterinas en mujeres no gestantes pueden visualizarse y medirse de forma no invasiva mediante ultrasonidos (Fanchin y Ayoubi, 2009). Las mejoras técnicas, como los sistemas computarizados, permiten una cuantificación más precisa y objetiva de las mismas. De acuerdo con estos hallazgos, Kunz et al. (2006) en su trabajo demuestran que durante la fase lútea las contracciones uterinas están controladas por la producción hormonal sistémica y local, confirmando el papel estimulador de los estrógenos y relajante de la progesterona, y favorecen la implantación fúndica del blastocito.
Fanchin (1998) publicó en solitario un trabajo prospectivo que incluye 220 ciclos en 209 pacientes a las que se realizó una determinación ecográfica de dinámica uterina mediante un sistema automático a lo largo de 5min antes de realizar el depósito de los embriones. Se definieron 4 grupos en función del número de contracciones por minuto medidas, desde 3 o menos contracciones hasta más de 5. Los autores demostraron cómo se van reduciendo de manera significativa los porcentajes de implantación y de embarazo clínico con el incremento del número de contracciones por minuto.
En ese mismo año, Lesny et al. (1998) publican otro trabajo en el que los autores pretenden establecer si la técnica de la transferencia puede inducir o modificar las contracciones de la zona de unión endomiometrial. Para ello se determina mediante ultrasonidos la «migración» que sufre un depósito de contraste ultrasónico, en concreto 30μl de Echovist, en 14 transferencias de prueba realizadas en donantes de ovocitos. Se consideraba transferencia sencilla cuando no se tocaba el fondo uterino. En estos casos no se detectaron modificaciones de la actividad mecánica endometrial durante la transferencia, y se comprobó que el contraste permanecía en la porción superior de la cavidad uterina tras 45min. Se consideró transferencia difícil tocar «deliberadamente» el fondo uterino. En estos casos se producían unas intensas ondas de contracción aleatorias a nivel del fondo y desde el fondo al cérvix que en 6 de los 7 casos produjeron la migración del depósito de contraste: en 4 de ellos hacia el cérvix y en 2 hacia las trompas. Los autores concluyeron que la actividad mecánica uterina puede ser la responsable de la migración del depósito embrionario, y que esa actividad es dependiente de la estimulación mecánica, que fácilmente puede inducirse en caso de transferencia difícil.
Preparación previa a la transferenciaDentro de las actuaciones que se pueden llevar a cabo con el objetivo de lograr que en el momento crítico la técnica de la transferencia sea suave y a traumática está la realización de una transferencia de prueba. Aunque se trata de un procedimiento ampliamente extendido, su práctica no está exenta de controversia. A favor de su realización está el hecho de que podemos conocer de antemano la anatomía uterina, pudiendo anticipar así posibles dificultades. La transferencia de prueba permite establecer variables como la posición del útero, la profundidad de la cavidad uterina y el ángulo cervicouterino. Además, con todos estos datos podemos realizar la selección del catéter óptimo y prevenir así un eventual cambio de catéter en el momento de la transferencia real, disminuyendo los tiempos de la transferencia, variable que también se ha vinculado a los resultados. En un ensayo clínico (Mansour et al., 1990) 167 pacientes fueron asignados de forma aleatoria al grupo de transferencia de prueba y 168 al grupo control. En el grupo de transferencia de prueba no hubo ningún caso de transferencia difícil en comparación con el grupo control. Asimismo, los porcentajes de implantación y embarazo fueron significativamente superiores en el grupo de transferencia de prueba (tabla 1). En caso de realizar la transferencia de prueba, existen controversias acerca del momento en el cual debería realizarse. Hay autores que plantean hacerla en el ciclo menstrual previo al ciclo de estimulación y otros que abogan por su realización en el mismo ciclo en el que se va a realizar la transferencia de embriones.
Las razones principales para realizarla en el ciclo previo son, en primer lugar, que no hay riesgo de producir una disrupción del endometrio en el ciclo de la transferencia real que conlleva la posibilidad de una lesión endometrial que reduzca las posibilidades de implantación y una decidualización prematura. Además, realizar una disrupción endometrial en el ciclo previo al inicio de la estimulación ovárica, mediante cánula de biopsia o histeroscopia, se ha propuesto como un mecanismo para incrementar las posibilidades de embarazo (Wise, 2013), especialmente en casos con fallo de implantación. Existen 3 metaanálisis (Nastri et al., 2012; Potdar et al., 2012; El-Toukhy et al., 2012) con cierto grado de heterogeneidad en los estudios incluidos, en los que parece que existe un beneficio en términos de mayor porcentaje de embarazo clínico cuando se realiza una biopsia endometrial en la cara posterior uterina, bien mediante histeroscopia o bien mediante cánula de Cornier, en el ciclo previo a la transferencia. Los resultados de los 3 trabajos se resumen en la tabla 2.
Revisiones sistemáticas con metaanálisis de los resultados acerca de la realización del «scratching» endometrial
| N.° de trabajos | N.° de pacientes | Resultados (embarazo clínico) | |
|---|---|---|---|
| Nastri et al. (2012) | 4 ECA | n=435 | OR=2,61 (1,71-3,97) |
| Potdar et al. (2012) | n=7 (3 ECA, 4 no ECA) | n=2062 | RR=2,33 (1,72-3,13) |
| El-Toukhy et al. (2012) | n=8 (2 ECA, 6 no ECA) | n=193 | RR=2,63 (1,39-4,96) |
| n=708 | RR=1,95 (1,61-2,35) |
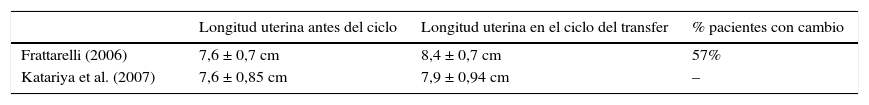
A favor de realizar la transferencia de prueba en el mismo ciclo está el hecho de que distintos autores han demostrado que del ciclo basal al ciclo estimulado se pueden modificar variables como la posición uterina, e incluso se han llegado a detectar diferencias en la longitud de la cavidad uterina. En un estudio publicado por Henne y Milkt (2004) con 623 pacientes, se vio que cuando el útero estaba en ante solo se detectaban cambios en la posición del útero entre el ciclo previo y el ciclo estimulado en el 2% de los casos, pero cuando el útero estaba en retroversión, en el 55% de los casos cambiaba a anterreversión en el ciclo estimulado. Datos similares se encontraron en otro estudio publicado por Yang et al. (2007), donde se detectaron hasta un 18% de cambios de posición cuando el útero estaba en retroversión. También se han detectado cambios en la longitud uterina entre el ciclo previo y el ciclo estimulado. En la tabla 3 se resumen los datos obtenidos en 2 trabajos (Frattarelli, 2006; Katariya et al., 2007) en los que se demostró cómo se incrementaba la longitud uterina —en uno de ellos de forma significativa— entre el ciclo de prueba y el ciclo estimulado.
Cambios en la longitud uterina entre el ciclo previo y el ciclo estimulado
| Longitud uterina antes del ciclo | Longitud uterina en el ciclo del transfer | % pacientes con cambio | |
|---|---|---|---|
| Frattarelli (2006) | 7,6 ± 0,7 cm | 8,4 ± 0,7 cm | 57% |
| Katariya et al. (2007) | 7,6 ± 0,85 cm | 7,9 ± 0,94 cm | – |
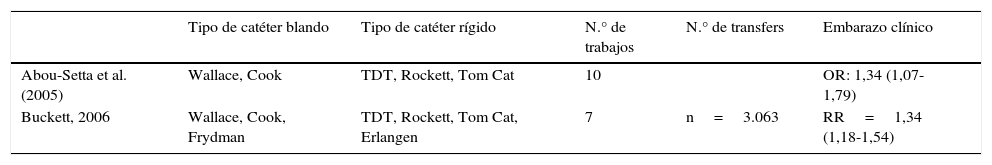
Otro de los puntos que se puede tener decidido antes del día de la transferencia es el tipo de catéter que se va a utilizar. Existen más de 50 modelos comercializados. Estos se pueden clasificar en función de diversas variables, como el nivel de rigidez, la maleabilidad, la «memoria» del material, que tenga o no vaina externa, las características de la punta, el calibre y la longitud o la ecogenicidad de la punta. Se han publicado 2 revisiones sistemáticas de ensayos clínicos que comparan los resultados, en términos de gestación clínica, cuando se realiza la transferencia con catéter rígido frente a catéter blando. En ambos casos los porcentajes de embarazo son significativamente superiores cuando se utiliza un catéter blando: OR de embarazo 1,34 (1,07-1,79) en la revisión publicada por Abu-Setta et al. (2005) y RR de 1,34 (1,18-1,54) en la revisión de Buckett (2006). Los resultados se resumen en la tabla 4. Parece que esto es debido a la mayor frecuencia de lesiones endometriales en el momento de la transferencia cuando se utiliza catéter rígido que cuando se utiliza uno blando. Algunos autores han demostrado la presencia de disrupciones importantes en cuello y cara posterior realizando una histeroscopia diagnóstica después de una transferencia de prueba. Así, el grupo de Poncelet et al. (2009), tras realizar histeroscopia en un grupo prospectivo de 100 pacientes tras transfer de prueba con 3 tipos de catéteres blandos (Sydney Set, Elliocath, Frydman Classic) y uno rígido (Memory Frydman), diagnosticó hasta un 85% de lesiones importantes cuando se utiliza el catéter rígido. En otro trabajo similar de Ressler et al. (2013) se comparan las lesiones producidas por 3 tipos de catéteres de rigidez creciente. Se ve que tras el empleo de un catéter rígido aparecen lesiones erosivas con sangrado petequial en la superficie del endometrio a pesar del uso de ultrasonidos. Esto puede justificar los menores porcentajes de embarazo con el uso de catéteres rígidos.
Probabilidad de embarazo clínico según el tipo de catéter de transferencia utilizado
| Tipo de catéter blando | Tipo de catéter rígido | N.° de trabajos | N.° de transfers | Embarazo clínico | |
|---|---|---|---|---|---|
| Abou-Setta et al. (2005) | Wallace, Cook | TDT, Rockett, Tom Cat | 10 | OR: 1,34 (1,07-1,79) | |
| Buckett, 2006 | Wallace, Cook, Frydman | TDT, Rockett, Tom Cat, Erlangen | 7 | n=3.063 | RR=1,34 (1,18-1,54) |
La técnica de la transferencia se lleva a cabo conjuntamente por un embriólogo y por un ginecólogo, cada uno de ellos con connotaciones técnicas específicas. Detallamos a continuación el procedimiento realizado durante la transferencia por el embriólogo.
Consideramos que los aspectos más importantes para la transferencia embrionaria desde el punto de vista del embriólogo (descartando la selección embrionaria, que no corresponde a este capítulo) son los siguientes:
- -
Elección del medio de cultivo para la transferencia.
- -
Cargado del catéter de transfer: formas de cargar, tiempo entre el cargado y la descarga…
- -
Descarga de los embriones: velocidad de expulsión.
- -
Comprobación del catéter.
En el artículo de Mahani y Davar (2007) se estudió el efecto del ácido hialurónico vs. albúmina en el medio de transferencia embrionaria. Se obtuvo una tasa de embarazo en el grupo de ácido hialurónico del 81,8%, respecto al 71,4% obtenido al utilizar medio de cultivo normal suplementado con albúmina.
En otro artículo de Urman et al. (2008) se comprobó que el enriquecimiento del medio de transferencia con hialuronano incrementaba las tasas de embarazo clínico y de implantación, tanto en transferencias en D+3 como en D+5. El efecto beneficioso resultó más evidente en mujeres de edades mayores de 35años, en pacientes con baja calidad embrionaria y en mujeres con fallos de implantación.
Y en el trabajo de Bontekoe et al. (2010), en el Cochrane, se concluye que los compuestos añadidos en el medio de transferencia, como por ejemplo el hialuronano, aumentaban las tasas de embarazo y de embarazo múltiple (se puso en duda si el aumento se debía a la combinación de los compuestos o a la transferencia de más de un embrión, por lo que recomendaron la realización de más estudios).
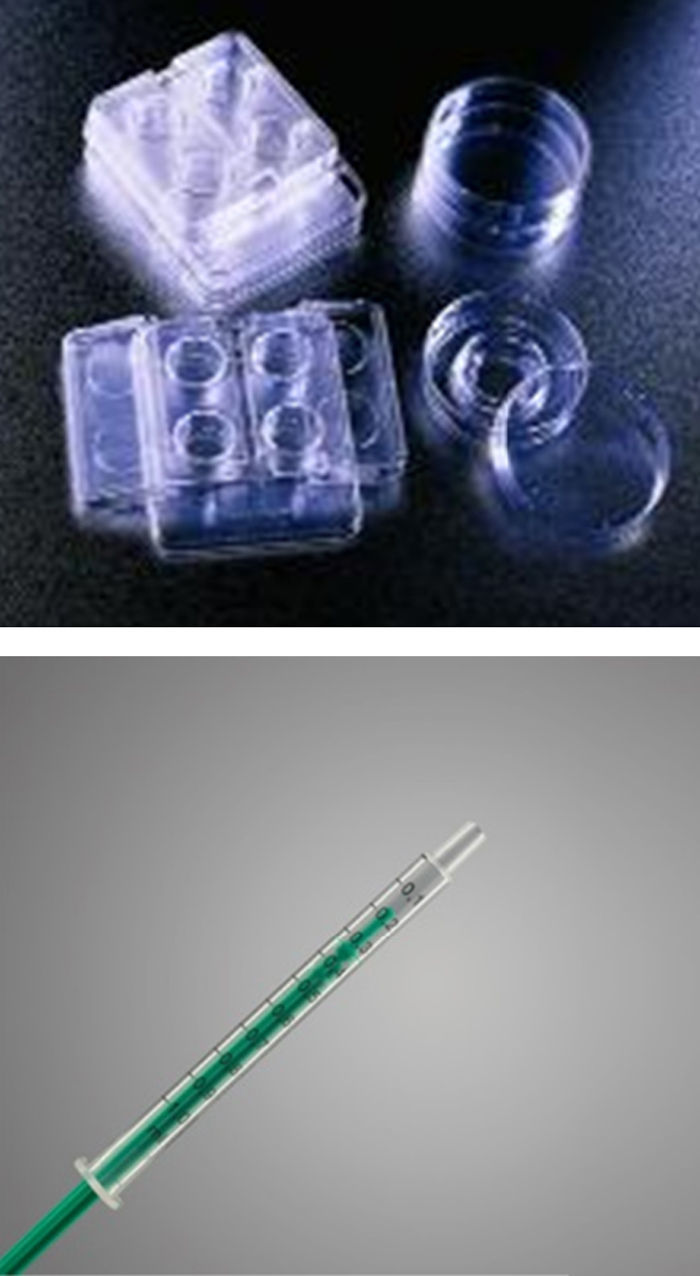
Cargado del catéter de transferEl uso de los diferentes tipos de jeringas y placas para cargar es algo muy heterogéneo, y no hay artículos sobre si pueden tener influencia o no sobre la transferencia (fig. 1).
Cantidad de líquido y aireHay varios artículos que hablan de la cantidad de líquido óptimo para realizar el cargado de los embriones en el catéter, y sobre si hace falta tener soportes de aire o no. Destacamos los siguientes.
En un artículo de Montag et al. (2002) se vio que un mayor volumen de líquido (40μl) para cargar el catéter, comparado con un bajo volumen (15-20μl), resultó tener significativamente una tasa de embarazo (40% vs 23%, p=0,012) y una tasa de implantación mayores (24,4% vs 14,7%, p=0,011).
En otro artículo, Moreno et al. (2004) estudiaron si era necesaria o no la presencia de aire en la carga del catéter, y concluyeron que el aire no afectó negativamente al éxito del tratamiento.
Ebner et al. (2001) observaron que un volumen medio de entre 10-20μl respecto a menos de 10μl y la no presencia de burbujas de aire no intencionadas resultaba tener tasas de embarazo e implantación significativamente más altas.
Descarga de los embrionesIntervalo entre la carga y la descarga del catéterEn una revisión de Matorras et al. (2008) se estudió la influencia de la variación del intervalo de tiempo entre la carga y la descarga de los embriones y se encontraron diferencias significativas entre el grupo de tiempo de descarga menor a 30s y el de más de 120s en la tasa de embarazo e implantación a favor del grupo que empleó menos tiempo, incluso excluyendo las transferencias difíciles.
Velocidad de la descarga de los embrionesEbner et al. (2001) estudiaron también la velocidad de descarga de los embriones, en función de si era rápida o lenta. Encontró una mayor tasa de implantación y embarazo cuando se descargan los embriones lentamente, aunque las diferencias no fueron significativas.
Retirada del catéter tras la descarga de los embrionesEn una revisión de Martínez et al. (2008) se observó que no había diferencias entre la retirada rápida o lenta del catéter, aunque la retirada no cuidadosa podía crear un efecto de succión que atrajera a los embriones recién depositados hasta una situación más inferior en el útero y, por tanto, menos deseable.
Comprobación del catéterUna vez realizada la transferencia, debe comprobarse el catéter para verificar que se han depositado los embriones en la cavidad. Vicdan et al. (2007) y Lee et al. (2004) demostraron en sus respectivos trabajos que la presencia de embriones retenidos en el catéter de transferencia y su inmediata re-transferencia no afectaba a las tasas de embarazo o implantación, a menos que hubiera otros signos o información previa de que la transferencia había sido difícil.
Técnica de transferencia. El ginecólogoLa labor que realiza el ginecólogo durante el proceso de transferencia se detalla a continuación.
Preparación cervical previaCon la paciente colocada en posición ginecológica, la aplicación del espéculo estéril se hará delicadamente, evitando tocar el cuello cervical en lo posible, para evitar la liberación de prostaglandinas y, por tanto, las contracciones uterinas. No hay que usar gel ni ningún otro lubricante más que el propio medio de lavado atemperado aplicado al espéculo para evitar las molestias de la introducción. Se procede al lavado cervical con medio de cultivo y se aspira el moco cervical. Tan importante es dejar el cérvix lo más libre de moco posible como no estimular el cuello; por tanto, este paso debe ser exhaustivo pero delicado. No importa el tiempo que se invierta en él (recordemos que los embriones aún no están cargados en la cánula). Además de limpiar con gasas estériles, se puede aspirar el moco cervical con el catéter de prueba que tendremos en la mesa de quirófano, pero aplicando siempre la misma máxima: retirar la mayor cantidad de moco que sea posible pero a la vez cuidando de no estimular el cérvix.
Previo a la carga del catéter de transferencia con los embriones que se van a transferir, se puede realizar una prueba, pasando el catéter solo hasta sobrepasar el orificio cervical interno (OCI): una vez canalizado el mismo, se procede a la carga de los embriones y su transferencia, intentando reducir al mínimo el tiempo de realización de la misma, como se ha comentado anteriormente. Se demostró en un estudio que si se prolongaba el tiempo de transferencia (mayor de 120s), había menor tasa de implantación (Sallam, 2005).
Una vez nos traen el/los embriones desde el laboratorio y se nos entrega la cánula, se realiza la introducción del catéter con sumo cuidado, evitando en todo momento estimular el cuello y, por supuesto, tocar el fondo, llegando con la cánula a la zona media endometrial.
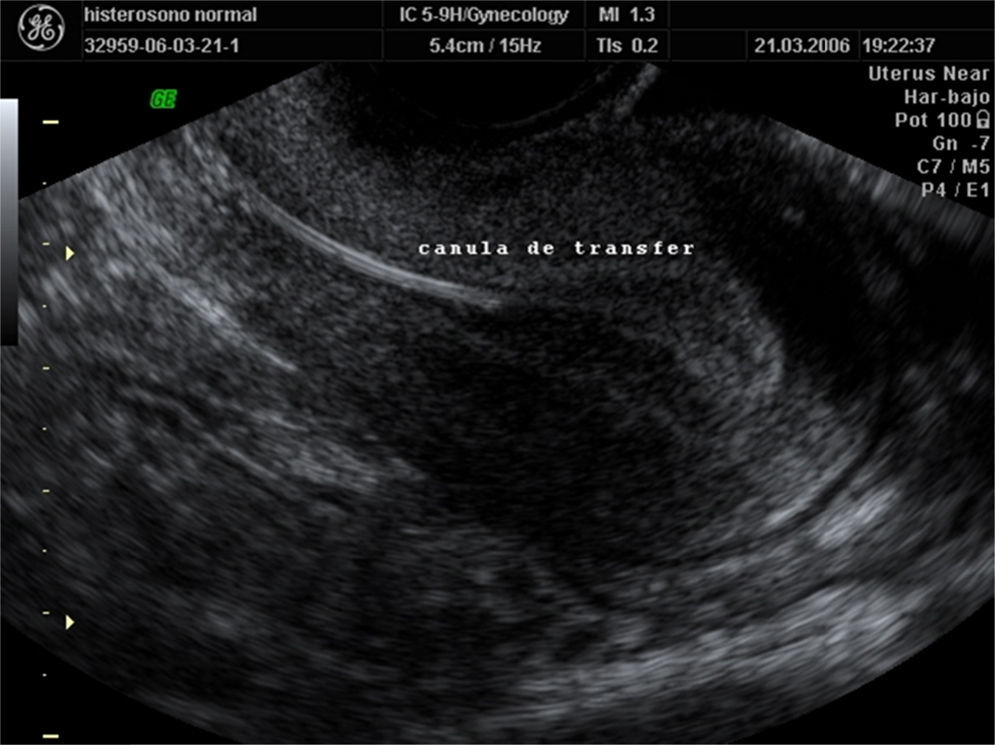
El uso de la ecografía abdominal para monitorizar la transferencia embrionaria ha sido ampliamente propuesta, ya que ayuda a definir el trayecto uterino y permite visualizar el área endometrial donde decidiremos dejar el/los embriones. Aunque hay cierta discusión sobre este punto, se sigue recomendando que las transferencias se hagan bajo control ecográfico, especialmente para evitar casos que, aunque poco frecuentes, pueden ser relevantes, como falsas vías, úteros que cambian sustancialmente de tamaño respecto a la prueba realizada en consulta, etc.
El metaanálisis de Abou-Setta et al. (2007) incluyó 8 estudios prospectivos aleatorizados, y concluía que las tasas de gestación eran superiores cuando se realizaban las transferencias ecoguiadas frente las que se llevan a cabo solo con manejo clínico. En cuanto a la ecografía tridimensional, no aporta beneficio sustancial frente a la ecografía bidimensional (Letterie, 2005) (fig. 2).
Aspectos técnicos durante el proceso de transferenciaHa quedado demostrado que el uso de catéteres blandos provoca menos lesiones en el endometrio (Marconi et al., 2003), menor inducción de contracciones uterinas y menor riesgo de contaminación con sangre y/o moco frente a los catéteres rígidos. También Abou-Setta et al. (2005) corroboraron estos resultados en su metaanálisis, por lo que sería recomendable usar en lo posible cánulas blandas (fig. 3).
Es importante evitar sobrepasar el OCI con la vaina del catéter, con el fin de no disminuir la tasa de implantación (Abdelmassih et al., 2007).
El uso de pinzas de tracción o cualquier instrumento de tracción cervical está desaconsejado, ya que induce la elevación de los niveles de oxitocina y, por tanto, favorece la aparición de contracciones uterinas (Dorn et al., 1999); por lo tanto, debería evitarse su uso en la transferencia embrionaria.
Hay que evitar la presencia de sangre, moco y/o bacterias en el catéter, puesto que su presencia disminuye las tasas de implantación. Algunos autores consideran la presencia de sangre en la punta del catéter o a través del OCI como un factor pronóstico desfavorable (Englert et al., 1986), otros no encuentran una asociación tan clara (Mansour et al., 1990). En simulaciones de transferencias en que se tocó el fondo uterino, se observó con mayor frecuencia la presencia de sangre en el catéter, lo que sugiere que la fuente de sangrado más probable y frecuente es el endometrio (Sallam, 2005).
No hay una clara evidencia sobre el posible efecto deletéreo de la presencia de moco cervical en la cánula, y su visualización sugiere que la transferencia puede haber sido traumática y haber inducido contracciones uterinas (Sallam, 2005).
La presencia de flora microbiana en el catéter de la transferencia se asocia a una menor tasa de implantación (Fanchin et al., 1998).
La posición uterina más habitual es la anteflexión, con lo cual una vejiga bien replecionada favorecerá que el trayecto cervicouterino que debe recorrer la cánula sea lo más rectilíneo posible (Abou-Setta et al., 2007). En caso de útero en retroversión, la repleción de la vejiga ha de ser menor, y el objetivo de seguir recomendando cierto nivel de llenado vesical en este caso sería realizar una transferencia ecoguiada con mayor nitidez.
La retirada del catéter brusca o excesivamente rápida, como hemos comentado anteriormente, puede provocar una presión negativa (efecto succión) que puede desplazar los embriones fuera de la cavidad uterina (Mansour, 2005; Mansour y Aboulghar, 2002). Por ello es importante evitar la presión final del émbolo y retirar el catéter lentamente. Sin embargo, esperar 30 a 60s antes de retirar el catéter, que es una práctica muy habitual, no ha demostrado que mejore la tasa de implantación.
Depositar los embriones en el tercio medio de la cavidad uterina y no a nivel fúndico, como ya hemos visto, aumenta la probabilidad de embarazo (Pope et al., 2004; Frankfurter et al., 2004; Coroleu et al., 2002; Pacchiarotti et al., 2007; Abou-Setta, 2007a,b). Esto posiblemente ocurre como consecuencia de evitar la inducción de contracciones uterinas que pueden favorecer la expulsión de los embriones al haber menos riesgo de tocar accidentalmente el fondo uterino con la cánula.
La comprobación del catéter al final de la transferencia tiene como finalidad verificar la no presencia del embrión en él. En ciertas ocasiones el embrión puede quedar suspendido en el medio y no depositarse correctamente en la cavidad por diversos factores (tapón mucoso, incorrecto impulso del émbolo…). La tasa de gestación no disminuye por volver a repetir la transferencia, siempre y cuando se actúe con las precauciones ya advertidas y en el menor tiempo posible (Poindexter et al., 1986).
Encuesta sobre la realización de la técnica de transferenciaPara conocer la técnica de la transferencia que se está utilizando en nuestro país se procedió a realizar una encuesta (2013) en la que participaron los responsables del laboratorio de FIV de 18 centros de reproducción asistida de España. Dicha encuesta incluía preguntas para conocer cada punto específico relacionado con la participación del embriólogo en la transferencia; por ejemplo, si se usaba un medio de cultivo específico para transferencia o no; si se realizaba de forma estéril; la forma de cargar el catéter; si se realizaba la transferencia con el catéter precargado con los embriones o si se introducía la vaina externa antes de cargarlos; si se usaba una jeringa específica para transferencia o una cualquiera; si expelían todo el volumen o solo una parte; si apretaba el émbolo el embriólogo o el ginecólogo; si después de la transferencia comprobaban el catéter y/o la vaina externa, y cuando había que repetir la transferencia por quedarse algún embrión en el catéter, si se cambiaba de catéter o no. La encuesta fue distribuida entre los especialistas por correo electrónico (mail), distribuidas por 5 comunidades autónomas entre las provincias de Madrid, Barcelona, Zaragoza, Valencia y Sevilla. Participaron centros de prestigio tanto públicos como privados. De las 18 encuestas enviadas, respondieron el total de centros y se recogió toda la información. Los resultados de dicha encuesta (datos no publicados) han sido los siguientes. Medio de cultivo: solo uno de cada 3 utiliza un medio específico enriquecido con hialuronano, el resto lo hace con el medio que corresponde al estadio del embrión. Cargado del catéter de transferencia: en el 40% de los centros se carga el catéter solo con medio y en el 60% con medio y aire; uno de cada 3 utiliza jeringa embriotestada y uno de cada 4 lo hace de forma completamente estéril. Descarga de los embriones: un 30% realiza la transferencia en un solo paso (con los embriones ya cargados) y el resto (la mayoría) lo hace en 2 tiempos, primero introducen la vaina y posteriormente los embriones. En la mitad de los centros la descarga la realiza el embriólogo y en la otra mitad lo hace el ginecólogo. El 56% descargan todo el volumen de la jeringa y el resto solo unos 30μl que contienen los embriones. Comprobación del catéter: el 25% de los profesionales comprueban solo el catéter y el 75% restante comprueban el catéter y la vaina externa.
En general, como puntos más destacables, los centros consultados no aplican medios de cultivo enriquecidos con hialuronano y la mayoría realizan la transferencia en 2 pasos (primero se introduce del catéter y en un segundo tiempo se realiza la transferencia de los embriones).
La fase lútea, último paso tras la transferenciaLa fase lútea se define como el periodo comprendido entre la ovulación (pico de LH) y la llegada de la menstruación (2 semanas más tarde) y/o implantación de un embrión. En el ciclo natural se caracteriza por la formación del cuerpo lúteo, el cual segrega hormonas esteroideas: estradiol y progesterona, ambas necesarias para inducir los cambios secretores en el endometrio, necesarios para que se produzca la implantación de un embrión.
En los ciclos de FIV con estimulación ovárica se produce un déficit de progesterona, HCG o ambos. Esto se debe a varias razones. Por un lado, al aspirar los folículos (cuando realizamos la punción folicular) se produce un efecto arrastre de las células de la granulosa que deberían convertirse en el cuerpo lúteo, por lo que dejamos el folículo muy debilitado. Por otro lado, los niveles de LH son muy bajos debido a la supresión previa con análogos de la GnRH; además, los niveles de HCG también son muy bajos, pues todavía no ha llegado el embrión para producirlos. Pero la razón principal y más importante es debida a los niveles suprafisiológicos de estradiol producidos por la hiperestimulación ovárica que durante la fase lútea temprana ejercen un efecto feed-back negativo sobre el eje hipotálamo-hipofisario, disminuyendo la secreción de LH y provocando una luteólisis precoz.
Opciones de tratamiento para suplementar la fase lúteaProgesteronaLa progesterona (PG) es el tratamiento de elección o tratamiento estándar para suplementar la fase lútea. Hay diferentes rutas o vías de administración: vía oral, vía vaginal, vía intramuscular y vía subcutánea. Las que se usan con mayor frecuencia son la vaginal y la intramuscular.
La PG oral ha demostrado tener una biodisponibilidad muy baja por el efecto del 1.er paso hepático, y se dejó de usar a finales de los ochenta debido a resultados muy desalentadores cuando se comparaba con otras vías de administración. A pesar de ello, la más utilizada fue la dydrogesterona, por su mejor biodisponibilidad oral. Algunos autores (Chakravarty et al., 2005; Ganesh et al., 2011) no encontraron diferencias cuando la comparaban con la PG intramuscular (i.m.). Por otro lado, en un estudio realizado por Fatemi et al. (2007) los resultados fueron significativamente mejores con PG i.m. para inducir cambios secretores en el endometrio.
La PG i.m. se usó mucho tradicionalmente hasta la aparición de la vía vaginal; tiene el inconveniente del dolor por su administración y está asociada a numerosos efectos secundarios, como enrojecimiento e inflamación en la zona de administración, e incluso se ha descrito algún caso de neumonía eosinófila. Dos estudios —el metaanálisis de Pritts y Atwood (2002) y la revisión Cochrane de Daya y Gunby (2004)— presentaron resultados estadísticamente significativos en favor de la PG i.m. respecto a la PG vaginal. Posteriormente se han publicado otros trabajos, como los de Doody et al. (2009), Yanushpolsky et al. (2008) y Silverberg et al. (2012), en los que no se encontraron diferencias significativas en las tasas de embarazo y las tasas de nacido vivo cuando comparaban PG i.m. y PG vaginal en ciclos de FIV con transferencias en fresco.
La PG vaginal sigue siendo el tratamiento de elección para suplementar la fase lútea: alcanza rápidamente niveles en útero (endometrio) y los niveles totales en sangre son bajos. Existen numerosos preparados de administración por vía vaginal, y en la literatura existen numerosos estudios que comparan los distintos preparados. Estudios relevantes, como el metaanálisis de Polyzos et al. (2010) o el de Stadtmauer et al. (2013), concluyen que no hay diferencias significativas en cuanto a tasas de embarazo clínico, tasas de embarazo evolutivo y tasas de nacido vivo cuando usamos los diferentes preparados de administración por vía vaginal.
La PG subcutánea se presenta en una solución acuosa, a través de una sencilla inyección subcutánea. En esta formulación, la PG se encuentra encapsulada en moléculas de ciclodextrina (muy usadas en la industria farmacéutica para moléculas no solubles en agua) que la protegen y permiten que llegue al torrente sanguíneo. Una vez allí, la molécula de PG se disocia de la ciclodextrina, quedando la PG libre para llegar hasta el útero y actuar sobre el endometrio para que se den las condiciones para la correcta implantación del embrión. Las dosis de 25mg han demostrado ser efectivas para inducir cambios secretores en el endometrio en pacientes sin producción endógena de PG (De Ziegler et al., 2013). Diversos estudios sostienen la no inferioridad de la PG subcutánea respecto a la vaginal en cuanto a tasas de embarazo evolutivo y tasas de nacido vivo (Lockwood et al., 2014; Baker et al., 2014). Por tanto, se presenta como alternativa eficaz, aparte de los productos vaginales y de la PG i.m. en el apoyo de la fase lútea.
Gonadotropina coriónica humanaLa gonadotropina coriónica humana (HCG) se ha utilizado también como tratamiento de suplementación de la fase lútea. La última y más reciente revisión Cochrane (Van der Linden et al., 2011) concluyó que no había diferencias respecto a usar HCG o PG para suplementar la fase lútea, pero sí había diferencias significativas a favor del uso de la HCG si comparamos HCG+PG vs PG sola, en tasas de embarazo clínico y en tasas de nacido vivo. Por otro lado, esto llevaba a un incremento de hasta 3 veces más del riesgo de hiperestimulación ovárica al usar HCG. Hoy por hoy debería considerarse su uso sobre todo en pacientes con riesgo de hiperestimulación ovárica.
EstrógenosEl uso de estrógenos asociados a la PG para el tratamiento de soporte de fase lútea sigue siendo muy debatido y muy controvertido, a pesar de llevar más de una década en uso. Publicaciones como los metaanálisis de Gelbaya et al. (2008), Kolibianakis et al. (2008), la revisión Cochrane de Van der Linden et al. (2011) y el trabajo de Lin et al. (2013) apoyan que el uso de estrógenos junto a la PG para suplementar la fase lútea no mejora los resultados de forma significativa ni en tasas de embarazo evolutivo ni en tasas de nacido vivo.
Agonistas de la GnRHSe han usado también para suplementar fase lútea. Los agonistas de la GnRH pueden mantener el cuerpo lúteo ejerciendo su acción a 3 niveles; por un lado, mediante la estimulación sobre la glándula hipofisaria segregando LH, pero también mediante 2 efectos directos: sobre el endometrio (sabemos que existen receptores para la GnRH en el endometrio) y sobre el propio embrión (Tesarik et al., 2006; Pirard et al., 2005). A pesar de que su uso es muy reciente, hay numerosos estudios publicados en la literatura que avalan su uso por los resultados obtenidos. Tesarik et al. (2006) fueron los primeros en usar agonistas en fase lútea con resultados significativamente mejores en favor del uso de los agonistas asociados a la PG en el soporte de fase lútea. Posteriormente otros estudios, como el metaanálisis de Oliveira et al. (2010), el metaanálisis de Kolibianakis et al. (2008), la revisión de Cochrane de Van der Linden et al. (2011) e Yıldız et al. (2014) demuestran que la administración de agonistas de la GnRH «usado como suplementación de fase lútea» asociado a la PG mejoría significativamente los resultados en términos de tasas de embarazo evolutivo, tasas de implantación y tasas de nacido vivo. Zafardoust et al. (2015), en su trabajo observó que la administración de un agonista GnRH en fase lútea mejoraba significativamente las tasas de implantación y embarazo en pacientes con fallos de implantación en dos ciclos previos. Existe una gran heterogeneidad en todos estos trabajos, y el número de ellos es todavía limitado. Por todo ello, hoy por hoy son necesarios más estudios prospectivos aleatorizados para disponer de una evidencia científica clara.
Duración del tratamiento de soporte de fase lúteaTambién sigue habiendo mucho debate en cuanto a la duración necesaria que debería tener el tratamiento de suplementación de la fase lútea. Andersen et al. (2002), del grupo danés, fueron los primeros autores en atreverse a suprimir la suplementación de fase lútea de forma precoz sin que se vieran afectados los resultados en cuanto a tasas de embarazo y tasas de aborto. Posteriormente han aparecido en la literatura más estudios, de los cuales podemos destacar el de Kohls et al. (2012), el de Kyrou et al. (2011) y el metaanálisis de Liu et al. (2012). Ambos corroboraron los resultados presentados anteriormente y concluyeron que no había diferencias en cuanto a resultados de tasas de nacido vivo y tasas de aborto, ni tampoco en episodios de sangrado, al suspender el tratamiento de soporte de fase lútea de forma precoz. A pesar de estos resultados se necesitan todavía más estudios prospectivos y aleatorizados para confirmar resultados y tener una evidencia científica más potente que nos permita realizar esos cambios.
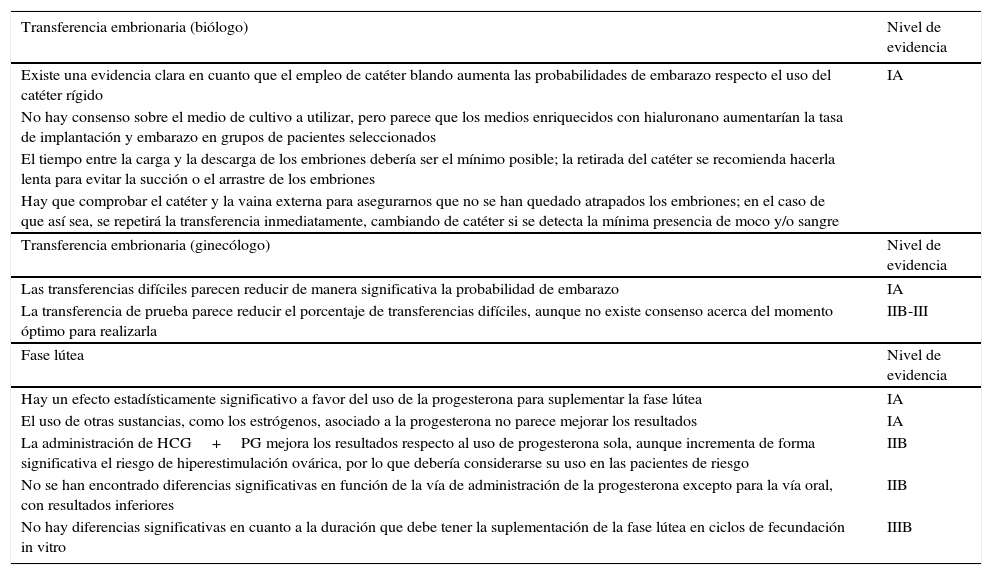
RecomendacionesEn base a la información obtenida con esta revisión sistemática de los trabajos publicados en los últimos 25 años, hemos realizado algunas recomendaciones (tabla 5) siguiendo los niveles de evidencia y recomendaciones de la Sociedad Española de Fertilidad, y se han establecido como puntos de buena práctica clínica las recomendaciones sin grado de evidencia.
Recomendaciones para la transferencia de embriones y el soporte de fase lútea
| Transferencia embrionaria (biólogo) | Nivel de evidencia |
|---|---|
| Existe una evidencia clara en cuanto que el empleo de catéter blando aumenta las probabilidades de embarazo respecto el uso del catéter rígido | IA |
| No hay consenso sobre el medio de cultivo a utilizar, pero parece que los medios enriquecidos con hialuronano aumentarían la tasa de implantación y embarazo en grupos de pacientes seleccionados | |
| El tiempo entre la carga y la descarga de los embriones debería ser el mínimo posible; la retirada del catéter se recomienda hacerla lenta para evitar la succión o el arrastre de los embriones | |
| Hay que comprobar el catéter y la vaina externa para asegurarnos que no se han quedado atrapados los embriones; en el caso de que así sea, se repetirá la transferencia inmediatamente, cambiando de catéter si se detecta la mínima presencia de moco y/o sangre | |
| Transferencia embrionaria (ginecólogo) | Nivel de evidencia |
| Las transferencias difíciles parecen reducir de manera significativa la probabilidad de embarazo | IA |
| La transferencia de prueba parece reducir el porcentaje de transferencias difíciles, aunque no existe consenso acerca del momento óptimo para realizarla | IIB-III |
| Fase lútea | Nivel de evidencia |
| Hay un efecto estadísticamente significativo a favor del uso de la progesterona para suplementar la fase lútea | IA |
| El uso de otras sustancias, como los estrógenos, asociado a la progesterona no parece mejorar los resultados | IA |
| La administración de HCG+PG mejora los resultados respecto al uso de progesterona sola, aunque incrementa de forma significativa el riesgo de hiperestimulación ovárica, por lo que debería considerarse su uso en las pacientes de riesgo | IIB |
| No se han encontrado diferencias significativas en función de la vía de administración de la progesterona excepto para la vía oral, con resultados inferiores | IIB |
| No hay diferencias significativas en cuanto a la duración que debe tener la suplementación de la fase lútea en ciclos de fecundación in vitro | IIIB |
Todos los autores están de acuerdo con el contenido del artículo y declaran no haber existido ningún conflicto de intereses en la elaboración del mismo.
Se agradece la participación en la encuesta a los centros que han aportado sus datos de forma voluntaria.