El cribado del primer trimestre es un test combinado que se realiza en el primer trimestre de la gestación. El test combina los resultados de valores de parámetros analíticos junto con parámetros ecográficos de la madre y del feto, y mediante estudios estadísticos calcula el riesgo fetal de padecer las cromosomopatías más frecuentes.
ObjetivoEvaluar la eficacia y rentabilidad de la implantación de este test en nuestro departamento sanitario.
Material y métodosDurante 3 años hemos realizado análisis bioquímicos de PaPP-A y beta-HCG mediante quimioluminiscencia a 5.798 sueros de pacientes gestantes de primer trimestre, que acudían a ecografía. Mediante el programa PRISCA 4.0 hemos estimado el riesgo de padecer síndrome de Down y síndrome de Edwards. El cut-off era de 1/250 para síndrome de Down y de 1/100 para síndrome de Edwards.
ResultadosPacientes estudiados: 5.798.
Síndrome de Down: alto riesgo 215, bajo riesgo 5.583.
Diagnóstico confirmación (cariotipo, FISH) 16 VP y 1.999 FP (S: 84%, E: 96,6%, PPV: 7,44%, NPV: 99,95%).
The first-trimester prenatal screening is a combination of tests performed during the first trimester of pregnancy. This approach combines biochemical analysis of maternal serum and foetal ultrasound. It helps to calculate the risk of a foetus of presenting with the most frequent chromosomopathies (i.e. Down's syndrome and Edward's syndrome) using multivariate statistical analysis.
ObjectiveTo evaluate the effectiveness and reliability of this first trimester screening program for foetal chromosomal anomalies in a health department.
Material and methodsDuring a three-year study 5,798, serum samples were analysed on women in the first trimester of pregnancy. PAPP-A and beta-HCG were determined by chemiluminescent immunoassay. Ultrasound was performed on all patients. The PRISCA 4.0 program was used to estimate the risk of suffering from Down's syndrome or Edward's syndrome, with cut-offs for this study of 1/250 and 1/100, respectively.
ResultsPatients studied: 5798.
Down's syndrome: High risk: 215 Low risk: 5,583.
Confirmatory diagnosis: (karyotype, FISH, birth): 16 Verified positive (VP) and 1999 False positive (FP). Sensitivity (Se): 84%, Specificity (Sp): 96.6%, Positive predictive value (PPV): 7.44%, Negative predictive value (NPV) 99.95%.
Dentro de los programas de salud materno-infantil está actualmente bien establecida la posibilidad de que las futuras madres puedan someterse a la detección prenatal de las anomalías congénitas y, muy especialmente, dentro de estas al cribado de las aneuploidías para poder decidir, con toda la información necesaria, sobre la continuación o no de la gestación cuando se presenta una anomalía fetal severa.
El diagnóstico prenatal de las anomalías cromosómicas solo se consigue mediante el estudio directo (cariotipo fetal), y para la obtención de la muestra se utilizan procedimientos como la amniocentesis, la biopsia de vellosidades coriales o la cordocentesis. Con estas técnicas se obtienen células o tejido de origen fetal y tras cultivo de la muestra se realiza el cariotipado.
Todas estas técnicas son de naturaleza invasiva, entrañan un riesgo de pérdida fetal cifrado alrededor del 1% y tienen un coste económico considerable, lo cual las hace inviables para una utilización indiscriminada en los programas de salud con financiación pública.
En 1990 Muller y Boue (1990), entre otros, evidenciaron la asociación de niveles bajos de la hormona hCG a gestaciones con feto afecto de trisomía 18, y en 1992 Mason et al. (1992) publicaron asociación de valores bajos de hCG con algunas triploidías.
El deseo de poder desplazar el cribado de las aneuploidías a fases más precoces de la gestación llevó a la búsqueda de marcadores bioquímicos útiles en el primer trimestre, como la proteína plasmática A asociada al embarazo (PAAP-A).
Por otro lado, la oportunidad que brinda la ecografía, además del estudio morfológico y funcional de la gestación, de poder detectar los fetos con mayor riesgo de ser portadores de una aneuploidía gracias a la valoración de algunos rasgos fenotípicos, más frecuentes en los fetos con aneuploidías que en los normales, ha llevado a la descripción de múltiples marcadores ecográficos de cromosomopatía.
La introducción de la medición del grosor de la translucencia nucal fetal (TN) a finales del primer trimestre del embarazo por Bronshtein et al. (1989), ampliamente difundida por Nicolaides et al. (1992) a partir de 1992, ha supuesto disponer del mejor marcador ecográfico de aneuploidías descrito hasta la actualidad.
ObjetivosNuestro objetivo desde la aparición del cribado de aneuploidías del primer trimestre es la aplicación de una técnica de cribado prenatal que nos permita identificar a las gestantes que presenten un mayor riesgo de portar un feto con aneuploidías fatales, para que sean candidatas a una prueba de diagnóstico definitiva.
En este estudio valoraremos los resultados obtenidos tras la implantación desde hace 3 años del cribado bioquímico del primer trimestre.
Un segundo objetivo fue valorar el ahorro económico que suponía la implantación de un test de cribado a todas las mujeres gestantes, incluidas las gestantes mayores de 35 años, que se les realizaba un test invasivo como primera opción para detectar posibles aneuploidías.
Material y métodosSe ha realizado un estudio retrospectivo en el que se han incluido un total de 5.798 pacientes con gestación única a las que se les realizó el test combinado del primer trimestre entre enero de 2010 y diciembre de 2012, ambos inclusive.
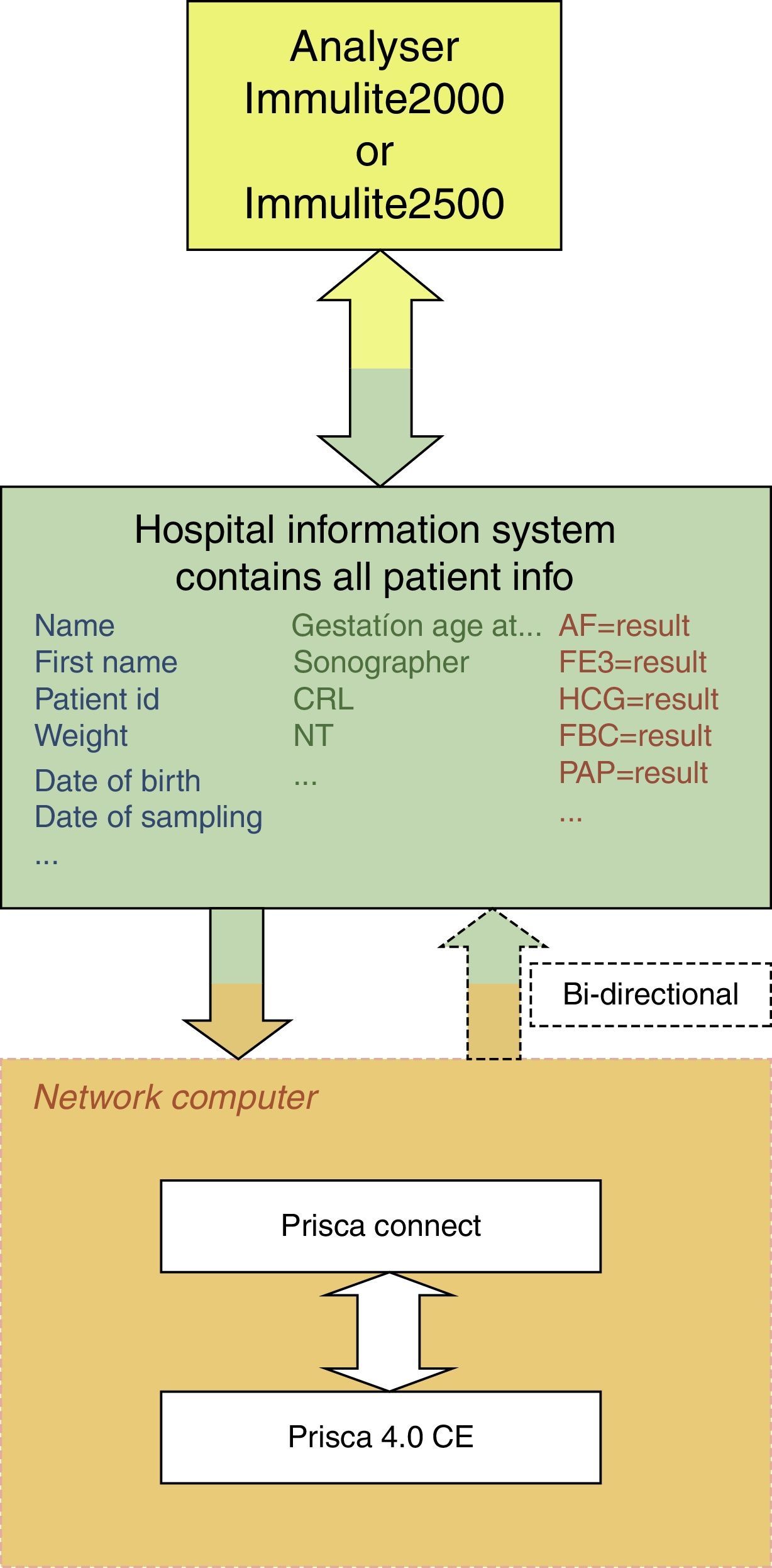
Los datos clínicos se han recopilado de la historia clínica electrónica (SIAS) disponible en nuestro hospital y de los datos recogidos en la base de datos del programa PRISCA (fig. 1).
Esta técnica de cribado se aplica a toda gestante del Departamento de Salud de La Ribera que se encuentra entre la semana 11 y 13+6 de gestación, y acude a realizarse la ecografía del primer trimestre al Servicio de Ginecología y Obstetricia. A su vez, se le extrae un tubo de sangre para la determinación de los marcadores bioquímicos en el laboratorio.
Los ecógrafos utilizados son: PHILIPS IU22, VOLUSON E6 y SIEMENS SONOLINE G40.
Con la ecografía se determina la longitud cráneo-caudal y la TN del feto. Estos datos son imprescindibles para el cálculo del riesgo. Otros datos necesarios de la historia clínica materno-obstétrica para el cálculo del mismo son: la fecha de nacimiento, la raza, el peso, si es fumadora, si padece diabetes mellitus, si la gestación procede de una FIV y si se trata de un embarazo gemelar.
Posteriormente, el mismo día o todo lo más en los 2-3 días siguientes, la paciente acude al laboratorio para la extracción sanguínea para la posterior determinación de los marcadores bioquímicos (subunidad beta libre de gonadotropina coriónica humana y proteína A plasmática asociada al embarazo).
Las determinaciones de los parámetros analíticos se realizan en la plataforma Inmulite 2000 (Siemens).
La determinación de beta-hCG libre se realiza por análisis secuencial inmunoturbidimétrico, con 2 sitios de unión quimioluminiscente en fase sólida, con una sensibilidad de 0,1ng/ml. Para ello se utilizan 2 tipos de anticuerpos, anticuerpos monoclonales murinos anti beta-hCG libre y anticuerpos policlonales de cabra anti beta-hCG libre.
La determinación de la proteína A plasmática asociada al embarazo es un ensayo enzimático inmunométrico quimioluminiscente en fase sólida, con una sensibilidad de 0,025mIU/ml, empleando anticuerpos monoclonales murinos anti PAPP-A.
Cálculo del riesgoUna vez obtenidos los valores de los marcadores bioquímicos y ecográficos se calcula el riesgo estadístico que tiene la gestante de ser portadora de un feto con cromosomopatía (trisomía del cromosoma 21 o síndrome de Down, trisomía del cromosoma 18 o síndrome de Edwards).
Para la realización de este cálculo se utiliza el programa informático PRISCA Connect, proporcionado por Siemens, software para automatizar la evaluación del riesgo por conectividad del SIL del Laboratorio (OMEGA y, posteriormente, SERVOLAB) con el software PRISCA 4. Una vez que los datos demográficos de los pacientes y los resultados de las pruebas del sistema IMMULITE han sido transferidos a PRISCA Connect, se calculan los múltiplos de la mediana (MoM) y los riesgos y se transfieren a las tablas de las bases de datos de PRISCA 4.
El programa utiliza un modelo matemático que se basa en la comparación de 2 poblaciones, una población de embarazadas portadoras de fetos afectos de trisomía 21 o trisomía 18 y otra población de gestantes con fetos no afectos.
Los resultados de cada marcador se expresan en MoM, esto se calcula con respecto a la mediana de la población de gestantes de la misma edad gestacional. Es por tanto muy importante la correcta datación de la edad gestacional. El programa PRISCA utiliza el algoritmo de la Fetal Medicine Foundation para dicho cálculo a partir del dato de la longitud cráneo-caudal ecográfica.
Posteriormente los MoM tienen que corregirse en función de los factores que influyen en la concentración sérica de los marcadores bioquímicos: el peso materno (Wenstrom et al., 1995), la raza (Spencer et al., 2005a), el hábito tabáquico (Spencer et al., 2004) y si padece diabetes mellitus tipo 1 (Spencer et al., 2005b), si el embarazo es gemelar (Chasen et al., 2007) o ha sido por FIV (Tul y Novak-Antolic, 2006).
Se considera un riesgo alto para síndrome de Down un valor igual o superior a 1/250, y para síndrome de Edwards un valor igual o superior a 1/100, y a esas pacientes se les ofrece la posibilidad de realizarse una amniocentesis para el estudio del cariotipo.
Los cariotipos se realizan en un laboratorio externo a partir de las metafases obtenidas del cultivo celular del líquido amniótico, vellosidad corial o aborto procedente de la gestante que se ha sometido a una IVE por resultado de cariotipo con cromosomopatía.
Estudio de costesPara el estudio de costes del cribado de primer trimestre se ha tenido en cuenta la Ley de Tasas 16/2010 del 27 de diciembre 2011 de la Generalitat Valenciana, que cifra en 650 euros el precio de la realización de una amniocentesis y el cariotipado, frente a 52 euros que fijamos para la determinación de los marcadores bioquímicos del primer trimestre en nuestro laboratorio.
Si se hubiera realizado amniocentesis y cariotipado a todas las pacientes del estudio el coste económico hubiera sido de 1.804.400 euros, frente al coste de realización de amniocentesis y cariotipado a los pacientes a los que el resultado del cribado fue de riesgo alto, que fue de 69.550 euros, a los que habría que sumar el gasto ocasionado por la realización del cribado prenatal a toda la población de gestantes, que sería de 144.352 euros. El total sería de 213.902 euros.
Como se deduce de los datos anteriores, la realización de la prueba de cribado supone un coste-beneficio importante a tener en cuenta.
ResultadosDel total de gestantes estudiadas 234 pacientes mostraron un riesgo elevado, 195 pacientes mostraron riesgo elevado para síndrome de Down (83,3%) y 19 pacientes mostraron riesgo elevado para síndrome de Edwards (8,1%). En 20 casos (8,6%) se obtuvo un riesgo alto para ambos síndromes.
Un total de 23 pacientes (9,8%) renunciaron a la realización de pruebas invasivas.
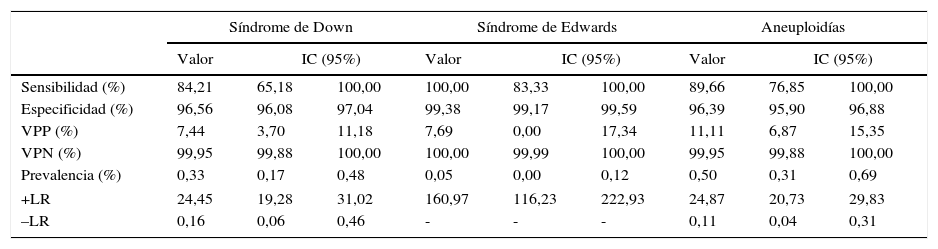
Se obtuvieron para síndrome de Down y para síndrome de Edwards, respectivamente; VP: 16 y 3; FP: 199 y 36; VN: 5.580 y 5.759; FN: 3 y 0. La sensibilidad para ambos fue del 84,2% y 100% respectivamente y la especificidad del 96,6% y 99,4% (tabla 1).
Resultados de datos estadísticos para síndrome de Down, síndrome de Edwards y riesgo total de aneuploidies
| Síndrome de Down | Síndrome de Edwards | Aneuploidías | |||||||
|---|---|---|---|---|---|---|---|---|---|
| Valor | IC (95%) | Valor | IC (95%) | Valor | IC (95%) | ||||
| Sensibilidad (%) | 84,21 | 65,18 | 100,00 | 100,00 | 83,33 | 100,00 | 89,66 | 76,85 | 100,00 |
| Especificidad (%) | 96,56 | 96,08 | 97,04 | 99,38 | 99,17 | 99,59 | 96,39 | 95,90 | 96,88 |
| VPP (%) | 7,44 | 3,70 | 11,18 | 7,69 | 0,00 | 17,34 | 11,11 | 6,87 | 15,35 |
| VPN (%) | 99,95 | 99,88 | 100,00 | 100,00 | 99,99 | 100,00 | 99,95 | 99,88 | 100,00 |
| Prevalencia (%) | 0,33 | 0,17 | 0,48 | 0,05 | 0,00 | 0,12 | 0,50 | 0,31 | 0,69 |
| +LR | 24,45 | 19,28 | 31,02 | 160,97 | 116,23 | 222,93 | 24,87 | 20,73 | 29,83 |
| –LR | 0,16 | 0,06 | 0,46 | - | - | - | 0,11 | 0,04 | 0,31 |
CI: intervalo de confianza; LR: likelihood ratio; VPN: valor predictivo negativo; VPP: Valor predictivo positivo.
La tasa de falsos positivos fue del 3,4% y del 0,6% respectivamente.
De los casos en que ambos marcadores eran positivos el 50% resultaron ser falsos positivos; el diagnóstico fue de trisomía 21 en el 30%, de trisomía 18 en el 10% y hubo un caso (5%) de síndrome de Patau (trisomía 13) y otro (5%) de síndrome de Klinefelter (47XXY).
ConclusionesEl test combinado del primer trimestre es una herramienta muy eficaz, que nos permite seleccionar a las gestantes con un riesgo elevado de ser portadoras de un feto con cromosomopatía con una sensibilidad, especificidad y valor predictivo negativo elevado.
Teniendo en cuenta que en nuestra sociedad la edad materna cada vez es más tardía para las gestaciones, el adoptar un método de cribado resulta económicamente más rentable que la realización de técnicas invasivas por cuestiones de edad.
La precocidad a la hora de la detección, ya que se realiza en el primer trimestre, es una ventaja a la hora de adelantar los procedimientos diagnósticos invasivos, y el impacto emocional en el caso de IVE será menor.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.