La hormona antimulleriana representa un marcador pronóstico de pobre respuesta en ciclos de estimulación ovárica. El objetivo principal del estudio es conocer el valor de la hormona antimulleriana como predictor de respuesta a la estimulación ovárica controlada. Como objetivos secundarios se plantean comparar ese valor predictivo de la AMH con el de RFA y la FSH y su valor como predictores de resultados clínicos (probabilidad de gestación).
Material y métodosEstudio retrospectivo observacional con un total de 220 casos de mujeres que acudieron desde enero de 2012 hasta diciembre de 2013 a la Unidad de Reproducción Asistida del Hospital General Universitario de Alicante para tratamiento de estimulación ovárica controlada.
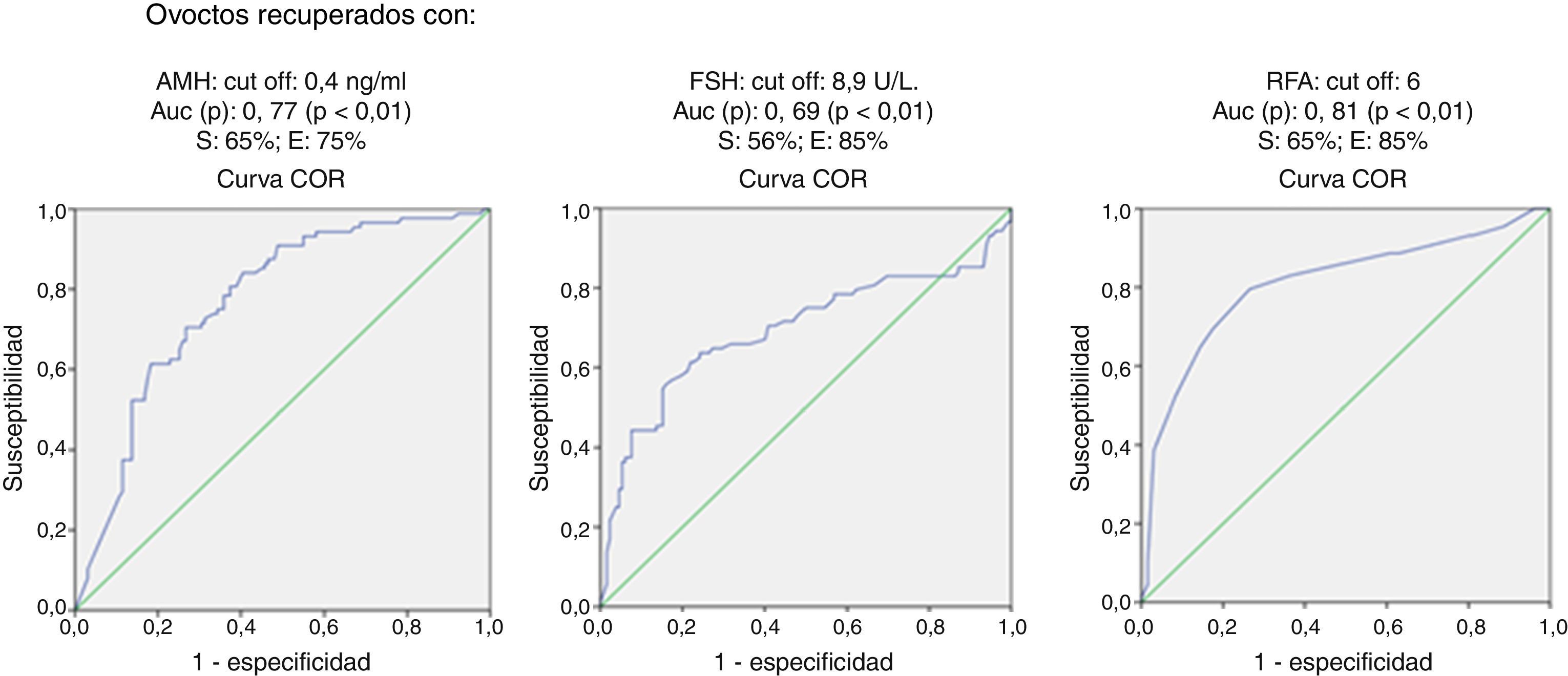
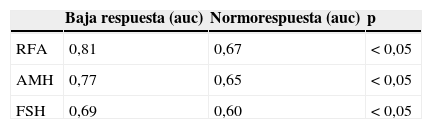
ResultadosRealizamos una curva ROC para ver la especificidad y sensibilidad de la AMH, RFA y FSH para valorar la baja respuesta en función de los ovocitos recuperados, encontrando que el RFA (ROC auc: 0,81, p<0,01) es mejor predictor de respuesta ovárica que la AMH (ROC auc: 0,77, p<0,01) y FSH (ROC auc: 0,69, p<0,01). Ninguno de los parámetros de la reserva ovárica estudiados se correlaciona con la probabilidad de gestación.
ConclusionesLos niveles séricos de AMH y el recuento ecográfico de folículos antrales predicen la respuesta a la estimulación ovárica, siendo el RFA el mejor predictor. Ambos test de reserva ovárica permiten diferenciar la normo de la pobre respuesta a la EOC, siendo el RFA el mejor predictor de baja respuesta, estableciendo un punto de corte para el RFA de 6 folículos.
Anti-Müllerian hormone (AMH) levels may represent the ovarian follicular pool and could be a useful marker of ovarian reserve. The present study aims to compare serum AMH levels with other ovarian reserve markers and to determine the cut-off values of these markers for predicting ovarian response in controlled ovarian hyperstimulation in an in vitro fertilization program. Secondary objectives are to compare the predictive values of AMH with antral follicle count (RFA) and follicle stimulating hormone (FSH), as well as their value as predictors of clinical outcome (probability of pregnancy).
Material and methodsA retrospective observational study was conducted on 220 cases of women undergoing controlled ovarian hyperstimulation (COH) program from January 2012 to December 2013 in Alicante Hospital.
ResultsA ROC curves were calculated to determine specificity and sensitivity of AMH, FSH and RFA in order to assess the low response in terms of retrieved oocytes, finding that the RFA (ROC AUC: .81, P<.01) is a better predictor of ovarian response than AMH (ROC AUC: .77, P<.01) and FSH (ROC AUC: .69, P<.01).
ConclusionsSerum levels of AMH and RFA predict the response to ovarian stimulation, with RFA being the best predictor. Both tests of ovarian reserve differentiate normal/poor response to COH, with the RFA at a cut-off level of 6 follicles being the best predictor of low response.
Poder predecir la respuesta a la estimulación ovárica controlada (EOC) en pacientes que se encuentran sometidas a técnicas de reproducción asistida (TRA) in vitro es útil para brindar un asesoramiento de las probabilidades de éxito del tratamiento, así como para optimizar los protocolos de estimulación, ofreciendo a cada paciente el mejor tratamiento según sus características individuales para maximizar sus posibilidades de embarazo y eliminar los riesgos.
Numerosos test de reserva ovárica han sido propuestos para predecir la respuesta a la estimulación ovárica (número de ovocitos recuperados) y probabilidad de gestación en ciclos de FIV/ICSI. Los indicadores de reserva ovárica más comunes son la hormona folículo estimulante (FSH) y el estradiol cuantificados en suero en el día 3 del ciclo. El valor predictivo de estos marcadores sigue siendo motivo de controversia, y la toma de muestras en suero requiere días específicos durante el ciclo (Broekmans et al., 2006). Estos parámetros fueron los más utilizados durante mucho tiempo, pero su escaso valor predictivo, sus variaciones intraciclo, la disparidad entre los diferentes ensayos de laboratorio o la falta de un claro punto de corte (Bancsi et al., 2002; La Marca y Sunkara, 2013; Mutlu et al., 2013) han limitado su uso.
El número de folículos antrales en la fase folicular precoz se correlaciona directamente con la reserva ovárica (Frattarelli et al., 2003), y la disminución del mismo detectada con ecografía transvaginal es un signo de envejecimiento ovárico, que puede ser detectado antes del incremento de los niveles séricos basales de FSH (Mutlu et al., 2013). De esta manera, Tomas y Chang, hacia 1997, introducen el término «recuento de folículos antrales» como método no invasivo y fácil de realizar, que proporciona información sobre la respuesta ovárica antes de iniciar la estimulación con GNF en TRA. Varios trabajos publicados correlacionan de forma eficaz el pool de folículos antrales (mayores de 1-2mm) visualizados por ecografía, con el pool de folículos primordiales obtenidos a partir de piezas quirúrgicas (Hansen et al., 2011). Se ha demostrado que un RFA entre 3 y 7 folículos refleja una reducción significativa de la reserva ovárica y, por lo tanto, una pobre respuesta a la EOC en ciclos de FIV (Bancsi et al., 2002; Frattarelli et al., 2003; Mutlu et al., 2013; Muttukrishna et al., 2005).
Por tanto, el RFA provee una mejor información pronóstica de baja respuesta ovárica durante las TRA que la obtenida con la edad y la FSH. No obstante, la ultrasonografía y su interpretación es operador dependiente y puede no ser constante.
La hormona antimulleriana (AMH), también llamada sustancia inhibidora de Müller, pertenece a la superfamilia del factor de crecimiento transformante-p (TGF-p) y se considera un factor de crecimiento local y de diferenciación celular. Esta hormona es producida por las células de la granulosa de folículos primordiales, preantrales y antrales tempranos (Durlinger et al., 2002; Mutlu et al., 2013), siendo los folículos de 3-7mm de diámetro los que mejor se correlacionan con los niveles de esta hormona. Sus niveles en sangre no se ven afectados a lo largo del ciclo ovárico por la administración de esteroides exógenos (tratamientos con GnRH agonistas o la toma de anticonceptivos orales) o durante el embarazo (La Marca et al., 2010). En 2002 se empezaron a publicar los primeros trabajos que correlacionaban la AMH con respuesta ovárica en ciclos FIV (Seifer et al., 2002).
Recientemente numerosos estudios han demostrado que el RFA y la AMH son los marcadores que mejor se correlacionan con la respuesta a la estimulación ovárica en ciclos de TRA (Arce et al., 2013; Bonilla-Musoles et al., 2010; Broekmans et al., 2006; Broer et al., 2009; Broer et al., 2013; Hansen et al., 2011; La Marca et al., 2010; La Marca y Sunkara, 2013; Nardo et al., 2009). La identificación de pacientes con alta o baja respuesta permite optimizar los protocolos de estimulación ovárica, disminuir la tasa de cancelación de ciclo y reducir efectos adversos, como el síndrome de hiperestimulación ovárica, y por tanto hacerlos más coste-eficientes.
Dada la controversia persistente a la hora de valorar la eficacia de los diferentes marcadores, y la gran variabilidad existente para establecer los puntos de corte, nos hemos planteado realizar este estudio retrospectivo. Así, el objetivo principal del estudio es conocer el valor de la hormona antimulleriana como predictor de baja respuesta a la estimulación ovárica en ciclos de fecundación in vitro/microinyección intracitoplasmática (FIV/ICSI). Como objetivos secundarios nos planteamos comparar ese valor predictivo de la AMH con el de RFA y FSH y su valor como posible predictor de gestación.
Material y métodosSe realizó un estudio retrospectivo observacional que incluyó un total de 220 casos de mujeres que acudieron desde enero de 2012 hasta diciembre de 2013 a la Unidad de Reproducción Asistida del Hospital General Universitario de Alicante para tratamiento de estimulación ovárica en ciclos FIV/ICSI.
Las mujeres seleccionadas debían de cumplir unos criterios de inclusión: 1) mujeres entre 18 y 40 años, ambos incluidos; 2) no cirugías ováricas previas; 3) no exposiciones previas a radioterapia y/o quimioterapia; 4) ambos ovarios presentes en ecografía transvaginal; 5) FSH medida en día 2-4 de un ciclo menstrual previo al inicio de la estimulación; 6) AMH medida en los 6 meses previos al inicio de la estimulación; 7) recuento de folículos antrales medido por ecografía transvaginal en los primeros 5 días de un ciclo previo al inicio de la estimulación.
Como criterio de exclusión: factor masculino severo.
Para contabilizar el número de folículos antrales antes de iniciar el tratamiento se realizó una ecografía transvaginal basal (con un ecógrafo 2D de General Electric Systems LOGIQ 600), siguiendo la sistemática recomendada en los Documentos de Consenso de la SEGO del 2011, en función de las consideraciones clínicas recomendadas por Broekmans et al. (2006).
Por otro lado, se obtuvieron muestras de sangre para la determinación de las concentraciones inmunorreactivas de AMH, FSH y estradiol. Las concentraciones de hormona antimulleriana se determinaron por medio del kit AMH Gen II ELISA (Beckman Coulter Inc, Webster, TX, EE. UU.). La imprecisión intraserie e interserie fue de 3,7 y 4,45% y la sensibilidad de 0,08ng/ml. La muestra de sangre para esta determinación se obtuvo en el día 3 del ciclo previo a la administración de gonadotropinas. Las concentraciones en suero de FSH y estradiol se midieron utilizando un inmunoanálisis de electroquimioluminescencia (Cobas 8000, Roche Diagnostics, Mannheim, Alemania). La imprecisión intraserie e interserie fue de 3,5% y 4,12% respectivamente para FSH y para estradiol 1,9% y 2,8%. La sensibilidad analítica para FSH fue 0,1mUI/ml y para el estradiol 5pg/ml.
En el estudio se incluyeron tanto ciclos con agonistas de GnRH como antagonistas de la misma. Antes de iniciar la estimulación ovárica, en ciclos con antagonistas de GnRH se administró un anticonceptivo previo al inicio de la estimulación, y se introdujo el antagonista el día 5-6 de la estimulación. Para iniciar la estimulación ovárica en ciclo de agonistas se realizó frenado con administración de agonista diario desde la fase lútea del ciclo previo.
La dosis inicial de FSH se decidió en función de la edad, IMC y niveles séricos de FSH, siendo entre 150-225UI en normorrespuesta y 300UI en pacientes con baja respuesta esperada. Se añadió LH solo en aquellas pacientes en las que la respuesta a la estimulación ovárica no fue adecuada (niveles séricos de estradiol bajos respecto a foliculometría o no incremento adecuado de los mismos).
Se realizaron controles seriados cada 48-72h con análisis sanguíneo de estradiol y foliculometrías por ecografía transvaginal, de tal manera que en función de ambos datos se fueron realizando ajustes de las dosis. Cuando se observaron, al menos, 3 o más folículos ≥18mm de diámetro se administró, como inductor de la ovulación, 6.500UI de HCG (Ovitrelle®).
Para la recuperación de los ovocitos se realizó una punción folicular guiada por ultrasonido 36h después de la administración de la HCG (bajo sedación) y se registró el número de folículos reclutados previos a la punción, los ovocitos recuperados, y el número de ovocitos en metafase ii.
Se consideró que existe una pobre respuesta cuando con el ciclo de estimulación ovárica se obtienen igual o menos de 5 ovocitos, una normorrespuesta cuando se obtienen más de 5 ovocitos y se considera una hiperrespuesta cuando recuperamos 15 o más ovocitos.
Los datos se procesaron con el programa de Microsoft Access y Excel como gestores de la base de datos. Dichos datos se volcaron posteriormente al programa estadístico Stadistical Package for Social Sciencies (SPSS) versión 20.0 para Windows para el análisis de los mismos. Se consideró significación estadística cuando p<0,05. Se utilizó el test de Spearmann y el test Chi-cuadrado para las variables no parámetricas y el «t» de Student para las paramétricas.
El equipo de investigación siguió en todo momento los principios éticos básicos de la declaración de Helsinki.
ResultadosSe recogieron un total de 220 ciclos de estimulación. La edad media de las pacientes fue de 35,29±3,57 años.
En nuestra muestra hemos obtenido un 40% (n=88) de baja respuestas, un 47,7% (n=105) son normorrespondedoras y un 12,3% (n=27) son consideradas hiperrespondedoras.
Dado que el tamaño muestral del grupo de hiperrespondedoras es pequeño (n=27), y el objetivo del presente estudio es el manejo de las bajas respondedoras en comparación con las normorrespondedoras, no consideraremos el grupo de hiperrespondedoras en el presente estudio.
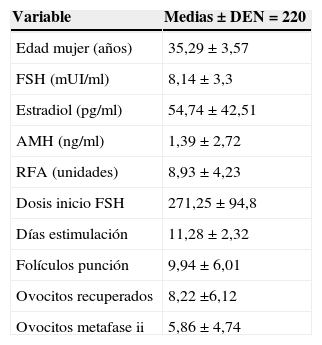
Las características de nuestra muestra de estudio (n=220), media y desviación estándar, quedan reflejadas en la tabla 1.
Características de la población a estudio; parámetros de reserva ovárica y parámetros de respuesta a la estimulación ovárica controlada
| Variable | Medias±DEN=220 |
|---|---|
| Edad mujer (años) | 35,29±3,57 |
| FSH (mUI/ml) | 8,14±3,3 |
| Estradiol (pg/ml) | 54,74±42,51 |
| AMH (ng/ml) | 1,39±2,72 |
| RFA (unidades) | 8,93±4,23 |
| Dosis inicio FSH | 271,25±94,8 |
| Días estimulación | 11,28±2,32 |
| Folículos punción | 9,94±6,01 |
| Ovocitos recuperados | 8,22 ±6,12 |
| Ovocitos metafase ii | 5,86±4,74 |
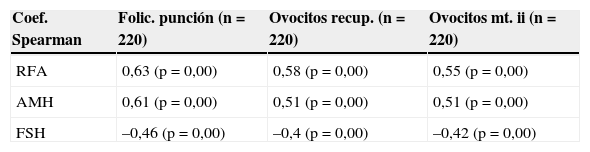
Se correlacionaron las diferentes variables del estudio, AMH, FSH y RFA con el número de folículos el día de la punción, ovocitos recuperados y número de ovocitos en metafase ii. La mejor correlación se encuentra entre el RFA y las 3 variables a estudio: número de folículos el día de la punción (0,63; p<0,05), número de ovocitos recuperados el día de la punción (0,58; p<0,05) y ovocitos en metafase ii (0,55; p<0,05). Así, a mayor número de folículos antrales, más ovocitos recuperaremos y más en metafase ii. El resto de variables (AMH y FSH) presentan coeficientes de correlación inferiores. Los datos se muestran en la tabla 2.
Correlación de las diferentes variables del estudio, AMH, FSH y RFA con el número de folículos el día de la punción, ovocitos recuperados y número de ovocitos en metafase ii
| Coef. Spearman | Folic. punción (n=220) | Ovocitos recup. (n=220) | Ovocitos mt. ii (n=220) |
|---|---|---|---|
| RFA | 0,63 (p=0,00) | 0,58 (p=0,00) | 0,55 (p=0,00) |
| AMH | 0,61 (p=0,00) | 0,51 (p=0,00) | 0,51 (p=0,00) |
| FSH | –0,46 (p=0,00) | –0,4 (p=0,00) | –0,42 (p=0,00) |
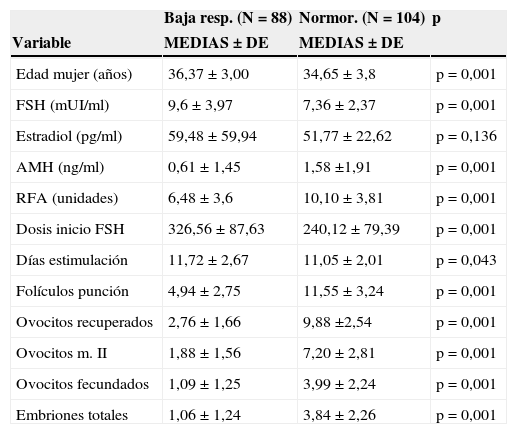
Tal como muestra la tabla 3, comparando el grupo de normorrespondedoras con el de baja respuesta, existen diferencias significativas en todos los parámetros estudiados excepto el estradiol (p=0,136).
Parámetros de reserva ovárica y de estimulación ovárica controlada según criterios de baja respuesta y normorrespuesta
| Baja resp. (N=88) | Normor. (N=104) | p | |
|---|---|---|---|
| Variable | MEDIAS±DE | MEDIAS±DE | |
| Edad mujer (años) | 36,37±3,00 | 34,65±3,8 | p=0,001 |
| FSH (mUI/ml) | 9,6±3,97 | 7,36±2,37 | p=0,001 |
| Estradiol (pg/ml) | 59,48±59,94 | 51,77±22,62 | p=0,136 |
| AMH (ng/ml) | 0,61±1,45 | 1,58 ±1,91 | p=0,001 |
| RFA (unidades) | 6,48±3,6 | 10,10±3,81 | p=0,001 |
| Dosis inicio FSH | 326,56±87,63 | 240,12±79,39 | p=0,001 |
| Días estimulación | 11,72±2,67 | 11,05±2,01 | p=0,043 |
| Folículos punción | 4,94±2,75 | 11,55±3,24 | p=0,001 |
| Ovocitos recuperados | 2,76±1,66 | 9,88 ±2,54 | p=0,001 |
| Ovocitos m. II | 1,88±1,56 | 7,20±2,81 | p=0,001 |
| Ovocitos fecundados | 1,09±1,25 | 3,99±2,24 | p=0,001 |
| Embriones totales | 1,06±1,24 | 3,84±2,26 | p=0,001 |
Realizamos una curva ROC para ver la especificidad y sensibilidad de la AMH, RFA y FSH para valorar la baja respuesta en función de los ovocitos recuperados, encontrando que el RFA (ROC auc: 0,81, p<0,05) es mejor predictor de respuesta ovárica que la AMH (ROC auc: 0,77, p<0,05) y FSH (ROC auc: 0,69, p<0,05) (fig. 1).
Analizando estas curvas consideramos una baja respuesta cuando la FSH≥8,9U/l con una sensibilidad del 56% y una especificidad de 85%. El punto de corte que proponemos de la AMH para predecir una baja respuesta es ≤0,4ng/ml, con una sensibilidad del 65% y una especificidad del 75%. En cuanto al RFA consideramos una baja respuesta cuando su valor es inferior a 6, con una sensibilidad del 65% y una especificidad del 85%.
Cualquiera de los 3 parámetros evaluados (RFA, FSH, AMH) predicen mejor la paciente que va a comportarse como una baja respuesta que la normorrespondedora. Pero aun así el RFA sigue siendo el predictor más robusto (tabla 4).
Con respecto a los resultados clínicos se realizaron 133 transferencias embrionarias con una tasa de gestación del 51,1% y una tasa de embarazo clínico del 44,4%.
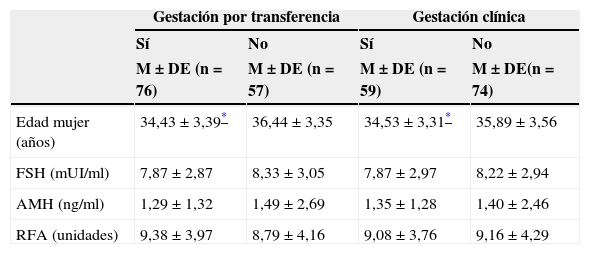
Por último, en la tabla 5 analizamos los parámetros de reserva ovárica (FSH, RFA, AMH y edad) con la probabilidad de gestación (esta a su vez desglosada por transferencia o gestación clínica). Así, observamos que la edad de la mujer es la única variable en la que encontramos diferencias estadísticamente entre mujeres que consiguen o no embarazo clínico.
Parámetros de reserva ovárica en función de gestación (sí o no)
| Gestación por transferencia | Gestación clínica | |||
|---|---|---|---|---|
| Sí | No | Sí | No | |
| M±DE (n=76) | M±DE (n=57) | M±DE (n=59) | M±DE(n=74) | |
| Edad mujer (años) | 34,43±3,39* | 36,44±3,35 | 34,53±3,31* | 35,89±3,56 |
| FSH (mUI/ml) | 7,87±2,87 | 8,33±3,05 | 7,87±2,97 | 8,22±2,94 |
| AMH (ng/ml) | 1,29±1,32 | 1,49±2,69 | 1,35±1,28 | 1,40±2,46 |
| RFA (unidades) | 9,38±3,97 | 8,79±4,16 | 9,08±3,76 | 9,16±4,29 |
M±DE: medias aritméticas±desviación estándar.
Numerosos estudios demuestran que la AMH y el RFA son los 2 mejores test para valorar la respuesta a la estimulación ovárica en ciclos de FIV/ICSI (Arce et al., 2013; Bonilla-Musoles et al., 2010; Broekmans et al., 2006; Broer et al., 2009; Broer et al., 2013; Hansen et al., 2011; La Marca et al., 2010; Nardo et al., 2009). La mayoría de estos estudios se han realizado en pacientes sometidas a EOC con protocolo largo de supresión hipofisaria con agonistas de la GnRH, y muy pocos han estudiado el valor de estos 2 marcadores en ciclos con antagonistas de GnRH (Arce et al., 2013; Lee et al., 2010; Polyzos et al., 2012). En nuestro estudio, y asumiendo que ambos protocolos tienen resultados clínicos comparables, incluimos pacientes en los que la supresión hipofisaria se realizó con ambos (protocolo largo con agonistas y con antagonistas de GnRH). El objetivo principal fue determinar la eficacia de la AMH para predecir la baja respuesta a la estimulación ovárica en ciclos de FIV/ICSI, y compararlo con el RFA y FSH. Al igual que otros autores (Anckaert et al., 2012; Arce et al., 2013; Hazout et al., 2004; Muttukrishna et al., 2005; Smeenk et al., 2007), encontramos una correlación positiva estadísticamente significativa entre los niveles de AMH y RFA con el número de folículos el día de la punción, ovocitos recuperados y número de ovocitos en metafase ii, y una correlación negativa estadísticamente significativa cuando la comparamos con la FSH, siendo la variable que mejor correlaciona con dicha respuesta el RFA seguido de la AMH y FSH.
De las pacientes incluidas en el estudio 105 tuvieron una respuesta normal y 88 una pobre respuesta a la estimulación ovárica. Hasta que se publicaron los criterios de la European Society of Human Reproduction and Embryology (ESHRE) Consensus Conference que establece para definir la baja respuesta a la estimulación ovárica<4 ovocitos obtenidos tras un protocolo de estimulación estándar (Ferraretti et al., 2011), existía en la literatura científica una gran heterogeneidad a la hora definir el concepto de «baja respuesta» a la estimulación ovárica. El número de folículos y/o ovocitos recuperados, tras un protocolo convencional de estimulación ovárica, eran los 2 criterios más frecuentemente utilizados, pero el número propuesto variaba entre los diferentes autores, desde menos de 3 o menos de 6 folículos dominantes el día de la administración de la HCG, y/o menos de 3 o menos de 6 ovocitos recuperados (Ferraretti et al., 2011; Frattarelli et al., 2003). En nuestro trabajo elegimos para definir la baja respuesta el número de ovocitos obtenidos el día de la punción, con un punto de corte menor o igual a 5 ovocitos. Se trata de un estudio retrospectivo, que se diseñó cuando todavía no se utilizaban los criterios de la ESHRE para definir la baja respuesta a la estimulación ovárica, por lo que no se consideraron los mismos, y esta sería la principal limitación de nuestro estudio. Es nuestra intención modificar esto en un próximo trabajo de diseño prospectivo y siguiendo los criterios de Bolognia. Puede ser difícil de asumir catalogar a una mujer con 5 ovocitos obtenidos el día de la punción como una baja respuesta; sin embargo eso solo es el punto de corte máximo considerado, puesto que como se refleja en la tabla 3, el número medio de ovocitos recuperados en el grupo de baja respuesta fue de 2,76±1,66 (vs 9,88±2,54 en normorrespondedoras, p=0,000).
En nuestro estudio el 40% de nuestras pacientes fueron pobres respondedoras, una tasa relativamente alta comparada con otros estudios (Jayaprakasan et al., 2010; La Marca y Sunkara, 2013), aunque similar a la referida por Bonilla-Musoles et al. (2010). La incidencia de baja respuesta en ciclos de FIV/ICSI varía entre 10-20% y la prevalencia varía dependiendo de la edad de la paciente, siendo baja en mujeres de edad<34 años e incrementándose considerablemente conforme aumenta la edad, llegando al 50% en mujeres mayores de 42 años (Ferraretti et al., 2011; La Marca y Sunkara, 2013). Pensamos que la edad media alta de nuestras pacientes (35,29±3,57 años) podría justificar esto en parte, y el hecho de establecer el punto de corte para definir la baja respuesta en la obtención de un número igual o menor de 5 ovocitos, como ya se ha señalado previamente.
La media de los niveles séricos de AMH y RFA fue significativamente mayor en normorrespondedoras comparado con las que tuvieron pobre respuesta. Igualmente, y como era de esperar, los parámetros de respuesta a la estimulación ovárica fueron mucho más favorables en el grupo de normorrespuesta (menores dosis de inicio de FSH y días de estimulación, así como un incremento significativo de folículos seleccionados el día de la punción, ovocitos recuperados, ovocitos en MII y embriones disponibles). Otros autores han llegado a conclusiones similares (Arce et al., 2013; Nelson et al., 2009).
Existe cierta controversia respecto a la capacidad de la AMH comparada con el RFA para predecir la pobre respuesta a la EOC con GNF en ciclos de FIV/ICSI. La AMH es mejor que el RFA en algunos estudios (Arce et al., 2013; Fiçicio¿lu et al., 2006; Mutlu et al., 2013), sin embargo otros reportan resultados similares de los dos marcadores (Jayaprakasan et al., 2010; Muttukrishna et al., 2005) y en 3 el RFA fue superior a AMH (Himabindu et al., 2013; Kwee et al., 2008; Mutlu et al., 2013). Las discrepancias entre los diferentes estudios pueden ser atribuidas a la heterogeneidad de la población de estudio, así como a las diferencias en la definición de la pobre respuesta a la estimulación ovárica. Sin embargo, tras la estandarización en la definición de pobre respuesta se evitará estos factores de confusión.
En nuestro estudio realizamos una curva ROC para determinar la especificidad y sensibilidad de la AMH, RFA y FSH para valorar la baja respuesta en función de los ovocitos recuperados, encontrando que el RFA (ROC auc: 0,81, p<0,01) es mejor predictor de respuesta ovárica que la AMH (ROC auc: 0,77, p<0,01) y FSH (ROC auc: 0,69, p<0,01). Nuestro punto de corte para el RFA capaz de discriminar la pobre de la normorrespuesta fue de 6, con una sensibilidad del 65% y una especificidad del 87%. Estos resultados han sido descritos por otros autores, con un valor del punto de corte de 3 a 7 (Bancsi et al., 2002; Frattarelli et al., 2003; Mutlu et al., 2013; Muttukrishna et al., 2005).
El valor del punto de corte de la AMH para discriminar la baja de la normorrespuesta fue 0,4ng/ml, con una sensibilidad del 56% y una especificidad del 85%. En la literatura el valor del punto de corte de la AMH para predecir la baja respuesta se sitúa entre 0,30 y 1,40 (Barad et al., 2009; Buyuk et al., 2011; Ebner et al., 2006; Fréour et al., 2007; Gnoth et al., 2008; Jayaprakasan et al., 2010; Kwee et al., 2008; La Marca et al., 2010; McIlveen et al., 2007; Mutlu et al., 2013; Nardo et al., 2009; Nelson et al., 2009; Riggs et al., 2011; Smeenk et al., 2007). Parte de esta variabilidad podría atribuirse a los diferentes tipos de métodos de análisis de la AMH (Inmunotech-Beckman Coulter, Diagnostic System laboratorios o más recientemente AMH Gen II), nosotros utilizamos el AMH Gen II, que es el que actualmente se recomienda, lo cual servirá en el futuro para normalizar los resultados y eliminar un factor de confusión. Además, recientes artículos señalan que los niveles de AMH experimentan variaciones a lo largo del ciclo y que estas variaciones no siguen un patrón definido, siendo mayor en mujeres jóvenes, que disminuyen durante la toma de anticonceptivos, independiente de la vía de administración o que podría no ser estable en determinadas condiciones de almacenamiento en el laboratorio (Kallio et al., 2013; Overbeek et al., 2012; Rustamov et al., 2012). En cuanto a la FSH se presenta como el indicador menos potente para predecir la respuesta a la estimulación ovárica controlada; esto, unido a la necesidad de su determinación en un momento específico del ciclo, hace que se pueda suprimir de la batería de pruebas en el estudio de esterilidad.
La fortaleza de nuestro estudio radica en la valoración de la reserva ovárica mediante la hormona antimulleriana en la población española, utilizando el inmunoanálisis AMH Gen II, con el pretratamiento de la muestra, que la hace más estable en las condiciones de procesamiento del laboratorio; hasta ahora solo 2 trabajos publicados utilizan este inmunoanálisis (Arce et al., 2013; La Marca y Sunkara, 2013; Polyzos et al., 2012), y hacerlo con un tamaño muestral importante. Así mismo, también consideramos valioso en este trabajo las curvas ROC, que nos han permitido establecer puntos de corte eficaces para predecir la baja respuesta en nuestra población.
Estos resultados consideramos que son de gran importancia, puesto que ya hemos comentado las limitaciones de la AMH (diferentes métodos de análisis de AMH, variaciones en el ciclo o inestabilidad en el laboratorio) que se han referido en estudios recientes, además de ser un test caro (12 euros por muestra). Sin embargo, el RFA es el mejor predictor de baja respuesta, siendo además un método no invasivo, sencillo y disponible, que lo realizamos de forma rutinaria en pacientes con problemas de fertilidad (Arce et al., 2013; Binder et al., 2012). Broekmans et al. (2010) publicaron un interesante trabajo en el que sugieren una sistemática al realizar RFA, el uso de un enfoque estandarizado para realizar el RFA podría mejorar la reproductibilidad entre observadores y mejorar la clasificación de las pacientes en categorías pronósticas.
La consecuencia práctica derivada de los resultados de este estudio es que actualmente, en nuestra unidad de reproducción, ya no utilizamos los niveles basales de FSH como marcador de reserva ovárica, y en caso de resultados discordantes entre AMH y RFA, o limitaciones de presupuesto (pues estamos en un hospital público con importantes problemas de financiación), el RFA sería para nosotros el mejor predictor respuesta, siendo capaz de identificar la baja respuesta con alta eficacia.
En cuanto al valor de la AMH y RFA para predecir la probabilidad de embarazo en ciclos de FIV/ICSI, en nuestro estudio solo encontramos diferencias significativas en la edad entre mujeres que consiguen o no embarazo clínico. Estos resultados están en sintonía con un reciente metaanálisis publicado por Broer et al. (2013), en el que incluyen 28 estudios y concluyen que la edad es el mejor predictor aislado de la probabilidad de embarazo. Además, los mismos autores concluyen que ni la AMH ni el RFA añaden más información que la edad de la mujer para predecir la posibilidad de gestación tras un ciclo de FIV/ICSI.
Existen muchos factores como la edad, la calidad embrionaria, la técnica de transferencia y la receptividad endometrial que determinan la posibilidad de conseguir un embarazo; sin embargo, la edad materna es el mejor predictor aislado de fertilidad, porque refleja el efecto que sobre la probabilidad de embarazo tienen tanto la reserva folicular como la calidad genética de los ovocitos. Por todo esto, pese a la utilidad del test de reserva ovárica en ciclos de FIV/ICSI para individualizar tratamientos de estimulación ovárica, mejorar el coste-beneficio o disminuir los riesgos relacionados con estos tratamientos, ninguno de ellos predice la posibilidad o no de gestación. De hecho, ha sido ampliamente demostrado que mujeres con pobre respuesta a EOC pueden conseguir embarazos y nacidos vivos, sobre todo si son jóvenes (Mutlu et al., 2013; Oudendijk et al., 2012), por lo que ninguno de estos parámetros debería ser usado para excluir parejas de ciclos de FIV/ICSI.
Como limitaciones que debemos reconocer del presente estudio son: el diseño retrospectivo y, como consecuencia de ello, haber elegido como punto de corte para el diagnóstico de la baja respuesta ovárica la obtención de un número menor o igual a 5 ovocitos (el estudio se diseñó cuando todavía no se utilizaban los criterios de la de la ESHRE Consensus Conference para definir la baja respuesta a la estimulación ovárica, por lo que no se consideraron los mismos).
En conclusión, los resultados de nuestro estudio demuestran que los niveles séricos de AMH y el recuento ecográfico de folículos antrales predicen la baja respuesta a la estimulación ovárica, siendo el RFA el mejor predictor. Ambos test de reserva ovárica permiten diferenciar la normal de la pobre respuesta a la EOC, siendo el RFA el mejor predictor de baja respuesta (con un punto de corte para el RFA de 6, sensibilidad del 65% y una especificidad del 85%). Sin embargo, ninguno de estos marcadores podría ser utilizado para predecir un resultado positivo de un ciclo de FIV/ICSI.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.