Establecer los efectos de la suplementación de vitamina D sobre el perfil lipídico en mujeres con síndrome de ovarios poliquísticos y deficiencia de vitamina D.
Material y métodosSe realizó un estudio doble ciego aleatorizado en mujeres con síndrome de ovarios poliquísticos y deficiencia de vitamina D (concentraciones menores de 20 ng/mL) que fueron asignadas para recibir 5.000 UI diarias de vitamina D o aceite de parafina por 12 semanas. Se compararon características generales, concentraciones hormonales y valores de perfil lipídico antes y después del tratamiento.
ResultadosPara el análisis final se seleccionó a 169 mujeres, 84 mujeres en el grupo A (casos) y 85 mujeres en el grupo B (controles). No se encontraron diferencias significativas entre los grupos en las características generales, concentraciones de hormonas sexuales ni vitamina D (p = ns). En las pacientes del grupo A se observó disminución en las concentraciones de colesterol total, triglicéridos y lipoproteínas de baja densidad después del tratamiento (p < 0,05). No se observaron diferencias significativas en las concentraciones de lipoproteínas de alta densidad (p = ns). Las concentraciones de vitamina D aumentaron en forma significativa (p < 0,0001). No se observaron diferencias significativas en los parámetros del perfil lipídico en las pacientes del grupo B (p = ns).
DiscusiónLa suplementación de vitamina D en mujeres con síndrome de ovarios poliquísticos y deficiencia de vitamina D produce disminución significativa de las concentraciones de colesterol, triglicéridos y lipoproteínas de baja densidad, sin afectar las concentraciones de lipoproteínas de alta densidad.
To establish the effects of vitamin D supplementation on the lipid profile in women with polycystic ovary syndrome and vitamin D deficiency.
Material and methodsA randomised double-blind study was conducted on women with polycystic ovary syndrome and vitamin D deficiency (concentrations less than 20 ng/mL), who were assigned to receive 5,000 IU daily of vitamin D or paraffin oil for 12 weeks. General characteristics, hormonal concentrations and lipid profile values before and after treatment were compared.
ResultsFor the final analysis, 169 women were selected, 84 women in group A (cases) and 85 women in group B (controls). No significant differences were found between the groups in the general characteristics, sex hormone concentrations, or vitamin D (P=ns). After supplementation, the patients in group A showed a decrease in the concentrations of total cholesterol, triglycerides and low-density lipoproteins (P<.05). No significant differences were observed in high-density lipoprotein concentrations (P=ns). Vitamin D concentrations increased significantly (P<.0001). No significant differences in lipid profile were observed in these parameters in patients in group B (P=ns).
DiscussionVitamin D supplementation in women with polycystic ovary syndrome and vitamin D deficiency leads to a significant decrease in the concentrations of cholesterol, triglycerides and low-density lipoproteins, without affecting high-density lipoprotein concentrations.
El síndrome de ovarios poliquísticos (SOPQ) es el trastorno endocrino femenino más común, ya que afecta aproximadamente al 4-18% de las mujeres en edad reproductiva, en función de la población de estudio y los criterios aplicados. Es la causa de importantes alteraciones metabólicas, reproductivas y psicológicas a corto y largo plazo a lo largo de la vida (Moore y Campbell, 2017). Se caracteriza por aumento de la secreción de andrógenos suprarrenales y ováricos, síntomas de hiperandrogenismo como hirsutismo, acné o alopecia, irregularidad menstrual y ovarios poliquísticos. También se asocia con varios trastornos metabólicos, como obesidad, síndrome metabólico, insulinorresistencia, hiperinsulinemia, diabetes mellitus y deficiencia de vitamina D (VitD) (Muscogiuri et al., 2017).
La VitD es un regulador esencial de la homeostasis mineral y ósea. Actúa induciendo la absorción de calcio y fósforo en los intestinos y tiene efectos directos en la formación de los huesos (Reid, 2004). Su deficiencia puede contribuir al desarrollo del síndrome metabólico y a la patogénesis de SOPQ al promover insulinorresistencia y dislipidemia, lo que aumenta el riesgo de desarrollar diabetes mellitus y enfermedades cardiovasculares (Bacopoulou et al., 2017). Estudios en mujeres con SOPQ demuestran que las concentraciones se correlacionan negativamente con el índice de masa corporal, grasa corporal, hiperandrogenismo, función de las células β pancreáticas e insulinorresistencia (Wehr et al., 2011; Bacopoulou et al., 2017). Además, la alteración inducida por la deficiencia de VitD en el calcio intracelular puede contribuir a la disfunción ovulatoria y a las anomalías reproductivas. Por lo tanto, parece que la suplementación de VitD es potencialmente beneficiosa para mejorar las alteraciones metabólicas en las mujeres con SOPQ.
Hasta la fecha, es poco lo que se conoce sobre los efectos de la suplementación de VitD sobre el perfil lipídico en mujeres con SOPQ, por lo que el objetivo de la investigación fue establecer los efectos de la suplementación de VitD sobre el perfil lipídico en mujeres con SOPQ y deficiencia de VitD.
Material y métodosEste estudio clínico, controlado, aleatorizado y doble ciego se realizó en las mujeres con SOPQ que asistieron a las consultas de Ginecología y Endocrinología del Hospital Central Dr. Urquinaona en Maracaibo (Venezuela) en el periodo de enero de 2014 a diciembre de 2017. Todas las participantes fueron evaluadas clínicamente (examen físico general y ginecológico, incluyendo ecografía transvaginal).
Selección de la muestra de pacientesEl diagnóstico de SOPQ fue establecido por los criterios del grupo de consenso (Daan et al., 2014) para su diagnóstico: oligomenorrea (menos de 4 ciclos menstruales en los últimos 6 meses) o amenorrea (ausencia de menstruaciones en los últimos 6 meses), manifestaciones clínicas o hallazgos de laboratorio de hiperandrogenismo (hirsutismo/acné/alopecia) y ovarios poliquísticos en la evaluación ecográfica (definido como presencia de más de 12 folículos que miden 2-9mm de diámetro o volumen ovárico igual o mayor a 10 cm cúbicos) dispuestos en forma periférica y dispersos a lo largo del núcleo denso del estroma (apariencia de collar de quistes foliculares) en la ecografía transvaginal, realizada por 2 médicos del departamento de diagnóstico por imágenes del hospital e independientes a la investigación. Adicionalmente, se seleccionó a las pacientes cuya concentración de VitD antes del inicio del estudio se encontrara por debajo de 20 ng/mL, lo cual se consideró como deficiencia (Bacopoulou et al., 2017).
Las mujeres se excluyeron si tomaban suplementos de VitD o calcio, tenían antecedentes de diabetes, hipertensión no controlada, hipotiroidismo o hipertiroidismo sin tratamiento, enfermedad hepática, osteopenia, osteomalacia, enfermedad renal, enfermedad cardiovascular, hábito tabáquico o consumían más de 2 bebidas alcohólicas por semana, así como las que no cumplieron los protocolos del estudio o no podían consumir más del 80% del tratamiento. Aquellas mujeres que usaban medicamentos que afectan parámetros metabólicos (por ejemplo, metformina, anticonceptivos orales o corticosteroides) fueron excluidas del estudio. Las mujeres con diagnóstico de síndrome de Cushing, hiperplasia suprarrenal congénita, hiperprolactinemia o tumor secretor de andrógenos no fueron incluidas en la investigación. Se aconsejó a todas las participantes que mantuvieran sus hábitos acostumbrados de dieta y estilo de vida, incluida la exposición al sol, actividad física e ingesta dietética de VitD y calcio. Se obtuvo el consentimiento informado por escrito de todas las mujeres después de explicarles el método y los objetivos de la investigación.
Todas las mujeres seleccionadas estuvieron de acuerdo en participar en la investigación y se obtuvo un consentimiento informado por escrito de cada participante. El protocolo del estudio estaba basado en las normas éticas y la Declaración de Helsinki de 1975, revisada en 2004. El Comité de Ética e Investigación de los diferentes centros docentes aprobaron la realización del estudio.
Para el cálculo del tamaño de la muestra se tomó como base la revisión de investigaciones previas, que demostraron una disminución promedio de alrededor del 10% de las concentraciones de los lípidos después del tratamiento de suplementación con VitD. Para alcanzar esta meta, se consideró un error de tipo i (α) de 0,05 y el error de tipo ii (β) de 0,20 (potencia = 80%). Se calculó la muestra en 95 sujetos en cada grupo. Considerando una tasa de deserción del 5% por grupo, se calculó que se necesitaba tener 100 sujetos por grupo.
Para la asignación aleatorizada se utilizó una lista de números aleatorios generada por ordenador. Los sobres sellados y numerados fueron guardados por una persona independiente al estudio, que desconocía los objetivos. Las participantes que fueron asignadas al grupo de estudio (grupo A) recibieron una cápsula de 5.000 UI de colecalciferol (VitD3) diaria por 12 semanas. Las pacientes del grupo control (grupo B) recibieron una cápsula con aceite de parafina. La apariencia (forma, tamaño y color) de las cápsulas utilizadas tanto en el grupo A como el grupo B era idéntica, por lo tanto, las participantes y los investigadores desconocían la asignación a cada grupo. Un laboratorio independiente suministró todos los suplementos para la investigación. Las cápsulas fueron divididas en A y B y colocadas en sobres sellados por una tercera persona ajena al estudio. El tratamiento se entregó a las participantes en el momento de su visita mensual.
Determinación de parámetros clínicosTodas las participantes de ambos grupos fueron consultadas semanalmente por vía telefónica y asistían a la consulta cada 4 semanas. El cumplimiento del consumo del tratamiento se evaluó contando las cápsulas sobrantes de cada paciente. Se les solicitó que mantuvieran sus hábitos de dieta y estilo de vida. Los registros de alimentos consumidos durante 7 días se obtuvieron al principio y al final del estudio y fueron analizados por 2 nutricionistas que formaban parte de la investigación, pero que desconocían a qué grupo pertenecía cada mujer, usando el Programa de Procesamiento de Alimentos y Análisis de Nutrición (Esha Research, EE. UU.). La exposición semanal a la luz solar en el periodo de estudio se estimó usando el cuestionario de exposición al sol, en el cual se les preguntaba a las participantes cuántas horas durante días de semana, fin de semana y en el trabajo pasaban al sol entre las 9 de la mañana y las 5 de la tarde.
Personal entrenado realizó las mediciones antropométricas al inicio y luego de la suplementación. La talla, sin zapatos, se registró con una precisión de 0,1cm con un estadiómetro portátil montado en la pared. El peso se determinó con una aproximación de 0,1kg con un mínimo de ropa en una balanza digital electrónica calibrada. Se calculó el índice de masa corporal (IMC = peso corporal en kilogramos [kg]/talla en metros cuadrados [m2]) y se expresó como kg/m2. La circunferencia de la cintura se estimó en la posición de pie en el punto medio entre el borde superior de la cresta ilíaca y el borde inferior de la última costilla a través de la cinta graduada en cm. De igual forma, la circunferencia de la cadera se estimó, en la posición de pie, como la mayor distancia entre los trocánteres mayores. La relación cintura/cadera se calculó como la circunferencia de la cintura en centímetros dividida por la circunferencia de la cadera en centímetros.
Determinación de parámetros de laboratorioLas muestras de sangre venosa al inicio y tras 12 semanas de tratamiento se tomaron entre las 8:00 y las 11:00 h de la mañana, con las participantes en ayunas. Se realizó la determinación de gonadotropina coriónica en orina para excluir embarazo. La prueba estándar de tolerancia oral a la glucosa (75g) y de la respuesta insulínica a esta sobrecarga, tras 10-12 h de ayuno, fueron realizadas entre las 8:30 y las 10:30 h de la mañana. El resultado de la tolerancia a la glucosa se evaluó utilizando los criterios de la Asociación Americana de Diabetes (Seaquist et al., 2013). Todas las muestras fueron almacenadas a −70°C hasta el momento de la determinación.
Las concentraciones plasmáticas de VitD se midieron con una prueba de ELISA (IDS, Reino Unido) con coeficientes de variabilidad inter- e intraensayo de 4,6 y 6,7%, respectivamente. Todas las hormonas se midieron por métodos basados en inmunoanálisis de electroquimioluminiscencia utilizando el autoanalizador Elecsys2010 (Boehringer Mannheim, Mannheim, Alemania) con reactivos específicos. Los coeficientes de variación intra- e interensayo para cada hormona fueron: hormona foliculoestimulante (1,7 y 4,7%), hormona luteinizante (1,1 y 3,1%), prolactina (2,9 y 4,1%), estradiol (2,1 y 4,5%), testosterona (2,4 y 3,8%), insulina (3,0 y 4,7%) y androstenediona (4,1 y 5,2%), respectivamente. Las concentraciones de sulfato de dehidroepiandrosterona (coeficientes de variación intra- e interensayo 7,5 y 5,5%, respectivamente) y androstenediona (coeficientes de variación intra- e interensayo: 6,8 y 7,2%, respectivamente) fueron medidas con pruebas de inmunoanálisis enzimático (Diagnostic Systems Laboratories, EE. UU.). La 17-hidroxiprogesterona fue medida utilizando una prueba de anticuerpo doble (ICN Pharmaceuticals, EE. UU; coeficientes de variación intra- e interensayo: 5,1 y 7,6%, respectivamente).
Las concentraciones de glucosa se determinaron por método enzimático. Estas mediciones se realizaron utilizando autoanalizador (Hitachi 912, Boehringer Mannheim, Alemania) con reactivos específicos. La resistencia a la insulina en ayunas se evaluó utilizando el modelo de homeostasis (HOMA-IR) y se calculó con la siguiente fórmula: (insulina × glucosa)/22,5. La insulina se midió en pU/ml y la glucosa en mmol/l (Matthews et al., 1985). Las puntuaciones de HOMA-IR por encima de 3,5 fueron interpretadas como insulinorresistencia (Seaquist et al., 2013). El área bajo la curva de insulina y glucemia se calculó de acuerdo con la fórmula que le corresponde a cada figura geométrica, que representa el incremento de las concentraciones plasmáticas posprandiales por encima de las concentraciones basales (Kuranuki et al., 2013). Las concentraciones séricas de colesterol total (CT), de colesterol ligado a lipoproteínas de alta densidad (cHDL), de colesterol ligado a lipoproteínas de baja densidad (cLDL) y de triglicéridos (TG) fueron medidas utilizando el analizador automático Abbott Aeroset (Abbott Diagnostics, EE. UU.). El coeficiente de variación intraensayo e interensayo para todas las pruebas fue menor del 10%.
Análisis estadísticoLas variables continuas se presentan como promedio ± desviación estándar y las categóricas como números absolutos y porcentaje. Se verificó la normalidad de los datos antes del análisis estadístico utilizando la prueba de Kolmogorov-Smirnov. Las comparaciones de las variables continuas entre los 2 grupos distribuidas normalmente se compararon usando la prueba t de Student para muestras no relacionadas, mientras que la prueba U de Mann-Whitney se utilizó para aquellas variables con distribución diferente a la normal. Para la comparación de las variables en cada una de las mediciones (inicial y final) se utilizó la prueba de t de Student para muestras relacionadas o prueba de rango de Wilcoxon. Se utilizó la prueba de Pearson para correlacionar los valores de VitD con los valores de las diferentes variables de laboratorio en cada uno de los periodos de estudio. Por otra parte, las variables categóricas se analizaron usando la prueba de chi-cuadrado o la prueba exacta de Fisher. El porcentaje de cambios en las variables después de la intervención se determinó mediante la fórmula: [(valores finales - valores iniciales)/valores iniciales] × 100. Todos los análisis estadísticos se realizaron con el programa STATA versión 12 (StataCorp, College Station, EE. UU.) Se consideró p menor de 0,05 estadísticamente significativo.
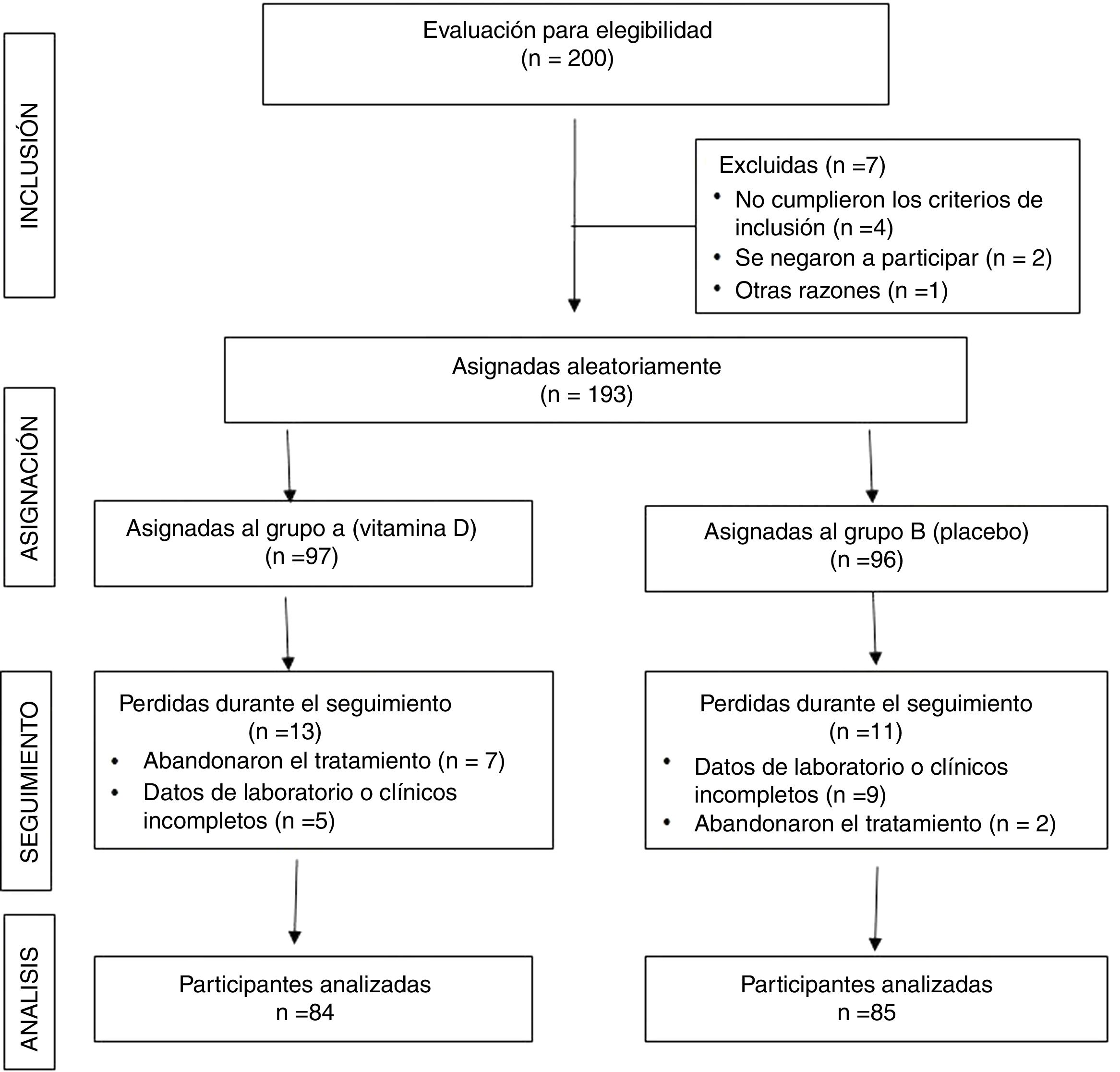
ResultadosSe seleccionó a 200 mujeres (100 mujeres por cada grupo) con diagnóstico de SOPQ y deficiencia de VitD. Se excluyó a 31 pacientes (16 en el grupo A y 15 en el grupo B) por dejar de tomar el tratamiento, no cumplir con el seguimiento de la investigación o no contar con los datos clínicos o de laboratorio completos al final del tratamiento. Esto llevó a que para el análisis final de la investigación se analizaran los datos de 84 mujeres en el grupo A (casos tratados con suplementación de VitD por 12 semanas) y 85 mujeres en el grupo B (controles). El diagrama de flujo de las participantes se muestra en la tabla 1.
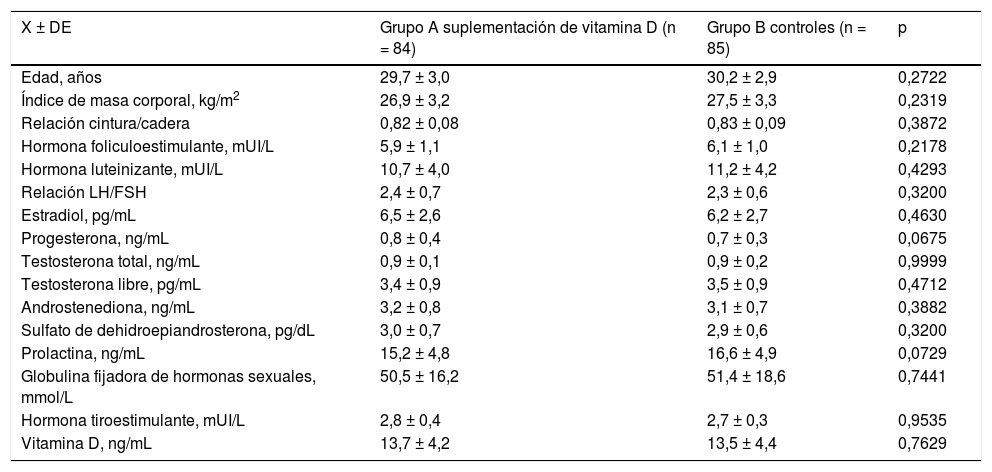
Características generales de los grupos de estudio
| X ± DE | Grupo A suplementación de vitamina D (n = 84) | Grupo B controles (n = 85) | p |
|---|---|---|---|
| Edad, años | 29,7 ± 3,0 | 30,2 ± 2,9 | 0,2722 |
| Índice de masa corporal, kg/m2 | 26,9 ± 3,2 | 27,5 ± 3,3 | 0,2319 |
| Relación cintura/cadera | 0,82 ± 0,08 | 0,83 ± 0,09 | 0,3872 |
| Hormona foliculoestimulante, mUI/L | 5,9 ± 1,1 | 6,1 ± 1,0 | 0,2178 |
| Hormona luteinizante, mUI/L | 10,7 ± 4,0 | 11,2 ± 4,2 | 0,4293 |
| Relación LH/FSH | 2,4 ± 0,7 | 2,3 ± 0,6 | 0,3200 |
| Estradiol, pg/mL | 6,5 ± 2,6 | 6,2 ± 2,7 | 0,4630 |
| Progesterona, ng/mL | 0,8 ± 0,4 | 0,7 ± 0,3 | 0,0675 |
| Testosterona total, ng/mL | 0,9 ± 0,1 | 0,9 ± 0,2 | 0,9999 |
| Testosterona libre, pg/mL | 3,4 ± 0,9 | 3,5 ± 0,9 | 0,4712 |
| Androstenediona, ng/mL | 3,2 ± 0,8 | 3,1 ± 0,7 | 0,3882 |
| Sulfato de dehidroepiandrosterona, pg/dL | 3,0 ± 0,7 | 2,9 ± 0,6 | 0,3200 |
| Prolactina, ng/mL | 15,2 ± 4,8 | 16,6 ± 4,9 | 0,0729 |
| Globulina fijadora de hormonas sexuales, mmol/L | 50,5 ± 16,2 | 51,4 ± 18,6 | 0,7441 |
| Hormona tiroestimulante, mUI/L | 2,8 ± 0,4 | 2,7 ± 0,3 | 0,9535 |
| Vitamina D, ng/mL | 13,7 ± 4,2 | 13,5 ± 4,4 | 0,7629 |
Las características generales iniciales se muestran en la tabla 1. La edad promedio de las pacientes en el grupo A fue de 29,7±3,0 años en el grupo A y de 30,2±2,9 años para el grupo B (p = 0,2722). El IMC para el grupo A y B fue de 26,9±3,2 kg/m2 y de 27,5±3,3 kg/m2, respectivamente (p = 0,2319). No se encontraron diferencias significativas entre los grupos con respecto a relación cintura/cadera, concentraciones de hormona foliculoestimulante ni luteinizante, hormonas sexuales, prolactina y globulina fijadora de hormonas sexuales (p = ns). Las concentraciones de VitD en el grupo A fueron de 13,7±4,2 ng/mL y en el grupo B fue de 13,5±4,4 ng/mL. Tampoco se encontraron diferencias estadísticamente significativas entre los 2 grupos (p = 0,7629).
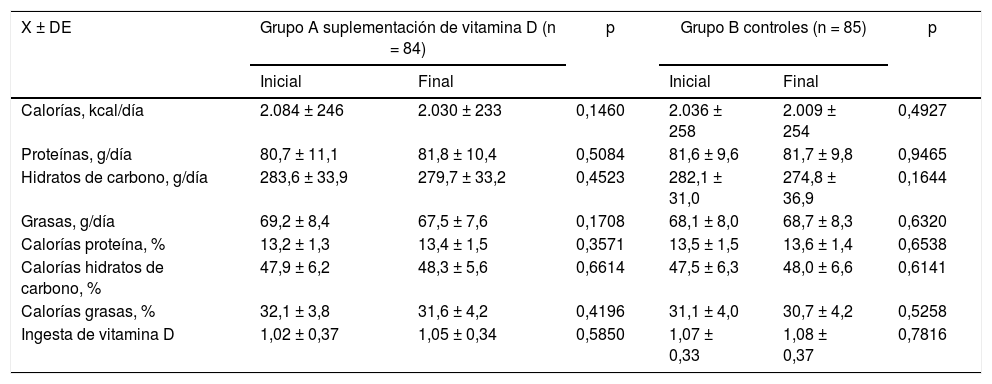
En la tabla 2 se muestran las variables de ingesta dietética en ambos grupos tanto antes como después del tratamiento. No se observaron diferencias significativas entre las mujeres de ambos grupos en los valores de calorías y porcentaje de calorías por proteínas, hidratos de carbono y grasas e ingesta de VitD (p = ns). Tampoco se encontraron diferencias estadísticamente significativas en los valores ya mencionados antes y después del tratamiento entre las mujeres del grupo A y grupo B (p = ns) (fig. 1).
Ingesta dietética de cada grupo al inicio y al final del estudio
| X ± DE | Grupo A suplementación de vitamina D (n = 84) | p | Grupo B controles (n = 85) | p | ||
|---|---|---|---|---|---|---|
| Inicial | Final | Inicial | Final | |||
| Calorías, kcal/día | 2.084 ± 246 | 2.030 ± 233 | 0,1460 | 2.036 ± 258 | 2.009 ± 254 | 0,4927 |
| Proteínas, g/día | 80,7 ± 11,1 | 81,8 ± 10,4 | 0,5084 | 81,6 ± 9,6 | 81,7 ± 9,8 | 0,9465 |
| Hidratos de carbono, g/día | 283,6 ± 33,9 | 279,7 ± 33,2 | 0,4523 | 282,1 ± 31,0 | 274,8 ± 36,9 | 0,1644 |
| Grasas, g/día | 69,2 ± 8,4 | 67,5 ± 7,6 | 0,1708 | 68,1 ± 8,0 | 68,7 ± 8,3 | 0,6320 |
| Calorías proteína, % | 13,2 ± 1,3 | 13,4 ± 1,5 | 0,3571 | 13,5 ± 1,5 | 13,6 ± 1,4 | 0,6538 |
| Calorías hidratos de carbono, % | 47,9 ± 6,2 | 48,3 ± 5,6 | 0,6614 | 47,5 ± 6,3 | 48,0 ± 6,6 | 0,6141 |
| Calorías grasas, % | 32,1 ± 3,8 | 31,6 ± 4,2 | 0,4196 | 31,1 ± 4,0 | 30,7 ± 4,2 | 0,5258 |
| Ingesta de vitamina D | 1,02 ± 0,37 | 1,05 ± 0,34 | 0,5850 | 1,07 ± 0,33 | 1,08 ± 0,37 | 0,7816 |
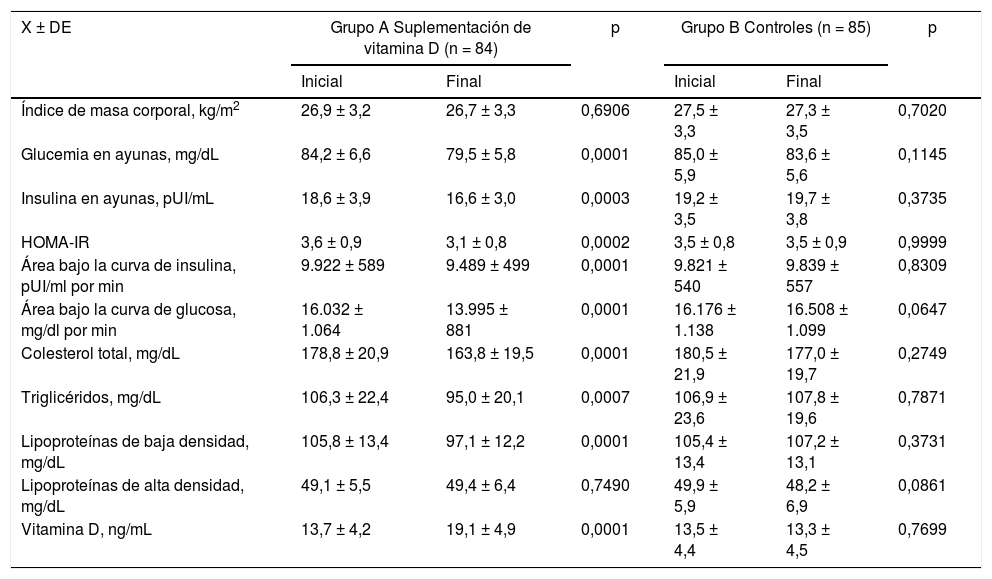
En la tabla 3 se muestran las variables metabólicas y de perfil lipídico en ambos grupos de estudio. En las pacientes del grupo A no se observaron cambios en los valores de IMC ni antes ni después del tratamiento (p = 0,6906). Se observaron disminuciones significativas en los valores de glucemia en ayunas (5%), insulina en ayunas (11%), HOMA-IR (13%), área bajo la curva de insulina (4%) y área bajo la curva de glucosa (14%) (p < 0,05). Con relación al perfil lipídico, se encontró un 8% de disminución en las concentraciones de CT (valor inicial de 178,9±20,0mg/dL comparado con el valor final de 163,8±19,6; p < 0,0001), un 10% en las concentraciones de TG (valor final de 95,0±20,1mg/dl comparado con el valor inicial de 106,3±22,5mg/dL; p < 0,0007) y un 9% en los valores de cLDL (valor inicial de 105,8±13,4mg/dL comparado con el valor final de 97,1±12,2mg/dL; p < 0,0001). No se observaron diferencias significativas en las concentraciones de cHDL ni antes ni después del tratamiento (p = 0,7490). Las concentraciones de VitD aumentaron de 13,7±4,2 a 19,1±4,9mg/mL. Esta diferencia fue estadísticamente significativa (p < 0,0001). En el grupo B no se encontraron diferencias estadísticamente significativas en el IMC, variables metabólicas ni perfil lipídico luego de 12 semanas de seguimiento (p = ns). Tampoco se observaron cambios significativos en las concentraciones de VitD (p = 0,7699) (tabla 4).
Parámetros metabólicos y del perfil lipídico en cada grupo al inicio y al final del estudio
| X ± DE | Grupo A Suplementación de vitamina D (n = 84) | p | Grupo B Controles (n = 85) | p | ||
|---|---|---|---|---|---|---|
| Inicial | Final | Inicial | Final | |||
| Índice de masa corporal, kg/m2 | 26,9 ± 3,2 | 26,7 ± 3,3 | 0,6906 | 27,5 ± 3,3 | 27,3 ± 3,5 | 0,7020 |
| Glucemia en ayunas, mg/dL | 84,2 ± 6,6 | 79,5 ± 5,8 | 0,0001 | 85,0 ± 5,9 | 83,6 ± 5,6 | 0,1145 |
| Insulina en ayunas, pUI/mL | 18,6 ± 3,9 | 16,6 ± 3,0 | 0,0003 | 19,2 ± 3,5 | 19,7 ± 3,8 | 0,3735 |
| HOMA-IR | 3,6 ± 0,9 | 3,1 ± 0,8 | 0,0002 | 3,5 ± 0,8 | 3,5 ± 0,9 | 0,9999 |
| Área bajo la curva de insulina, pUI/ml por min | 9.922 ± 589 | 9.489 ± 499 | 0,0001 | 9.821 ± 540 | 9.839 ± 557 | 0,8309 |
| Área bajo la curva de glucosa, mg/dl por min | 16.032 ± 1.064 | 13.995 ± 881 | 0,0001 | 16.176 ± 1.138 | 16.508 ± 1.099 | 0,0647 |
| Colesterol total, mg/dL | 178,8 ± 20,9 | 163,8 ± 19,5 | 0,0001 | 180,5 ± 21,9 | 177,0 ± 19,7 | 0,2749 |
| Triglicéridos, mg/dL | 106,3 ± 22,4 | 95,0 ± 20,1 | 0,0007 | 106,9 ± 23,6 | 107,8 ± 19,6 | 0,7871 |
| Lipoproteínas de baja densidad, mg/dL | 105,8 ± 13,4 | 97,1 ± 12,2 | 0,0001 | 105,4 ± 13,4 | 107,2 ± 13,1 | 0,3731 |
| Lipoproteínas de alta densidad, mg/dL | 49,1 ± 5,5 | 49,4 ± 6,4 | 0,7490 | 49,9 ± 5,9 | 48,2 ± 6,9 | 0,0861 |
| Vitamina D, ng/mL | 13,7 ± 4,2 | 19,1 ± 4,9 | 0,0001 | 13,5 ± 4,4 | 13,3 ± 4,5 | 0,7699 |
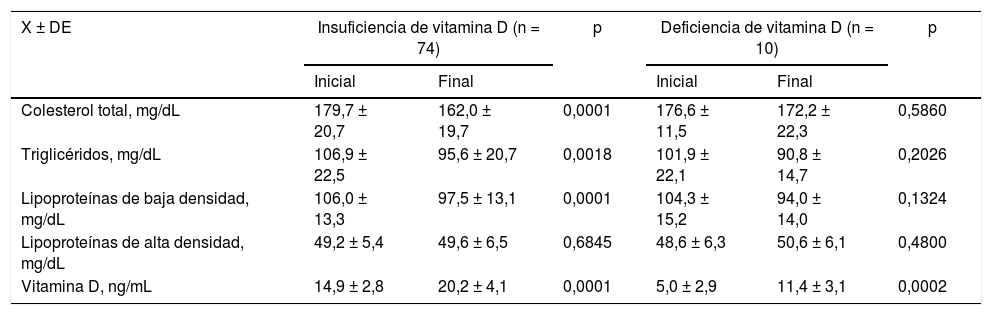
Perfil lipídico al inicio y al final del estudio en pacientes con síndrome de ovarios poliquísticos tratadas con suplementos de vitamina D de acuerdo a las concentraciones de vitamina D iniciales
| X ± DE | Insuficiencia de vitamina D (n = 74) | p | Deficiencia de vitamina D (n = 10) | p | ||
|---|---|---|---|---|---|---|
| Inicial | Final | Inicial | Final | |||
| Colesterol total, mg/dL | 179,7 ± 20,7 | 162,0 ± 19,7 | 0,0001 | 176,6 ± 11,5 | 172,2 ± 22,3 | 0,5860 |
| Triglicéridos, mg/dL | 106,9 ± 22,5 | 95,6 ± 20,7 | 0,0018 | 101,9 ± 22,1 | 90,8 ± 14,7 | 0,2026 |
| Lipoproteínas de baja densidad, mg/dL | 106,0 ± 13,3 | 97,5 ± 13,1 | 0,0001 | 104,3 ± 15,2 | 94,0 ± 14,0 | 0,1324 |
| Lipoproteínas de alta densidad, mg/dL | 49,2 ± 5,4 | 49,6 ± 6,5 | 0,6845 | 48,6 ± 6,3 | 50,6 ± 6,1 | 0,4800 |
| Vitamina D, ng/mL | 14,9 ± 2,8 | 20,2 ± 4,1 | 0,0001 | 5,0 ± 2,9 | 11,4 ± 3,1 | 0,0002 |
No se encontraron correlaciones significativas entre las concentraciones de VitD inicial y los parámetros metabólicos y perfil lipídico ni en las iniciales ni en las finales en las mujeres del grupo A (p = ns).
DiscusiónLas mujeres con diagnóstico de SOPQ son susceptibles de sufrir insulinorresistencia, aumento del estrés oxidativo, inflamación crónica de bajo grado y dislipidemia (Maktabi et al., 2018). Los resultados de la investigación demuestran que la suplementación de VitD por 12 semanas disminuye las concentraciones de CT, TG y cLDL, sin alterar en forma significativa las concentraciones de cHDL en pacientes con SOPQ y deficiencia de VitD. También se observó disminución de la insulinorresistencia en este grupo de mujeres. A pesar de que algunos estudios han evaluado los efectos de la suplementación sobre diferentes parámetros metabólicos en mujeres con y sin SOPQ (Sollid et al., 2016; Azadi-Yazdi et al., 2017), los resultados son contradictorios, al igual que los datos de los efectos sobre el metabolismo lipídico, que son limitados. La VitD puede modificar el perfil lipídico al aumentar la absorción de calcio, lo que a su vez aumentaría la absorción de grasas (Reid, 2004). También produce una mayor sensibilidad a la insulina, mediada por el aumento de los receptores celulares, lo que podría explicar sus efectos beneficiosos potenciales sobre el perfil lipídico (Schnatz et al., 2014).
La deficiencia de VitD parece asociarse a anomalías menstruales en las mujeres con SOPQ (Thys-Jacobs et al., 1999). Esta podría tener un papel importante en los procesos reproductivos, ya que sus receptores se encuentran en útero, oviductos, ovario, placenta y membranas fetales (Jamali et al., 2018). La insuficiencia de VitD en ratas puede reducir el éxito del apareamiento y la fertilidad (Mousa et al., 2016). Los ratones que carecen de receptores y enzimas claves son infértiles y presentan hipoplasia uterina, alteración de la foliculogénesis y anovulación (Hayward et al., 2017; Jamali et al., 2018). Además, la deficiencia conduce a disminución de la apoptosis y al aumento del factor antiapoptosis, que puede alterar la foliculogénesis ovárica normal y propiciar el desarrollo del SOPQ (Thys-Jacobs et al., 1999).
Existe evidencia de asociación entre la deficiencia de VitD y el aumento del riesgo de enfermedad cardiovascular (Zittermann, 2018). Además, diferentes informes en mujeres con SOPQ han demostrado una relación inversa entre las concentraciones de VitD y el riesgo de enfermedad cardiovascular (Figurová et al., 2016). Otros estudios han demostrado que la suplementación de VitD produce efectos beneficiosos sobre la insulinorresistencia y la concentración de lípidos séricos en mujeres con el síndrome (Kotsa et al., 2009; Gupta et al., 2017). Uno de los estudios demostró aumento de la secreción de insulina y de las concentraciones de cHDL y disminución de los valores de HOMA-IR y TG en mujeres con SOPQ. No se detectaron cambios significativos en las concentraciones de CT, cLDL e IMC (Kotsa et al., 2009). Sin embargo, ese estudio no incluyó grupo control y las concentraciones de VitD no aumentaron de forma significativa.
En un estudio en el que se utilizaron 50.000 unidades de colecalciferol en mujeres con SOPQ por 2 meses, se demostró disminución significativa de las concentraciones de CT, TG y cLDL (Rahimi-Ardabili et al., 2013). Otro estudio demostró que las concentraciones de CT y cLDL disminuyeron en forma significativa después de la suplementación de VitD (Karadağ et al., 2018). De igual forma, una investigación previa demostró disminución significativa en las concentraciones de TG y LDLc luego de la administración de la suplementación de 4.000 UI/día de VitD durante 12 semanas comparado con 1.000 UI/día y placebo en mujeres con SOPQ (Foroozanfard et al., 2017). Pero, al igual que en la presente investigación, no encontró ningún efecto significativo sobre los valores de cHDL.
También se ha descrito disminución significativa en las concentraciones de CT con la suplementación de VitD a dosis de 4.000 UI/día durante 12 semanas en pacientes con infección por virus de inmunodeficiencia humana y deficiencia de VitD (Longenecker et al., 2012). Además, la suplementación con dosis altas de VitD (5.000 UI/día) en sujetos con síndrome metabólico por 16 semanas disminuyó las concentraciones de TG, sin cambios en otros elementos del perfil lipídico (Moreira-Lucas et al., 2017). Sin embargo, algunos investigadores no observaron ningún efecto significativo de la administración de VitD en los perfiles lipídicos (Wang et al., 2012). Las diferencias entre los estudios pueden deberse a duración del estudio, características clínicas de las participantes y diferencias en las concentraciones basales de lípidos en la sangre. El SOPQ puede aumentar el riesgo de enfermedad cardiovascular al presentar elevadas concentraciones de CT, cLDL y TG (Daan et al., 2014).
Un hallazgo importante de la presente investigación fue la demostración de que las pacientes con SOPQ e hipovitaminosis D tienen cambios significativos en las concentraciones de CT, TG y cLDL junto con el aumento de las concentraciones de VitD. Este efecto sobre el perfil lipídico no se observó en las pacientes con insuficiencia de VitD a pesar de que sí se encontró un aumento significativo en las concentraciones de VitD. Se desconoce si este hallazgo ha sido descrito por investigaciones previas. La posible explicación a esto es que las concentraciones de VitD probablemente deben llegar a una concentración mínima para realizar sus funciones celulares y modificar sus efectos metabólicos.
De igual forma, los resultados de la presente investigación mostraron que el tratamiento produce una disminución significativa en la concentración de CT, TG y cLDL, sin observarse variaciones significativas en las concentraciones de cHDL, como se demostró en investigaciones previas (Gupta et al., 2017). Es posible que el efecto observado en los indicadores de insulinorresistencia, y en especial el valor de glucemia en ayunas, después de la administración del suplemento de VitD pudieran afectar las concentraciones de CT y cLDL (Karadağ et al., 2018).
En un ensayo previo de los factores de enfermedad cardiovascular en mujeres obesas con SOPQ se presentó disminución significativa en la insulinorresistencia 3 semanas después de una dosis única de VitD (300.000 UI). Esta dosis única aumentó significativamente la concentración de VitD (Selimoglu et al., 2010). Otro estudio demostró que el tratamiento con 20.000 UI de colecalciferol semanalmente durante 24 semanas de mujeres con SOPQ producía aumento de la concentración de VitD a las 12 y 24 semanas, asociado a una disminución significativa en los valores de glucemia en ayunas y HOMA-IR (Wehr et al., 2011). Al igual que los estudios previos, esta investigación demostró modificaciones significativas en los indicadores de insulinorresistencia y concentraciones de insulina en ayunas luego de la suplementación de VitD.
El mecanismo potencial por el cual la suplementación de VitD afecta los marcadores metabólicos y el perfil lipídico podría ser el resultado de acciones directas e indirectas de la VitD en suero, estimulación directa de la liberación de insulina mediante la expresión de VitD y la acción de 25-hiodroxivitamina-D3-1-α- hidroxilasa en las células β del páncreas; a través de la unión del receptor de VitD con el receptor X del ácido retinoico, dando origen a un complejo heterodímero con el 25-hiodroxivitamina-D que activa el receptor de insulina tisular y, por lo tanto, potencia la respuesta de la insulina en el transporte intracelular de glucosa. A todo esto se suma la supresión de la liberación de citocinas proinflamatorias, que se asocia a la insulinorresistencia (Maddaloni et al., 2018). La VitD también tiene un papel indirecto a través de sus efectos sobre la regulación de calcio extra- e intracelular, elemento esencial para el transporte de glucosa en los tejidos diana.
Una de las fortalezas de este estudio es que fue un estudio doble ciego, controlado y aleatorizado de pacientes con diagnóstico de SOPQ y diferentes grados de deficiencia de VitD. No obstante, este estudio tiene algunas limitaciones. Fue realizado en un único centro, con un tiempo de seguimiento corto y se evaluó a un grupo relativamente homogéneo de mujeres con SOPQ y es posible que estos resultados no sean generalizables a otros grupos étnicos. Por otro lado, la evaluación de la insulinorresistencia solo se basó con los valores de HOMA-IR. No se utilizaron pruebas dinámicas directas, como la prueba de tolerancia a la glucosa. Por lo tanto, esto debe tenerse en cuenta en la interpretación de los hallazgos. Para obtener la ingesta los participantes, se utilizó un diario de alimentación por 3 días. Este cuestionario quizá no refleja con exactitud la ingesta dietética habitual, ya que la variación diaria en los individuos puede ser alta, por lo que estos resultados deben interpretarse con precaución.
ConclusiónSe concluye que la suplementación de VitD en mujeres con SOPQ y deficiencia de VitD produce disminución significativa de las concentraciones de CT, TG y cLDL, sin afectar las concentraciones de cHDL. La evidencia del aumento de los valores de VitD, disminución de la insulinorresistencia y modificaciones beneficiosas del perfil lipídico con la suplementación de VitD son indicadoras del posible papel de este tratamiento en el tratamiento del síndrome.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.