Aproximadamente el 50% de las parejas estériles necesitará de técnicas de reproducción asistida para obtener una gestación, las cuales requieren de estimulación ovárica. Esta afecta a la calidad ovocitaria y embrionaria por el desarrollo de folículos de diferentes tamaños y estadios funcionales, que llevan a patrones hormonales diferentes al ciclo folicular natural. Muchos investigadores han adoptado el término luteinización precoz en ciclos de estimulación ovárica para los pacientes con elevación de progesterona (P) en el día del desencadenamiento de la ovulación. Sin embargo, el efecto fisiopatológico de esta elevación es controvertido. En este trabajo hemos querido profundizar en la fisiopatología de la luteinización precoz, analizando su influencia sobre la calidad ovocitaria.
Material y métodosPara ello, se comparan los resultados de los ovocitos donados en mujeres receptoras según procedan los ovocitos de ciclos de donante de estimulación ovárica con luteinización precoz o no, definida esta por diversos marcadores: índice de luteinización prolongada de la P; índice P/n.o folículos; índice P/estradiol e índice P/ovocitos. Además se ajustó un modelo de regresión lineal múltiple paso a paso para la variable dependiente niveles de progesterona el día del desencadenamiento de la ovulación y como variables candidatas los marcadores foliculares que en el análisis univariante de regresión resultaron significativos.
ResultadosNo encontramos diferencias en las tasas de embarazo cuando los embriones son obtenidos a partir de ciclos con o sin luteinización precoz, independientemente del marcador de luteinización precoz utilizado. Tras ajustar un modelo de regresión lineal múltiple paso a paso para la variable dependiente progesterona el día del desencadenamiento de la ovulación, las variables incluidas en el modelo fueron el índice P/n.o folículos y el número de folículos.
ConclusiónConcluimos, por tanto, en primer lugar que la luteinización precoz observada en ciclos de estimulación ovárica parece ser consecuencia tanto del crecimiento de múltiples folículos como del desarrollo de folículos ováricos que tienen un patrón metabólico diferente al de folículos de ciclos naturales. Y en segundo lugar, que el efecto negativo de la LP, evaluada por diferentes índices dentro del mismo estudio, sobre los resultados de ciclos FIV/ICSI parecería deberse a una alteración de la receptividad endometrial, más que a un efecto deletéreo sobre la calidad ovocitaria.
Approximately 50% of infertile couples that wish to have children will need assisted reproductive techniques involving ovarian stimulation. This technique affects oocyte and embryo quality through the development of follicles of different sizes and functional stages, thus creating hormonal patterns that differ from the natural follicular cycle. Many researchers employ the term premature luteinisation to describe the case of patients who, in cycles of ovarian stimulation, present with higher levels of progesterone (P) when ovulation is triggered. However, the pathophysiological effect of this elevation is uncertain. This study examines the pathophysiology of premature luteinisation, analysing its influence on oocyte quality.
Material and methodsA comparison is made of the outcomes for donated oocytes, according to whether they were obtained from ovarian stimulation cycles with or without premature luteinisation, as defined by the following markers: index of prolonged P luteinisation; P/number of follicles; P/oestradiol; and P/oocytes. In addition, a stepwise linear regression model was constructed, in which the dependent variable was levels of P when ovulation was triggered, and the candidate variables, the follicular markers shown to be significant in univariate regression analysis.
ResultsNo differences in pregnancy rates were recorded when the embryos were obtained from cycles with or without premature luteinisation, regardless of the marker considered. After fitting a stepwise multiple linear regression model for the dependent variable P when ovulation was triggered, the variables included in the model were P/number of follicles and the number of follicles.
ConclusionsIt is concluded that the premature luteinisation observed in cycles of ovarian stimulation seems to be the consequence of the growth of multiple follicles, on the one hand, and of the development of ovarian follicles that have a metabolic pattern which differs from that of natural cycle follicles, on the other. It is also concluded that high levels of P are not prejudicial to oocyte quality and that their negative effect on the results of assisted reproduction could arise in the endometrium.
La estimulación ovárica llevada a cabo en las técnicas de reproducción asistida provoca patrones hormonales diferentes al ciclo folicular natural, que afectan negativamente su eficacia. Entre estos cambios se encuentran la luteinización precoz (LP), que hace referencia al incremento de la progesterona sérica (P) al final de la estimulación ovárica, antes del desencadenamiento de la ovulación. Clásicamente se ha definido la LP cuando la P sérica es≥1,2ng/mL el día de la inyección de la hCG (Bosch et al., 2003). Diferentes puntos de corte de la concentración sérica de P se han establecido en la bibliografía de un modo algo arbitrario para definirla, que oscilan entre 0,5 y 2ng/mL (Bosch et al., 2010).
Desde los primeros trabajos publicados, diversos estudios han demostrado que la LP tiene un efecto deletéreo sobre los resultados del ciclo (Melo et al., 2006; Silverberg et al., 1994; Venetis et al., 2015). Sin embargo, estos resultados fueron discutidos por otros investigadores que encontraron que la elevación de la P era irrelevante (Saleh et al., 2009). En 2012 se publicó un metaanálisis que concluyó, tras el análisis de más de 60.000 ciclos, que la P elevada el día de la administración de hCG está asociada con menor probabilidad de embarazo en ciclos de FIV/ICSI con transferencia en fresco (Venetis et al., 2013). Existen 2 posibles explicaciones que justifiquen estos resultados negativos que la LP produce: la alteración de la receptividad endometrial y la disminución de la calidad ovocitaria. Si bien la primera explicación parece claramente demostrada (Van Vaerenbergh et al., 2011; Labarta et al., 2011), la segunda es más controvertida (Ubaldi et al., 1995; Huang et al., 2016). Algunos trabajos han utilizado el modelo de donación ovocitaria, evaluando así separadamente los efectos de la LP sobre el endometrio y el embrión, ya que en estos casos el endometrio en el momento de la transferencia no ha estado expuesto a niveles de P anormalmente elevados (Legro et al., 1993).
Recientemente se han descrito en estudios aislados nuevos marcadores de LP, más allá del criterio «clásico» de la determinación sérica aislada de P el día del desencadenamiento de la ovulación. Entre estos criterios pueden considerarse algunos como: índice de luteinización prolongada de la P (Lee et al., 2014); índice P/n.o folículos>14mm (IPF) (Shufaro et al., 2015); índice P/estradiol (IPE) (Mascarenhas et al.,2015) e índice P/ovocitos en metafase ii (Martínez et al., 2015). En este estudio nos proponemos en un modelo de donación de ovocitos, para controlar el factor endometrial, analizar la influencia de la LP en la calidad ovocitaria. Para ello, partimos de la hipótesis de que la calidad ovocitaria no debería verse afectada si no influye la LP en la maduración folicular.
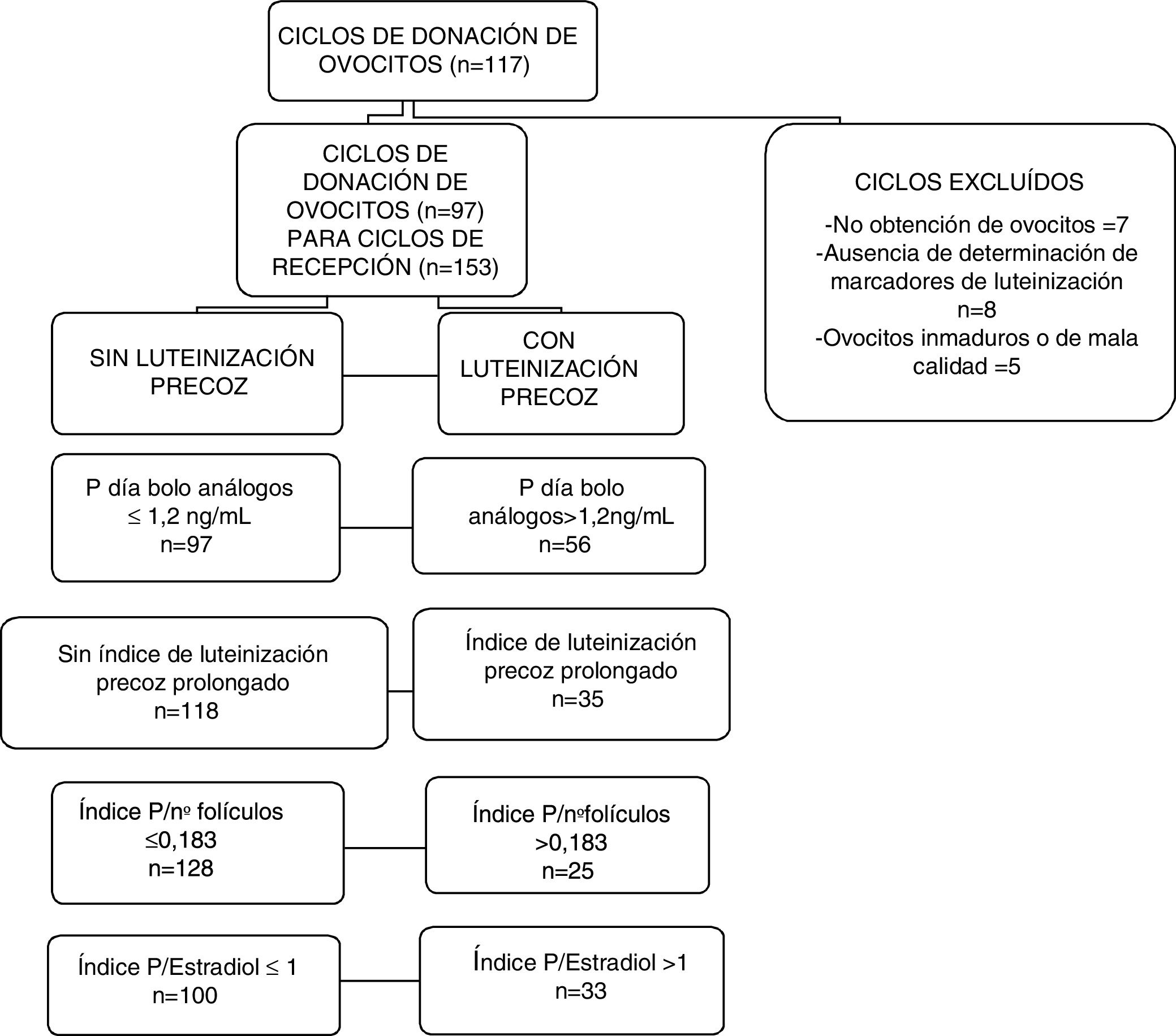
Material y métodosEstudio retrospectivo basado en los resultados del programa de reproducción asistida del Complejo Hospitalario Universitario de Granada entre 2012 y 2015 para poner de manifiesto si la LP repercute negativamente en la calidad embrionaria. Al tratarse de un análisis retrospectivo de una base de datos anónima analizada como una cohorte, no es necesaria la aprobación de un comité de ética para la investigación clínica según la Ley Española (Orden SAS/3470/2009). Se analizaron 117 ciclos de donación de ovocitos, excluyéndose 20 (7 por no obtención de ovocitos, 8 por ausencia de determinación de marcadores de luteinización y 5 por obtención de ovocitos inmaduros o de mala calidad), que dieron lugar a 153 ciclos de recepción de ovocitos, en los que el varón no presentó un factor masculino severo (concentración<5×106 espermatozoides/mL) ni existía enfermedad uterina asociada (fig. 1).
Las donantes siguieron un tratamiento de estimulación ovárica, con el propósito de conseguir un desarrollo folicular múltiple. La estimulación ovárica se llevó a cabo con protocolo de antagonistas de la GnRH de inicio flexible (cuando se visualizó un folículo dominante de 14mm de diámetro) y de dosis múltiple (0,25mg/día desde el inicio hasta el desencadenamiento de la ovulación) y 150UI diarias de FSH. Cuando se visualizaron folículos de 18mm o más de diámetro se desencadenó la ovulación mediante un bolo de análogos de la GnRH (0,2mg de acetato de leuprorelina). Los días 6-7 y el día de la administración del bolo de análogo se realizaron determinaciones séricas de E2 y P para controlar la respuesta ovocitaria.
La recuperación ovocitaria se realizó por punción folicular ecoguiada vía transvaginal 36h después de la administración del análogo, anticipándose a la ovulación. Una vez que los líquidos foliculares llegaron al laboratorio, se inició la búsqueda e identificación del ovocito. Se depositaron los cúmulos en medio de cultivo de maduración IVF Vitrolife (IVF Sciende Scandinavia, Gotheburg, Suecia) hasta la realización de la ICSI. En este momento, se procedió a la asignación de los ovocitos a las receptoras, pudiendo los ovocitos de una donante ser divididos para una o varias receptoras. Para realizar la ICSI se eliminaron el cúmulo y la corona radiada del ovocito.
Para llevar a cabo una adecuada selección del embrión o embriones con mejor potencial implantatorio se evaluaron los mismos según los criterios de la Asociación Española para el Estudio de la Biología de la Reproducción (ASEBIR) revisados en 2008. Dichos criterios consideran embriones de máxima calidad con alta probabilidad de implantación los tipo A, y de menor calidad y mínima probabilidad de implantación los tipo D.
La transferencia embrionaria en fresco a las receptoras se realizó el segundo o tercer día tras la punción de la donante. La preparación endometrial mediante un ciclo hormonal de sustitución se inició en cuanto se produjo la menstruación con una pauta ascendente de valerianato de estradiol (Meriestra®): se administró 2mg/24h durante 8 días, después 3 días (9-11 del ciclo) se administró 2mg/12h y a partir del día 12 se aumentó a 2mg/8h. Se realizaron revisiones ecográficas a los 14 días de iniciar el tratamiento para valorar el endometrio, y cuando el espesor fue≥7mm, se indicó la criotransferencia. Además, 3 días antes de la criotransferencia se administró progesterona natural micronizada vía vaginal 200mg/8h (Progefik® o Utrogestan®). La transferencia se realizó a través del canal cervical, mediante catéter de transferencia (Labotect Labor-Technik-Göttingen, Göttingen, Alemania) en el que se sitúan uno o 2 de los embriones obtenidos, vitrificándose el resto de los embriones obtenidos.
Para definir que un ciclo de recepción de ovocitos de donante procedía de un ciclo con LP, se utilizaron varios criterios: el criterio clásico (concentración arbitraria de P el día del bolo de análogos≥1,2ng/mL); el criterio de luteinización prolongada de la P (P día del bolo de análogos≥1,2ng/mL y P el día 6-7≥0,9ng/mL), el criterio índice P/ovocitos en metafase ii (>0,23), el criterio IPF (>14mm>0,183) y el criterio IPE (>1). Las características del ciclo de estimulación en donantes y los resultados de las transferencias embrionarias en receptoras se analizaron para los 5 criterios anteriores. Las variables cualitativas se describen mediante su valor absoluto (n) y valor relativo (%). La calidad ovocitaria se evaluó mediante tasa de fecundación, calidad embrionaria, tasa de implantación, tasa de gestación y tasa de nacido vivo por transferencia. La determinación de E2 y P se realizó mediante inmunoanálisis (Beckman Coulter). Los coeficientes de variación intra- e interensayo fueron siempre<10%.
Para la comparación entre grupos con o sin LP se utilizó el test de la Chi-Cuadrado o la prueba exacta de Fisher. Además, se calculó la odds ratio y su intervalo de confianza del 95% para evaluar el tamaño del efecto entre los 2 grupos. Las variables cuantitativas se describen mediante media, desviación estándar, máximo y mínimo. Se analizaron las diferencias entre grupos con o sin LP mediante la prueba t de Student o el test de Mann-Whitney, dependiendo de la normalidad de los resultados. La normalidad de la distribución se evaluó mediante la prueba de Shapiro-Wilk. Las diferencias estandarizadas de las medias y sus intervalos de confianza del 95% se calcularon para evaluar el tamaño del efecto. Se consideró significativo un nivel de p<0,05 con ajuste de Bonferroni. Se calculó el coeficiente de regresión (R2), recta de regresión y su intervalo de confianza al 95% para analizar la asociación entre los niveles de P y otros marcadores foliculares. Se ajustó un modelo de regresión lineal múltiple paso a paso para la variable dependiente niveles de P elevados el día del desencadenamiento de la ovulación, y como variables candidatas los marcadores foliculares que en el análisis univariante de regresión resultaron significativos.
ResultadosEl análisis de ciclos de recepción de ovocitos procedentes de ciclos de donantes de ovocitos con LP definida por el índice P/ovocitos en metafase ii no se pudo realizar dado el bajo número (n=6) de ciclos que presentaron LP definido de esta manera. Cuando el criterio empleado para definir LP fue el criterio clásico, observamos niveles superiores de E2 y n.o de folículos>14mm en los ciclos de donación con P≥1,2ng/mL que en los ciclos de donación con P<1,2ng/mL (tabla 1; p<0,05). También resultó estadísticamente significativo el mayor número de ovocitos en metafase ii recibidos en el grupo con LP. No se encontró ninguna diferencia estadísticamente significativa en el resto de variables analizadas en los ciclos de recepción de ovocitos según los ovocitos procedieron de ciclos con o sin LP definido por el criterio clásico (tabla suplementaria 1).
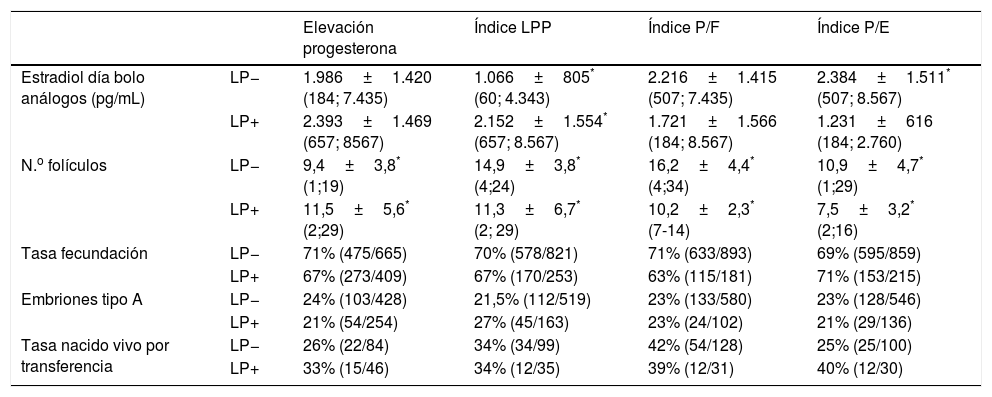
Ciclos de donación y recepción de ovocitos según la aparición de LP, definida por 4 marcadores, durante la estimulación ovárica
| Elevación progesterona | Índice LPP | Índice P/F | Índice P/E | ||
|---|---|---|---|---|---|
| Estradiol día bolo análogos (pg/mL) | LP− | 1.986±1.420 (184; 7.435) | 1.066±805* (60; 4.343) | 2.216±1.415 (507; 7.435) | 2.384±1.511* (507; 8.567) |
| LP+ | 2.393±1.469 (657; 8567) | 2.152±1.554* (657; 8.567) | 1.721±1.566 (184; 8.567) | 1.231±616 (184; 2.760) | |
| N.o folículos | LP− | 9,4±3,8* (1;19) | 14,9±3,8* (4;24) | 16,2±4,4* (4;34) | 10,9±4,7* (1;29) |
| LP+ | 11,5±5,6* (2;29) | 11,3±6,7* (2; 29) | 10,2±2,3* (7-14) | 7,5±3,2* (2;16) | |
| Tasa fecundación | LP− | 71% (475/665) | 70% (578/821) | 71% (633/893) | 69% (595/859) |
| LP+ | 67% (273/409) | 67% (170/253) | 63% (115/181) | 71% (153/215) | |
| Embriones tipo A | LP− | 24% (103/428) | 21,5% (112/519) | 23% (133/580) | 23% (128/546) |
| LP+ | 21% (54/254) | 27% (45/163) | 23% (24/102) | 21% (29/136) | |
| Tasa nacido vivo por transferencia | LP− | 26% (22/84) | 34% (34/99) | 42% (54/128) | 25% (25/100) |
| LP+ | 33% (15/46) | 34% (12/35) | 39% (12/31) | 40% (12/30) |
LP: luteinización precoz.
Índice LPP: índice de luteinización precoz prolongada.
Índice P/F: índice progesterona/folículos> 14mm.
Índice P/E: índice progesterona/estradiol.
La presencia de luteinización prolongada de la P se asoció a valores superiores de E2 y P séricos el día del bolo de análogos en los ciclos de donación. También se asoció la LP a un número inferior de folículos el día del bolo del análogo (tabla 1; p<0,05). No hubo diferencias estadísticamente significativas en el resto de las variables analizadas: ni en las relacionadas con los ovocitos recibidos, ni en la calidad de los embriones obtenidos, ni en el resultado de las transferencias (tabla suplementaria 2). También, el día del desencadenamiento de la ovulación con bolo de análogos se observó valores superiores de E2, y n.o de folículos>14mm en los ciclos de donación con LP definida por el IPF (tabla 1; p<0,05). No hubo diferencias estadísticamente significativas en el resto de las variables analizadas cuando existió LP definida por el IPF (tabla suplementaria 3).
Por último, el día del desencadenamiento de la ovulación con bolo de análogos se observó valores superiores de E2, y n.o de folículos>14mm en los ciclos de estimulación ovárica con LP definida según IPE (tabla 1; p<0,05). No hubo diferencias estadísticamente significativas en el resto de las variables analizadas (tabla suplementaria 4). Observamos una correlación significativa entre los niveles de P el día del desencadenamiento de la ovulación y el n.o de folículos (R2=0,023) (p<0,05), el IPF (R2=0,115)(p<0,05), el E2 (R2=0,047) (p<0,05) y el IPE (R2=0,040)(p<0,05).
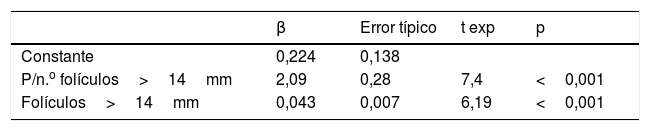
Tras ajustar un modelo de regresión lineal múltiple paso a paso para la variable dependiente P el día del desencadenamiento de la ovulación, las variables incluidas en el modelo fueron el IPF y el n.o de folículos (tabla 2).
DiscusiónNuestros resultados no encuentran diferencias en la calidad ovocitaria de ciclos con o sin LP independientemente del marcador utilizado para definir LP. Según nuestros resultados, la LP en el ciclo de estimulación ovárica, definida por el criterio clásico de elevación de la P, se asocia a niveles más elevados de E2 y a un mayor número de folículos. Esta observación apoya la teoría fisiopatológica que explica la LP como el resultado de la suma de las pequeñas cantidades de P secretadas por la cohorte de folículos maduros en desarrollo, propios de un ciclo de estimulación ovárica controlada. Este resultado apoyaría la conclusión de Wu et al (2012) en su análisis de la influencia del E2 y la P el día de la BhCG, acerca de que el desarrollo de un número elevado de folículos y las concentraciones séricas suprafisiológicas de E2 asociadas pueden conducir a un aumento prematuro de P en la fase folicular tardía. Pero, según esta teoría, la LP debería aparecer preferentemente asociada a los casos con hiperrespuesta, y sin embargo también se describe en casos de respuesta ovárica normal o incluso baja, por lo que actualmente su patogenia no está aclarada. Al ajustar por la intensidad de la respuesta a la estimulación mediante el IPF e IPE, observamos que el E2 es menor cuando existe LP. Del mismo modo, el número de folículos es menor en los casos de LP establecida según el criterio de los índices de LP prolongada, IPF e IPE. Esto es más concordante con la hipótesis acerca de la fisiopatología de la LP, en la cual no tendría por qué asociarse un mayor n.o de folículos y unos niveles mayores de E2 a la elevación de la P, sino que más bien la elevación de P se debe a un patrón metabólico folicular diferente en los folículos de estos ciclos. Estos folículos tendrían aumentada la sensibilidad a la LH, probablemente por un aumento en el número de receptores de LH, que haría que se luteinizaran precozmente, cambiando la producción de esteroides de E2 a P (Elnashar, 2010). Recientemente, Lawrenz et al (2016) observan una mayor incidencia de LP en ciclos que recibieron más unidades de FSH a igual número de ovocitos obtenidos, lo que apoya la idea de que la LP se debe a cambios metabólicos intrafoliculares producidos por un exceso constante de FSH más que a un mayor número de folículos maduros.
Dado que las 2 variables incluidas en el modelo de regresión lineal múltiple para la variable dependiente (niveles de P el día del desencadenamiento de la ovulación) fueron el IPF y el n.o folículos, creemos que la LP se debe tanto al desarrollo de múltiples folículos como a la aparición de folículos con un patrón metabólico diferente. Al analizar los resultados de los ciclos de FIV/ICSI en los ciclos de recepción de ovocitos de donantes, no encontramos diferencias ni en el porcentaje de embriones tipo A, ni en las tasas de recién nacido vivo cuando se transfieren embriones procedentes de ovocitos obtenidos a partir de los ciclos con LP, definida como P sérica el día del bolo de análogos mayor de 1,2ng/mL. Esto proporciona una evidencia indirecta de apoyo a la hipótesis de que el efecto perjudicial de la LP en las tasas de embarazo no sería por afectación de la calidad ovocitaria, sino más bien, por otros factores como un efecto negativo sobre la receptividad endometrial. Este resultado coincide con los observados por otros autores (Elnashar, 2010; Dai et al., 2015) y las conclusiones del metaanálisis de 2013 de Venetis et al (2013).
Tampoco obtenemos diferencias en las tasas de gestación al analizar la duración de la elevación de la P, mediante el índice de elevación prolongada. Nuestros resultados contrastan con los obtenidos por Dai et al (2015), que observaban un descenso en las tasas de gestación a mayor duración de la elevación de la P. Estas discrepancias podrían deberse al diseño utilizado, en su caso mujeres sometidas a FIV con ovocitos propios, mientras que en nuestro caso se trata de receptoras de ovocitos de donantes, cuyo endometrio no está expuesto al posible efecto deletéreo de los altos niveles de P. Por lo que estos autores no pueden delimitar si el efecto negativo de la LP es debido a un defecto en la calidad ovocitaria o la receptividad endometrial. Además, el efecto deletéreo de un aumento prolongando de la P sobre la receptividad endometrial ha sido demostrado por Lee et al (2014) en un modelo de criotransferencias con ciclo natural.
En nuestro estudio, como ya hemos visto, hemos ajustado la P según el número de folículos, utilizando el IPF, ya que diversos autores han sugerido la posibilidad de que la P sérica sea la suma de la P secretada por múltiples folículos y no necesariamente tiene que relacionarse con el empeoramiento del resultado del ciclo (Griesinger et al., 2013).No hemos obtenido diferencias estadísticamente significativas en las tasas de gestación entre receptoras que recibían ovocitos procedentes de ciclos con o sin LP definidos por el IPF. Otros autores que han utilizado este mismo índice han observado, en modelos de ciclos de FIV con ovocitos propios, una menor tasa de gestación con un índice elevado (Shufaro et al., 2015). Estos resultados contrapuestos según el modelo que se utilice (FIV con ovocitos propios o donación de ovocitos), definiendo la LP mediante el IPF, indican un efecto deletéreo del aumento de P sobre la receptividad endometrial y no sobre la calidad ovocitaria.
Por otra parte, actualmente se afirma que el IPE permite identificar un subgrupo de pacientes con P elevada, en la que se harían evidentes los efectos deletéreos de esta, que sería aquel grupo con IPE>1 (Mascarenhas et al., 2015). Sin embargo, en nuestros resultados tampoco observamos diferencias al analizar las tasas de gestación. Estas discrepancias podrían deberse tanto a las diferencias en el punto de corte de P, 1,5ng/mL en su caso frente a 1,2ng/mL en nuestro estudio; como al protocolo de estimulación utilizado. Su estudio incluye a mujeres sometidas a técnicas de reproducción asistida en las cuales se utilizaron diferentes protocolos de estimulación según la edad, IMC y reserva folicular, mientras que en nuestro caso todas las donantes fueron estimuladas con protocolo de antagonista. Dado que en los ciclos con agonistas los niveles de E2 el día del desencadenamiento de la ovulación son más elevados que con antagonistas, podrían explicarse los diferentes resultados obtenidos utilizando este índice (Streda et al., 2009). Existen estudios que afirman que la LP definida mediante el IPE podría estar relacionado con baja reserva ovárica (Younis et al., 2001). Esto no podemos valorarlo en nuestro estudio dado que todas las donantes tenían una edad comprendida entre 19 y 25 años, con una reserva ovárica normal.
Concluimos, por tanto, en primer lugar que la LP observada en ciclos de estimulación ovárica parece ser consecuencia tanto del crecimiento de múltiples folículos como del desarrollo de folículos ováricos que tienen un patrón metabólico diferente al de folículos de ciclos naturales. Y en segundo lugar, que el efecto negativo de la LP, evaluada por diferentes índices dentro del mismo estudio, sobre los resultados de ciclos FIV/ICSI parecería deberse a una alteración de la receptividad endometrial, más que a un efecto deletéreo sobre la calidad ovocitaria.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.