Actualmente, existe una ausencia de evaluaciones económicas en el manejo de la esclerosis múltiple remitente-recurrente en segunda línea. El objetivo del trabajo fue comparar la eficiencia de fingolimod y natalizumab en España.
MétodosSe desarrolló un modelo de minimización de costes en un horizonte temporal de 2 años. La tasa de recaída aplicada fue la misma para los 2 tratamientos y los recursos utilizados fueron calculados a partir de los costes vigentes en España en euros de 2012. Se aplicó la perspectiva del Sistema Nacional de Salud, con un descuento anual del 3% de los costes futuros. Se desarrolló un análisis de sensibilidad para comprobar la consistencia del modelo.
ResultadosLa comparación indirecta de fingolimod con natalizumab no fue significativa (hazard ratio entre 0,82 y 1,07). Los costes directos para el horizonte temporal de 2 años, considerando una tasa media anual de recaídas de 0,22 y el descuento por Real Decreto del 7,5%, fueron de 40.914,72 € para fingolimod y 45.890,53 € para natalizumab. Del total de costes directos valorados, el máximo ahorro por paciente derivado del uso de fingolimod fue de 4.363,63 € y correspondió a la reducción en los costes de administración y mantenimiento. En función del análisis de sensibilidad considerado, fingolimod generó ahorros medios del 11% (rango 3,1%-18,7%).
ConclusionesFingolimod es un tratamiento eficiente de segunda línea para el tratamiento de la esclerosis múltiple remitente-recurrente comparado con natalizumab, generando ahorros para el Sistema Nacional de Salud.
At present, there is a lack of economic assessments of second-line treatments for relapsing-recurring multiple sclerosis. The aim of this study was to compare the efficiency between fingolimod and natalizumab in Spain.
MethodsA cost minimisation analysis model was developed for a 2-year horizon. The same relapse rate was applied to both treatment arms and the cost of resources was calculated using Spain's stipulated rates for 2012 in euros. The analysis was conducted from the perspective of Spain's national health system and an annual discount rate of 3% was applied to future costs. A sensitivity analysis was performed to validate the robustness of the model.
ResultsIndirect comparison of fingolimod with natalizumab revealed no significant differences (hazard ratio between 0.82 and 1.07). The total direct cost, considering a 2-year analytical horizon, a 7.5% discount stipulated by Royal Decree, and a mean annual relapse rate of 0.22, was € 40914.72 for fingolimod and € 45890.53 for natalizumab. Of the total direct costs that were analysed, the maximum cost savings derived from prescribing fingolimod prescription was € 4363.63, corresponding to lower administration and treatment maintenance costs. Based on the sensitivity analysis performed, fingolimod use was associated with average savings of 11% (range 3.1%-18.7%).
ConclusionsFingolimod is more efficient than natalizumab as a second-line treatment option for relapsing-remitting multiple sclerosis and it generates savings for the Spanish national health system.
La esclerosis múltiple (EM) es una enfermedad neurológica inflamatoria, crónica y degenerativa que afecta mayoritariamente a jóvenes y a adultos1 laboralmente activos, limitando su calidad de vida2 y la de sus cuidadores3. Todo ello se traduce en importantes costes directos e indirectos para el Sistema Nacional de Salud (SNS), que aumentan significativamente con el deterioro de la enfermedad4,5. En estudios realizados en España, se ha estimado que el coste promedio total por paciente, actualizado a 2012, oscila entre 29.037 € y 38.596 €, representando los costes directos entre un 60 y un 73,8% del total4,6. Además, se ha observado una relación positiva entre el coste total y la variación en la Escala Expandida del Estado de Discapacidad4,6.
Según los últimos datos publicados en el Atlas of MS1, se estima que globalmente más de 1,3 millones de personas presentan EM, siendo Europa el continente con mayor número de pacientes diagnosticados, 630.000, representando cerca del 48% del total de casos mundiales. En consecuencia, el continente europeo tiene las mayores tasas de incidencia y prevalencia mundiales: con una incidencia de 3,8 casos por cada 100.000 personas-año, observándose un incremento de la incidencia, sobre todo en mujeres, y una prevalencia de 80 casos por cada 100.000 habitantes1.
España tiene una prevalencia de la enfermedad de entre 42-125 casos por cada 100.000 habitantes7,8 y una tasa de incidencia anual que oscila entre los 2,1-5,3 casos por cada 100.000 habitantes7. La patología afecta, en mayor medida, a las mujeres que a los hombres, con una ratio mujeres/hombres de 2,3/11. Asimismo, se estima que el 85-90% de los casos corresponden a EM recurrente-remitente (EMRR)9.
La prevalencia de EM ha aumentado en los últimos años en España, tal y como ha ocurrido en otras regiones del mundo8. Además, se estima que todavía hay un elevado número de casos latentes por falta del adecuado diagnóstico10, implicando una gran cantidad de recursos sanitarios consumidos y afectando a la sostenibilidad del sistema9. Por este motivo, se espera que la búsqueda del tratamiento más adecuado para el manejo de la EM se mantenga como una de las preocupaciones de los gestores sanitarios en los próximos años.
En la actualidad, las investigaciones en nuevos tratamientos para tratar la EM están aumentando, dejando atrás un periodo precedente de pocas innovaciones terapéuticas9. Los principales tratamientos existentes en la actualidad para el manejo de la EMRR en pacientes que no responden a los inmunomoduladores convencionales, o que presentan mucha actividad desde el diagnóstico son natalizumab, de administración inyectable11, y fingolimod, cuya aprobación en 2010 supuso el primer fármaco de administración por vía oral12 para la enfermedad.
La comparación directa de la eficacia de ambos fármacos no es posible en la actualidad por la falta de publicación de este tipo de estudios entre ambos fármacos13. Asimismo, en la comparación indirecta a partir de los resultados de los respectivos ensayos clínicos (FREEDOMS14 para fingolimod y AFFIRM15 para natalizumab) se debe tener en consideración que existen diferencias en el seguimiento de los pacientes, las características basales de los mismos y el diseño de los ensayos clínicos de ambos fármacos16. De este modo, en el estudio FREEDOMS14 los pacientes tenían entre 18-55 años, una o más recaídas en los 2 años previos al estudio, pudiendo haber sido tratados con interferón-beta o acetato de glatirámetro (cuando el tratamiento hubiese sido interrumpido 3 meses antes del inicio del estudio). En el estudio AFFIRM15 se incluyó a pacientes con edad entre 18-50 años, con una o más recaídas en los 12 meses previos al estudio, y uno de los criterios que determinan la población es que se excluyó a los pacientes tratados previamente con interferón-beta o acetato de glatirámetro.
En un metaanálisis reciente realizado por Del Santo et al.13, se comparó indirectamente la eficacia de los medicamentos disponibles en la actualidad para tratar la EM. En el estudio se comparó la eficacia entre fingolimod y natalizumab a partir de los estudios FREEDOMS14 y AFFIRM15, a partir de la variable individuos libres de recaídas a los 12 meses. Los resultados apuntaron a la falta de diferencias significativas en eficacia entre ambos fármacos. En una línea similar, Zintzaras et al.17 realizaron también una comparación entre los tratamientos disponibles en EM, mostrando resultados parecidos a los Del Santo et al.13 en cuanto a la no existencia de diferencias significativas entre fingolimod y natalizumab.
A nivel español, el Grupo de Evaluación de Novedades, Estandarización e Investigación en Selección de Medicamentos, Grupo GÉNESIS, en su evaluación sobre fingolimod18, también concluyó que ambos fármacos son considerados opciones igualmente válidas de tratamiento, por lo que la elección de uno u otro debería ser realizada, principalmente, teniendo en cuenta criterios de eficiencia. Además, se sugería el análisis de minimización de costes como el estudio farmacoeconómico de comparación óptimo entre ambos fármacos.
Todo ello permite considerar que en la actualidad existe una ausencia de evidencias que indiquen la superioridad de uno u otro tratamiento en el manejo de la EMRR. El objetivo de este estudio fue evaluar la eficiencia entre natalizumab y fingolimod como tratamiento para la EMRR en segunda línea dentro del contexto del SNS español.
MétodosAnálisis de minimización de costesSobre la base de la evidencia disponible13,17, la evaluación del Grupo GÉNESIS18, y a falta de diferencias significativas entre la eficacia de fingolimod y natalizumab, se escogió la minimización de costes como análisis farmacoeconómico óptimo para evaluar las diferencias económicas entre ambos tratamientos.
Para realizar el análisis de minimización de costes entre fingolimod y natalizumab se desarrolló un modelo farmacoeconómico a través del programa Microsoft Excel® 2010.
El análisis se realizó desde la perspectiva del SNS, por lo que solo se tuvieron en cuenta los costes sanitarios directos. Los costes directos considerados fueron costes farmacológicos, costes de administración y mantenimiento, costes de las pruebas complementarias y costes de los brotes. Asimismo, todos los costes valorados fueron actualizados a euros del 2012.
El horizonte temporal considerado fue de 2 años y se aplicó un descuento del 3% en los costes estimados en el segundo año, siguiendo las recomendaciones de López-Bastida et al.19 en la evaluación de tecnologías sanitarias.
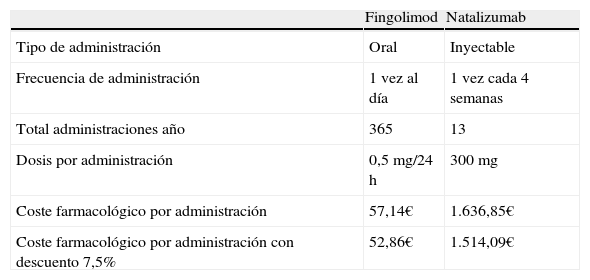
Coste farmacológicoLas opciones terapéuticas comparadas fueron fingolimod por vía oral y natalizumab por vía intravenosa, teniendo en cuenta el número de administraciones indicadas en sus respectivas fichas técnicas11,12 y considerando como escenario base un grado de cumplimiento total para ambos tratamientos. El coste farmacológico fue estimado a partir de los precios unitarios públicos para España disponibles en el Consejo General de Colegios Oficiales de Farmacéuticos expresados como precios de venta del laboratorio (PVL)20 sin IVA, descontando, además, un 7,5%, según se indica en el Real Decreto de Ley 8/201021 (tabla 1).
Coste farmacológico y tipo de administración
| Fingolimod | Natalizumab | |
| Tipo de administración | Oral | Inyectable |
| Frecuencia de administración | 1 vez al día | 1 vez cada 4 semanas |
| Total administraciones año | 365 | 13 |
| Dosis por administración | 0,5mg/24 h | 300mg |
| Coste farmacológico por administración | 57,14€ | 1.636,85€ |
| Coste farmacológico por administración con descuento 7,5% | 52,86€ | 1.514,09€ |
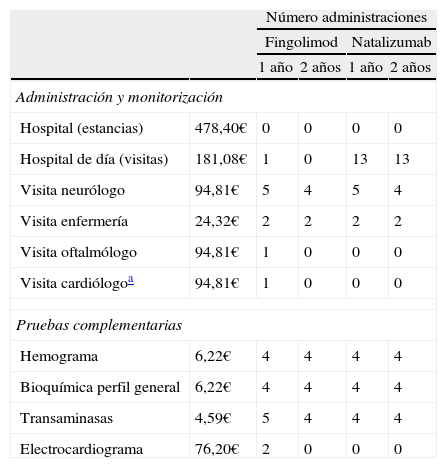
La cantidad de recursos utilizados en la administración y el mantenimiento de cada tratamiento, así como las pruebas complementarias necesarias en cada opción terapéutica, fueron consideradas a partir de la opinión de un experto clínico (tabla 2). Los costes unitarios asociados a estos recursos fueron obtenidos a partir de la base de datos de costes sanitarios eSalud22.
Coste y volumen de recursos utilizados en la administración, el mantenimiento y las pruebas complementarias
| Número administraciones | |||||
| Fingolimod | Natalizumab | ||||
| 1 año | 2 años | 1 año | 2 años | ||
| Administración y monitorización | |||||
| Hospital (estancias) | 478,40€ | 0 | 0 | 0 | 0 |
| Hospital de día (visitas) | 181,08€ | 1 | 0 | 13 | 13 |
| Visita neurólogo | 94,81€ | 5 | 4 | 5 | 4 |
| Visita enfermería | 24,32€ | 2 | 2 | 2 | 2 |
| Visita oftalmólogo | 94,81€ | 1 | 0 | 0 | 0 |
| Visita cardiólogoa | 94,81€ | 1 | 0 | 0 | 0 |
| Pruebas complementarias | |||||
| Hemograma | 6,22€ | 4 | 4 | 4 | 4 |
| Bioquímica perfil general | 6,22€ | 4 | 4 | 4 | 4 |
| Transaminasas | 4,59€ | 5 | 4 | 4 | 4 |
| Electrocardiograma | 76,20€ | 2 | 0 | 0 | 0 |
En la estimación de los costes de los brotes se tuvo en cuenta tanto la tasa de recidivas de los estudios pivotales como de los estudios de comparación activa, debido a que el diseño de los estudios pivotales y las características basales diferentes entre los estudios de fingolimod y natalizumab dificultan la realización de comparaciones indirectas18. De este modo, la tasa de brotes considerada fue el promedio entre las tasas establecidas en las fichas técnicas de ambos fármacos vs. placebo (0,22)11,12.
El coste de brotes considerado fue el obtenido en el estudio de Kobelt et al.6, 3.181,77 €, estimado en el marco del SNS a partir de los datos de 1.848 pacientes españoles y actualizado a 2012 mediante el índice de precios al consumo23.
Análisis de sensibilidadSe realizó un análisis de sensibilidad considerando diferentes escenarios para analizar la variación de los costes directos entre los 2 tratamientos. De este modo, se tuvo en cuenta un escenario donde se eliminara el descuento actual establecido por Real Decreto21 del 7,5% sobre el PVL. También se consideraron las tasas de recidivas que figuran en las fichas técnicas de ambos fármacos11,12. Para tener en cuenta el grado de cumplimiento en cada tratamiento en función del tipo de administración de este (inyectable u oral), se valoró un cumplimiento de un 90% para natalizumab y un 80% para fingolimod, acorde con las consideraciones clínicas de los expertos, y su repercusión en el número de administraciones y en la tasa de brotes. Los costes fueron considerados para un horizonte temporal de 10 años. Asimismo, se consideró un análisis específico para los pacientes con riesgo cardíaco y en tratamiento con fingolimod, añadiendo una visita al cardiólogo el primer año y otro análisis asumiendo que se debe hacer de nuevo la monitorización en los pacientes que interrumpen el tratamiento durante al menos un día durante las primeras 2 semanas de tratamiento, o durante más de 7 días durante las semanas tercera y cuarta de tratamiento o durante más de 2 semanas después de transcurrido el primer mes de tratamiento. Con respecto natalizumab, se evaluó cómo varía el resultado en los pacientes positivos a la determinación de los anticuerpos antivirus-JC que precisan de una resonancia magnética. Por último, se consideró un escenario conservador en uso de los recursos para fingolimod basándose en el uso de recursos considerado en un estudio reciente español con resultados todavía preliminares, donde se incluía, entre otros, el coste de la vacunación frente a la varicela en el 5% de los pacientes24 y solo se asumieron 12 inyecciones de natalizumab en vez de las 13 indicadas en la ficha técnica11.
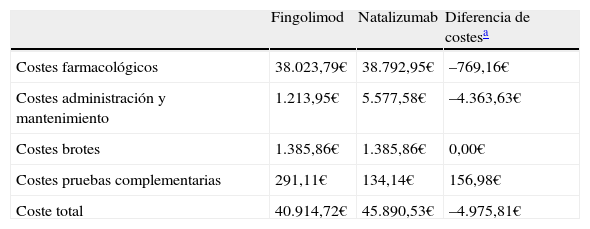
ResultadosLos resultados para el horizonte temporal de 2 años considerado y con el descuento del 7,5% según Real Decreto21 mostraron unos menores costes por paciente para fingolimod en comparación con natalizumab. De este modo, fingolimod reflejó un coste total por paciente a los 2 años de 40.914,72 €, mientras que natalizumab mostró unos costes totales por paciente de 45.890,53 €. Fingolimod redujo los costes directos generados en un 10,8%, lo que supuso un ahorro total por paciente para el SNS de 4.975,81 € (tabla 3).
Costes directos horizonte temporal 2 años
| Fingolimod | Natalizumab | Diferencia de costesa | |
| Costes farmacológicos | 38.023,79€ | 38.792,95€ | –769,16€ |
| Costes administración y mantenimiento | 1.213,95€ | 5.577,58€ | –4.363,63€ |
| Costes brotes | 1.385,86€ | 1.385,86€ | 0,00€ |
| Costes pruebas complementarias | 291,11€ | 134,14€ | 156,98€ |
| Coste total | 40.914,72€ | 45.890,53€ | –4.975,81€ |
El mayor ahorro generado por fingolimod se observó en los costes de administración y mantenimiento, 4.363,63 € por paciente, gracias a la reducción en el número de visitas al hospital de día con fingolimod. En la partida de los costes farmacológicos, la reducción por paciente fue de 769,16 €. Los costes de brotes considerados para ambos tratamientos fueron 1.385,86 € por paciente. Fingolimod obtuvo un coste mayor en pruebas complementarias de 156,98 € por paciente.
Para ambos tratamientos, los costes con mayor contribución al peso total fueron los costes farmacológicos, que representaron para fingolimod y natalizumab el 92,9 y el 84,5% del coste total, respectivamente. Ambos fármacos presentaron una distribución del peso de los costes directos similar, a excepción de los costes de administración y mantenimiento, que representan el 12,2% de los costes totales para natalizumab, mientras que para fingolimod supusieron el 3%.
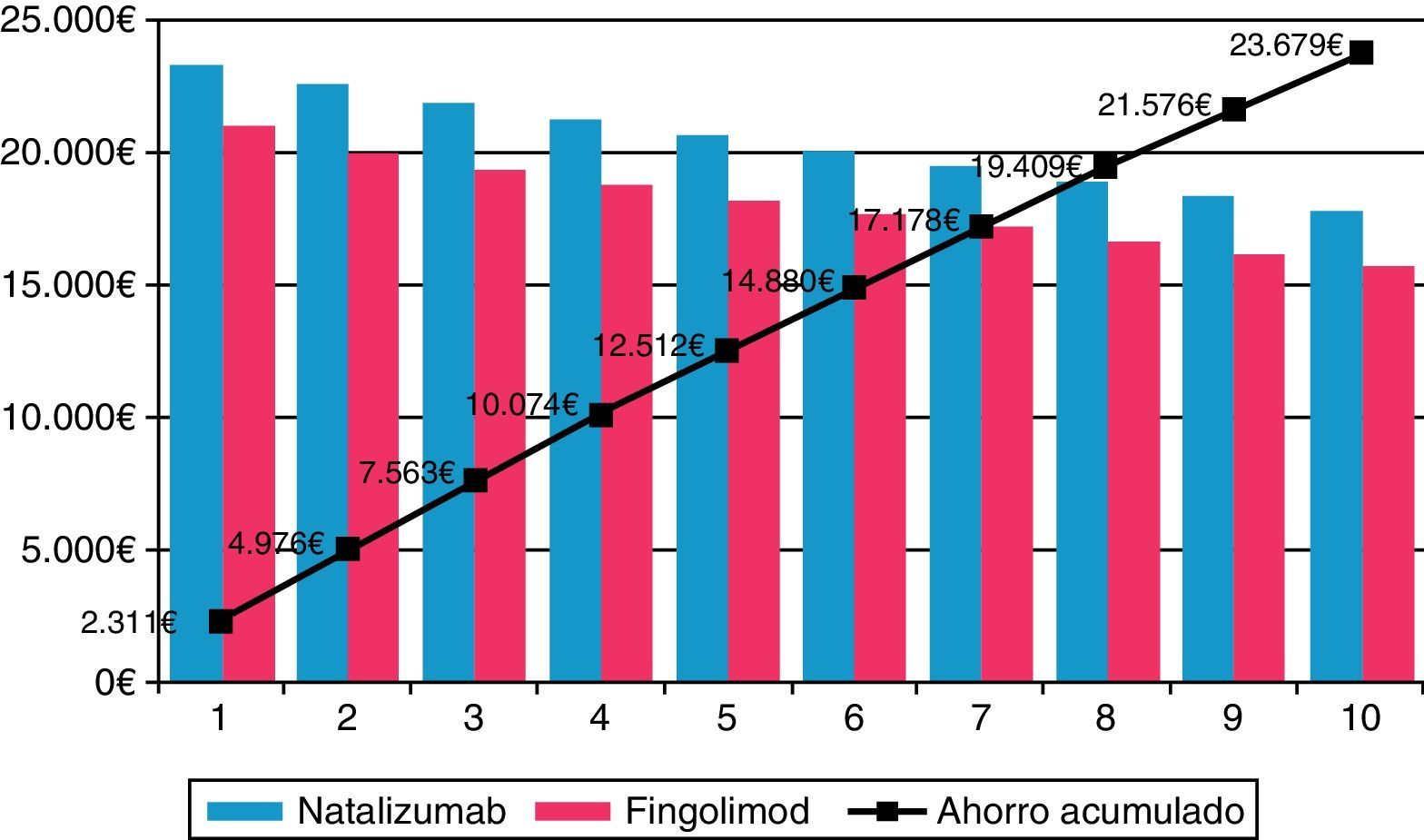
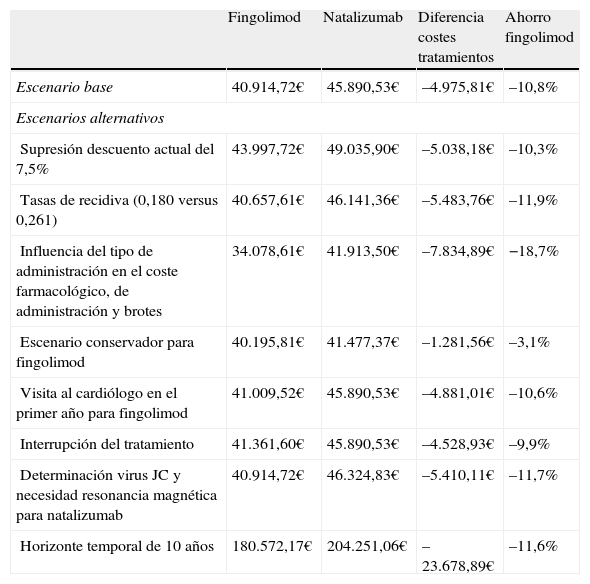
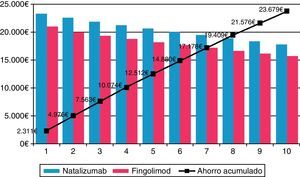
En los diferentes escenarios considerados en el análisis de sensibilidad, fingolimod fue la opción menos costosa (tabla 4). En el escenario sin considerar el descuento del 7,5% aplicado por Real Decreto21, fingolimod continuó siendo la opción más eficiente, recortando costes en 5.038,18 € (ahorro del 10,3%) en comparación con natalizumab. Ampliando el horizonte temporal a 10 años aumentaron las diferencias en costes entre fingolimod y natalizumab de 23.678,89 € (ahorro del 11,6%) (fig. 1). El ahorro conseguido con fingolimod se relacionó positivamente con el tiempo. La máxima diferencia en costes se produjo al considerar la afectación del cumplimiento terapéutico no solo en el descenso del consumo farmacológico y de administración para natalizumab, sino también en el cambio de la tasa de recidivas para los pacientes sin cumplimiento equivalente a la eficacia de placebo (0,805), siendo de 7.834,89 € (ahorro del 18,7%). Considerando una visita adicional al cardiólogo para fingolimod en pacientes de riesgo cardíaco, los costes de este frente a natalizumab se redujeron en 4.881,01 € (ahorro del 10,6%). Asimismo, teniendo en cuenta la interrupción del tratamiento y, por consiguiente, la necesidad de volver a monitorizarlos (hospital de día, electrocardiograma y cardiólogo adicional), se obtuvieron también ahorros del 9,9%. Teniendo en cuenta un escenario en el que natalizumab precisaría una prueba de amplificación del virus JC, así como una resonancia magnética para el control de los pacientes positivos, las diferencias en costes entre natalizumab y fingolimod fueron de 5.410,11 € (ahorro del 11,8% para fingolimod). En el escenario considerado como conservador para fingolimod, se mantuvo la diferencia en costes directos frente a natalizumab, aunque esta fue menor, 1.281,56 € (ahorro del 3,1%).
Análisis de sensibilidad
| Fingolimod | Natalizumab | Diferencia costes tratamientos | Ahorro fingolimod | |
| Escenario base | 40.914,72€ | 45.890,53€ | –4.975,81€ | –10,8% |
| Escenarios alternativos | ||||
| Supresión descuento actual del 7,5% | 43.997,72€ | 49.035,90€ | –5.038,18€ | –10,3% |
| Tasas de recidiva (0,180 versus 0,261) | 40.657,61€ | 46.141,36€ | –5.483,76€ | –11,9% |
| Influencia del tipo de administración en el coste farmacológico, de administración y brotes | 34.078,61€ | 41.913,50€ | –7.834,89€ | −18,7% |
| Escenario conservador para fingolimod | 40.195,81€ | 41.477,37€ | –1.281,56€ | –3,1% |
| Visita al cardiólogo en el primer año para fingolimod | 41.009,52€ | 45.890,53€ | –4.881,01€ | –10,6% |
| Interrupción del tratamiento | 41.361,60€ | 45.890,53€ | –4.528,93€ | –9,9% |
| Determinación virus JC y necesidad resonancia magnética para natalizumab | 40.914,72€ | 46.324,83€ | –5.410,11€ | –11,7% |
| Horizonte temporal de 10 años | 180.572,17€ | 204.251,06€ | –23.678,89€ | –11,6% |
El presente estudio fingolimod fue la opción más eficiente en el manejo de la EMRR al tener unos menores costes directos. El mayor coste generado por el mayor número de pruebas complementarias necesarias fue compensado por el menor coste farmacológico, de administración y de manejo de la afección. El coste farmacológico supuso la mayor parte del coste total, en el mismo perfil y proporción similar (92,9%) a otros estudios realizados en primera línea de tratamiento dentro del contexto español6,25.
El análisis escogido fue el de la minimización de costes, por los motivos comentados con anterioridad en el estudio y siguiendo los resultados de las comparaciones indirectas de Del Santo et al.13 y Zintzaras et al.17. No obstante, cabe señalar la necesidad de nuevos estudios head to head o de comparación directa que corroboren la no existencia de diferencias significativas en eficacia entre ambos fármacos, tanto en el comienzo de la misma como en segunda línea. Asimismo, existen limitaciones metodológicas en el metaanálisis realizado, tal como declaran los autores13,17.
También la Agencia Europea del Medicamento26 ha evaluado fingolimod como un fármaco similar a natalizumab en términos de eficacia y efectos adversos. De igual modo, las autoridades sanitarias de países como Holanda27 y Suecia27 han aceptado la minimización de costes en la comparación de ambos tratamientos. Igualmente, otros investigadores, como Heisen et al.27, han seguido este enfoque en sus estudios, debido a que no existe aún evidencia de diferencias significativas entre ambos fármacos.
Recientemente, el National Institute for Health and Clinical Excellence (NICE) 28 y el Scottish Medicines Consortium29 han recomendado fingolimod en el tratamiento de la EMRR al considerarlo coste-efectivo para los sistemas de salud de Reino Unido y Escocia, respectivamente. El rango de coste-efectividad de fingolimod más plausible estimado por el NICE28 estaría entre las £ 25.000-£ 35.000 por año de vida ajustado por calidad comparado con la media ponderada de los comparadores. En el contexto español, existe un estudio preliminar reciente que también ha comparado ambos fármacos siguiendo un enfoque de coste-efectividad, pese a no existir en la actualidad estudios que demuestren diferencias significativas entre la eficacia de fingolimod y de natalizumab24. Cabe destacar que este estudio también mostró que tratar a los pacientes con EMRR tras fallo en primera línea fue más económico con fingolimod que con natalizumab.
Una limitación general para la selección de cualquier análisis farmacoeconómico es la falta de estudios de comparación directa9,13,17 que midan la eficacia entre fingolimod y natalizumab, lo que hace aumentar la prudencia en los resultados y destacar la necesidad de futuros trabajos en este campo para confirmar la solidez de los resultados hallados. Cabe mencionar que en los ensayos pivotales de natalizumab15 la reducción en la tasa de recaídas en comparación con placebo fue mayor que en el ensayo de fingolimod14, aunque, tal y como se explicó en la introducción del presente trabajo, las diferencias en las características poblacionales, el seguimiento de los estudios y el diseño de los mismos impiden la comparación indirecta naïve entre ambos fármacos, ya que tendría una fiabilidad baja16.
Una consideración que se debe hacer sobre el presente trabajo es que solo se incorporaron el uso de recursos y los costes directos relacionados con la enfermedad y que son relevantes para los decisores sanitarios actuales, cuando se sabe que los costes indirectos que tienen que cubrir los pacientes por su afección pueden representar entre el 30 y el 40% del coste total4,6.
En un trabajo reciente realizado por Heisen et al.27 también se realizó una minimización de costes en la comparación económica de fingolimod y natalizumab dentro del sistema de salud holandés. En el estudio, el ahorro con fingolimod en comparación con natalizumab se mantenía en el tiempo, en línea con los resultados del presente trabajo. Los autores estimaron que para obtener un resultado neutral con natalizumab, este medicamento debería reducir sus costes con un factor 3. Los autores señalaron los posibles peligros de considerar un análisis coste-efectividad en la comparación de ambos medicamentos, como el seguido por O’Day et al.30 (donde natalizumab mostró ser una alternativa más coste-efectiva que fingolimod en el sistema sanitario estadounidense, coste medio de $ 86.461 para natalizumab y $ 98.748 para fingolimod) a partir de la consideración de las tasas de recidiva de las fichas técnicas11,12. Entre los principales motivos, los autores argumentan que dichas tasas fueron recogidas en estudios que consideraron diferentes conceptos para la recaída o también difirieron las características basales de los pacientes27.
En los últimos años, los esfuerzos en innovaciones en los fármacos para tratar la EM se han centrado principalmente en mejora de la eficacia, así como aumentar la comodidad y flexibilidad en la administración para los pacientes. En este segundo objetivo, tal y como subrayan las guías NICE28, fingolimod supone un importante avance por su administración por vía oral, siendo además la partida de los costes de administración donde se observó un mayor ahorro en el actual trabajo (78,2%). El mayor coste de administración para natalizumab se debió básicamente al coste de las visitas al hospital de día necesarias para cada administración.
Una de las críticas realizadas a los fármacos orales es el posible menor cumplimiento por parte de los pacientes al estar menos controlados y sus repercusiones en cuanto a eficacia, resultando en mayores costes por elevar el número de brotes anuales. En el análisis de sensibilidad, se consideró una potencial mayor adherencia de natalizumab y un menor cumplimiento de fingolimod, traduciéndose en menores costes farmacológicos y en un aumento del coste del brote, pero no a una variación en las conclusiones obtenidas. Para conseguir una mayor eficacia con los fármacos por vía oral, es necesario el estudio individualizado de conveniencia del tratamiento para cada paciente. Algunos autores han apuntado que para aumentar la adherencia a los tratamientos en la EM bastaría con mantener a los pacientes más informados sobre el tratamiento que siguen para combatir la afección31. Olascoaga et al.2 recomiendan realizar cuestionarios de calidad de vida para recomendar un tratamiento determinado, ya que encontraron que la depresión se relacionó con la peor adherencia al tratamiento, mientras que la pauta de administración no influyó de manera significativa en el grado de adherencia del paciente.
En conclusión, teniendo en cuenta los resultados del análisis de minimización de costes realizado para el SNS entre fingolimod y natalizumab, fingolimod resultó ser el tratamiento que proporcionó menores costes directos en el tratamiento de la EMRR en segunda línea en España, proporcionando, en consecuencia, unos mayores ahorros para el SNS.
FinanciaciónEste estudio ha sido financiado por Novartis Farmacéutica SA España.
Conflicto de interesesEste estudio ha sido financiado por Novartis Farmacéutica S.A. España. Los autores declaran la independencia del órgano promotor y financiador en el análisis de resultados y la elaboración de las conclusiones. Dr. G. Izquierdo y Dr. A. García-Ruiz recibieron honorarios por su participación en el proyecto. M. Brosa y C. Crespo trabajan en una consultora independiente que recibió financiación por parte de Novartis Farmacéutica S.A. Granell es empleada de Novartis Farmacéutica S.A.
Los autores quieren mostrar su agradecimiento a N. López, de la consultora Oblikue Consulting, y a M. Riera, de Novartis Farmacéutica S.A., por su colaboración inestimable en el desarrollo y la consecución de este proyecto.
Resultados preliminares de este estudio fueron presentados en el xv Congreso Europeo de la International Society for Pharmacoeconomics and Outcomes Research (ISPOR) en Berlín.