Los astrocitos han sido considerados como células de sostén en el SNC. Sin embargo, hoy día se sabe que participan de forma activa en muchas de las funciones del SNC y que pueden tener un papel destacado en las enfermedades neurodegenerativas.
DesarrolloSe revisan las funciones del astrocito en el desarrollo y plasticidad del SNC, en el control sináptico, regulación del flujo sanguíneo, energía y metabolismo, en la barrera hematoencefálica, regulación de los ritmos circadianos, metabolismo lipídico y secreción de lipoproteínas y en la neurogénesis. Asimismo, se revisan sus marcadores y el papel de la astrogliosis.
ConclusiónLos astrocitos tienen un papel activo en el SNC. Su conocimiento parece esencial para comprender los mecanismos de las enfermedades neurodegenerativas.
Astrocytes have been considered mere supporting cells in the CNS. However, we now know that astrocytes are actively involved in many of the functions of the CNS and may play an important role in neurodegenerative diseases.
DevelopmentThis article reviews the roles astrocytes play in CNS development and plasticity; control of synaptic transmission; regulation of blood flow, energy, and metabolism; formation of the blood-brain barrier; regulation of the circadian rhythms, lipid metabolism and secretion of lipoproteins; and in neurogenesis. Astrocyte markers and the functions of astrogliosis are also described.
ConclusionAstrocytes play an active role in the CNS. A good knowledge of astrocytes is essential to understanding the mechanisms of neurodegenerative diseases.
Las células de la glía constituyen la mayor parte de las células del sistema nervioso. La glía (del griego glía, que significa «unión», «pegamento») se conserva a lo largo de la evolución y su proporción en el sistema nervioso parece estar correlacionada con el tamaño del animal: por ejemplo, es del 25% en la mosca de la fruta, del 65% en el ratón, del 90% en el ser humano y de hasta el 97% en elefante1. Las células gliales se clasifican, según su morfología, función y localización, en: 1) microglía, las únicas células gliales de origen inmunitario, que llegan al cerebro a través de la sangre durante el desarrollo temprano; 2) astrocitos, y 3) células de Schwann y oligodendrocitos, que forman capas de mielina alrededor de los axones en el sistema nervioso periférico y central, respectivamente. Algunos autores describen un tipo especial de células gliales, la glía-NG2, que recibe input sináptico directamente de las neuronas2. Los astrocitos son las células gliales más abundantes (constituyen el 25% del volumen cerebral)3. Mientras que la función de la microglía y la de los oligodendrocitos es ampliamente conocida (defensa local y mielinización, respectivamente), la de los astrocitos es más enigmática. Aunque desde su descripción por Ramón y Cajal y más tarde por Río-Ortega se habían considerado tradicionalmente como simples células de soporte, en los últimos años se ha reconsiderado su función. A medida que se avanzó en su conocimiento se estableció que eran elementos necesarios para mantener el microambiente que permite el correcto funcionamiento, y en los últimos 20 años se les ha atribuido una gran variedad de funciones específicas. La caracterización molecular de estas células ha puesto de manifiesto que desempeñan un papel fundamental en la transmisión de información en el sistema nervioso. En esta revisión, que consta de 2 partes, se pretende analizar el papel que los astrocitos pueden tener en los mecanismos potenciales de las enfermedades neurodegenerativas más frecuentes.
Morfología y organización de los astrocitosEn función de su morfología, fenotipo antigénico y localización, los astrocitos se clasifican en 2 grandes grupos: protoplásmicos y fibrosos. Los astrocitos protoplásmicos se encuentran en la sustancia gris y sus procesos envuelven tanto sinapsis −alrededor de 100.000 cada astrocito4− como vasos sanguíneos (fig. 1). Presentan una morfología globosa, con varias ramas principales que dan lugar a procesos muy ramificados con distribución uniforme. Los astrocitos fibrosos se localizan en la sustancia blanca y contactan con los nodos de Ranvier y con los vasos sanguíneos. Su ramificación es menor y sus procesos más alargados, a modo de fibras. Aunque los astrocitos ocupan lugares discretos y sus proyecciones no se solapan en el cerebro adulto, análisis de microscopia electrónica revelan que ambos subtipos establecen uniones gap con procesos de astrocitos vecinos .Aunque esta clasificación es ampliamente utilizada, los astrocitos son una población muy heterogénea donde se distinguen muchos subtipos. Es más, los astrocitos se diferencian incluso dentro de una misma región cerebral. Esto no es sorprendente si se tiene en cuenta que deben llevar a cabo sus funciones en regiones específicas del sistema nervioso1. Existen, por ejemplo, astrocitos especializados, como la glía de Müller en la retina, o la glía de Bergmann en el cerebelo5. Las células de estirpe astrocitaria de la zona subventricular (SVZ) constituyen un subtipo de astrocitos con capacidad proliferativa en cerebro adulto. La disposición de los astrocitos en el sistema nervioso es ordenada y sin apenas solapamiento desde su origen en el período posnatal, paralelamente a los territorios vasculares y neuronales6. En la sustancia gris, solo los extremos distales de los astrocitos protoplásmicos se entrelazan, proporcionando el sustrato para la formación de uniones gap7–9. Una organización similar podría existir en los astrocitos fibrosos de sustancia blanca, aunque esto aun no ha sido demostrado10.
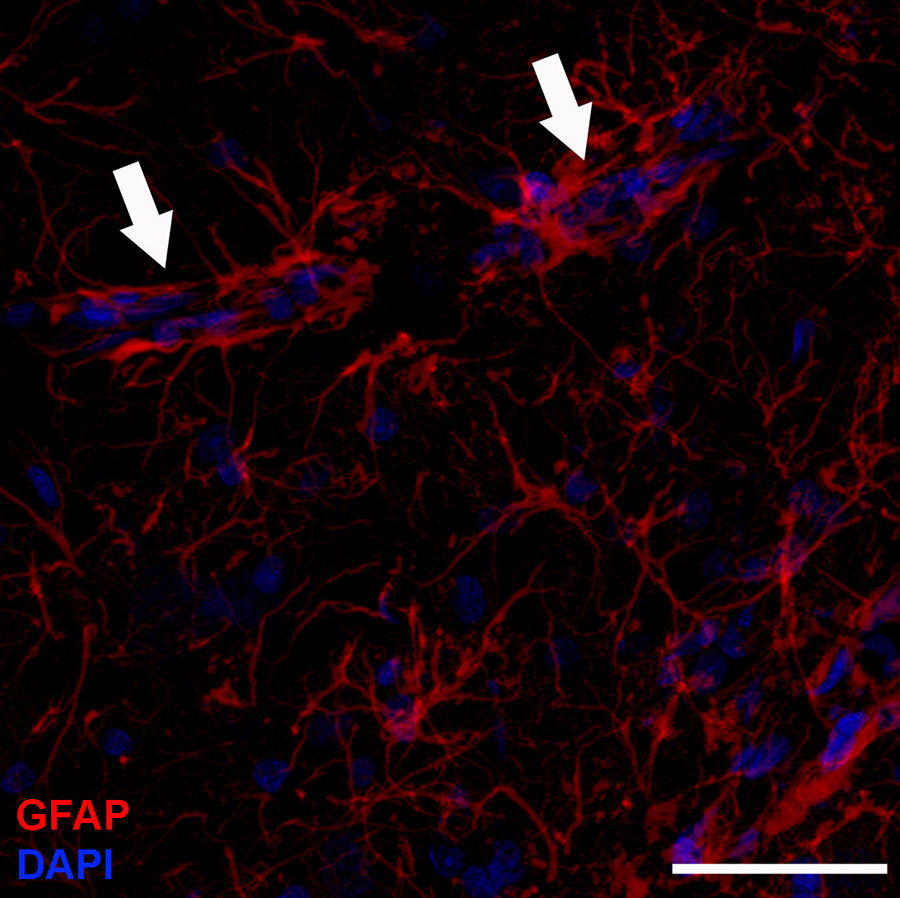
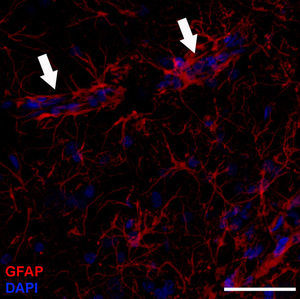
Los astrocitos se caracterizan por presentar una morfología estrellada, además los capilares cerebrales están rodeados casi en su integridad por los pies terminales de las fibras astrocitarias (flechas). Imnunohistoquímica contra GFAP, (rojo: astrocitos; azul: núcleos). Imagen de microscopia confocal. Barra=70micras.
Las propiedades estructurales del citoesqueleto de astrocitos son mantenidas gracias a la red de filamentos intermedios (fig. 2), de la cual el componente fundamental es la proteína ácida fibrilar glial (GFAP). Además de las propiedades estructurales, se ha propuesto que la red de filamentos intermedios tiene otras asociadas a transducción de señales biomecánicas y moleculares11. La GFAP, inducida en daño cerebral y degeneración del sistema nervioso central (SNC) y cuya expresión aumenta con la edad, es el marcador clásico para la identificación inmunohistoquímica de astrocitos. Se aisló por primera vez en placas de pacientes con esclerosis múltiple, constituidas por axones desmielinizados y astrocitos fibrosos12,13.
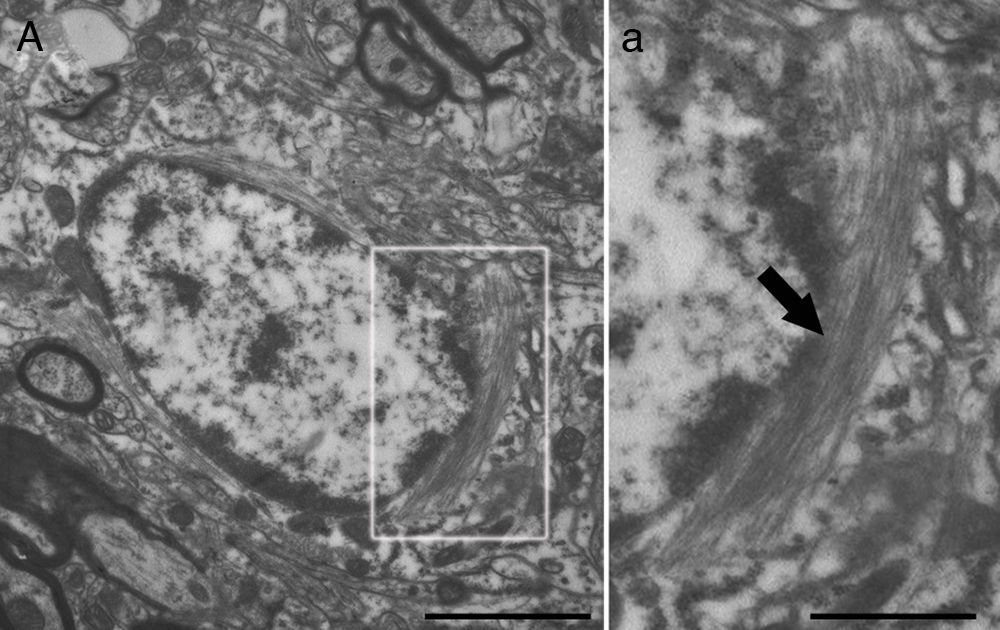
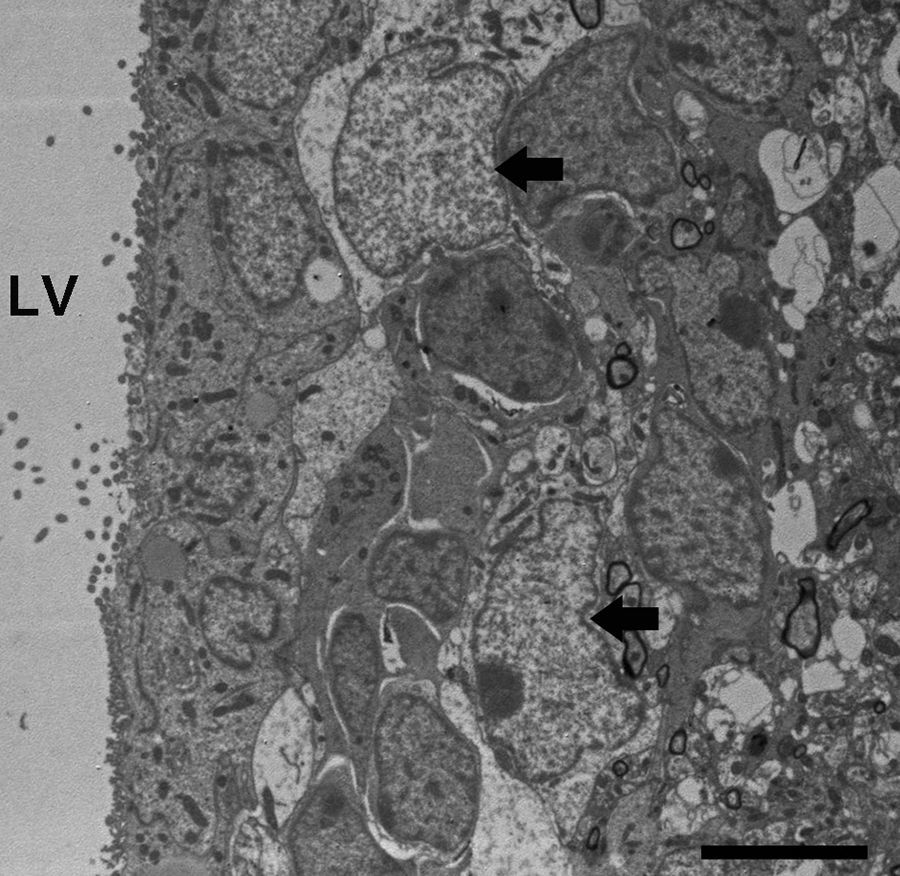
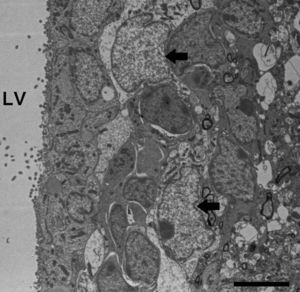
Imagen de microscopia electrónica donde se muestra un astrocito (A) donde sobresalen las siguientes características: el citoplasma es más claro y con algunos ribosomas. El núcleo de estas células presenta cromatina densa. Son células ricas en filamentos intermedios (a, flecha), constituidos entre otras por una proteína específica, GFAP (del inglés glial fibrillary acidic protein) (detalle a). Barras A=2micras; a=0,5micras.
La GFAP tiene 8 isoformas, que se forman por splicing alternativo, cada una de las cuales se expresa en subgrupos específicos de astrocitos y confiere propiedades estructurales diferentes a la red de filamentos intermedios. La isoforma más abundante, la GFAPα, fue la primera en ser identificada14. Más tarde se describieron las isoformas β (la única que no se ha identificado en seres humanos, solo en rata)15, γ16, δ/¿17,18, κ19 y Δ135, Δ164 y Δexon620.
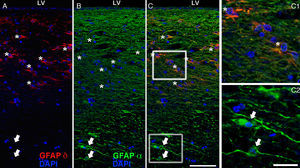
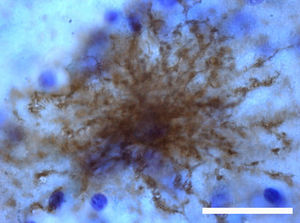
De las isoformas humanas, probablemente la más interesante es la GFAPδ. Una subpoblación específica de astrocitos situada en la SVZ y en la zona subpial de los ventrículos expresa GFAPδ17 (fig. 3). La localización subventricular de estos astrocitos sugiere que se trata de células madre neurales (NSC, del inglés neural stem cells) en el cerebro humano adulto21–23. Durante el desarrollo embrionario temprano, en las semanas 13-15 de gestación, GFAPδ se expresa en la glía radial de la zona ventricular, paralelamente a GFAPα. A partir de la semana 17, GFAPδ se expresa también en SVZ, lo que continúa hasta el nacimiento24. La GFAPδ se expresa también en seres humanos en el hipocampo, zona subventricular25 (fig. 3), además de en zonas de la médula espinal ricas en astrocitos, incluido el canal ependimario26. Además, se ha visto expresión de GFAPδ en diferentes tipos de gliosis. Curiosamente, GFAPδ y vimentina coexisten en tejido normal y gliosis, pero no en gliomas27.
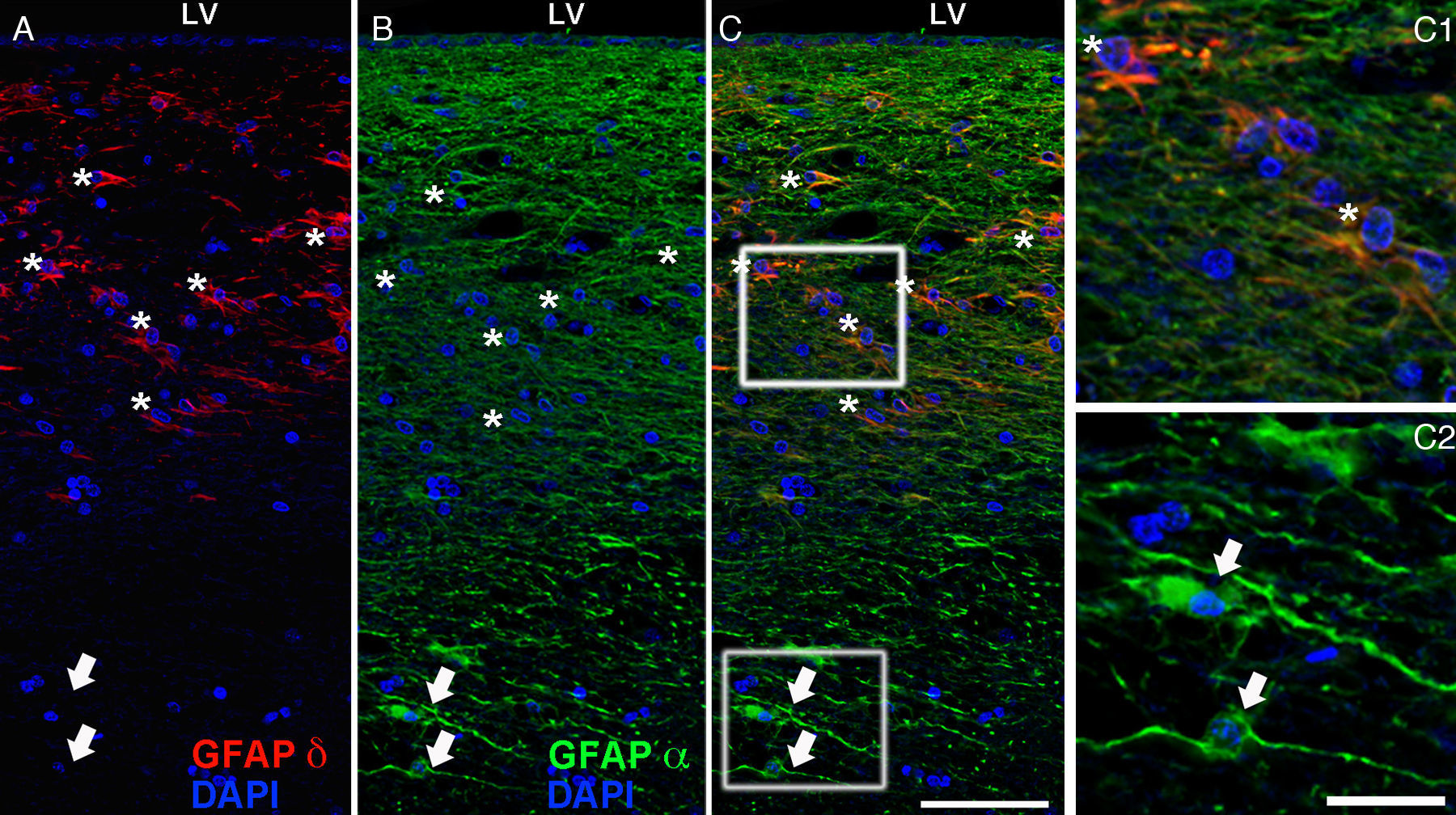
La GFAPα (en la imagen en verde) y la GFAP-δ (en la imagen en rojo) son isoformas de la proteína GFAP. La isoforma α se expresa en todos los astrocitos, es el marcador clásico para su identificación por técnicas de inmunohistoquímica (B, c2) y la isoforma δ solo se expresa en poblaciones de astrocitos, las que están estrechamente ligadas a nichos neurogénicos como es la SVZ (A, c1). En la imagen se muestran imágenes de microscopia confocal donde se observan las 2 isoformas en la SVZ humana, donde en C y c1 podemos ver la colocalización de la GFAP-α y δ (asteriscos), y en c2 solo la expresión de GFAP-α (flechas). Barras A-C: 75micras; c1 y c2: 25micras.
Aunque la detección inmunohistoquímica es el método clásico utilizado para la identificación de astrocitos, el uso de este marcador también tiene algunas limitaciones10. 1) La GFAP es expresada por la mayoría de los astrocitos reactivos, que responden a lesiones en el SNC, pero no siempre es inmunohistoquímicamente detectable en astrocitos de tejido sano o lejanos al lugar de la lesión. Además, la expresión de GFAP es variable y está regulada por un gran número de moléculas de señalización intra e intercelular28. 2) La GFAP no está presente en todo el citoplasma, solo en las ramificaciones principales; por tanto, la estimación del tamaño y del grado de ramificación de los astrocitos mediante inmunohistoquímica de GFAP es limitada. 3) Finalmente, la expresión de GFAP no es exclusiva de astrocitos protoplásmicos y fibrosos; dentro del SNC, la GFAP es también expresada por glía de Müller en retina, glía de Bergmann en el cerebelo, tanicitos en la base del tercer ventrículo o pituicitos en la neurohipófisis, entre otros, así como por las NSC en cerebro embrionario y adulto29. Fuera del SNC, expresan GFAP las células de Schwann no mielinizantes de sistema nervioso periférico y una población de glía entérica que se extiende por los plexos neurales de sistema nervioso entérico. La glía entérica rodea los cuerpos celulares y axones del sistema nervioso entérico y contacta con vasos sanguíneos y células epiteliales. Además, algunos estudios parecen indicar que llevan a cabo funciones equivalentes a las de los astrocitos en el SNC30,31. También expresan GFAP las células estrelladas mesenquimales de muchos órganos, como hígado, riñón, páncreas, pulmón y testículos32.
Debido a estas limitaciones, para la identificación de astrocitos han sido utilizados otros marcadores, como la glutamina sintetasa33,34, o la S100β35. En este sentido, el análisis del transcriptoma ha permitido la identificación de marcadores moleculares característicos de astrocitos36,37. Algunos de estos son el gen Aldh1L1, que mostró un patrón de expresión en astrocitos más amplio que la GFAP, o las vías fagocíticas Draper/Megf10 y Merk/integrinalpha(v)beta5, que sugieren que los astrocitos son verdaderos fagocitos5. La vía Draper/Megf10 se ha identificado previamente en astrocitos de Drosophila, donde media el pruning de axones durante la metamorfosis38, y en células de Schwann, que median la eliminación de axones en la unión neuromuscular durante el desarrollo39. Estos hallazgos sugieren que los astrocitos pueden mediar la eliminación de sinapsis durante el desarrollo en mamíferos. Otros genes específicos del transcriptoma son ApoE, ApoJ, MFGE8 y cistatina. Aunque la función de estos aun no es bien conocida, parece que los 3 primeros participan en la secreción de partículas lipoproteicas por los astrocitos y que actúan probablemente como opsoninas que facilitan la fagocitosis5.
Fisiología de los astrocitosAunque no generan potenciales de acción, los astrocitos son células excitables con propiedades de comunicación: se activan por señales internas o externas, y envían mensajes específicos a las células vecinas en lo que se conoce como proceso de «gliotransmisión»6. Los astrocitos presentan aumentos transitorios de la concentración de calcio intracelular [Ca2+]i. Estas oleadas de calcio son las responsables de la comunicación astrocito-astrocito y astrocito-neurona, y ocurren 1) como oscilaciones intrínsecas resultantes de la liberación de calcio de almacenes intracelulares (excitación espontánea),o 2) inducidas por transmisores liberados por las neuronas. En este último caso, las neuronas liberan sustancias como ATP o glutamato, que activan receptores acoplados a proteínas G que conducen a un aumento de IP3 y este, a su vez, media la liberación de calcio desde el retículo endoplasmático40. Sorprendentemente, Schummers et al.41 encontraron que estas oleadas de calcio no se propagan in vivo a otros astrocitos, lo que sugiere que los astrocitos responden como células individuales y con patrones únicos de respuesta, de forma análoga a como lo hacen las neuronas. Como consecuencia del aumento de [Ca2+]i los astrocitos liberan «gliotransmisores» al espacio extracelular, que inducen corrientes mediadas por receptor en neuronas y son conducidos también a los astrocitos vecinos. Esta señalización mediada por calcio sugiere que los astrocitos tienen un papel activo en el control de la transmisión sináptica, lo que se discutirá más adelante.
FuncionesDesarrollo del sistema nervioso y plasticidad sinápticaLos astrocitos desempeñan un papel fundamental en el desarrollo del sistema nervioso. Los axones en crecimiento son guiados hacia sus targets mediante moléculas guía derivadas de astrocitos, como tenascina C y proteoglicanos42.También se ha sugerido el papel de los astrocitos en el pruning sináptico, mediante las vías fagocíticas Draper/Megf10 y Merk/integrinalpha(v)beta55 y la liberación de señales que inducen la expresión de la proteína C1q, iniciadora de la vía clásica del complemento43. Además, la alteración de las uniones gap entre astrocitos por pérdida de las conexinas 43 y 30 causa desmielinización44.
Los astrocitos también participan activamente en la sinaptogénesis, no solo durante el desarrollo sino también tras lesión del SNC. En un estudio con células ganglionares de retina, Pfrieger y Barres observaron que, en ausencia de glía, estas neuronas presentaban poca actividad sináptica, mientras que con astrocitos la actividad sináptica era 100 veces mayor. Curiosamente, en cocultivo con otros tipos celulares, como oligoendrocitos, la actividad sináptica de las células ganglionares de retina no aumentaba45. Este incremento de actividad sináptica mediado por astrocitos se debe precisamente al aumento del número de sinapsis, que es 7 veces mayor en células ganglionares de retina cultivadas con astrocitos que en ausencia de astrocitos46.
Este aumento del número de sinapsis es mediado por unas proteínas asociadas a la matriz, llamadas trombospondinas47,48. Las trombospondinas son una familia de 5 proteínas homólogas, al menos 4 de las cuales expresan los astrocitos durante el desarrollo y tras daño cerebral, que inducen sinaptogénesis. Las trombospondinas son capaces de inducir la formación de sinapsis ultraestructuralmente normales, tanto a nivel presináptico (clustering de sinapsinas) como postsináptico (PSD-95)5. Sin embargo, estas sinapsis son silentes y necesitan que los astrocitos secreten otra proteína, todavía no identificada, que induce respuesta postsináptica a glutamato (AMPA)48. Además, el colesterol formando complejos con lipoproteínas con ApoE también aumenta la función presináptica, según Mauch et al.49. La secreción de trombospondinas por astrocitos inmaduros está mediada por ATP y otros neurotransmisores50, lo que sugiere que la actividad neuronal puede a su vez controlar la capacidad sinaptogénica de los astrocitos. Paradójicamente, el gen de la trombospondina es uno de los pocos que están mucho más expresados en seres humanos que en el resto de primates, lo que sugiere que contribuyen a la gran plasticidad cerebral característica de los humanos51. Debido a esto y a su papel en la eliminación de sinapsis, se ha propuesto también que los astrocitos participan en la construcción de nuevos circuitos y en la reconstrucción de los mismos tras lesión.
Control de la función sinápticaExisten evidencias de que los astrocitos participan directamente en la transmisión sináptica a través de la liberación de moléculas sinápticamente activas: los «gliotransmisores». Estas moléculas son liberadas por los astrocitos en respuesta a la actividad sináptica neuronal, que produce excitación de los astrocitos con oleadas de [Ca2+]i, y producen a su vez excitabilidad neuronal. Las evidencias que prueban el impacto de los astrocitos sobre la actividad sináptica son cada vez más numerosas. Por ejemplo, Kang et al. muestran cómo los astrocitos median la potenciación de la transmisión sináptica inhibitoria en rodajas de hipocampo52. Fellin et al. proporcionan la primera evidencia de que los astrocitos inducen sincronía neuronal mediada por glutamato53 y Shigetomi et al. demuestran que 2 formas de excitabilidad astrocítica por calcio tienen efectos distintos sobre receptores NMDA de piramidales de CA154.
Uno de los gliotransmisores más estudiados es el glutamato. La liberación de glutamato por parte de la subpoblación de astrocitos NG2-positivos, células precursoras de oligodendrocitos, ha sido ya demostrada55, aunque la vía por la que lo hacen es objeto de controversia. Se ha propuesto que los astrocitos liberan glutamato mediante vesículas, sin embargo, algunos autores son escépticos. Barres propone 2 razones por las que la liberación por vesículas es improbable5: 1) a diferencia de las neuronas, los astrocitos tienen altas concentraciones de la enzima glutamina sintetasa, que cataliza la degradación de glutamato a glutamina, siendo los niveles de glutamato en astrocitos relativamente bajos y difíciles de detectar por técnicas inmunológicas; y 2) además, in vivo los astrocitos no expresan ninguno de los componentes que intervienen en la liberación vesicular de neurotransmisores en neuronas. No se han encontrado en astrocitos ni SNAP25 ni las proteínas vesiculares sinápticas sinaptotagmina I y sinaptofisina, ni tampoco la glucoproteína 2 de vesículas sinápticas56–58.
Aunque los astrocitos en principio no son capaces de liberación vesicular, sí tienen microvesículas semejantes a las vesículas sinápticas o synaptic-likemicrovesicles (SLMV)59. Algunos estudios han demostrado que estas células secretan los «gliotransmisores» por medio de exocitosis lisosomal60–62. Los lisosomas secretores están especialmente presentes en células inmunitarias y en glía. En astrocitos, los lisosomas secretores liberan ATP y el bloqueo de esta liberación de ATP bloquea la propagación de las oleadas de calcio entre astrocitos vecinos5. Además, in vivo, se ha visto que los astrocitos regulan la transmisión sináptica y la plasticidad por medio de la liberación de ATP63.
Otra sustancia liberada por los astrocitos que actúa como «gliotransmisor» es la D-serina, un coagonista, junto con el glutamato, del receptor NMDA64,65. Aunque la serin-racemasa es expresada también por las neuronas, solo los astrocitos son capaces de sintetizar serina, por lo que los niveles de D-serina en la sinapsis dependen de la cantidad de serina que los astrocitos producen7. Otra enzima expresada fundamentalmente por astrocitos es la piruvatocarboxilasa, que proporciona el esqueleto de 4 carbonos necesario para la síntesis de novo de glutamato y GABA neuronales66, lo que sugiere que la velocidad a la que los astrocitos liberan este precursor determina la velocidad a la que las neuronas disparan.
Además, los astrocitos liberan factores de crecimiento y citoquinas que ejercen efectos más potentes y prolongados sobre la sinapsis. Por ejemplo, el TNFα induce la inserción de receptores AMPA en la membrana presináptica67, aunque aun no se conoce con exactitud si este factor es producido por microglía o por astrocitos. Otras sustancias secretadas por astrocitos que pueden estar implicadas en la función sináptica son los ácidos grasos poliinsaturados y esteroides como el estradiol, la progesterona y otros intermediarios y metabolitos que son neuroactivos, y tienen especial afinidad por receptores GABAA68.
Todas estas evidencias han dado lugar a la hipótesis de la «sinapsis tripartita», según la cual los astrocitos tienen un papel directo e interactivo en la actividad sináptica y son indispensables para el correcto procesamiento de la información en los circuitos cerebrales69–71.
Más allá de la liberación de gliotransmisores, los astrocitos participan en la correcta actividad sináptica mediante el mantenimiento de la homeostasis del fluido intersticial sináptico. Los astrocitos envuleven la sinapsis y mantienen los niveles adecuados de pH, iones, neurotransmisores y fluido72. Así, por ejemplo, los procesos astrocitarios son ricos en acuaporina 4 (fig. 4), para el transporte de agua y en transportadores para la captación de K+ Los astrocitos presentan también en su membrana transportadores Na+/H+, distintos tipos de transportadores de bicarbonato, transportadores de ácido monocarboxílico y la protón ATPasa de tipo vacuolar73, todos ellos implicados en la regulación del pH.
Regulación del flujo sanguíneoLos astrocitos regulan también el flujo sanguíneo que llega al sistema nervioso, acoplando los cambios en la microcirculación cerebral con la actividad neuronal74. De hecho, las oleadas de calcio en astrocitos se correlacionan con aumentos de la microcirculación vascular y hay evidencias de que las señales neuronales inducen oleadas de calcio en los astrocitos que liberan mediadores como prostaglandina E, óxido nítrico o ácido araquidónico, que tienen efectos vasodilatadores o vasoconstrictores75–78.
Los astrocitos ejercen esta función gracias a que tienen 2 dominios: un pie vascular (fig. 1) y un pie neuronal. A esta íntima unión entre neuronas, astrocitos y vasos sanguíneos se le denomina unión neurovascular (fig. 1). A través de estos contactos los astrocitos ajustan el flujo vascular a la actividad sináptica, como demuestran estudios recientes de corteza visual, donde se han detectado mediante fMRI cambios en la microcirculación mediada por astrocitos como respuesta a estímulos visuales41,79. La homeostasis de la unión neurovascular es fundamental para la función cognitiva y su alteración podría estar relacionada con alteraciones cognitivas como la enfermedad de Alzheimer80.
Energía y metabolismo de sistema nervioso centralLos astrocitos contribuyen al correcto metabolismo del SNC. Gracias a los procesos en contacto con los vasos sanguíneos, los astrocitos captan glucosa de la circulación y proporcionan a las neuronas metabolitos energéticos10. De hecho, los astrocitos constituyen la principal reserva de gránulos de glucógeno en el SNC y estos gránulos son más abundantes en zonas de alta densidad sináptica81. Además, hay evidencias de que los niveles de glucógeno en astrocitos están modulados por glutamato82 y que los metabolitos de glucosa se transmiten a astrocitos vecinos por las uniones gap en un proceso mediado también por glutamato83.
Barrera hematoencefálicaLa barrera hematoencefálica está constituida por células endoteliales que forman uniones estrechas rodeadas por lámina basal, pericitos perivasculares y los terminales de los astrocitos. La función de los astrocitos en la barrera hematoencefálica (BHE) no se conoce bien, pero hay evidencias de que inducen propiedades de barrera en las células endoteliales mediante la liberación de factores como TGFβ, GDNF, bFGF y angiopoetina 184, e influyendo sobre la polaridad de la BHE85.
Regulación de ritmos circadianosTanto en Drosophila como en mamíferos, hay cambios morfológicos y bioquímicos circadianos en células gliales86. Por ejemplo, en el núcleo supraquiasmático (SCN)-marcapasos interno- de hámster, hay cambios rítmicos en los niveles de GFAP y en la morfología de los astrocitos87. Los astrocitos se comunican con las neuronas, vía adenosina, y están implicados en la homeostasis del sueño y en los efectos cognitivos resultantes de la deprivación del sueño. De hecho, la inhibición de la gliotransmisión previene el déficit cognitivo asociado a la deprivación del sueño88. No hay modelos animales en mamíferos que demuestren que los astrocitos regulan directamente la función de las neuronas marcapasos del SCN, sin embargo, estudios con cultivos de astrocitos muestran que la presencia de péptido intestinal vasoactivo es esencial para lo contrario: la comunicación neurona-glia en los ritmos circadianos89.
Metabolismo lipídico y secreción de lipoproteínasEl cerebro es el órgano del cuerpo humano más rico en colesterol. Los niveles de colesterol están estrechamente regulados entre neuronas y glía, y alteraciones en el metabolismo de lípidos, especialmente del colesterol, están estrechamente relacionadas con el desarrollo de enfermedades neurodegenerativas como la enfermedad de Alzheimer o la enfermedad de Niemann-Pick tipo C90–92. Las lipoproteínas y el colesterol en SNC no proceden de sangre periférica, sino que son sintetizados por la glía, fundamentalmente por los astrocitos. La ApoE es la principal apo del SNC y las lipoproteínas con ApoE glial suministran a las neuronas colesterol y otras moléculas por medio de receptores de la familia LDL93. Estos receptores actúan no solo internalizando las lipoproteínas, sino también como transductores de señales ante la unión de sus ligandos. Así, las lipoproteínas con ApoE estimulan el crecimiento axonal en SNC94, y el colesterol unido a lipoproteínas con ApoE participa en la sinaptogénesis49 También se ha visto que la ApoE media el efecto neuroprotector de los estrógenos en la isquemia global en un modelo de ratón95. Además, la ApoE tiene efectos antiinflamatorios96 y de protección frente a la apoptosis97,98. En definitiva, los lípidos producidos por la glía, y más concretamente por los astrocitos, median funciones esenciales y su alteración podría afectar a la homeostasis del SNC. De hecho, se han descrito alteraciones en la biosíntesis de colesterol cerebral y reducción de la secreción de lipoproteínas que contienen ApoE en la enfermedad de Huntington, tanto en seres humanos como en modelos animales99,100. También la relación entre la enfermedad de Alzheimer y la ApoE ha sido ampliamente estudiada, ya que la herencia del alelo ¿4 de la Apo E es un factor de riesgo para padecer la enfermedad101,102 y está relacionado con una menos efectiva eliminación de Aβ103.
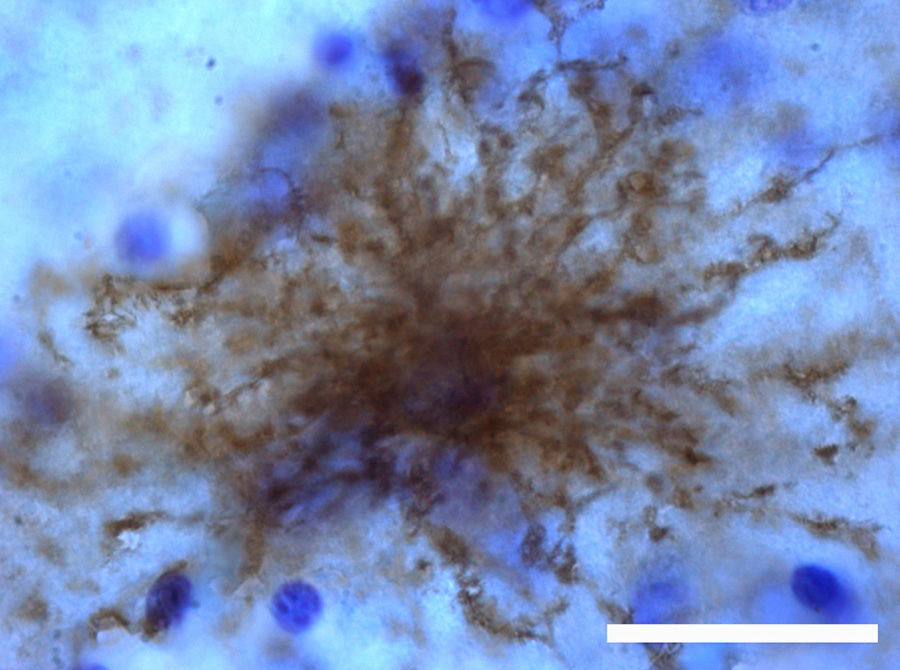
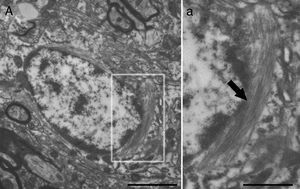
Neurogénesis adultaUna de las funciones más recientemente descritas de los astrocitos es la de capacidad neurogénica en el cerebro adulto. Las NSC están presentes en los mamíferos no solo durante el desarrollo, sino también en el cerebro adulto, en la SVZ, en la pared de los ventrículos laterales. Estas células generan nuevas neuronas104–106, que migran a través de la corriente migratoria rostral (RMS, del inglés rostral migratory stream) hasta el bulbo olfatorio (BO), donde se diferencian a interneuronas granulares y periglomerulares107,108. Las células madre de la SVZ, también llamadas células B, expresan GFAP, y tienen morfología y ultraestructura de astrocitos21 (figs. 2 y 5).
Los precursores neurales migran hasta el BO en cadenas rodeadas por procesos astrocitarios y utilizando como andamiaje la red de vasos sanguíneos que delimita la RMS. Recientemente se ha demostrado que los astrocitos orquestan la formación y la reorganización estructural de este andamiaje vascular mediante la expresión del factor de crecimiento del endotelio vascular109.
En cuanto al cerebro humano, los astrocitos de la SVZ se comportan como NSC in vitro, pero su significado funcional in vivo permanece sin resolver. Inicialmente se describió que existían células madre en la SVZ23, pero no se encontraron evidencias de cadenas migradoras en humanos adultos22. Un estudio posterior encontró evidencias de RMS, y por tanto de migración, en el cerebro humano adulto110. Más recientemente, Sanai et al. han proporcionado evidencias de que existen neurogénesis posnatal y migración en seres humanos hasta los 18 meses de edad, pero que se ven reducidas en niños mayores y es mínima en adultos111. Sorprendentemente, en esta corta ventana temporal, la migración se produce no solo a BO sino también a corteza prefrontal.
Astrogliosis reactiva y cicatriz glialEl término astrogliosis reactiva hace referencia a una serie de cambios en astrocitos que ocurren a nivel molecular, celular y funcional como respuesta a daños y enfermedades del SNC de distinto grado. Los cambios que experimentan los astrocitos reactivos varían según el grado de severidad de la lesión, son regulados por moléculas de señalización inter- e intracelular y modifican la actividad astrocitaria bien mediante ganancia bien mediante pérdida de funciones, lo que puede afectar a las células circundantes28. De acuerdo con esta definición, la astrogliosis reactiva no es un «todo o nada», sino un continuum de progresivos cambios. Así, se pueden distinguir 3 grados de severidad10. 1) Astrogliosis reactiva leve o moderada. En este nivel aumenta la expresión de GFAP por los astrocitos y hay hipertrofia tanto del cuerpo celular como de los procesos astrocitarios. Esto se produce dentro del propio dominio del astrocito y no hay solapamiento con astrocitos vecinos, y hay poca o ninguna proliferación. Este grado de astrogliosis reactiva es reversible y se da en traumatismos leves y no penetrantes, en caso de activación difusa de inmunidad innata y en áreas distantes del lugar de una lesión focal. 2) Astrogliosis reactiva severa difusa. En caso de lesiones focales graves, infecciones o áreas con neurodegeneración crónica, la sobreexpresión de GFAP y la hipertrofia de cuerpo celular y procesos son más pronunciadas. Además, hay solapamiento de astrocitos y aumento de su proliferación. Estos cambios pueden conducir a una reorganización tisular duradera. 3) Astrogliosis reactiva severa con formación de cicatriz glial compacta. En este caso, además de los cambios anteriores, se forma la cicatriz glial, que inhibe la regeneración axonal y la migración celular112, pero también protege frente a la llegada de células inflamatorias y agentes infecciosos113–115. Los desencadenantes son lesiones graves del SNC, penetrantes y/o contuas, infecciones invasivas y abscesos, neurodegeneración crónica e incluso infecciones sistémicas. La cicatriz glial supone reorganización tisular y cambios estructurales persistentes, que permanecen incluso cuando ha desaparecido el desencadenante.
Aunque durante mucho tiempo se ha considerado solo la inhibición de la regeneración axonal, lo cierto es que los astrocitos reactivos ejercen también funciones beneficiosas. Por ejemplo, protegen a las células del SNC captando glutamato potencialmente excitotóxico116,117, liberando glutatión para contrarrestar el estrés oxidativo118–120, degradando péptido β-amiloide121 o facilitando la reparación de la BHE113. Además, como ya se ha mencionado, limitan la difusión de células inflamatorias y agentes infecciosos113–115.
Modelos experimentales en la investigación de la función de los astrocitosLos ratones transgénicos y knockout han proporcionado valiosa información acerca de los efectos de las alteraciones en los astrocitos. La deleción de GFAP no produjo ninguna patología específica en ratones en ausencia de lesión, aunque sí ciertas anormalidades en respuesta a lesiones122. La expresión de GFAP humana en ratones provoca en astrocitos la formación de fibras de Rosenthal, características de la enfermedad de Alexander123. La deleción de GFAP y vimentina resultó en una patología más marcada tras la aplicación del modelode lesión en cortex entorrinal, si bien se observó un mejor potencial regenerador, restaurándose el número de sinapsis entre los días 4 y 14124. En otro modelo animal, en el que se bloqueó la proliferación de astrocitos, y por consiguiente la formación de la cicatriz glial, se observó: infiltrado leucocitario, neurodegeneración y sobrecrecimiento de neuritas tras lesión mecánica profunda en prosencéfalo113; errores en la reparación de la BHE, degeneración tisular, infiltrado leucocitario, desmielinización profunda, muerte de neuronas y oligodendrocitos y déficits motores pronunciados tras lesión de médula espinal114; y alteración de la BHE con el consiguiente aumento de la inflamación y la infección en un modelo de encefalitis autoinmune experimental115.
Un aspecto importante ha sido el estudio del papel de los astrocitos en la excitotoxicidad por glutamato. Se han descrito 3 transportadores de glutamato en rata: los astrogliales GLAST y GLT-1 (también llamado EAAT2) y el neuronal EAAC1. La pérdida de los transportadores gliales GLAST y GLT-1 en un modelo de rata produjo elevación de los niveles extracelulares de glutamato, aumento de excitotoxicidad y parálisis progresiva. La pérdida del transportador neuronal EAAC1 no elevó la concentración extracelular de glutamato, si bien produjo ciertos cambios conductuales y epilepsia, probablemente debido a que los cambios en el glutamato intrasináptico afectan a la despolarización y a la liberación del neurotransmisor116. En ratones nulos para GLT-1 homocigotos también se observó epilepsia y exacerbación de daño tras lesión cerebral125. Esta mayor susceptibilidad al daño cerebral también se comprobó en un modelo de isquemia en la región CA1 del hipocampo, en el que los ratones deficientes para GLT-1 presentaban niveles más altos de glutamato126. En cuanto al transportador GLAST, los ratones GLAST(−/−) presentan episodios convulsivos más severos tras la administración de pentilentetrazol que los ratones GLAST(+/+)127. En seres humanos, se ha descrito un polimorfismo del transportador glial EAAT2, que está específicamente relacionado con aumento de la concentración plasmática de glutamato y con una mayor frecuencia de empeoramiento tras accidente cerebrovascular128.
La alteración de la comunicación entre astrocitos a través de las uniones gap también tiene efectos negativos. Así, los mutantes nulos heterocigotos para la conexina 43 presentan mayor tamaño de zona infartada tras oclusión de la arteria cerebral media que los normales129. En otro modelo animal, la deleción de las conexinas astrocitarias 43 y 30 produjo un fenotipo desmielinizante y vacuolización en la región CA1 hipocampal44, pero no alteró la susceptibilidad o la severidad de la encefalitis autoinmune experimental aguda130.
Implicación de los astrocitos en patologías del sistema nervioso centralLos astrocitos, y específicamente los astrocitos reactivos, desempeñan funciones esenciales para el correcto funcionamiento del SNC. Existen numerosas evidencias de que las alteraciones de la función astrocitaria pueden contribuir al desarrollo, e incluso provocar, enfermedades del SNC, especialmente neurodegenerativas. Por un lado, la pérdida de funciones de los astrocitos podría tener efectos negativos; por otro, el exceso de reactividad astrocitaria podría causar, de modo análogo a la inflamación, efectos perjudiciales en el SNC, lo que revisaremos en un nuevo artículo.
Conflicto de interesesLos autores declaran que no existe ningún conflicto de interés.
Al Prof. José Manuel García Verdugo, por el apoyo otorgado para realizar las imágenes de microscopia electrónica, así como al Servicio de Microscopia Confocal del CAI, Centro de Microscopía y Citometría de la Universidad Complutense de Madrid.