Los niños con hipotiroidismo congénito (HC) están en riesgo de presentar déficit cognitivos sutiles, a pesar de tener un rendimiento intelectual global dentro de rangos normales. Estos déficits pueden ser consecuencia de condiciones inherentes a la enfermedad y a factores relacionados con el tratamiento. El presente estudio explora el efecto de las desviaciones del estado de eutiroidismo durante los primeros 3 años de vida en el rendimiento atencional durante la edad escolar.
MétodosFueron evaluados 49 niños con HC diagnosticado y bajo tratamiento, de ellos 14 fueron niños (9,5±2,8 años de edad) y 35 niñas (9,6±2,6 años de edad). Se calculó el total de episodios de sobre, infra y normotratamiento a partir de los valores de TSH durante los primeros 3 años de vida (medidos a los 12, 18, 24, 30 y 36 meses de edad). Los niños fueron evaluados mediante una versión computarizada del Test de atención sostenida. Se calcularon los modelos lineales generales usando el índice de atención como variable dependiente y el género, la etiología y los episodios de sobre, infra y normotratamiento como independientes.
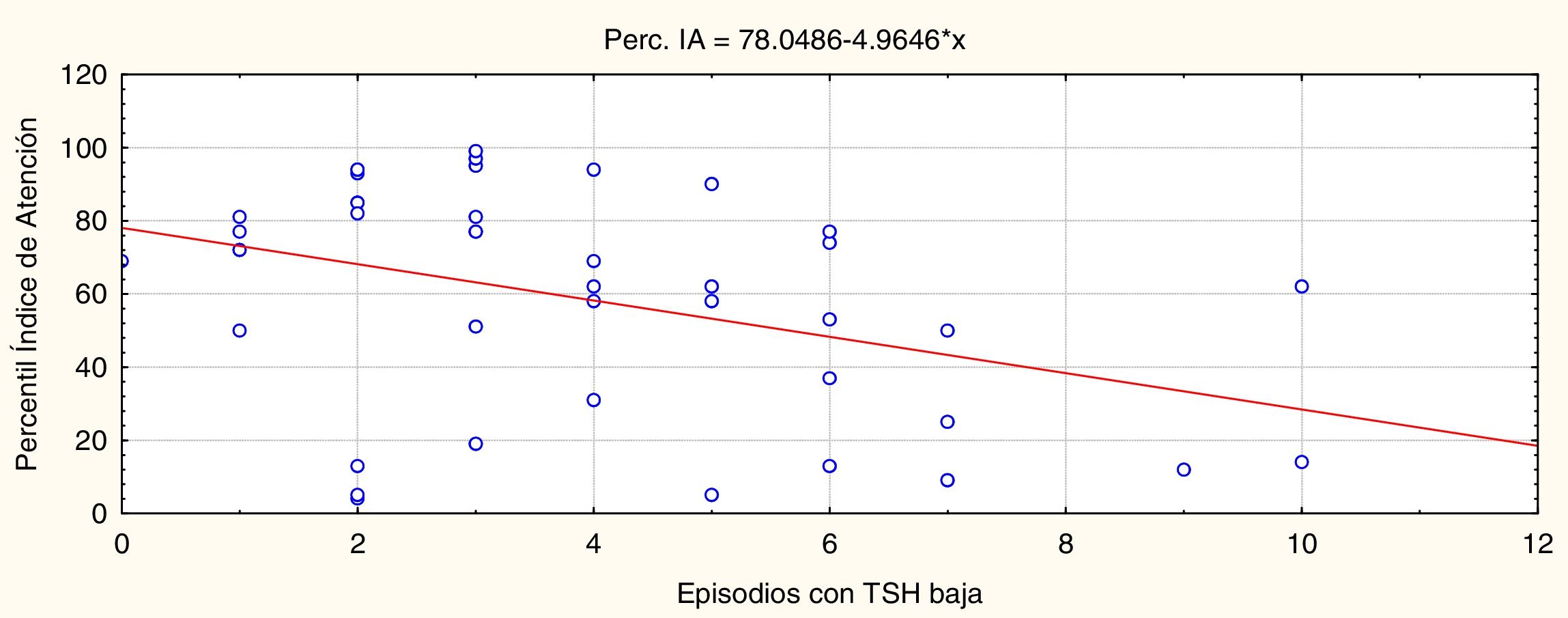
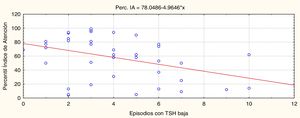
ResultadosEl número de episodios de sobretratamiento (TSH baja) se asoció a un peor rendimiento atencional en la edad escolar (p=0,005, r=–0,45).
ConclusiónDebe realizarse un seguimiento estrecho en los 3 primeros años en pacientes con HC para evitar no solo el hipotiroidismo, sino también los efectos adversos de episodios de hipertratamiento que pueden comprometer el procesamiento atencional en edad escolar.
Children with congenital hypothyroidism (CH) are at risk of developing mild cognitive impairment despite normal overall intellectual performance. These deficits may be caused by disease-related and treatment-related factors. This study explores the impact of abnormal thyroid function during the first 3 years of life on attention performance at school age.
MethodsWe included 49 children diagnosed with CH and receiving treatment for the condition: 14 boys (mean age 9.5±2.8 years) and 35 girls (9.6±2.6 years). The number of episodes of normal, under-, and overtreatment were estimated based on TSH levels during their first 3 years of life (at 12, 18, 24, 30, and 36 months). Children were assessed using a computerised version of a Sustained attention test. General linear models were calculated with the attention index as the dependent variable and sex, aetiology, and number of episodes of normal, under-, and overtreatment as independent variables.
ResultsHigher numbers of episodes of overtreatment (low TSH level) were associated with poorer attention performance at school age (P=.005, r=–0.45).
ConclusionsChildren with CH should be monitored closely during the first 3 years of life in order to prevent not only hypothyroidism but also any adverse effects of overtreatment that may affect attentional function at school age.
Un cuerpo consistente de resultados indica que, aunque los cocientes de inteligencia de los niños con hipotiroidismo congénito (HC) están dentro del rango normal y pueden cursar la enseñanza elemental tradicional, estos presentan un patrón de déficit cognitivo ligero caracterizado por problemas en el procesamiento visoespacial y auditivo, déficit ligeros de memoria, pobre rendimiento sensorimotor, alteraciones electroencefalográficas subclínicas y especialmente déficit atencionales1–5.
En 2004 Álvarez et al.6 plantearon la hipótesis del doble efecto. En la misma se formulaba que en el HC aparecerán déficits cognitivos por 2 motivos: a) relacionado con las características intrínsecas de la enfermedad7; y b) relacionado con el tratamiento8. Dentro de los factores intrínsecos de la enfermedad están la duración y severidad del hipotiroidismo fetal, la severidad bioquímica inicial (niveles de T4 sérica por debajo de 42nmol/l)9, así como su etiología10,11 y configuración genética12,13.
En cuanto a los factores relacionados con el tratamiento existe un menor acuerdo. La dosis inicial óptima de levotiroxina es el aspecto más controvertido, existiendo contradicciones respecto a si una dosis inicial alta (15μg/kg/día) es beneficiosa e inocua o si es preferible una dosis inicial más baja14–24. El problema es que no existe una relación simple y directa entre la dosis inicial y la cognición debido a la diversidad de metodologías con las que se ha estudiado esta influencia.
Como ejemplo de estas contradicciones pueden tomarse 2 estudios realizados mediante potenciales relacionados a eventos. Marti et al.25 encontraron que, aunque la organización estructural y anatómica del sistema auditivo no difiere entre los niños con HC y los controles, la latencia del componente N200 de los potenciales cognitivos fue mayor en el HC. Esta prolongación se correlacionó con el exceso de tratamiento inicial, sugiriendo que la velocidad de procesamiento de información del sistema nervioso central puede estar subclínicamente comprometida con una dosis alta de levotiroxina. Un estudio en 20 niños cubanos con HC encontró que la dosis inicial alta de levotiroxina sódica se asoció a un mejor rendimiento intelectual general, pero con bajos indicadores en la ejecución de pruebas cognitivas asociadas a los procesos de atención y memoria visual26.
En un estudio preliminar colaborativo entre instituciones españolas y cubanas se encontró una pista que podría aclarar la contradicción anterior27. Si los niños tenían una dosis inicial de levotiroxina entre 10-15μg/kg/día era el número de episodios de sobretratamiento (valores de TSH inferiores a 0,5μIU/ml en los primeros 6 meses de vida) el factor que estaba asociado a un rendimiento en atención sostenida más bajo cuando el niño alcanzara la edad escolar, y no las variaciones de la dosis inicial en el rango mencionado. Es decir, que no solo era necesario evitar el hipotiroidismo, sino también los episodios de hipertiroidismo en este periodo sensible y temprano del desarrollo cerebral. Sin embargo, quedaba sin dilucidar si esta asociación se extendía durante un tiempo mayor que comprendiera los 3 primeros años de edad, ya que en este periodo se incluye la etapa de mayor sinaptogénesis y comienza el podado de las áreas visomotoras.
Sujetos y métodosSe estudiaron 49 pacientes, de ellos 14 eran niños (9,5±2,8 años de edad) y 35 niñas (9,6±2,6 años de edad). Los pacientes se diagnosticaron mediante el programa de pesquizaje neonatal para HC. La detección de los niveles de TSH se realizó mediante una muestra de sangre seca del talón en las primeras 48horas de nacidos usando la técnica de inmunofluorescencia en tiempo retardado (DELFIA®)28. El punto de corte para sospechar la condición enferma fue TSH≥10μIU/ml29 y la confirmación diagnóstica se realizó mediante las determinaciones plasmáticas de tiroxina libre (FT4) y TSH y el diagnóstico etiológico mediante una gammagrafía urgente del tiroides (99Tc).
La etiología del HC fue atireosis en 7 niños, tiroides sublingual en 28 niños y con tiroides eutópica 14 niños.
La terapia de reemplazo hormonal comenzó con la dosis oral recomendada de levotiroxina (LT4) 10-15μg/kg/día30. El tratamiento comenzó a los 8,2±7 días. Los valores normales de TSH y FT4 para este período fueron TSH 0,5-4,5μIU/ml y FT4 0,8-2,5ng/dl31. Los valores de TSH se monitorizaron durante los primeros 3 años de vida de la siguiente manera: a los 12, 18, 24, 30 y 36 meses de edad cronológica. Se calculó la cantidad de episodios de sobretratamiento contando el número de veces que la TSH estaba inhibida por debajo de 0,5μIU/ml y de infratratamiento contando el número de veces en que estaba por encima de 4,5μIU/ml, así como las veces en que estaba en rango normal.
Se cumplieron las normas éticas vigentes según la Declaración de Helsinki para el estudio en humanos y los tutores legales de los niños participantes firmaron el modelo de consentimiento informado.
Variables neurocognitivasSe diseñó la batería computarizada Neurohipot 1.0, que evalúa procesos neurocognitivos potencialmente deficitarios en niños con HC25. A esta batería se le ha calculado la validez contrastante comparando niños sanos, niños con trastornos del aprendizaje y niños con hipotiroidismo congénito. En este estudio se reportan los resultados de la atención sostenida mediante la variable índice de atención, que es un indicador de la proporción de las respuestas correctas, errores y omisiones durante una tarea de ejecución continua visual que dura 12minutos (aciertos-errores-omisiones/aciertos+omisiones+errores con resultados desde –1 hasta+1). Se usó el paradigma tarea de ejecución continua (CPT)32. Se presentaron 700 estímulos, 70 dianas y 630 distractores, con un tiempo de exposición y de ocultamiento de 500milisegundos para ambos. La prueba fue aplicada en un ambiente controlado (laboratorio de neuropsicología) por personal entrenado, utilizando un ordenador de mesa (pantalla de 21,5×28,5cm) durante el horario de la mañana. Los casos fueron evaluados de acuerdo al manual de usuario editado por UNICEF para normas de niños sanos entre 7 y 15 años. Los resultados de las evaluaciones se compararon con las normas establecidas para la batería (UNICEF)33. Dichas normas fueron elaboradas a partir de la evaluación de 220 niños escolares sanos estratificados por sexo y edad. La prueba realizada tiene una sensibilidad del 95%.
Análisis estadísticoMediante el paquete estadístico Statistica 8.0 para Windows (StatsoftInc, 2010) se utilizó el análisis de varianza de una clasificación para determinar diferencias entre los valores medios de la TSH, así como las diferencias entre la cantidad de episodios de infra, sobre y normotratamiento según la etiología del HC. Se calcularon los modelos lineales generales usando como variable dependiente el índice de atención, como variables predictoras categóricas el género y la etiología y como predictoras continuas los episodios de sobre, infra y normotratamiento. Se trabajó con un nivel de significación estadística p<0,05 y el cálculo del tamaño del efecto se realizó mediante el método de Cohen (grande d≥0,8, mediano d=0,5-0,7 y pequeño d=0,2-0,4)
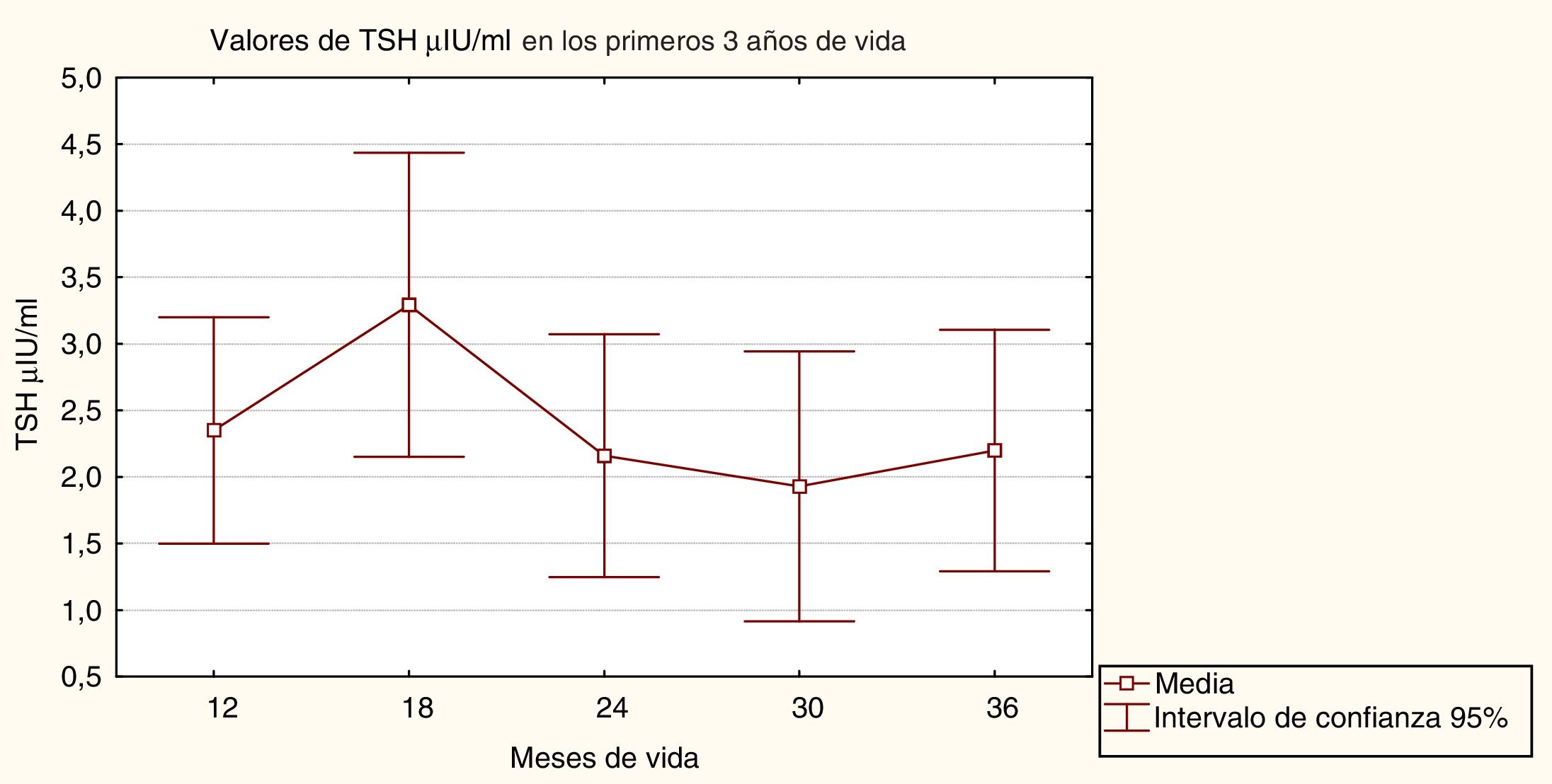
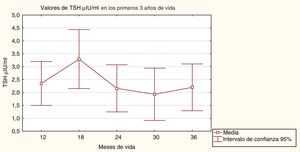
ResultadosResultados generales del seguimiento y control endocrinoLos valores iniciales de TSH variaron según la etiología del HC, siendo de 133,3±81,6μIU/ml en la atireosis, 76,9±28,6μIU/ml en la tiroides sublingual y de 46,4±32,2μIU/ml en la tiroides eutópica. Los valores iniciales de FT4 fueron 0,2±0,1ng/dl en la atireosis, 0,8±0,4ng/dl en la tiroides sublingual y de 1,0±0,7ng/dl en la tiroides eutópica. La dosis media inicial de LT4 fue 11,2±2,3μg/kg/día. La figura 1 muestra los valores medios de TSH durante los primeros 3 años de vida.
Un análisis de varianza de una clasificación muestra que no existen diferencias estadísticamente significativas entre los valores medios de TSH, encontrándose estos en rangos normales (F=0,25, p=0,91).
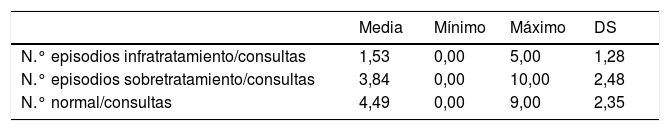
La tabla 1 muestra el estimado de los episodios de sobre o infratratamiento. Se realizó el recuento de la cantidad de veces en que los niveles de TSH estaban aumentados, disminuidos y en rango normal y se dividió entre el número de consultas asistidas en los 3 años para tener un índice valorativo de la cantidad de veces que el niño había estado en sobre o infratratamiento. Como puede observarse, la cantidad de veces en que el tratamiento estaba en rangos normales fue superior al infra o sobretratamiento.
Este análisis se realizó de acuerdo a la etiología del HC, los resultados se muestran en la tabla 2. El análisis de varianza muestra que no existen diferencias en la cantidad de episodios de TSH aumentada según la etiología del HC (F=0,91, p=0,4). Sin embargo, los episodios de TSH disminuida (sobretratamiento) sí tuvieron una relación significativa con la etiología del HC (F=3,30, p=0,04). Los casos con agenesia (p=0,02) y tiroides sublingual (p=0,04) tuvieron una cifra significativamente superior de estos episodios que los casos con tiroides eutópica. Por otra parte, los casos con tiroides eutópica tuvieron una cifra significativamente superior de episodios de normalidad que las otras 2 etiologías (F=7,47, p=0,002).
Media del número de episodios de TSH aumentada, disminuida y normal según la etiología del HC
| Etiología | Media del n.° episodios TSH aumentadaa | N | DS |
|---|---|---|---|
| Agenesia | 2,00 | 7 | 1,53 |
| Sublingual | 1,57 | 28 | 1,07 |
| Eutópico | 1,21 | 14 | 1,53 |
| Etiología | Media del n.° episodios TSH disminuidab | N | DS |
|---|---|---|---|
| Agenesia | 5,14 | 7 | 2,79 |
| Sublingual | 4,14 | 28 | 2,45 |
| Eutópico | 2,57 | 14 | 1,95 |
| Etiología | Media del n.° episodios TSH normalc | N | DS |
|---|---|---|---|
| Agenesia | 3,29 | 7 | 1,79 |
| Sublingual | 3,89 | 28 | 2,08 |
| Eutópico | 6,29 | 14 | 2,23 |
Los resultados significativos se muestran en las figuras 2 y 3. La figura 2 permite ver que los episodios de TSH disminuida (sobretratamiento) están asociados significativamente y de manera inversa (p=0,005, r=–0,45) al rendimiento en atención.
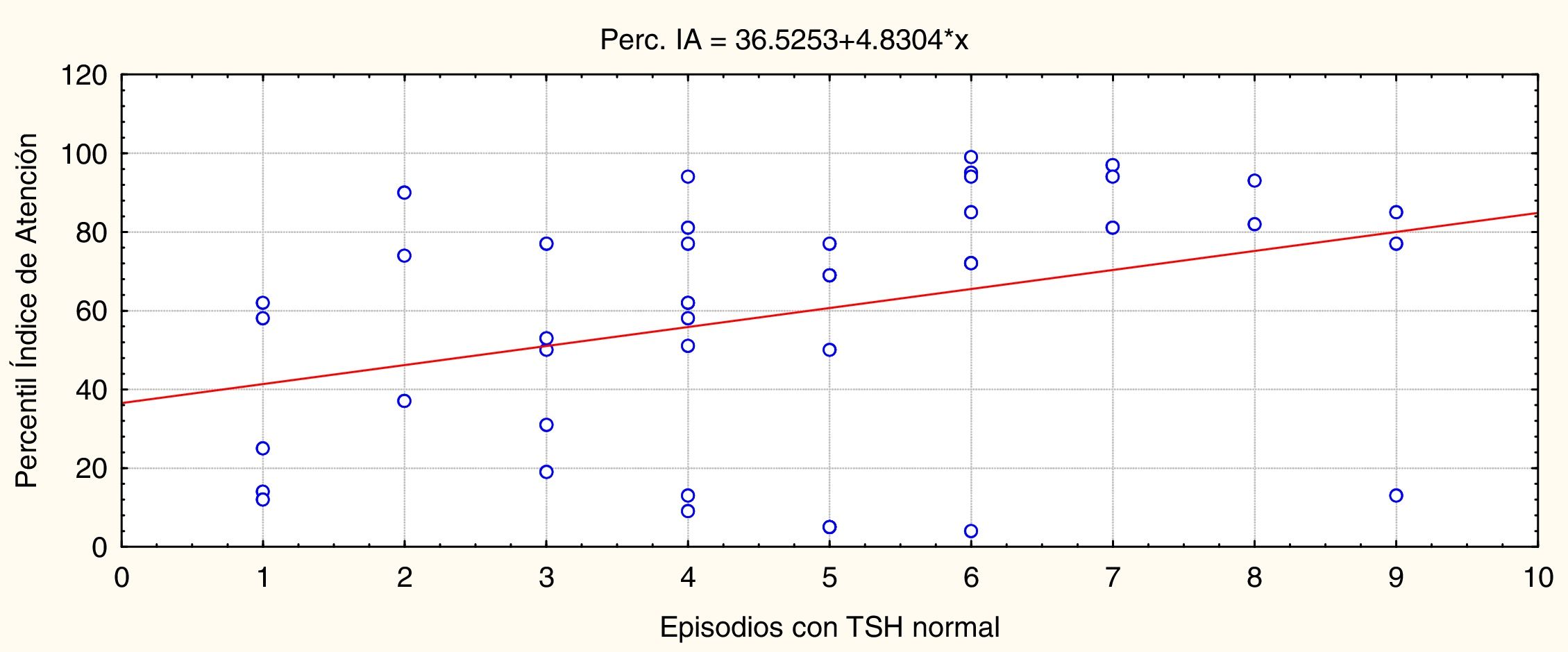
En la figura 3 observamos que los episodios de TSH normales están asociados de manera significativa y directa (p=0,02, r=0,38) al rendimiento atencional.
En resumen, mientras más veces la TSH esté en rangos normales en los primeros 3 años de vida el rendimiento de atención en la edad escolar será mejor, y mientras más veces el tratamiento haya sido excesivo habrá un peor rendimiento atencional. Los episodios de TSH elevados no ajustan en la ecuación debido a que durante este periodo de tiempo ha sido la condición que se ha evitado y se mueve en un rango de variabilidad muy reducido. Estos resultados son independientes del género del paciente y la etiología del HC.
DiscusiónLos resultados encontrados en este trabajo sugieren que los episodios de exceso de dosis de levotiroxina durante los primeros años de vida influyen en la cognición y obligan a extender en el tiempo la vigilancia sobre los niveles de TSH para mantenerse dentro de los márgenes del eutiroidismo. En la práctica clínica ha sido incorporado como un factor de riesgo para la cognición del niño con HC en el Consenso Internacional sobre HC celebrado en Roma30, y se propone una monitorización estricta de la función tiroidea y una reevaluación del diagnóstico después de 3 años de tratamiento si la tiroides es eutópica.
El trastorno de atención sostenida sutil que se ha encontrado relacionado con los episodios de sobretratamiento se expresa sin hiperactividad11,12, por lo que puede pasar inadvertido. No implica un daño cognitivo mayor que comprometa severamente el rendimiento académico, sino una potencial limitación a las posibilidades del niño que persiste en la adolescencia y en la adultez.
El valor neurobiológico de este resultado es necesario analizarlo desde el concepto del cerebro como órgano diana de moléculas con efecto modulador sobre procesos cognitivos básicos.
La temporalidad es un concepto clave en neurobiología, y el mismo tiene una clara expresión en la acción de las hormonas tiroideas sobre la cognición y el neurodesarrollo34. El efecto de las hormonas en el neurodesarrollo tiene lugar de acuerdo con la fase del ciclo vital en que se encuentre el organismo y los tipos de plasticidad cerebral predominantes durante la misma. La influencia hormonal es, por tanto, epigenética. Las hormonas, en su condición de factor epigenético, influyen en la conducta mediante los procesos de plasticidad, provocando 2 efectos principales: el organizador y el activador35,36 que en ocasiones se solapan.
El efecto organizador se refiere a la capacidad de las hormonas de influir en la citoarquitectura y estructura del cerebro de manera permanente durante su desarrollo. La necesidad de hormonas tiroideas varía según el área cerebral y la etapa del neurodesarrollo. Estas intervienen en procesos de neurogénesis, migración neuronal, formación axonal y dendrítica, mielinización y sinaptogénesis37 a partir de la regulación de genes específicos y la activación o supresión de receptores específicos para estas hormonas en los núcleos neuronales34,38. Los genes bajo esta regulación tienen especificidad temporal y regional dentro del cerebro en desarrollo, al igual que los receptores nucleares mencionados39. La acción de las hormonas tiroideas en el cerebro tiene una secuencia posteroanterior, siendo la región frontal la última que requiere de estas hormonas en el periodo posnatal. La carencia de hormonas tiroideas durante el inicio de la gestación se ha asociado a problemas en la atención y procesamiento visuales y en las habilidades motrices gruesas, y de presentarse al final del embarazo existe el riesgo de alteraciones en la sensibilidad al contraste y habilidades visoespaciales; en la etapa posnatal las áreas más afectadas son el lenguaje y la memoria. En ambos períodos del desarrollo cerebral la disminución de estas hormonas influye en la corticogénesis y migración neuronal en las regiones visual, auditiva y en zonas parietales, así como en el tamaño, estructura y migración neuronal del hipocampo con los déficits subsecuentes40–44.
El efecto activador se relaciona con la activación de células diana para facilitar conductas en contextos específicos. Son influencias transitorias determinadas por la concentración de las hormonas en cada instante. El cerebro requiere una cantidad precisa de hormonas a lo largo del ciclo vital para la neurotransmisión45,46, y cualquier desviación fuera de estos límites impide la normal actividad cognitiva47.
El exceso puntual de hormonas tiroideas en la etapa del ciclo vital estudiada tiene ambos efectos. El efecto organizacional ocurre debido a que la mayor parte del desarrollo cerebral es posnatal y en estos primeros 3 años la citoarquitectura está en proceso de formación crítica; el efecto activador se evidencia en un rendimiento en atención concentrada inferior al de controles sanos pareados como consecuencia directa del exceso de estas hormonas en el sistema nervioso central47,48.
La atención sostenida49 es la variable que con más frecuencia aparece reportada como deficitaria11,12,27,50 en el HC. Es un sistema complejo con varios circuitos neuronales que presentan su propia anatomía y estructura celular, así como un patrón de desarrollo que puede o no modificarse en dependencia de la edad50–52. No se sabe todavía cuál es la secuencia de maduración hormonas tiroideas dependientes de estas áreas en los primeros 3 años de vida, pero los resultados sugieren que la ventana de ese periodo sensible es más amplia que lo que trabajos previos habían indicado11,12,34. Esta plasticidad del neurodesarrollo, en la medida en que es más extendida en el tiempo, hace más vulnerable el cerebro del niño con HC. Es necesario entonces establecer un control frecuente del niño con HC en los primeros 3 años de vida con el propósito de mantener los niveles de hormonas tiroideas en el estrecho margen que evite tanto la aparición de episodios de hipotiroidismo como de hipertiroidismo por sobretratamiento.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Al Real Patronato sobre discapacidad y a la Asociación Española de Screening Neonatal.