La enfermedad de Alexander es una enfermedad rara causada por mutaciones en el gen que codifica la proteína glial ácida fibrilar (GFAP). En un estudio previo hemos observado que la diferenciación de neuroesferas transfectadas con estas mutaciones genera un tipo celular que comparte la expresión de GFAP y NG2.
ObjetivosDeterminar el efecto de las mutaciones en marcadores moleculares en comparación con células de glioma diferenciados que expresan simultáneamente GFAP y NG2.
MétodosSe utilizaron muestras de glioblastoma humana (GLM) y neuroesferas procedentes de rata transfectadas con mutaciones de GFAP para el análisis de la expresión tras diferenciación de GFAP y NG2, así como el análisis inmunocitoquímico de diferenciación de ambos tipos celulares y detección de ambas proteínas, junto a nestina, vimentina, Olig2 y caspasa 3 a los 3 y 7 días de diferenciación.
ResultadosTanto las células transfectadas con mutaciones de GFAP como las células procedentes de GLM mostraron un incremento de NG2 y GFAP. Sin embargo, la expresión de células caspasa 3 positiva era marcadamente mayor entre las células transfectadas que entre las células procedentes de GLM.
ConclusiónNuestros resultados parecen indicar que la expresión de GFAP no es el único factor que condiciona la muerte celular en la enfermedad de Alexander y que la expresión de caspasa 3 y el potencial papel de la NG2 en incrementar la resistencia a la apoptosis en las células que coexpresan GFAP y NG2 deben ser considerados en la búsqueda de acciones terapéuticas en esta enfermedad.
Alexander disease is a rare disorder caused by mutations in the gene coding for glial fibrillary acidic protein (GFAP). In a previous study, differentiation of neurospheres transfected with these mutations resulted in a cell type that expresses both GFAP and NG2.
ObjectiveTo determine the effect of molecular marker mutations in comparison to undifferentiated glioma cells simultaneously expressing GFAP and NG2.
MethodsWe used samples of human glioblastoma (GBM) and rat neurospheres transfected with GFAP mutations to analyse GFAP and NG2 expression after differentiation. We also performed an immunocytochemical analysis of neuronal differentiation for both cell types and detection of GFAP, NG2, vimentin, Olig2, and caspase-3 at 3 and 7 days from differentiation.
ResultsBoth the cells transfected with GFAP mutations and GBM cells showed increased NG2 and GFAP expression. However, expression of caspase-3–positive cells was found to be considerably higher in transfected cells than in GBM cells.
ConclusionsOur results suggest that GFAP expression is not the only factor associated with cell death in Alexander disease. Caspase-3 expression and the potential role of NG2 in increasing resistance to apoptosis in cells co-expressing GFAP and NG2 should be considered in the search for new therapeutic strategies for the disease.
La base patológica de la enfermedad de Alexander (AxD) es la aparición de los cuerpos de Rosenthal1, unas inclusiones citoplasmáticas, que también han sido descritas en otras enfermedades. Estas inclusiones están constituidas por proteína glial ácida fibrilar (GFAP). El origen de la enfermedad se ha relacionado con la presencia de mutaciones en el gen que codifica la GFAP, pero todavía no se conoce a través de qué mecanismo2,3, aunque se ha defendido la hipótesis de que las mutaciones de GFAP pueden conducir al acúmulo de GFAP y la elevación de la proteína sea dañina para la célula, no solo porque pueda ser estructuralmente anómala sino por un mecanismo de ganancia de función4 y agregación5. A pesar de ello, se han planteado otras hipótesis que pueden contribuir a desarrollar la enfermedad6–8. En un estudio previo, hemos indicado que las mutaciones de la GFAP podrían suponer la persistencia de esta proteína durante la diferenciación a la estirpe oligodendrocitaria, generando un tipo celular con la expresión persistente y conjunta de GFAP y NG2 que no conduciría a la generación de precursores oligodendrocitarios9 y que podría explicar las alteraciones de la mielina que se presentan en la mayoría de los pacientes. La glía NG2 es una población celular que coexpresa GFAP y NG2 y estas células pueden migrar al cuerpo calloso donde se convierten en progenitores oligodendrogliales. Al margen de ello, la expresión de estas proteínas supone poblaciones celulares excluyentes10,11. Sin embargo, la coexpresión de GFAP y NG2 está también descrita en las células de algunos gliomas (GLM), tanto en el propio tumor12,13 como en el tejido alrededor del mismo14. Estos gliomas que expresan NG2 pueden proceder de las llamadas células madre tumorales, que son indiferenciadas15, aunque hay distintos tipos de glioma que lo presentan. La expresión de NG2 en estos gliomas parece promover la quimiorresistencia y proteger contra la muerte celular y también puede fomentar la invasión tumoral ya que NG2 promueve la migración16. El aumento de la resistencia de las células de glioma que expresan NG2 a la quimioterapia y radioterapia se ha atribuido a la interacción cis de NG2 con α3β1-integrina que activa la vía de señal PI3K/Akt17. Los GLM pueden expresar GFAP y desarrollar fibras de Rosenthal de forma similar a la AxD18, pero no generan alteraciones de la mielina, de forma que puede ser interesante comparar en que se diferencia entre ambas situaciones en cuanto existe la coexpresión de NG2. Con este objetivo, hemos analizado la diferenciación de células indiferenciadas procedentes de GLM con neuroesferas a las que se han transfectado las mutaciones de GFAP con el objetivo de evaluar las diferencias en los tipos celulares resultantes.
MétodosObtención de las células procedentes de GLMPrevio consentimiento informado, las muestras fueron recolectadas mediante abordaje estereotáctico y recolectadas en Dulbecco's Modified Eagle Medium hasta su disgregación y cultivo en Dulbecco's Modified Eagle Medium bajo en glucosa y suplementado con L-glutamina (2mM), aminoácidos no esenciales (1%), suero fetal bovino 10%), penicilina (1.00U/ml) y estreptomicina (0,1μg/ml) en una atmósfera húmeda a 37°C y 5% de CO2. Todos los medios de cultivo y suplementos fueron adquiridos en Sigma Aldrich. Para su diferenciación, en pase 8, las células fueron disgregadas y cultivadas en chambers slides pretratadas (Fisher) de 4 pocillos y sembradas a una concentración de 25×103 células; posterior a esto, al día 3 y 7 se procedió a su fijación en PFA 4% para su ulterior análisis por técnicas de inmunocitoquímica.
Obtención de los plásmidos de las mutaciones de GFAPPara la realización de los experimentos se obtuvieron los plásmidos de las mutaciones más frecuentes de GFAP. A través del Dr. Michael Brenner (NINDS, NIH, Maryland, EE. UU.), se obtuvieron las construcciones de hGFAPR79H, hGFAPR239H y hGFAPR416W. La construcción de hGFAPR88C se obtuvo en el laboratorio mediante mutagénesis dirigida. Se transfectaron neurosferas con hGFAPwt (WT), hGFAPR88C, hGFAPR79H, hGFAPR239H y hGFAPR416W mediante Pfu Turbopolimerasa (Stratagene). Las neuroesferas se transfectaron 5 días in vitro (DIV) después del paso 6-7 por medio de la tecnología de nucleofección (Amaxa Nucleofector II, Lonza), usando el programa A-33. Cada matraz de 75cm2 se transfectó usando 4μg de ADN plasmático y se cultivó con medio completo. Con el fin de estimar la eficiencia de la transfección se utilizó el plásmido pMAX-GFP suministrado en el kit Amaxa Nucleofector® de células madre neuronales de ratón (Lonza). El método completo de realización a las neurosferas ha sido descrito previamente9.
DiferenciaciónTranscurridas 72h de recuperación en medio completo, las neuroesferas se sembraron en medio de diferenciación compuesto por medio control suplementado con 1,5% de suero fetal bovino (Gibco; Ref. 16000). Para ello, las neuroesferas procedentes de un pocillo de 9cm2 se sembraron en 3 pocillos de 2cm2 que contenían un cubreobjetos tratado previamente con poly-D-lisina (Sigma; Ref P1024). Para cada transfección se obtuvieron un total de 6 pocillos de 2cm2. Antes de cada siembra en el medio de diferenciación se realizaron 2 lavados para eliminar los restos de factores de crecimiento del medio completo. Para el análisis de la diferenciación se establecieron 2 puntos temporales de análisis: 3 y 7 días dedicando 3 pocillos de 2cm2 para cada tiempo. Las inmunocitoquímicas de realizaron sobre las neuroesferas adheridas a los cubreobjetos.
InmunocitoquímicaSe utilizaron los siguientes anticuerpos primarios: anti-hGFAP de ratón (1: 500, Sternberger Monoclonal), chicken anti-Vimentin (1:200, Millipore), rabbit anti-NG2 (1:200, Millipore), mouse anti-Olig2 (1:200, Millipore), mouse anti-Nestin (1:200, Millipore), rabbit anti-active caspase-3 (1:200, Abcam). Los anticuerpos secundarios correspondientes se incubaron durante 2h (Alexa-Fluor 405, 488, 555 o 647 de cabra anti-ratón, pollo o conejo, 1: 500, Invitrogen), seguido de incubación con DAPI (1: 1000, Sigma) durante 10min y enjuagado antes de ser montado en portaobjetos de vidrio con FluorSave (Calbiochem). Los análisis se realizaron con un microscopio de fluorescencia Nikon 80i con una ampliación de 40x o 63x.
Análisis estadísticoPara el análisis estadístico, las muestras fueron procesadas por triplicado y de 2 experimentos independientes se contaron para cada condición utilizando el microscopio Nikon 80i con ampliaciones de 40 o 63x. Se contaron un mínimo de 150 células transfectadas por cubreobjetos, los resultados de las transfecciones se utilizaron como dato único vs. los datos observados en las células GLM. En los cultivos de GLM, se analizaron al menos 300 células por condición y experimento. Todos los valores se presentan como media±error estándar.
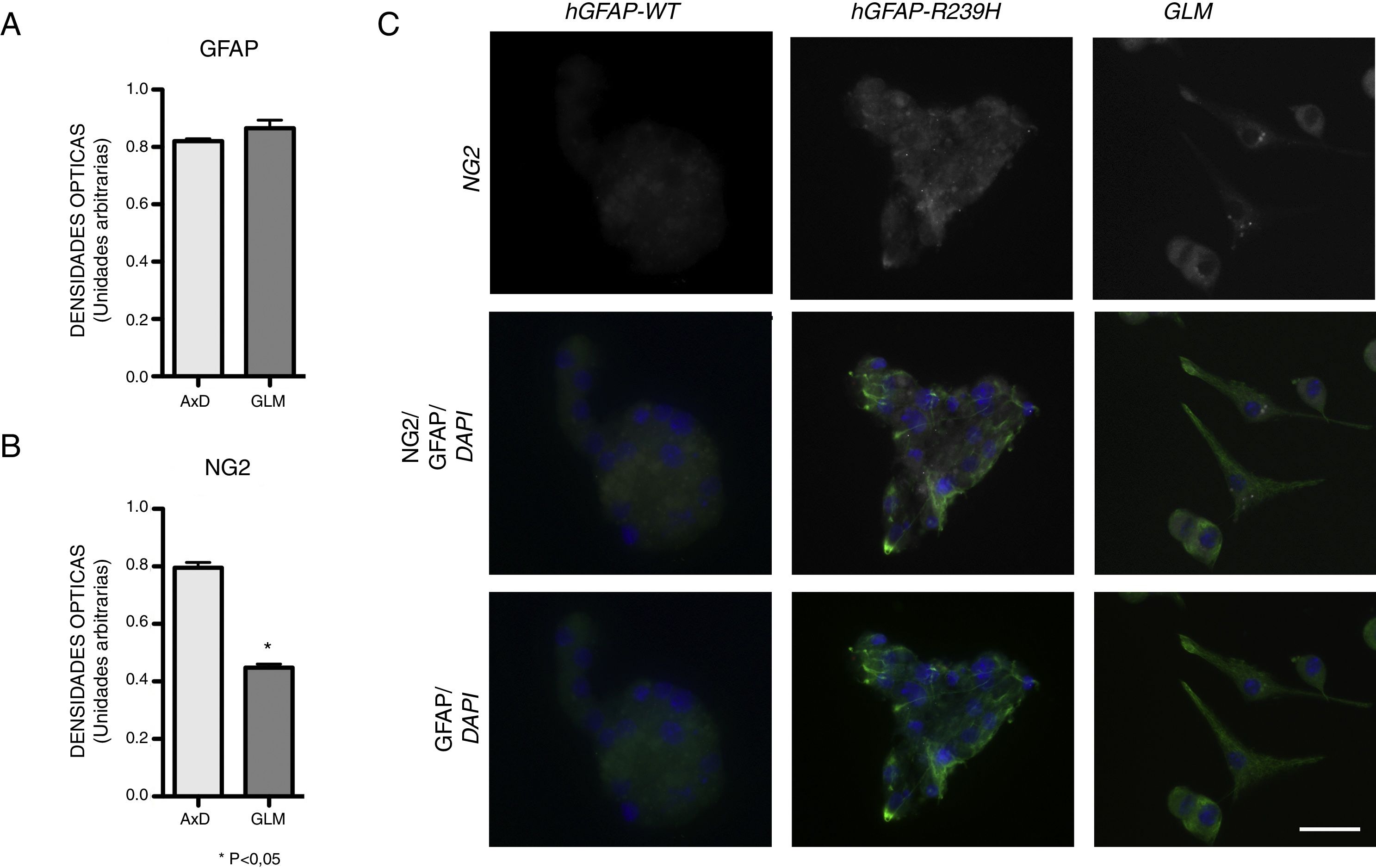
ResultadosLa expresión de GFAP está aumentada en las células GLM previamente a la diferenciación con una media de 0,339OD, con un rango 0,333-0342 frente a WT (0,272; rango 0,256-0,287). Al proceder al proceso de diferenciación, la expresión aumenta de forma clara. Así, al tercer día de diferenciación estas células muestran una expresión de GFAP 0,664 OD (0,632-0,691) y al séptimo día, la expresión era de 0,865 OD (0,822-0,918). Si se compara con la expresión que muestran las células AxD, se observa que la expresión de GFAP es similar. La expresión de GFAP a los 3 días de diferenciación fue 0,648 OD (0,578-0705) mientras que a los 7 días fue 0,820 OD (0,797-0,834), sin diferencias significativas (fig. 1A). La expresión de GFAP se observa aumentada tanto en las células AxD como GLM durante la diferenciación frente a WT en los 3 días (0,357OD; 0,315-0,391) como a los 7 días (0,511OD: 0,491-0,521). Asimismo, se ha observado diferencias en la expresión de NG2 en GLM previamente a la diferenciación frente a WT (0,339OD, rango 0,333-0,345; 0,184OD, rango 0,178-0,189 respectivamente). Al proceder al mismo proceso de diferenciación, la expresión aumenta (0,411OD; 0,388-0,435) frente a WT (0,271OD; 0,225-0,282), pero existe un incremento mayor en la expresión de NG2 frente a GLM y a WT en las células transfectadas (0,772OD; 0,625-0,868). Asimismo, estas diferencias se observan al séptimo día de diferenciación, ya que, aunque la expresión de NG2 en GLM (0,423OD; 0,401-0,467) es discretamente mayor a la que se halla en WT (0,201OD; 0,125-0,229), parece menor a la encontrada en las células transfectadas (0,807OD; 0,745-0,888) (fig. 1B).
Expresión de GFAP y NG2. A-B) Cuantificación de la expresión de GFAP y NG2 a 7 días de diferenciación C) se muestran imágenes de inmunofluorescencia de las muestras WT, AxD y GLM, donde se observan los patrones diferentes de expresión y de tipos de agrupación de las células. Es evidente que en las neuroesferas AxD se observa un mayor grado de agregados de filamentos GFAP positivos y marcaje NG2 atípico en la membrana celular. En las células de GLM el marcaje se la NG2 se observa en la membrana celular y en pequeños agregados perinucleares. La GFAP se observa en estas células en su citoesqueleto y en sus filopodios en su porción apical, donde el marcaje es más intenso.
Barra=25μm. Los gráficos muestran la media+error estándar, *p<0,05.
La comparación entre GFAP y NG2 aparece en la figura 1, donde la expresión de NG2 se observa en forma de grupos y con una mayor densidad de marcaje; cabe señalar que la expresión de NG2 se observa en conjunto de células agrupadas en neuroesferas de forma atípica, ya que no mantienen una estructura esférica y uniforme como la observada en el grupo WT, en cambio en las células de GLM la expresión de NG2 se observa en células individuales o agrupadas en pequeños conjuntos con una forma estrellada o fusiforme donde la mayor densidad de marcaje se observa en los brazos apicales y en pequeñas zonas perinucleares (fig. 1C). La expresión de GFAP se observa de forma similar en las neuroesferas transfectadas, así como en las células GLM, manteniendo una mayor expresión de marcaje en las zonas o áreas donde hay expresión de NG2.
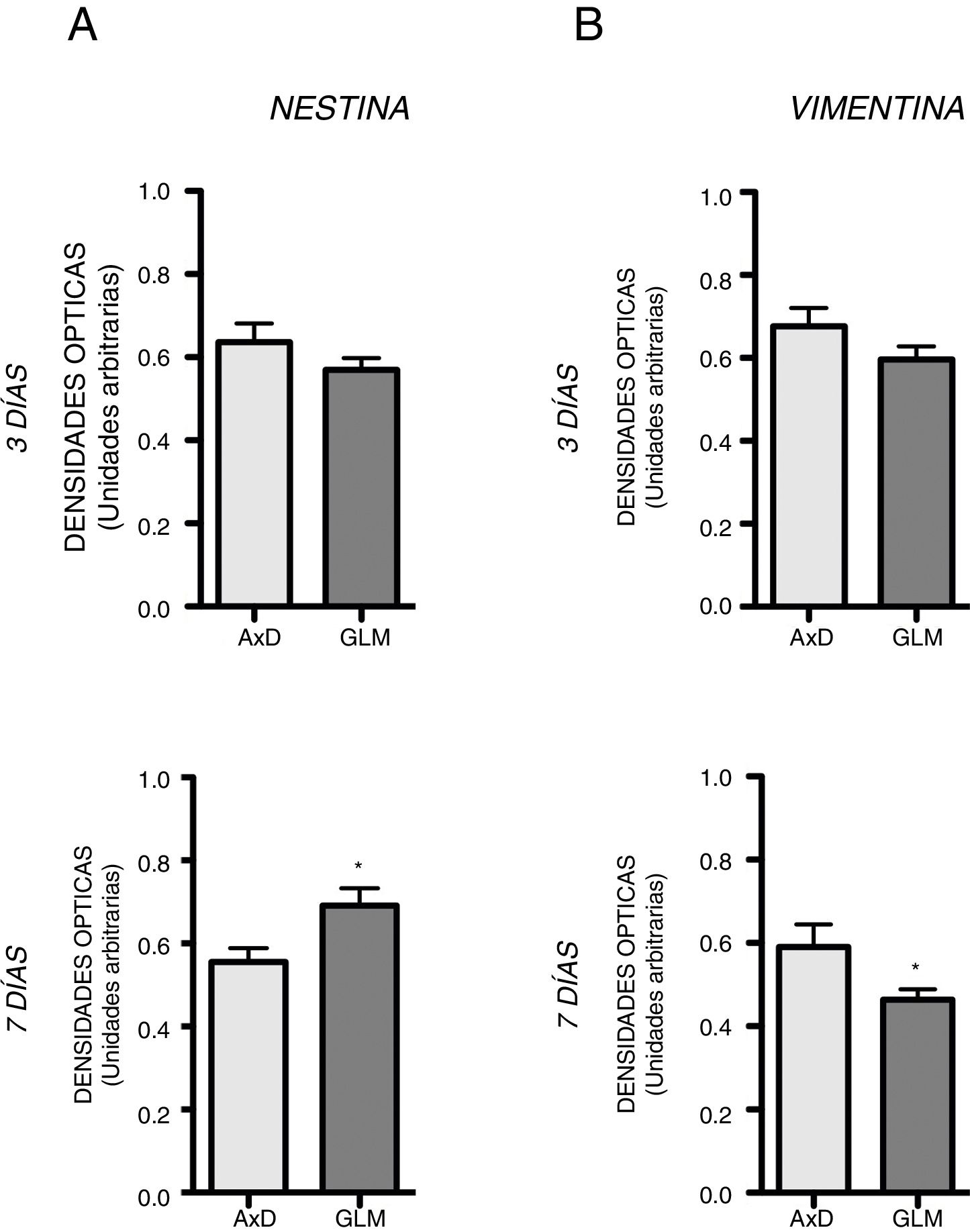
En el proceso de diferenciación no se observan diferencias en la expresión de nestina entre las células transfectadas (0,636OD; 0,429-0,764) y GLM (0,569OD; 0,490-0,670) al tercer día (fig. 2A). Al día 7, tampoco se hallan entre GLM (0,691OD; 0,589-0,865) a la hallada en las células transfectadas (0,555OD; 0,408-0,671) (fig. 2A). Sin embargo, en GLM existe una tendencia ascendente de nestina con la diferenciación, en AxD la tendencia parece ser inversa. Con relación a la expresión de vimentina(VIM) no existen diferencias entre las células transfectadas (0,676OD; 0,494-0,870) y GLM (0,596 OD; 0,521-0,665) al tercer día. Tampoco se hallan entre GLM (0,463OD; 0,412-0,513) a la hallada en las células transfectadas (0,590OD; 0,310-0,847) al séptimo día, con una tendencia a disminuir en ambos tipos celulares (fig. 2B). El % de células que coexpresan VIM y NG2 era algo mayor en AxD que en GLM durante el proceso de diferenciación ya que al tercer día el 25,5% de las células eran VIM+ NG2+ en AxD frente al 16% en GLM mientras que el 37,5 y 33% eran VIM+ NG2− en AxD y GLM respectivamente. Al séptimo día el 24% de las células eran VIM+ NG2+ en AxD frente al 19% en GLM mientras que el 37,75 y 31% eran VIM+ NG2− en AxD y GLM respectivamente. Respecto a la OLIG2+, que implica la diferenciación de las células NG2, al tercer día el 15,1% de las células eran OLIG2+ en AxD frente al 13,2% en GLM mientras que al séptimo día el 16,9% de las células eran OLIG2+ en AxD frente al 8% en GLM.
Expresión de nestina y vimentina. Los gráficos muestran la expresión de nestina y vimentina en células transfectadas y de GLM, mostrando al tercer día de diferenciación niveles similares, pero al séptimo día se observan diferencias en la expresión de los marcadores. Las células con mutación de GFAP muestran un comportamiento que en un caso pretende compensar una posible diferenciación alterada y en el caso de GLM una tendencia confirmar su naturaleza de estirpe glial.
Los gráficos muestran la media+error estándar, *p<0,05.
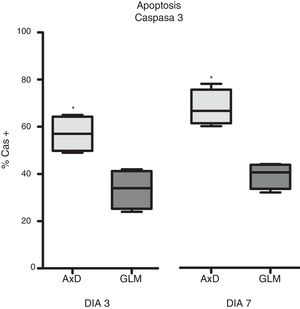
Hemos comparado también la expresión de caspasa 3 (Cas3) en los 3 grupos celulares. Así, el 57% de las células de AxD eran Cas+, mientras que el GLM solo lo era el 33,5% en el tercer día, incrementándose ese porcentaje en el séptimo día (AxD 67,75%; GLM 39,25%) (fig. 3).
Expresión de caspasa 3. El gráfico muestra un claro aumento tendencia de las células transfectadas desde el día 3 en el % de células Cas+, al compararlas con las células procedentes de los GLM; este evento fue más evidente al séptimo día de diferenciación, donde las células de AxD prácticamente duplicaban el porcentaje observado en las células GLM.
Los gráficos muestran la media+error estándar, *p<0,05.
Las proteínas GFAP y NG2 no comparten el mismo tipo celular en las células adultas19,20, salvo en algunas poblaciones celulares embrionarias y adultas21–23. Transfectando los plásmidos de mutaciones de GFAP relacionadas con la AxD a neuroesferas y estableciendo un proceso de diferenciación, observamos un tipo celular que compartía la expresión de ambas proteínas, lo que ha conducido a postular que el mecanismo de desarrollo de esta enfermedad puede estar relacionado con alteraciones en la diferenciación. Para aumentar el conocimiento de lo que supone la coexpresión de GFAP y NG2, hemos comparado distintos marcadores en las células transfectadas con mutaciones de AxD frente a un tipo celular que las comparte como son algún tipo celular de GLM. Así, células en las que se había comprobado que expresaban GFAP y NG2 simultáneamente, procedentes de GLM extirpados quirúrgicamente, las hemos sometido al mismo procedimiento in vitro. Efectivamente, ambos tipos celulares muestran un incremento de NG2 y GFAP frente a WT12,13.
En algunos GLM se han descrito células que expresan marcadores de células OPC como son NG2 y PDGFR-α, ambos marcadores distintivos de la glía NG224–26 y ello ha reforzado la hipótesis del papel de NG2 en esta neoplasia27 .Sin embargo, estas células también expresan nestina y GFAP y por lo tanto no pueden ser identificadas como esta forma de glía28. La coexpresión de nestina y NG2 también ha sido descrita en GLM29. Las células de gliomas, que son capaces de diferenciarse, han sido consideradas como iniciadoras30,31 y por ello las hemos comparado con las neuroesferas transfectadas. En nuestro modelo, el proceso de diferenciación de GLM supone el incremento de la expresión de NG2 y GFAP, de forma similar a lo que hemos descrito previamente en AxD9. Dado que las mutaciones de GFAP deben condicionar el aumento de expresión de esta proteína y no de nestina, hemos comprobado la correlación de esta proteína con NG2 y, así, mientras que en GLM existe una tendencia ascendente de nestina con la diferenciación, en AxD la tendencia parece ser inversa, lo que no ocurre con la GFAP ni con la expresión de VIM, en que la tendencia a disminuir aparece en ambos tipos celulares, aunque está presente, probablemente porque la mayor expresión de un neurofilamento intermedio se acompaña de la expresión de los otros31,32 lo que ya ha sido descrito en modelos de AxD33. Mientras que las células AxD generan por la diferenciación la expresión muy alta de Olig2, en las células GLM, la expresión está presente, lo que ya había sido descrito, aunque sea inferior. Sin embargo, el dato comparativo que parece de mayor interés es la diferencia en la expresión de Cas3 entre ambos tipos celulares. Estas células generan una expresión de Cas3 y, así, al séptimo día de diferenciación el 67,75% de las células transfectadas son Cas+; mientras que en las células procedentes de GLM solo lo eran el 39,25%. La asociación de un incremento de Cas3 en AxD ya ha sido descrita previamente34. La expresión de procaspasa-3 influye en la resistencia de las OPC al estrés oxidativo35 y en consecuencia la mayor expresión de Cas3 podría reducir esta resistencia, aunque dependiendo el grado de expresión de Cas3 se ha planteado que su incremento puede ser neuroprotector36,37.En la esclerosis múltiple, el estrés oxidativo en las lesiones también puede resultar en la muerte de las OPC38. El estrés oxidativo, que se observa en los astrocitos que expresan la GFAP mutada, podría incrementar la transcripción procedente del gen de GFAP, con un mecanismo no conocido, lo que contribuiría aún más al acúmulo de GFAP33. La proteína NG2 tiene un papel protector frente a la apoptosis, ya factores apoptóticos de la vía intrínseca que aparecen por estrés oxidativo39 se unen en el citoplasma al motivo PDZ de NG2, lo que aumentaría la resistencia de las células de estirpe oligodendrocitaria40. Estos datos señalan la necesidad de conocer con mayor detalle cuál es el papel que puede tener la expresión de Cas3 en la AxD. Este estudio tiene por objeto conocer las consecuencias de la coexpresión de GFAP y NG2 en 2 tipos celulares y que son muy distintos para poder comprender si muestran mecanismos distintos. Sin embargo, el estudio tiene 2 claras limitaciones que deben ser consideradas en el momento de interpretar los hallazgos. En primer lugar, una línea celular procede de neuroesferas obtenidas de rata, y la segunda de células humanas extraídas de tumores intervenidos a pacientes con gliomas indiferenciado y por lo tanto deben tenerse en cuenta las diferencias de especie entre las células. En segundo lugar, a ambos tipos celulares se les ha aplicado el mismo procedimiento in vitro de diferenciación, que en el caso de las células de GBM no tiene lugar en el paciente. A pesar de estas limitaciones metodológicas, el estudio nos permite establecer una serie de conclusiones que pueden ser interesantes para comprender qué puede suceder en el paciente con AxD, y que serían muy difíciles de obtener de otra manera. En primer término, ambas células coexpresan GFAP y NG2 que son potenciadas por la diferenciación y que cuando se compara con la expresión de nestina, los comportamientos son distintos lo que favorece mantener la hipótesis de un papel propio de la GFAP en las células NG2/GFAP producidas in vitro por la transfección de las mutaciones de AxD. En segundo lugar, el incremento de células Cas3+ por la diferenciación en las células transfectadas frente a las células de GLM, lo que plantea una posible vía de actuación en AxD.
Contribuciones de los autoresDiseño del estudio: UG-P, SS-P, JM-G-V, JBA y JM-G.a
Obtención de muestras de glioma: JBA.
Construcción del plásmido hGFAPR88C y transfecciones: SS-P.
Microscopia y estudio molecular: UG-P, MD, SS-P y JM-G-V.
Análisis estadístico: UG-P, JAMG y JM-G.
Análisis de resultados: todos los autores.
Figuras: UG-P.
Borrador manuscrito: JAMG, UGP, JM-G.
Revisión y aprobación del manuscrito: todos los autores.
Conflicto de interésLos autores declaran que la investigación se realizó en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un posible conflicto de intereses.
Los autores desean expresar su agradecimiento a Irene Borredá por su experta asistencia técnica; al Servicio de Microscopía Confocal del Centro de Investigación Príncipe Felipe y de la Universidad Complutense de Madrid; al Dr. Guillermo Velasco de la facultad de Ciencias Biológicas de la Universidad Complutense de Madrid por su apoyo en el cultivo de las muestras de GLM. Al Dr. Michel Brenner por facilitar los plásmidos mutados AxD; y a la Fundación Ayuda-Juanma por la colaboración en la financiación de este estudio.