La acetona cianohidrina (ACH) es una sustancia tóxica resultante de la hidrólisis enzimática de linamarina, contenido en las raíces de yuca (Manihot esculenta Crantz); su consumo a largo plazo se asocia con 2 trastornos neurológicos: konzo y la neuropatía atáxica tropical. Estudios anteriores han evaluado las alteraciones conductuales después del consumo de esta sustancia, pero los efectos tóxicos sobre los procesos fisiológicos se desconocen.
MétodoSe asignaron 32 ratas Wistar macho a 4 grupos experimentales (n=8): un grupo vehículo (solución salina 0,3ml/rata, ip) y 3 grupos con ACH (PubChem CID: 6406) a concentraciones de 10, 15 y 20mM, durante 28 días, cada 24 h. Se evaluó la actividad motora espontánea en campo abierto y la coordinación motora en pruebas de rotarod y nado a 0, 7, 14, 21 y 28 días de tratamiento. Al final de las pruebas conductuales (día 28) se tomaron muestras de sangre por punción transcardiaca para evaluar la función renal y hepática.
ResultadosLa ACH promovió alteraciones en la actividad locomotora y promovió tanto el nado lateral como la conducta de giro en la prueba de nado los días 21 y 28 del tratamiento. La ACH incrementó los parámetros de la función renal y hepática de una manera dependiente de la concentración, excepto la glucosa y la bilirrubina total.
ConclusiónEstos datos indican que el contenido de este compuesto tóxico contenido en las raíces de yuca podría ser potencialmente peligroso bajo el consumo a largo plazo en sujetos vulnerables.
Acetone cyanohydrin (ACH) is a toxic substance present in cassava roots (Manihot esculenta Crantz) which results from enzymatic hydrolysis of linamarin. Long-term consumption is associated with 2 neurological disorders: konzo and tropical ataxic neuropathy. Previous studies have evaluated behavioural alterations linked to ACH consumption, but the toxic effects of this substance on physiological processes remain unknown.
Method32 male Wistar rats were assigned to 4 experimental groups (n=8 per group): a vehicle group (0.3mL saline solution, IP) and 3 ACH groups (PubChem CID: 6406) dosed at 10, 15, and 20mM/24h for 28 days. We evaluated spontaneous motor activity with the open field test and motor coordination with the rotarod and forced swimming tests at 0, 7, 14, 21, and 28 days of treatment. At the end of the assessment period (day 28), blood samples were collected by transcardiac puncture to evaluate kidney and liver function.
ResultsACH caused alterations in locomotor activity and promoted both lateral swimming and spinning in the forced swimming test at 21 and 28 days of treatment. Furthermore, it led to an increase in the levels of the parameters of kidney and liver function in a concentration-dependent manner, except for glucose and total bilirubin.
ConclusionOur results suggest that long-term consumption of this toxic compound present in cassava roots may be potentially dangerous for vulnerable subjects.
La yuca (Manihot esculenta Crantz, familia botánica: Euphorbiaceae) es una planta nativa de América Latina y el Caribe. Se introdujo en África y Asia debido a su amplio uso en la industria alimentaria, mercado versátil y crecimiento relativamente fácil. Se considera un alimento nutritivo debido a su alto contenido en carbohidratos1,2. Se cultiva ampliamente en América del Sur y México en los estados de Guerrero, Tabasco, Michoacán, Morelos y Veracruz3. La yuca contiene 2 compuestos cianogénicos (linamarina y lotaustralina), cuyo metabolismo produce cianuro. La hidrólisis de linamarina se produce a través de linamarasa, que está contenida en la pared celular, dando lugar a la formación de metabolitos que son altamente tóxicos, incluyendo acetona cianohidrina (ACH)4. La (ACH) contenida en productos como harina de yuca es inestable y puede ser descompuesta espontáneamente en acetona y cianuro de hidrógeno5. Hemos encontrado una estrecha relación entre el consumo de yuca y sus compuestos químicos con deterioro locomotor6-9. Estos hallazgos apoyan experimentalmente informes epidemiológicos que han asociado el consumo excesivo de yuca o sus derivados y enfermedades del sistema nervioso central, como la neuropatía atáxica tropical y el konzo10.
En ratas macho Wistar, el análisis histológico determinó que tanto los glucósidos cianogénicos como el cianuro son elementos que generan toxicidad después del consumo a largo plazo del jugo de yuca, que produce la vacuolización de los hepatocitos, alteraciones en los glomérulos y degeneración o necrosis de los túbulos renales11. Sin embargo, la función fisiológica de los riñones y el hígado con la administración de ACH a largo plazo y su relación con las alteraciones de la actividad locomotora siguen sin explorar. El presente estudio investigó los efectos de diferentes concentraciones de ACH que fueron administradas por vía intraperitoneal (para evitar la hidrólisis) en la función renal y hepática (es decir, efectos hepatotóxicos y nefrotóxicos, respectivamente) y su relación con alteraciones en la actividad locomotora espontánea en la rata Wistar.
Diseño experimentalAnimales, concentraciones y grupos experimentalesTreinta y dos ratas macho Wistar, con un peso de 250-300g al inicio de los experimentos, se incluyeron en el estudio. Las ratas se alojaron en cajas de acrílico a una temperatura de 25±2°C bajo un ciclo de luz/oscuridad de 12/12h (se encendió a las 7:00 AM). El agua y los alimentos fueron ad libitum. Las manipulaciones experimentales se realizaron sobre guías internacionales para el cuidado y el uso de animales de laboratorio12 y la Norma Oficial Mexicana NOM-062-ZOO-1999 Especificaciones Técnicas para la Producción, Cuidado y Uso de Animales de Laboratorio13. Se hicieron todos los esfuerzos para minimizar el número de animales que fueron incluidos en el estudio.
Las concentraciones de ACH (PubChem CID: 6406) se basaron en estudios previos que encontraron que en 10 y 20mM se producen daños neuronales en el tejido cerebral y la médula espinal14. Por lo tanto, utilizamos estas concentraciones más una concentración intermedia (15mM) para explorar los efectos sobre el hígado y la función renal, y los cambios en la actividad locomotora espontánea.
El experimento incluyó un grupo vehículo (NaCl al 0,9%) y 3 grupos que recibieron ACH (10, 15 y 20mM). Las sustancias se administraron durante 28 días consecutivos, cada 24h, en un volumen de 0,3ml/rata de acuerdo con Machholz et al.15. La salud de las ratas se observó diariamente y sus pesos corporales registraron cada tercer día. Los animales se sometieron a las pruebas conductuales desde el día 0 (prueba basal) y cada 7 días, finalizando en el día 28 del experimento, donde se extrajo una muestra de sangre por punción transcardiaca donde se evaluaron los parámetros bioquímicos como química sanguínea y pruebas de funcionamiento hepático.
Pruebas conductualesActividad locomotrizLa rata fue evaluada durante 5min en una caja de acrílico opaco (44×33×20cm) con la base dividida en cuadros de 11×11cm. Se evaluaron: a) el número de cuadros cruzados, cuando la rata pasó al menos 3 cuartas partes de su cuerpo de un cuadro a otro, y b) el número de conducta vertical, definida como los períodos en los que la rata adquiere una postura vertical con respecto al piso, apoyada en sus extremidades posteriores. Los cuadros cruzados se tomaron como un indicador de actividad motora espontánea, mientras que la conducta vertical se utilizó para detectar posibles alteraciones en la coordinación motora16. Después de la prueba de actividad locomotriz, las ratas se sometieron posteriormente a ensayo de rotarod.
Prueba rotarodAntes de comenzar las administraciones de las sustancias, las ratas fueron entrenadas en un Rotarod (LE 8300, Letica LSI, Panlab Scientific Instruments, Barcelona, España) durante 5 días consecutivos a una velocidad de 18 rotaciones por minuto. Se registró la latencia de caída del rotarod (es decir, la latencia entre la colocación de la rata en el rotarod hasta que cayó del mismo) a 0, 7, 14, 21 y 28 días de tratamiento. Esta variable se utilizó para identificar los cambios en la coordinación motora y el equilibrio17. Después de la prueba de rotarod, las ratas fueron posteriormente evaluadas en la prueba de nado.
Prueba de nadoLas ratas se colocaron individualmente durante 5 min en un estanque de vidrio rectangular (26×29×50cm), que se llenó con agua (25±1C). El nivel del agua se ajustó de tal manera que la rata pudiera tocar el fondo del estanque con sus 2 extremidades posteriores y la cola. Al comienzo de la prueba, la rata se colocó en una esquina del estanque de vidrio. Las ratas nadaron vigorosamente en cuanto entraron en contacto con el agua. Ninguno de los animales se ahogó. Las variables evaluadas durante esta prueba fueron el número de nado lateral y la conducta de giro mostrada por la rata, que fueron evaluados como un indicador de incoordinación motora6. El nado lateral se define operacionalmente como un comportamiento en el que la rata nada lentamente sobre su costado sin mantener su equilibrio horizontal. Durante este comportamiento, la rata nada en su lado derecho o izquierdo, con su cabeza mantenida horizontalmente. Los miembros posteriores permanecen extendidos y rígidos, paralelos a la superficie del agua, durante cortos períodos. Los miembros posteriores se mueven sin coordinación para lograr el desplazamiento del agua. Uno o ambos miembros anteriores permanecen retraídos. Después del nado lateral, las ratas finalmente nadan «normalmente» por períodos cortos. La conducta de giro se define como períodos en los que la rata no se desplaza en el agua y nada girando alrededor su propio eje6,16.
Todas las sesiones de prueba en actividad locomotriz y nado fueron videograbadas. La cuantificación de las variables en campo abierto fue realizada por 2 observadores independientes hasta llegar a una concordancia de al menos el 95%. La cuantificación de la variable en la prueba de nado se realizó mediante un software (ANY-maze 4.73. Stoelting, Wood Dale, Illinois, EE. UU.), en el cual se analizaron automáticamente los vídeos.
Obtención de muestras sanguíneasUna vez concluidas las pruebas conductuales, se obtuvieron las muestras de sangre (día 28). Para este procedimiento, se utilizaron jeringas de 5ml, con un tamaño de aguja de 22mm. Los animales se sometieron a una anestesia profunda con pentobarbital sódico. Luego se colocaron en decúbito supino y se insertó la jeringa a través de la pared torácica lateral y el espacio intercostal en la región máxima del latido del corazón en un ángulo de 20 a 30°. La aguja se movió entonces lentamente, haciendo así una ligera presión negativa en el cilindro de la jeringa y succionando suavemente hasta que el flujo sanguíneo se detuvo. La sangre se depositó en tubos secos de la marca Vacutainer (sin anticoagulante) hasta el análisis bioquímico (BD Vacutainer Co. Ciudad de México 11000, México)18.
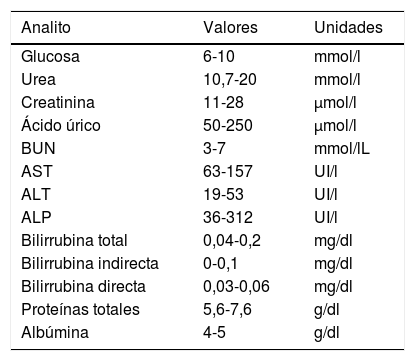
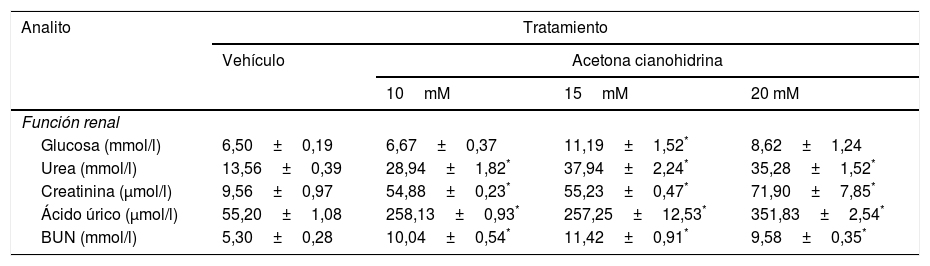
Evaluación de la función renal glucosa, urea, creatinina, ácido úrico, nitrógeno uréico) y funcionamiento hepático (transaminasa glutámico-oxalacética, transaminasa glutámico-piruvica, fosfatasa alcalina, bilirrubina, proteínas totales, albúmina)Una vez obtenidas las muestras sanguíneas, se transfirieron a tubos secos (sin anticoagulante) de la marca Vacutainer, dejando coagular la sangre, posteriormente se centrifugaron a 3.500 revoluciones por minuto durante 5min para obtener suero, el cual se transfirió inmediatamente con una pipeta Pasteur a los recipientes correspondientes para los exámenes indicados en química seca en el equipo Vitros 250 (Johnson & Johnson, Ramsey, MN, EE. UU.). Finalmente, se compararon los intervalos de referencia normales de las distintas pruebas para verificar posibles alteraciones de tipo renal o hepático de acuerdo con la tabla 1.
Parámetros evaluados y rangos normales de referencia para pruebas de función renal y hepática en ratas Wistar
| Analito | Valores | Unidades |
|---|---|---|
| Glucosa | 6-10 | mmol/l |
| Urea | 10,7-20 | mmol/l |
| Creatinina | 11-28 | μmol/l |
| Ácido úrico | 50-250 | μmol/l |
| BUN | 3-7 | mmol/lL |
| AST | 63-157 | UI/l |
| ALT | 19-53 | UI/l |
| ALP | 36-312 | UI/l |
| Bilirrubina total | 0,04-0,2 | mg/dl |
| Bilirrubina indirecta | 0-0,1 | mg/dl |
| Bilirrubina directa | 0,03-0,06 | mg/dl |
| Proteínas totales | 5,6-7,6 | g/dl |
| Albúmina | 4-5 | g/dl |
El análisis estadístico consistió en una ANOVA de 2 vías de muestras repetidas para la pruebas conductuales y la determinación de la función renal y hepática se analizaron mediante un ANOVA de una vía, cuya significación representativa (p ≤ 0,05) se aplicó como prueba post hoc, Student-Newman-Keuls, para la comparación entre medias. Todos los datos fueron representados como la media±el error estándar de cada variable evaluada. El análisis estadístico fue realizado utilizando el paquete estadístico Sigma Stat versión 3.5.
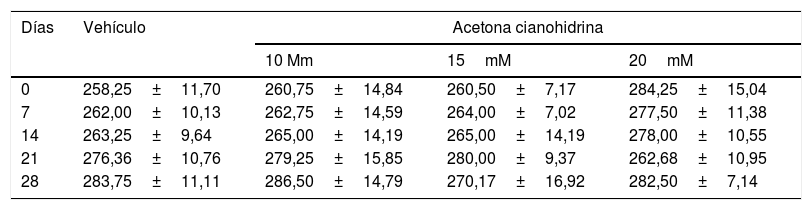
ResultadosPeso corporalLa tabla 2 muestra el peso corporal de ratas a lo largo del estudio. El análisis no reveló diferencias significativas según el tratamiento (F3,132=0,791, p=0,501, NS), días de tratamiento (F4,132=0,661; p=0,620, NS) o interacción de factores (F21,132=0,674; p=0,774, NS).
Peso corporal de las ratas incluidas en los estudios de acuerdo a los tratamientos
| Días | Vehículo | Acetona cianohidrina | ||
|---|---|---|---|---|
| 10 Mm | 15mM | 20mM | ||
| 0 | 258,25±11,70 | 260,75±14,84 | 260,50±7,17 | 284,25±15,04 |
| 7 | 262,00±10,13 | 262,75±14,59 | 264,00±7,02 | 277,50±11,38 |
| 14 | 263,25±9,64 | 265,00±14,19 | 265,00±14,19 | 278,00±10,55 |
| 21 | 276,36±10,76 | 279,25±15,85 | 280,00±9,37 | 262,68±10,95 |
| 28 | 283,75±11,11 | 286,50±14,79 | 270,17±16,92 | 282,50±7,14 |
Los valores se expresan como la media±error estándar. No se encontraron diferencias estadísticamente significativas de acuerdo con los factores ni en la interacción. ANOVA de 2 vías, post hoc Student Newman Keuls.
El análisis de cuadros cruzados no reveló diferencias significativas (F3,132=0,679; p=0,566, NS) entre los tratamientos, pero en los días de tratamiento sí se encontraron diferencias significativas (F4,148=7,400; p < 0,001). La prueba post hoc mostró que el número de cruces se redujo significativamente (p < 0,05) en los días 14 (42,06 ± 3,66), 21 (47,23 ± 6,5) y 28 (43,46 ± 5,78) de tratamiento, respecto al día 0 (77,72 ± 6,67) y al día 7 (62,41 ± 5,28) de tratamiento, mientras que la reducción de cruces en el día 7 solo fue significativa contra el día 0. La interacción de los factores no mostró diferencia significativa (F12,148=1,443; p=0,154, NS).
Conducta verticalEl análisis de la conducta vertical no reveló diferencias significativas (F3,148=0,203; p=0,894, NS) entre los tratamientos, pero sí en los días de tratamiento (F4,148=2,486; p < 0,046). La prueba post hoc mostró que el tiempo empleado en la conducta vertical fue menor al día 7 (208,68±9,54 s), en comparación con el día 0 (247,73±7,93 s) del tratamiento, y no hubo cambios significativos en los días 14 (213,37±14,17 s), 21 (235,95±10,11 s) y 28 (235,74±10,56 s) de tratamiento, en comparación con el día 0. Por otro lado, el análisis del tiempo empleado en la conducta vertical, según la interacción de los factores, no mostró diferencias significativas (F12,148=1,581, p=0,105 NS).
RotarodLa latencia a la caída en el rotarod no reveló diferencias significativas entre los tratamientos, los días de tratamiento ni la interacción de los factores (F128=0,678; p=0,567, NS; 148=0,750; p=0,701, NS), datos no mostrados.
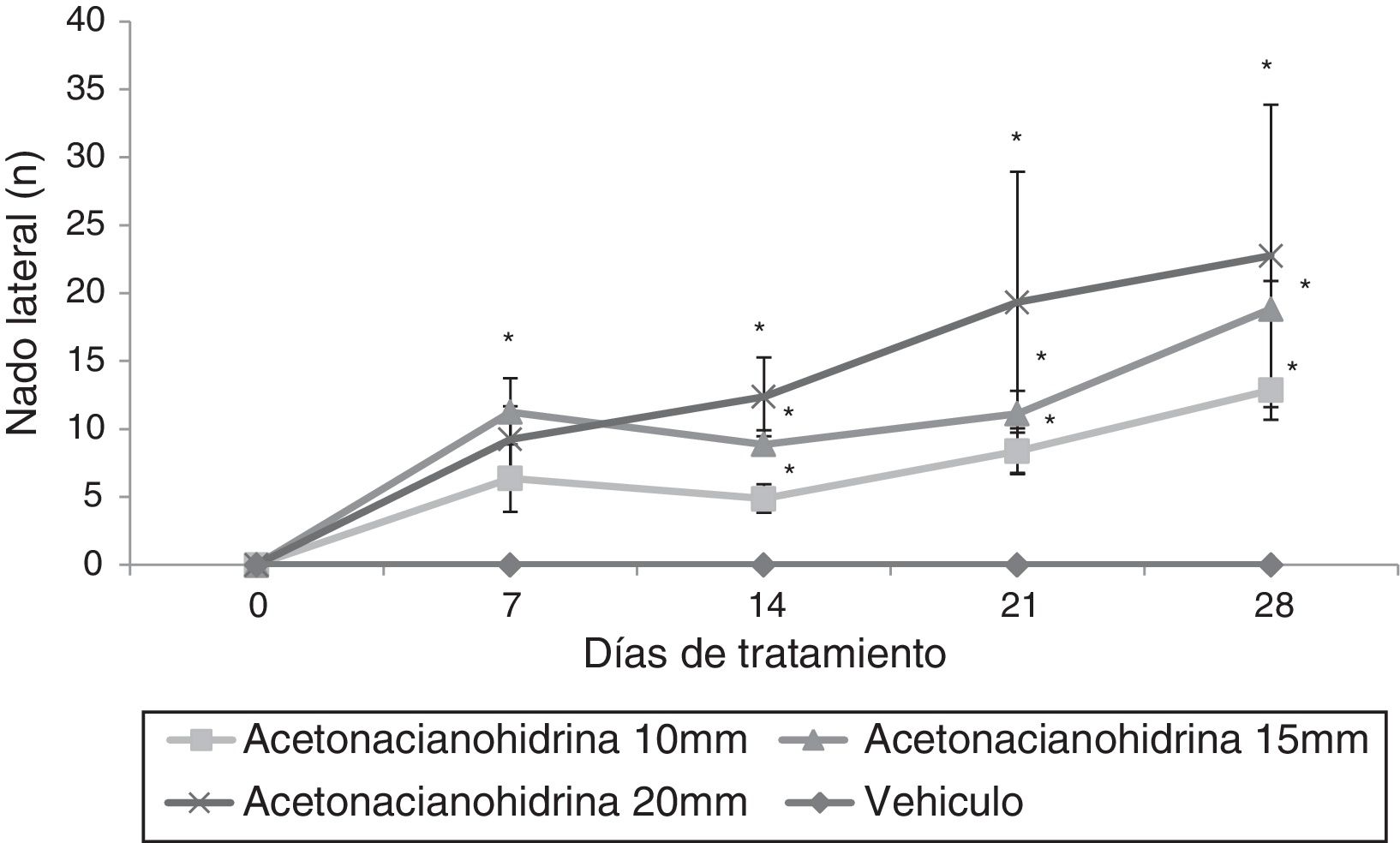
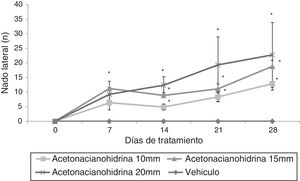
Prueba de nadoNado lateralEl análisis de esta variable reveló diferencias significativas (F3,148=9,592; p < 0,001) entre los tratamientos. Los 3 grupos tratados con ACH desplegaron este comportamiento, pero no el grupo vehículo. La prueba post hoc mostró que 15mM y 20mM aumentaron significativamente esta variable, con respecto al grupo tratado con 10mM. El análisis según los días de tratamiento reveló diferencias significativas (F4,148=5.654; p < 0,001). La prueba post hoc muestra que el número de nado lateral fue significativamente mayor (p < 0,05) en el día 7 (6,72±1,63), 14 (6,53±1,12), 21 (9,07±2,47) y 28 (11,80±2,94), en comparación con el día 0 de tratamiento, donde este comportamiento no fue detectado. La interacción de los factores no reveló ninguna diferencia significativa (F12,148=1,472, p=0,142, NS). Sin embargo, la prueba post hoc mostró que esta variable aumentaba significativamente a partir del día 7 en todos los grupos tratados con ACH respecto del grupo tratado con vehículo; Este efecto fue más evidente en el grupo de 20mM (fig. 1).
Número de nado lateral. Las ratas tratadas con diferentes concentraciones de acetona cianohidrina aumentaron esta variable con respecto al día 0 y la sesión respectiva del grupo vehículo.
* p < 0,05 vs. día 0 y sesión respectiva del grupo de vehículo. ANOVA de 2 vías, prueba post hoc de Student-Newman-Keuls.
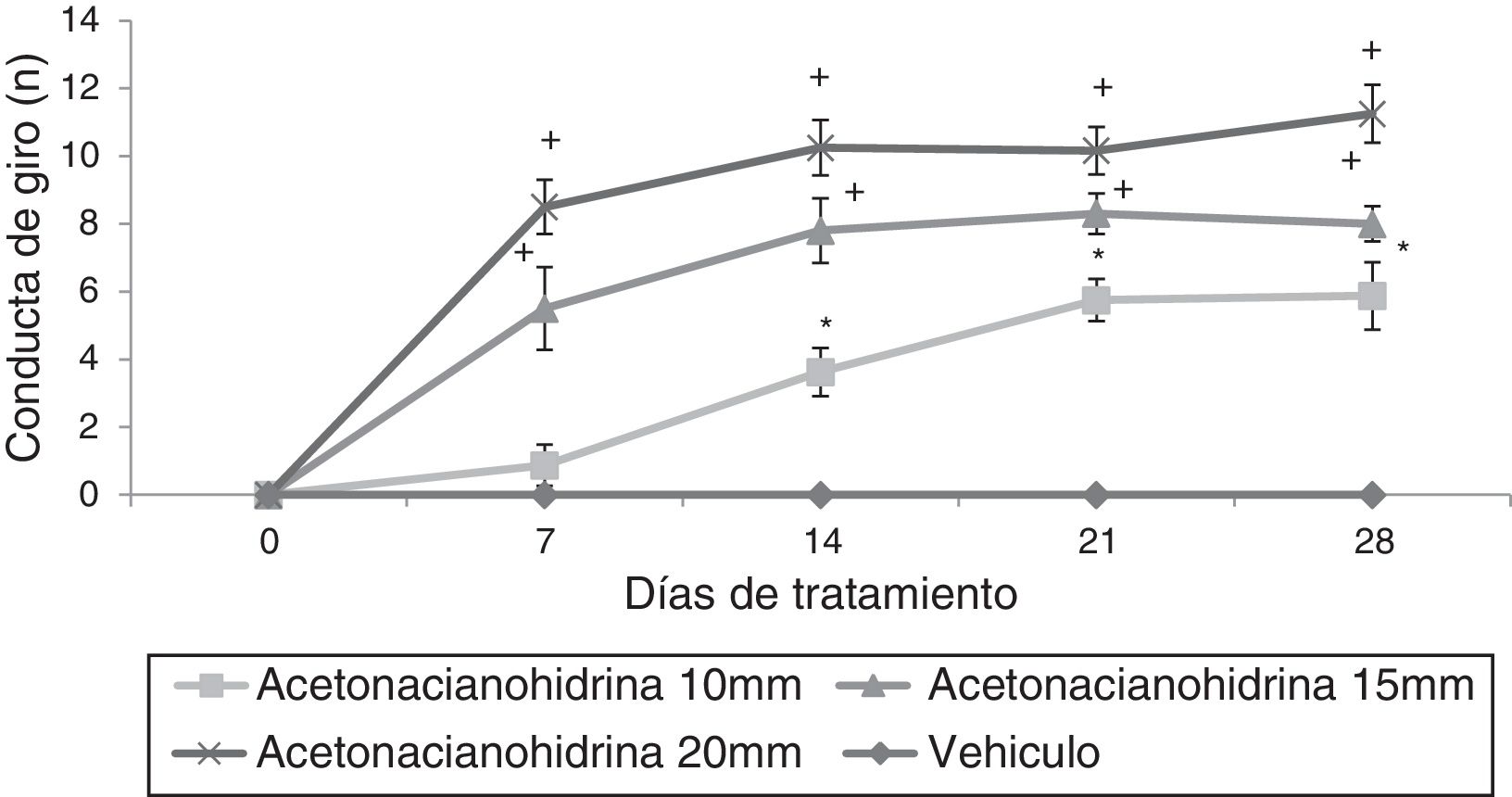
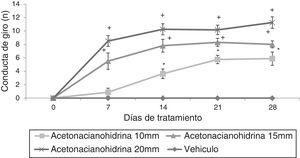
El análisis del número de giros reveló diferencias significativas (F3,148=36,943; p < 0,001) entre tratamientos, días de tratamiento (F4,148=4,569; p < 0,002) y la interacción de los factores (F12,148=12,263, p < 0,001). La prueba post hoc mostró que esta variable aumentó significativamente en todos los grupos de ACH, en el caso de ACH 10mM aumentó a partir del día 14, mientras que en ACH 15mM y 20mM aumentó a partir del día 7 del tratamiento, en todos los casos respecto al día 0 del tratamiento, y la respectiva sesión del grupo vehículo (fig. 2).
Número de conducto de giro. El grupo vehículo no mostró este comportamiento durante todo el experimento, pero las ratas tratadas con acetona cianohidrina mostraron este comportamiento dependiente de la concentración.
* p < 0,05 frente al día 0 y 7 del mismo grupo y la respectiva sesión del grupo de vehículos.
**p < 0,05 frente al día 0 del mismo grupo y la respectiva sesión de los grupos vehículo y 10mM. ANOVA de 2 vías, prueba post hoc de Student-Newman-Keuls.
Efectos de la ACH en la función renal y hepática se presentan en las tablas 3 y 4.
Efectos de la acetona cianohidrina en la función renal en ratas Wistar
| Analito | Tratamiento | |||
|---|---|---|---|---|
| Vehículo | Acetona cianohidrina | |||
| 10mM | 15mM | 20 mM | ||
| Función renal | ||||
| Glucosa (mmol/l) | 6,50±0,19 | 6,67±0,37 | 11,19±1,52* | 8,62±1,24 |
| Urea (mmol/l) | 13,56±0,39 | 28,94±1,82* | 37,94±2,24* | 35,28±1,52* |
| Creatinina (μmol/l) | 9,56±0,97 | 54,88±0,23* | 55,23±0,47* | 71,90±7,85* |
| Ácido úrico (μmol/l) | 55,20±1,08 | 258,13±0,93* | 257,25±12,53* | 351,83±2,54* |
| BUN (mmol/l) | 5,30±0,28 | 10,04±0,54* | 11,42±0,91* | 9,58±0,35* |
Los datos se expresan como media±error estándar.
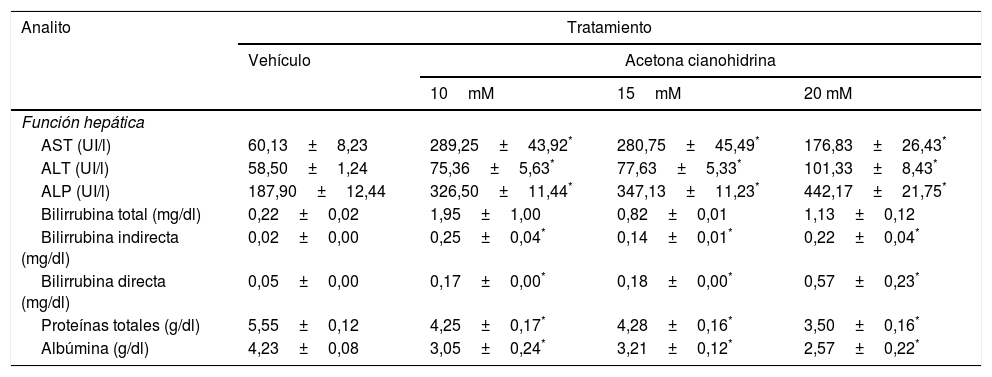
Efectos de la acetona cianohidrina en la función hepática en ratas Wistar
| Analito | Tratamiento | |||
|---|---|---|---|---|
| Vehículo | Acetona cianohidrina | |||
| 10mM | 15mM | 20 mM | ||
| Función hepática | ||||
| AST (UI/l) | 60,13±8,23 | 289,25±43,92* | 280,75±45,49* | 176,83±26,43* |
| ALT (UI/l) | 58,50±1,24 | 75,36±5,63* | 77,63±5,33* | 101,33±8,43* |
| ALP (UI/l) | 187,90±12,44 | 326,50±11,44* | 347,13±11,23* | 442,17±21,75* |
| Bilirrubina total (mg/dl) | 0,22±0,02 | 1,95±1,00 | 0,82±0,01 | 1,13±0,12 |
| Bilirrubina indirecta (mg/dl) | 0,02±0,00 | 0,25±0,04* | 0,14±0,01* | 0,22±0,04* |
| Bilirrubina directa (mg/dl) | 0,05±0,00 | 0,17±0,00* | 0,18±0,00* | 0,57±0,23* |
| Proteínas totales (g/dl) | 5,55±0,12 | 4,25±0,17* | 4,28±0,16* | 3,50±0,16* |
| Albúmina (g/dl) | 4,23±0,08 | 3,05±0,24* | 3,21±0,12* | 2,57±0,22* |
Los datos se expresan como media±error estándar.
El análisis de AST reveló diferencias significativas en el tratamiento (F3,26=9,59, p < 0,001). La prueba post hoc reveló que, después de 28 días, todas las concentraciones de ACH que se ensayaron incrementaron la AST en comparación con el grupo vehículo. También se encontraron diferencias significativas del tratamiento sobre ALT (F3,26=9,78, p < 0,001). El ensayo post hoc mostró que todas las concentraciones de ACH incrementaron ALT en comparación con el grupo vehículo. El análisis de la ALP también reveló diferencias significativas del tratamiento (F3,26=54,75, p < 0,001). La prueba post hoc mostró que todas las concentraciones de ACH incrementaron ALP en comparación con el grupo vehículo.
El análisis de las concentraciones de glucosa reveló diferencias significativas del tratamiento (F3,26=5,39, p < 0,005). Solo la concentración 15mM de ACH incrementó significativamente las concentraciones de glucosa en comparación con el grupo vehículo. El análisis también reveló diferencias significativas del tratamiento con urea (F3,26=44,286, p < 0,001), creatinina (F3,26=72,18, p < 0,001), ácido úrico (F3,26=327,86, p < 0,001) y BUN (F3,26=20,52, p < 0,001). El análisis post hoc de estos 4 parámetros reveló que las 3 concentraciones de ACH causaron incrementos de 3, 6, 7 y 2 veces (p < 0,05) en urea, creatinina, ácido úrico y BUN en comparación con el grupo de vehículo.
El análisis de proteínas totales (F3,26=29,54, p < 0,001) y albúmina (F3,26=15,73, p < 0,001) también reveló diferencias significativas en el tratamiento. La prueba post hoc mostró que las 3 concentraciones de ACH redujeron significativamente estos 2 parámetros en comparación con el grupo vehículo. El análisis de la bilirrubina indirecta (F3,26=11,759, p < 0,001) y directa (F3,26=5,1, p < 0,007) reveló efectos significativos en el tratamiento. La prueba post hoc indicó que las 3 concentraciones de ACH incrementaron ambos parámetros en comparación con el grupo vehículo.
El análisis de la bilirrubina total no indicó diferencias significativas en el tratamiento (F3,26=1,90, p=0,155), aunque se encontró una tendencia a un efecto mayor en las concentraciones de 10 y 20mM.
DiscusiónEl estudio de la toxicidad de una sustancia química debe no solo precisar los signos clínicos y biológicos de intoxicación, sino también su mecanismo de acción, es decir, descubrir la lesión inicial (efecto enzimático) responsable de alteraciones fisiológicas y anatómicas que puedan producir las conductas observadas en el transcurso de la intoxicación22. Los estudios de toxicidad en animales de experimentación se fundamentan en detectar comportamientos inusuales por el animal e identificarlos mucho antes de que se presenten daños a nivel neurológico, que probablemente sean de carácter irreversible23 como ocurre después de un consumo excesivo de yuca y que produce enfermedades neurológicas, como el konzo y la neuropatía atáxica tropical. En el presente estudio, la prueba de campo abierto permite identificar un estado de hipoactividad independientemente del tratamiento, lo que indica un efecto de habituación asociado con la repetición de la prueba, como se informó en estudios previos24, pero no con ningún efecto de tratamiento en la actividad locomotora espontánea.
La conducta vertical se considera un comportamiento exploratorio, sin embargo, algunos autores la utilizan para identificar algunas alteraciones en la actividad locomotora ya que la postura en este comportamiento requiere un cierto equilibrio25,26. En el presente estudio se encontró una disminución significativa de este comportamiento en los grupos de vehículo y ACH de 10mM, que podría estar relacionado con una menor exploración, mientras que los mayores episodios de conducta vertical en los grupos ACH de 15 y 20mM podría estar relacionada con una hiperactividad exploratoria asociada con acciones neurotóxicas de ACH27. Por lo tanto, es posible que los efectos tóxicos de la ACH en la prueba de campo abierto estén relacionados con el incremento de un comportamiento exploratorio particular (p. ej., conducta vertical) pero no con el desplazamiento en la rata (es decir, cuadros cruzados), que también está apoyado por ningún cambio en rotarod, en el que no se detectó incoordinación locomotora general.
En la prueba de nado se pudo detectar con mayor sensibilidad las alteraciones motoras asociadas con los tratamientos, esto se debe a que las funciones motrices involucradas en el nado requieren la integración de los músculos, los reflejos y las regiones específicas del cerebro para dar una respuesta adecuada. Las ratas tratadas con ACH de 10, 15 y 20mM presentaron nado lateral y conducta de giro; la primera se atribuye principalmente a la incoordinación motora y el desequilibrio, que se ha indicado que es causada por la desmielinización de las neuronas en la médula espinal, así como el daño al cerebelo28-30. Curiosamente, este mismo patrón locomotor anormal detectado en el nado se produce en ratas tratadas con jugo de yuca a largo plazo6. Por otra parte, la conducta de giro puede estar relacionada con la desmielinización de la médula espinal, lo que impide una comunicación adecuada entre las neuronas que producen la falta de coordinación de los miembros, por lo tanto, las ratas nadan anormalmente tratando de mantener el equilibrio, apareciendo la conducta de giro. Así mismo, este comportamiento se muestra por las ratas tratadas oralmente con el neurotóxico contenido en semillas de cícada, como el metilazoximetanol16. En resumen, los resultados actuales muestran que la ACH produce deterioro motor, lo que indica que esta sustancia tóxica también podría participar en el desarrollo de trastornos neurológicos asociados con el consumo de yuca como ocurren en el konzo y la neuropatía atáxica tropical.
Los estudios toxicológicos miden una amplia gama de parámetros bioquímicos para evaluar e identificar los cambios fisiológicos y metabólicos en la función de órganos o tejidos31. La evaluación de algunos parámetros bioquímicos comunes puede proporcionar información sobre posibles daños a un órgano particular (p. ej., la actividad de enzimas como AST y ALT puede ser un indicador de hepatotoxicidad y la urea y la creatinina son parámetros que pueden proporcionar información sobre la función glomerular)32. Los resultados actuales indican que la ACH ejerce efectos hepatotóxicos y nefrotóxicos cuando se administra a concentraciones de 10, 15 y 20mM durante 28 días en ratas, apoyando estudios previos que informaron que diferentes concentraciones de cianuro de potasio y extractos de yuca produjeron altas concentraciones de tiocianato en sangre en los modelos murinos, que se asoció con daño morfológico al hígado y el riñón11,33.
El hígado es susceptible a los daños por exposición directa a sustancias tóxicas debido a su participación en la desintoxicación de xenobióticos y productos metabólicos34. En el presente estudio, valores elevados de ALT, AST, ALP y bilirrubina directa e indirecta, y menor de proteína total y albúmina, se asociaron con la exposición ACH, lo que indica daño al hígado35-38. Los cambios hepáticos que se evaluaron en el presente estudio dependieron de la concentración a la exposición de ACH. Estudios anteriores evaluaron los efectos de diferentes concentraciones de jugo de yuca y cianuro en perros y cabras y mostraron que las concentraciones más altas se asociaron con mayor daño hepático, caracterizado por la vacuolización hepatocelular periportal39,40. Los niveles elevados de bilirrubina directa son indicativos de la menor capacidad funcional del tejido hepático, atribuida principalmente a un intento de metabolizar sustancias xenobióticas. Los resultados de la bilirrubina indirecta mostraron un deterioro de la captación y conjugación de la bilirrubina por el hígado que fue causada por la disfunción de la respuesta de los hepatocitos41,42. El aumento de los niveles de AST y ALT podría atribuirse a la hepatotoxicidad que causa la degeneración vacuolar y un hígado graso. Estos efectos también se encontraron en ratas macho Wistar tratadas durante 14 días con extractos acuosos y metanólicos de yuca11. Además, las disminuciones en las concentraciones de proteínas totales y albúmina pueden estar asociadas con daño significativo a hepatocitos o insuficiencia renal. Tales efectos también pueden ocurrir en conejos después de una exposición crónica al cianuro, detectada por análisis histológico del hígado, cuantificación de enzimas del metabolismo celular y evaluaciones de parámetros sanguíneos. Tales disminuciones en las proteínas totales se han asociado con probable insuficiencia renal, que impide la filtración adecuada de los residuos, con el consecuente aumento de la creatinina y la urea en sangre43.
Los riñones se consideran órganos excretores en el cuerpo. A través de la formación de orina, eliminan sustancias innecesarias o tóxicas (p. ej., urea en la desaminación de aminoácidos, bilirrubina del catabolismo de la hemoglobina, creatinina de la creatina de las fibras musculares, ácido úrico del catabolismo del ácido nucleico y otras sustancias metabolizadas, como drogas y toxinas ambientales)44. En el presente estudio, se detectaron altos niveles de BUN, urea, creatinina y ácido úrico, lo que indica que el daño renal fue causado por ACH. Los aumentos significativos en las concentraciones de estas sustancias en la sangre se asocian con daño funcional a los riñones. Esto puede ser atribuible a una reducción de la tasa de filtración glomerular y la disfunción tubular renal44. Un aumento significativo de la concentración de creatinina está estrechamente correlacionado con los cambios histopatológicos en el riñón, marcados por sangrado, congestión y otros cambios degenerativos.
Los presentes resultados demuestran que ACH (es decir, un metabolito de linamarina que está contenido en yuca) produce daño renal y hepático. Tales alteraciones pueden estar asociadas con la formación de cianuro a través de procesos metabólicos. El cianuro es un potente inhibidor de las cadenas de electrones y promueve el estrés oxidativo. Los presentes resultados contribuyen a nuestro conocimiento sobre los efectos tóxicos de los compuestos químicos que están contenidos en la yuca y sus derivados. Estudios futuros deberían explorar los mecanismos de estos efectos tóxicos, incluyendo distribución, absorción, metabolismo y eliminación, para desarrollar posibles formas de eliminar o evitar los efectos neurotóxicos producidos por los compuestos de yuca o sus derivados en los productos alimenticios que los contengan.
ConclusiónLa administración a largo plazo de ACH causa daños en el riñón y el hígado, que podrían estar asociados o influir a largo plazo en el deterioro locomotor descrito en ratas Wistar, lo que indica que este componente de la yuca puede ser potencialmente tóxico. Se deben realizar estudios toxicológicos adicionales para identificar las condiciones específicas en los que la yuca y sus derivados pueden ser perjudiciales para la salud o ser ingeridos con seguridad.
FinanciaciónEste estudio fue apoyado parcialmente con recursos financieros del Cuerpo Académico Biología, Química y Funcionalidad Molecular de Metabolitos Vegetales (UV-CA-368) de la Universidad Veracruzana.
Conflicto de interesesLos autores declaran que no hay conflicto de intereses con respecto a este trabajo de investigación.
Durante el desarrollo del presente trabajo C.J. Rosas-Jarquín recibió una beca para estudios de posgrado por parte del Consejo Nacional de Ciencia y Tecnología (CONACyT) con número de Registro 714879.