La epilepsia resistente al tratamiento médico afecta a una cuarta parte de los pacientes con epilepsia. Como consecuencia de las crisis estos pacientes presentan una peor calidad de vida, por lo que es fundamental su diagnóstico para establecer posibles alternativas terapéuticas e iniciar una valoración prequirúrgica.
DesarrolloBúsqueda de artículos en PubMed y recomendaciones de las Guías de Práctica Clínica (GPC) y Sociedades Científicas más relevantes, referentes a epilepsia refractaria y al tratamiento médico y quirúrgico. Se clasifican las evidencias y recomendaciones según los criterios pronósticos del Oxford Center for Evidence Based Medicine (2001) y de la European Federation of Neurological Societies (2004) para actuaciones terapéuticas.
ConclusionesLa identificación de los pacientes con epilepsia refractaria es importante para optimizar el tratamiento farmacológico. Se recomienda el empleo de una politerapia racional de fármacos antiepilépticos, buscando combinaciones que aumenten la eficacia y minimicen los efectos adversos. Cuando no se consigue el control adecuado de las crisis es necesario realizar una valoración prequirúrgica en un centro especializado, con el fin de resecar la zona epileptógena sin producir déficits al paciente en los casos en los que sea posible. En caso contrario se recurrirá a procedimientos de cirugía paliativa o sistemas de neuroestimulación (vagal, trigeminal o cerebral). Otras alternativas, como la dieta cetógena, también pueden considerarse en pacientes seleccionados.
Drug-resistant epilepsy affects 25% of all epileptic patients, and quality of life decreases in these patients due to their seizures. Early detection is crucial in order to establish potential treatment alternatives and determine if the patient is a surgical candidate.
DevelopmentPubMed search for articles, recommendations published by major medical societies, and clinical practice guidelines for drug-resistant epilepsy and its medical and surgical treatment options. Evidence and recommendations are classified according to the criteria of the Oxford Centre for Evidence-Based Medicine (2001) and the European Federation of Neurological Societies (2004) for therapeutic actions.
ConclusionsIdentifying patients with drug-resistant epilepsy is important for optimising drug therapy. Experts recommend rational polytherapy with antiepileptic drugs to find more effective combinations with fewer adverse effects. When adequate seizure control is not achieved, a presurgical evaluation in an epilepsy referral centre is recommended. These evaluations explore how to resect the epileptogenic zone without causing functional deficits in cases in which this is feasible. If resective surgery is not achievable, palliative surgery or neurostimulation systems (including vagus nerve, trigeminal nerve, or deep brain stimulation) may be an option. Other treatment alternatives such as ketogenic diet may also be considered in selected patients.
La identificación de los pacientes con epilepsia refractaria es fundamental para optimizar el tratamiento farmacológico, iniciar el proceso de evaluación para determinar si son buenos candidatos quirúrgicos y, según cada caso, propiciar la cirugía u otras alternativas no farmacológicas.
Los pasos metodológicos que se han seguido para la elaboración de este capítulo de la Guía Oficial de Práctica Clínica en Epilepsia están descritos en el primero de los artículos de esta Guía, publicados en Neurología. Así mismo, para la clasificación de los niveles de evidencia y grados de recomendación se han mantenido las directrices de la Federación Europea de Sociedades Neurológicas del 2004 para las actuaciones terapéuticas y la versión modificada de la Oxford Center for Evidence-Based Medicine (2001) para los estudios sobre pronóstico.
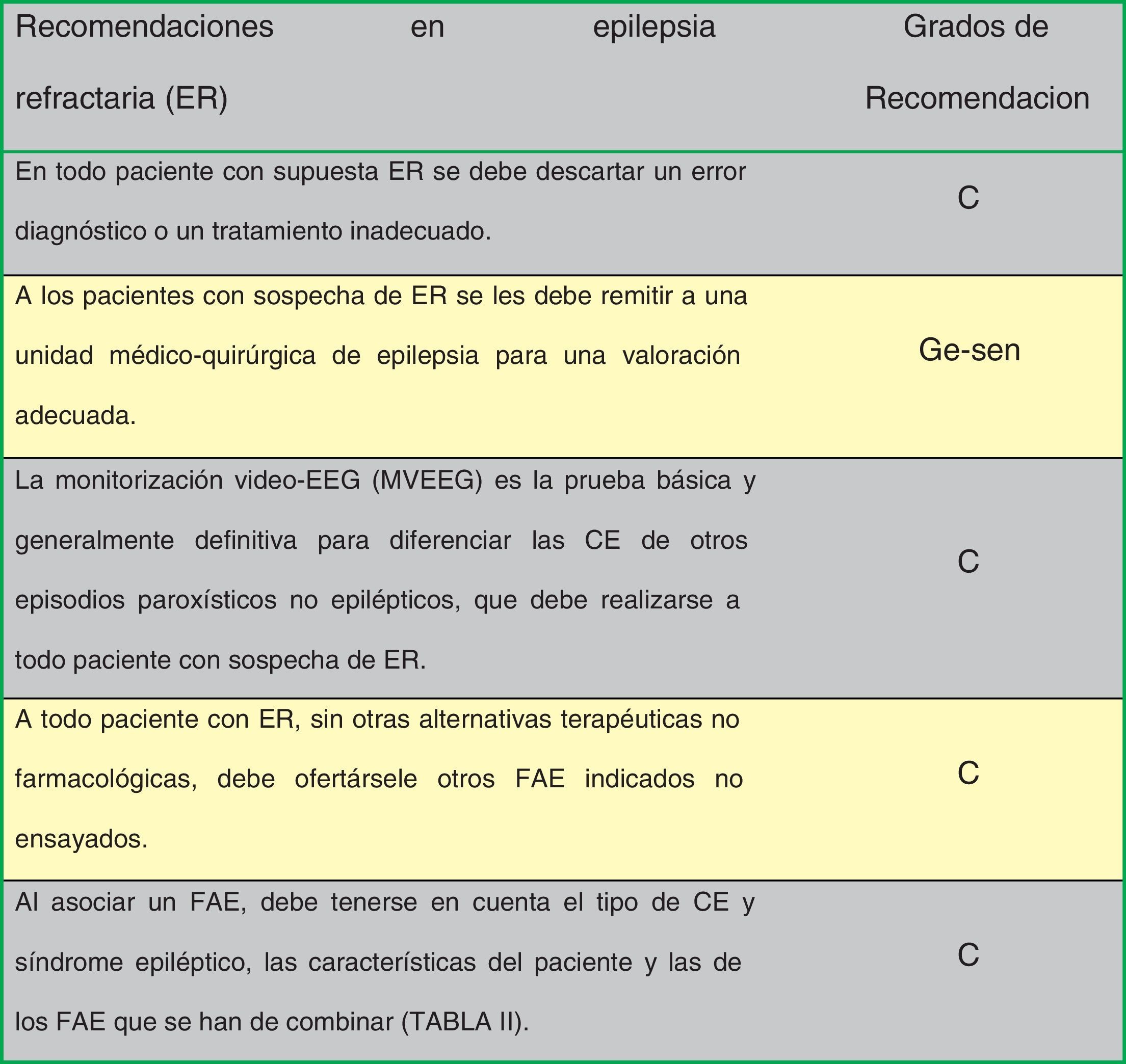
Epilepsia refractariaLa International League Against Epilepsy (ILAE) define la epilepsia refractaria como «aquella en la cual se ha producido el fracaso a 2 ensayos de fármacos antiepilépticos (FAE), en monoterapia o en combinación, tolerados, apropiadamente elegidos y empleados de forma adecuada, para conseguir la ausencia mantenida de crisis»1. Se considera ausencia mantenida de crisis un periodo de un año o, en caso de crisis muy esporádicas, un periodo de al menos el triple al mayor intervalo intercrisis pretratamiento, escogiéndose el que sea mayor de ellos. La epilepsia refractaria afecta aproximadamente a una cuarta parte de los pacientes con epilepsia2. Como consecuencia del mal control de las crisis estos pacientes tienen aumentado el riesgo de muerte prematura, traumatismos y/o alteraciones psicosociales, así como una calidad de vida reducida. Aunque la epilepsia refractaria pudiera remitir temporalmente (4% al año en adultos, con un porcentaje mayor en los niños), la reaparición de las crisis epilépticas (CE) es frecuente. Por tanto, la identificación de pacientes con epilepsia refractaria es fundamental para facilitar el inicio de la evaluación prequirúrgica y establecer posibles alternativas terapéuticas en unidades o centros especializados.
Factores pronósticos para el desarrollo de una epilepsia refractariaExisten una serie de factores de riesgo asociados a un mal pronóstico de la epilepsia que varían ligeramente según la edad:
- •
En niños (estudio prospectivo)3: edad menor de un año, epilepsia sintomática, retraso mental o global del desarrollo, neuroimagen patológica o una frecuencia alta de crisis previa al diagnóstico de epilepsia refractaria (nivel de evidencia [NE] II).
- •
En niños (estudio prospectivo)4: crisis semanales durante el primer año de tratamiento, crisis semanales previamente al inicio del tratamiento o epilepsia sintomática remota (NE I).
- •
En adolescentes5: epilepsia focal, retraso mental o alteraciones psiquiátricas (NE II).
- •
En adultos (prospectivo)6: epilepsia focal sintomática, crisis con afectación de la consciencia precoz, múltiples tipos de crisis, crisis tónico-acinéticas o anomalías en el electroencefalograma (EEG) (NE IV).
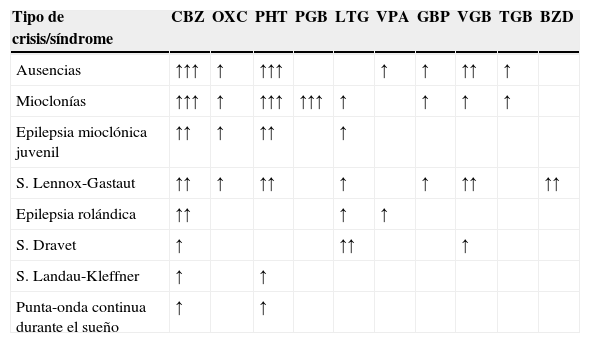
La evaluación de pacientes con epilepsia refractaria en un centro especializado permitirá excluir causas de pseudofarmacorresistencia (hasta el 25% de los pacientes remitidos a un centro especializado no tienen epilepsia y los diagnósticos más habituales en estos casos son síncopes, pseudocrisis o trastornos del sueño)7. La realización de la monitorización vídeo-electroencefalográfica resulta fundamental en la caracterización de los episodios. Es necesario optimizar el tratamiento médico, ya que existen FAE eficaces para determinados tipos de CE que pueden agravar otros (tabla 1). Hay que asesorar al paciente sobre factores que puedan dificultar el control de las CE, como el incumplimiento terapéutico, la privación de sueño, enfermedades intercurrentes, alcohol, cambios hormonales o interacciones farmacológicas)8,9.
Fármacos antiepilépticos que inducen un aumento de la frecuencia de crisis o agravan un determinado tipo de epilepsia
| Tipo de crisis/síndrome | CBZ | OXC | PHT | PGB | LTG | VPA | GBP | VGB | TGB | BZD |
|---|---|---|---|---|---|---|---|---|---|---|
| Ausencias | ↑↑↑ | ↑ | ↑↑↑ | ↑ | ↑ | ↑↑ | ↑ | |||
| Mioclonías | ↑↑↑ | ↑ | ↑↑↑ | ↑↑↑ | ↑ | ↑ | ↑ | ↑ | ||
| Epilepsia mioclónica juvenil | ↑↑ | ↑ | ↑↑ | ↑ | ||||||
| S. Lennox-Gastaut | ↑↑ | ↑ | ↑↑ | ↑ | ↑ | ↑↑ | ↑↑ | |||
| Epilepsia rolándica | ↑↑ | ↑ | ↑ | |||||||
| S. Dravet | ↑ | ↑↑ | ↑ | |||||||
| S. Landau-Kleffner | ↑ | ↑ | ||||||||
| Punta-onda continua durante el sueño | ↑ | ↑ |
BZD: benzodiacepinas; CBZ: carbamazepina; GBP: gabapentina; LTG: lamotrigina; OXC: oxcarbazepina; PGB: pregabalina; PHT: fenitoína; TGB: tiagabina; VGB: vigabatrina; VPA: ácido valproico.
No se dispone de información suficiente de los últimos FAE: lacosamida (LCM), eslicarbacepina (ESL), retigabina (RTG), perampanel (PER).
Potencial para el agravamiento: ↑limitado; ↑↑moderado;↑↑↑ significativo.
Se recomienda en los pacientes con epilepsia refractaria una politerapia racional buscando las combinaciones de FAE que aumenten la eficacia (efecto supraditivo) y minimicen los efectos adversos (efecto infraditivo)10 (tabla 2):
- •
Combinar FAE con diferentes mecanismos de acción y con un espectro de acción complementario para tratar de cubrir todos los tipos de CE del paciente11-15.
- •
Evitar FAE con un perfil de toxicidad superponible y ajustar dosis según las características del paciente (edad, género, condición física y comorbilidad).
- •
Considerar que emplear más de 2 FAE suele asociar más efectos adversos que una mejoría real en el control de CE (sobre todo en ancianos o en pacientes polimedicados).
- •
Individualizar el tratamiento al tipo de CE, de epilepsia y hasta del síndrome epiléptico en función de la etiología o incluso el gen (evitar FAE que bloqueen los canales de sodio en pacientes con mutaciones en el canal de sodio SCN1A en el síndrome de Dravet).
Asociaciones de fármacos antiepilépticos (FAE)
| Tipo de epilepsia | |
|---|---|
| Asociaciones de FAE potencialmentes útiles | |
| VPA+ESM | Ausencias infantiles |
| VPA+LTG | Epilepsia con ausenciasEpilepsia mioclónica juvenilEpilepsia focal |
| LCM + FAE no bloqueantes canales Na | Epilepsia focal |
| CBZ/OXC/ESL + VPA | Epilepsia focalEpilepsia focal 2a g |
| CBZ/OXC/PHT/ESL+GBP/LEV/PGB/LCM/ZNS | Epilepsia focal |
| LTG/VPA + GBP/LEV/PGB/TPM/ZNS/LCM | Epilepsia focalSíndrome de Lennox-Gastaut |
| CBZ/PHT+TGB/TPM | Epilepsia focal |
| Asociaciones de FAE que se deben vigilar | |
| PB/PRM + CBZ/PHT/VPA | Epilepsia focalEpilepsia focal 2a g |
| CBZ/OXC/PHT + LTG | Epilepsia focal |
| PHT + VPA | Epilepsia focal |
| CBZ/PHT + TGB/TPM | Epilepsia focal |
| Asociaciones de FAE no recomendables | |
| PB/PRM + CZP/CLB | Epilepsia focalEpilepsia focal 2a g |
| PB/PRM + LTG/TGB/TPM | Epilepsia focal |
| CBZ + PHT | Epilepsia focalEpilepsia focal 2a g |
| OXC + ESL | Epilepsia focal 2a g |
CLB: clobazam; CZP: clonazepam; ESM: etosuximida; LEV: levetiracetam; PB: fenobarbital; PRM: primidona; TPM: topiramato; ZNS: zonisamida.
La mayoría de autores aconsejan probar todos los nuevos FAE que se vayan comercializando siempre que no obtengamos el control de la epilepsia refractaria y que estén indicados para el tipo de CE o de epilepsia del paciente16. Una revisión sistematizada y un metaanálisis sobre la eficacia de todos los nuevos FAE en terapia añadida en epilepsia refractaria determinan el control absoluto de las CE en un 6% y una reducción de la frecuencia crítica en un 21% de los pacientes17(NE I). Estudios poblacionales de pacientes con epilepsia refractaria han alcanzado remisiones prolongadas con sucesivos cambios de medicación (8-28%)18,19(NE III).
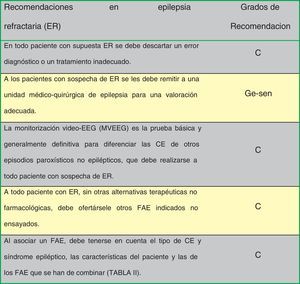
En la figura 1 se indican las recomendaciones de consenso entre los autores de la Guía en epilepsia refractaria.
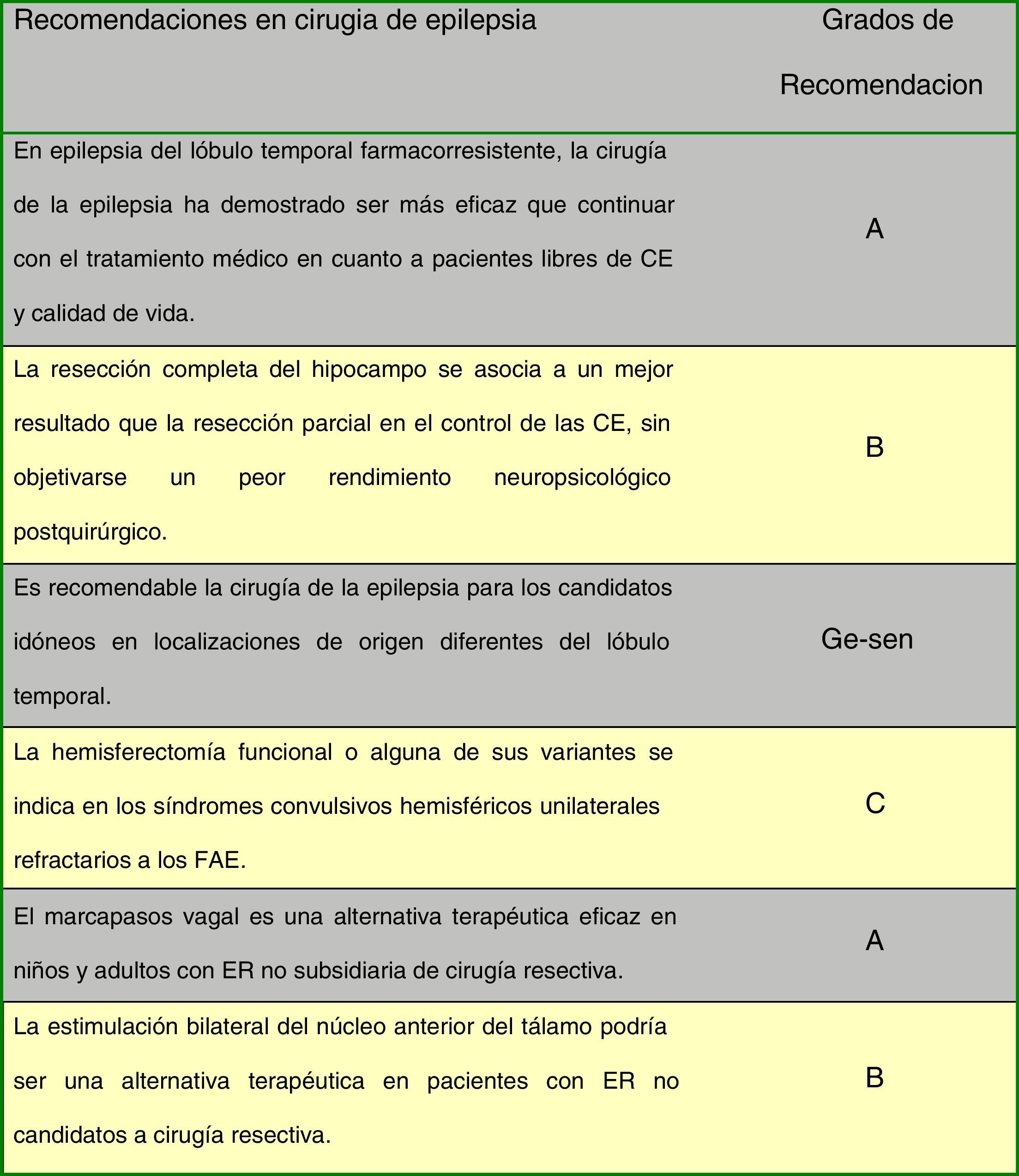
Cirugía de la epilepsiaEs la cirugía que tiene como objetivo la eliminación o disminución de las CE mediante la resección de la zona epileptógena sin producir déficits al paciente (cirugía resectiva). Alrededor del 5% de los pacientes podrían beneficiarse del tratamiento quirúrgico20. En el caso de que este no sea posible se recurrirá a procedimientos de desconexión o a sistemas de estimulación vagal o cerebral21,22.
Las indicaciones para cirugía incluyen:
- 1.
Pacientes con epilepsia refractaria con crisis que interfieran en la vida diaria. En el caso de niños se valorará especialmente la existencia de efectos secundarios de los FAE23.
- 2.
El tiempo de evolución de la epilepsia será de al menos 2años, salvo en el caso de crisis que puedan amenazar la vida o en niños.
- 3.
Epilepsias tratables quirúrgicamente: «síndromes remediables quirúrgicamente» (mal control con fármacos y buenos resultados con cirugía), o cuando la cirugía puede mejorar la epilepsia con secuelas aceptables considerando la situación basal y la gravedad de las crisis24.
Como contraindicaciones absolutas o relativas:
- •
Edad: no constituye una contraindicación absoluta. Hay que valorar la relación beneficio/riesgo en pacientes de edad avanzada.
- •
Causa de la epilepsia: se excluyen de cirugía si la etiología es una enfermedad neurológica progresiva, excepto en el caso de la encefalitis de Rasmussen.
- •
Enfermedades médicas concomitantes: no si comprometen el pronóstico vital o funcional.
- •
Enfermedades psiquiátricas concomitantes: contraindican la cirugía si pueden comprometer el resultado quirúrgico o el seguimiento posterior.
- •
CI inferior a 70: constituye un factor de peor pronóstico pero no una contraindicación.
La cirugía de la epilepsia actual requiere de un equipo multidisciplinario de especialistas con una formación específica en la materia, de su colaboración en una misma unidad, y de los medios tecnológicos necesarios25. Este equipo estará constituido por epileptólogos, neurólogos y/o neuropediatras, neurocirujanos, especialistas en neuroimagen estructural y funcional, neuropsicólogos, psiquiatras y personal de enfermería con formación específica en epilepsia o técnicos en EEG. La evaluación prequirúrgica de los pacientes comprenderá estudios encaminados a identificar la localización y la extensión del zona epileptógena y a valorar el posible impacto de la cirugía sobre las funciones neurológicas, cognitivas y estado emocional del paciente26. Inicialmente se realizarán una serie de estudios complementarios asociados a la evaluación clínica que incluyen vídeo-EEG, RM cerebral con protocolo de epilepsia, estudios neuropsicológicos y evaluación psiquiátrica. En determinados casos serán necesarios otros más específicos, como la RM funcional, el test de Wada, el SPECT ictal, técnicas de SISCOM, PET, magnetoencefalografía, electrocorticografía o electrodos semiinvasivos o invasivos27. Estos estudios estarán encaminados a identificar la localización y extensión de la zona epileptógena y a valorar el posible impacto de la cirugía sobre las funciones neurológicas, cognitivas y estado emocional del paciente. Es aconsejable que la decisión final del tratamiento quirúrgico se tome en una sesión multidisciplinar con todos los miembros del equipo.
Epilepsias tratables mediante cirugíaEpilepsias tratables mediante técnicas resectivas- •
Epilepsia del lóbulo temporal medial secundaria a esclerosis del hipocampo. Se suele realizar una amigdalohipocampectomía acompañada de una lobectomía temporal anterior, y con ella 2/3 de los pacientes quedan habitualmente libres de CE. La cirugía y el tratamiento posterior con FAE ofrecen mejores resultados de control de crisis que el tratamiento médico28,29 (NE I). Se ha observado en un ensayo clínico aleatorizado que la resección completa del hipocampo podría asociarse a una mejor respuesta en el control de CE sin objetivarse un peor rendimiento neuropsicológico posquirúrgico30(NE II). La resección o no del girus temporal superior no supone una diferencia en el resultado de la cirugía ni en la nominación31(NE II). Generalmente los pacientes con esclerosis del hipocampo son remitidos tarde para valoración quirúrgica, a pesar de que la cirugía precoz es más eficaz que los FAE comparado con el tratamiento médico32,33(NE II).
- •
Epilepsias neocorticales con lesión única circunscrita. La intervención indicada es la lesionectomía. La zona epileptógena se sitúa en la proximidad inmediata a la lesión estructural y la RM suele ser suficiente para guiar la cirugía. A veces son necesarios estudios invasivos para definir los límites de la zona epileptógena. Los resultados de libertad de crisis en series lesionales temporales son similares a los de la epilepsia temporal medial por esclerosis del hipocampo y ligeramente inferiores en las lesionectomías extratemporales34. Recientemente la ILAE ha establecido nuevas recomendaciones de cirugía en el caso de CE secundarias a cavernomas35.
- •
Síndromes de epilepsia hemisféricos. Destacan la hemimegalencefalia, el síndrome de Sturge-Weber, el síndrome de Rasmussen y otras epilepsias catastróficas unilaterales. La técnica quirúrgica empleada es la hemisferectomía funcional o hemisferotomía. Hasta un 60-80% de los pacientes quedan sin CE36(NE III). Se realizan en pacientes con hemiparesia preexistente y sin función útil de la mano contralateral al hemisferio afectado.
- •
Otros síndromes tratables quirúrgicamente con peores resultados: epilepsias neocorticales sin lesión única circunscrita. La cirugía consiste en la resección de la zona neocortical identificada como el área de inicio de las CE. Incluye a pacientes con patología dual, lesiones mal circunscritas e incluso pacientes sin lesión en las pruebas de neuroimagen. En la epilepsia no lesional la cirugía se basa en el resultado de las pruebas funcionales (EEG, SPECT y PET) como guía para colocar los electrodos intracraneales. Si la epilepsia es temporal, los pacientes libres de CE pueden alcanzar el 60%, reduciéndose al 35% si el origen es extratemporal37-39(NE IV).
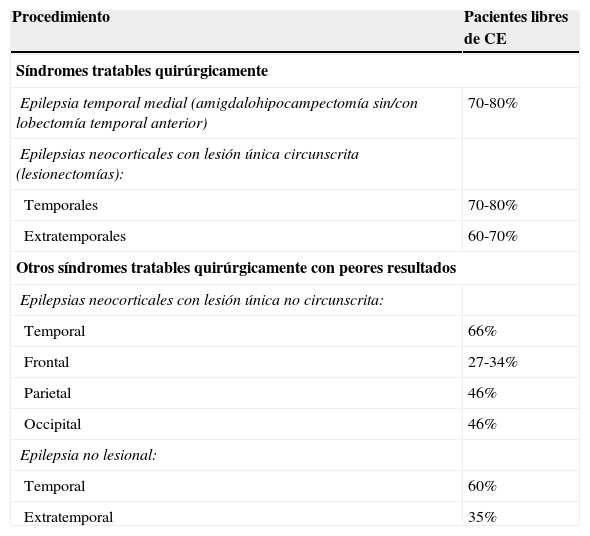
En la tabla 3 se recogen los datos de pronóstico de los distintos procedimientos quirúrgicos.
Resultados de la cirugía de la epilepsia. Pacientes libres de crisis
| Procedimiento | Pacientes libres de CE |
|---|---|
| Síndromes tratables quirúrgicamente | |
| Epilepsia temporal medial (amigdalohipocampectomía sin/con lobectomía temporal anterior) | 70-80% |
| Epilepsias neocorticales con lesión única circunscrita (lesionectomías): | |
| Temporales | 70-80% |
| Extratemporales | 60-70% |
| Otros síndromes tratables quirúrgicamente con peores resultados | |
| Epilepsias neocorticales con lesión única no circunscrita: | |
| Temporal | 66% |
| Frontal | 27-34% |
| Parietal | 46% |
| Occipital | 46% |
| Epilepsia no lesional: | |
| Temporal | 60% |
| Extratemporal | 35% |
Incluye procedimientos encaminados a buscar una reducción de las CE que conlleve una mejoría en la calidad de vida de los pacientes.
- •
Resecciones subpiales múltiples. Hoy en día únicamente se reserva para áreas elocuentes en entidades como el síndrome de Landau-Kleffner. Hasta el 55% de pacientes permanecen libres de CE, con un 4% de déficits permanentes26.
- •
Callosotomía. Sección parcial o total del cuerpo calloso. Se emplea sobre todo para las crisis atónicas, con una mejoría hasta en el 70% de los pacientes intervenidos40.
- •
Radiocirugía gamma. Consiste en la destrucción diferida de un pequeño volumen de tejido cerebral, aplicando una dosis alta de radiación (partículas gamma emitidas por cobalto radiactivo), de forma estereotáctica, en una única sesión, con una irradiación mínima en la zona circundante. Se utiliza en casos seleccionados de epilepsia temporal medial, hamartomas hipotalámicos y cavernomas, entre otros.
- •
Estimulación cerebral profunda. Se basa en el posible papel regulador de las estructuras subcorticales en la génesis y transmisión de las CE. Se han empleado dianas como el cerebelo, núcleos talámicos y subtalámicos, caudado, núcleo hipotalámico y sustancia negra. El estudio SANTE, con estimulación bilateral del núcleo anterior del tálamo, muestra tras un seguimiento de 2 años una disminución de la frecuencia de CE del 56% y una reducción del 50% en el 54% de los pacientes41(NE II).
- •
Estimulación del nervio vago. Consiste en la estimulación periódica del nervio vago mediante la colocación de unos electrodos bipolares helicoidales alrededor del nervio en su porción cervical que se conectan a través de un cable con un generador localizado en la pared torácica. Consigue reducir la frecuencia de las CE en pacientes con epilepsia refractaria no candidatos a cirugía resectiva42-44. Un metaanálisis reciente donde se revisan todos los estudios publicados en la literatura con niveles de evidenciai, ii y iii, que incluye a 3.321 pacientes, encuentran una media de reducción de CE del 44,6% tras un seguimiento medio de 10meses. La mejoría en la frecuencia de crisis fue significativa a partir del primer año tras la cirugía (51% si>1 año, p<0,001). El 50,6% de los pacientes tuvieron una reducción de CE>50% (clasesi-iii de Engel), con un 4,6% de los pacientes libres de CE45(NE I). En el grupo de niños menores de 6años la reducción de CE es mayor (62,0%). En 93 pacientes con síndrome de Lennox-Gastaut la reducción de CE fue del 47,8%45. Su eficacia y su tolerabilidad también se han descrito en pacientes con otras encefalopatías epilépticas, como el síndrome de Dravet, y con síndrome mioclónico-astático46(NE IV). Su uso se ha ampliado más allá de su indicación inicial en epilepsias focales y también se ha utilizado en epilepsias generalizadas idiopáticas, pacientes con estados epilépticos de repetición y en ancianos47-49(NE IV).
- •
Estimulación del nervio trigémino. Se ha aprobado recientemente en la Unión Europea como terapia asociada en epilepsia refractaria en adultos y niños mayores de 9años. En el ECR, el 40,5% de los pacientes son respondedores tras un seguimiento de 18semanas50.
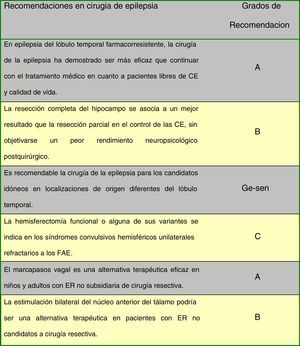
En la figura 2 se indican las recomendaciones de consenso entre los autores de la Guía en cirugía de epilepsia.
Otros procedimientos no quirúrgicosDieta cetógenaSe basa en sustituir los hidratos de carbono de la dieta por lípidos. El metabolismo de los ácidos grasos genera cuerpos cetónicos (CC) (beta-hidroxibutirato, acetoacetato y acetona en menor medida), que serán la fuente de energía para el cerebro. La dieta cetógena favorece la síntesis de glutamina (precursora del ácido gamma-aminobutírico, un neurotransmisor inhibidor) que, al ser estructuralmente similar al GABA, tendría una acción directa antiepiléptica. Existe un efecto beneficioso en niños51,52. Es el tratamiento de elección en el déficit del complejo piruvato-deshidrogenasa y en el déficit de trasportador de glucosa (GLUT-1). Debe introducirse precozmente para permitir que el cerebro utilice los CC como fuente energética53(NE III). En el síndrome de Lennox-Gastaut sería especialmente eficaz para reducir las crisis mioclónicas y las atónicas, con hasta un 16% de pacientes libres de CE54(NE III). En adultos los datos existentes indican que su eficacia puede ser similar a la de los pacientes pediátricos.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.