Evaluar la seguridad y tolerancia de las inmunoglobulinas por vía intravenosa (IgIV) para el tratamiento de la neuromielitis óptica (NMO).
MétodosOcho pacientes que cumplían los criterios diagnósticos revisados de Wingerchuk fueron tratados con IgIV cada 2 meses (0,7 g por kg de peso y día durante 3 días). Las medidas de resultado principales fueron los eventos adversos graves, definidos de acuerdo con las directrices NIH para los ensayos clínicos. Las medidas de resultado secundarias fueron los cambios en la tasa anualizada de brotes y la discapacidad neurológica medida con la Expanded Disability Status Scale (EDSS).
ResultadosOcho pacientes fueron tratados: 5 con episodios recidivantes de neuritis óptica y/o mielitis y 3 pacientes con mielitis transversa longitudinal extensa recurrente. La edad media de inicio fue de 20,5 años (rango 7-31), el 87,5% mujeres. El tiempo medio de duración de la enfermedad al inicio del tratamiento fue de 9,0 años (rango 3-17). Tras 83 infusiones (rango 4-21) y una media de seguimiento de 19,3 meses (rango 6-39), hubo eventos adversos menores (dolor de cabeza en 3 pacientes y erupción cutánea leve en un paciente). La tasa de recaídas se redujo de 1,8 en el año anterior a 0,006 en el seguimiento (z=–2,5, p=0,01). La EDSS se redujo de 3,3±1,3 a 2,6±1,5 (z=–2,0, p=0,04).
ConclusionesEl tratamiento con IgIV es seguro y bien tolerado y podría ser una alternativa de tratamiento para los trastornos del espectro de la NMO.
Evaluate safety and tolerance levels for intravenous immunoglobulins (IVIG) as treatment for neuromyelitis optica (NMO).
MethodsEight patients meeting Wingerchuk's revised diagnostic criteria were treated with IVIG every 2 months (0.7 g per kg body weight per day for 3 days). The primary outcome measure was the occurrence of serious adverse effects, defined according to NIH guidelines for clinical trials. Secondary outcome measures were changes in the yearly rate of attacks and in the degree of neurological disability measured with the Expanded Disability Status Scale (EDSS).
ResultsAll 8 patients were treated; 5 had relapsing optic neuritis with or without myelitis and 3 had recurrent longitudinally extensive transverse myelitis. The mean age of onset was 20.5 years (range, 7-31 years) and 87,5% were female. The mean duration of the disease before beginning treatment was 9.0 years (range, 3-17 years). Following 83 infusions (range, 4-21 per patient) and a mean follow-up time of 19.3 months (range, 6-39 months), minor adverse events had occurred (headache in 3 patients and a mild cutaneous eruption in a single patient). The relapse rate decreased from 1.8 in the previous year to 0.006 during follow-up (z=2,5, P=.01). The EDSS score fell from 3.3±1.3 to 2.6±1.5 (z=−2.0, P=.04).
ConclusionsTreatment with IVIG is safe and well-tolerated, and it may be used as a treatment alternative for NMO spectrum disorders.
La neuromielitis óptica (NMO, enfermedad de Devic) es una enfermedad idiopática inflamatoria desmielinizante, del sistema nervioso central, que se caracteriza por brotes de neuritis óptica y mielitis1. En su origen se pensó que patogénicamente estaba relacionada con la esclerosis múltiple, pero los estudios de la última década, evidencian cada vez más el papel de la alteración de la inmunidad humoral que subyace en la patogénesis de la NMO. La detección de depósitos de IgG e IgM colocalizados con productos de la cascada de activación del complemento, depositados alrededor de los vasos, inicialmente sugirieron que el agente patógeno desencadenante de la respuesta inmunológica humoral era un antígeno localizado en el espacio perivascular2,3.
Posteriormente, la identificación en suero de un anticuerpo específico IgG (NMO-IgG), que se dirige al canal de agua acuaporina-4, se propuso como un marcador altamente específico de la NMO4,5. La disminución de la acuaporina-4 en los sitios de lesión6 y la demostración in vitro de los roles funcionales de NMO-IgG7,8 han proporcionado evidencia adicional del papel fisiopatológico de estos anticuerpos. El tratamiento con inmunoglobulinas por vía intravenosa (IgIV) se utiliza comúnmente para los trastornos neurológicos disinmunidad9. Las IgIV tienen varios mecanismos de acción propuestos, tales como bloqueo de los receptores Fc10; la activación de componentes del complemento en la fase líquida de la superficie celular11; la inducción de producción de autoanticuerpos antiidiotipo con efecto de bloqueo12; el aumento del catabolismo de las IgG patógenas; la reducción de la expresión y diferenciación de los linfocitos B a nivel de la médula ósea, y la modulación de la producción de citocinas, lo que explica sus múltiples puntos de actuación en el complejo proceso de la respuesta inmunitaria humoral9. Además, las IgIV reducen la proliferación de células T y varias citocinas proinflamatorias, como la interleucina 1, el factor de necrosis tumoral alfa y el interferón gamma. En reportes anteriores de casos clínicos se ha mostrado un posible efecto beneficioso de las IgIV en la NMO, en la prevención de nuevas recaídas13,14. Por tanto, con la hipótesis de que las IgIV podrían ser un tratamiento seguro y efectivo para este trastorno, hemos diseñado este estudio abierto, observacional, prospectivo y no controlado. Presentamos nuestra experiencia con el tratamiento con IgIV en 8 pacientes afectados de NMO, o de trastornos dentro del espectro de esta entidad.
MetodologíaEstudio prospectivo, abierto, observacional, no controlado, para evaluar la seguridad, la tolerabilidad y el efecto clínico de las IgIV en los trastornos del espectro de la NMO. Los eventos adversos se definieron de acuerdo con los criterios del NIH para los ensayos clínicos como: un efecto no deseado causado por la administración de fármacos15. Pacientes con diagnóstico de NMO16,17 y/o trastornos del espectro de la NMO1 se ofrecieron para recibir tratamiento con IgIV, cuando tenían la enfermedad activa. Definimos actividad de la enfermedad como tener al menos una recaída durante el año anterior y la falta de respuesta a terapias convencionales o al tratamiento inmunosupresor. Los pacientes firmaron un consentimiento informado antes de entrar en el estudio. Al inicio del estudio, los datos registrados fueron los siguientes: la edad en el momento del primer evento clínico, género, discapacidad neurológica medida con la Expanded Disability Status Scale (EDSS), el número y la fecha de las recaídas o brotes en el año anterior y en años previos.
La evaluación clínica y paraclínica previa incluyó la serología para virus de Epstein-Barr, virus del sarampión, rubéola, herpes simple tipo 1, VIH, reacción en cadena de polimerasa para virus JC y tuberculosis, reacciones treponémicas, y un análisis de sangre para descartar otras posibles causas de mielitis y/o neuritis óptica.
Se realizó al inicio una resonancia magnética cerebral y medular. También potenciales evocados visuales, y somatosensoriales; determinación de los anticuerpos NMO-IgG en suero y la determinación de anticuerpos antinucleares; análisis del LCR con bandas oligoclonales de IgG e IgM (OCGB, OCMB. La OCGB se determinó en 7 pacientes y OCMB, en 6 pacientes).
Las visitas se realizaron cada 2 meses. Antes de la administración de IgIV los pacientes eran evaluados por una neuróloga, para registrar la EDSS, la aparición de recaídas o los posibles efectos adversos del tratamiento.
Las medidas de resultado principal fueron los eventos adversos y los eventos adversos graves, y las secundarias, la aparición de brotes nuevos y el aumento de la discapacidad después del tratamiento con IgIV. Todos los pacientes habían sido tratados previamente con altas dosis de metilprednisolona por vía intravenosa para los brotes de mielitis o neuritis óptica. La detección de los NMO-IgG se realizó en el Hospital Clínic de Barcelona, utilizando una técnica de avidina-biotina en paraformaldehído-fijo, con secciones congeladas de cerebro de rata, descrita en el referenciado trabajo16. El análisis de las bandas oligoclonales en LCR se realizó en el Hospital Ramón y Cajal, Madrid. Las OCGB y OCMB fueron determinadas mediante la técnica de isoelectroenfoque (IEF) y de inmunodetección18,19, también descritas anteriormente.
Los pacientes recibieron IgIV (Grifols Flebogamma® 5%), 0,7 g por kg de peso corporal por día durante 3 días, en un intervalo de dosificación de 8 semanas. Los pacientes que provenían de fracaso de terapias de mantenimiento anteriores (algún tipo de inmunosupresor) no hicieron período de lavado. Flebogamma® 5% es un complejo de anticuerpos humanos altamente purificado (≥99%IgG), sin modificar, la IgG humana que contiene los anticuerpos específicos en la población de donantes. Las subclases de IgG están plenamente representados en el siguiente porcentaje, aproximadamente, del total de IgG: IgG1 es del 70,3%; IgG2, el 24,7%; IgG3, el 3,1%, e IgG4, un 1,9%. El contenido de IgA es inferior a 0,05mg/ml y la IgM está presente en pequeñas cantidades.
Todos los pacientes tenían niveles séricos normales de IgA antes del inicio del tratamiento. Cada infusión se administró en el hospital de día y fueron supervisadas por enfermeras especializadas y evaluadas por una neuróloga. La infusión se inició a un ritmo de 0,5mg/kg/min. Si durante los primeros 30 min, el paciente no experimentó incomodidad, la velocidad de infusión fue aumentando gradualmente hasta un máximo de 5mg/kg/min. La perfusión total duró una media de 6h. Los eventos adversos fueron registrados durante la infusión y en las visitas programadas.
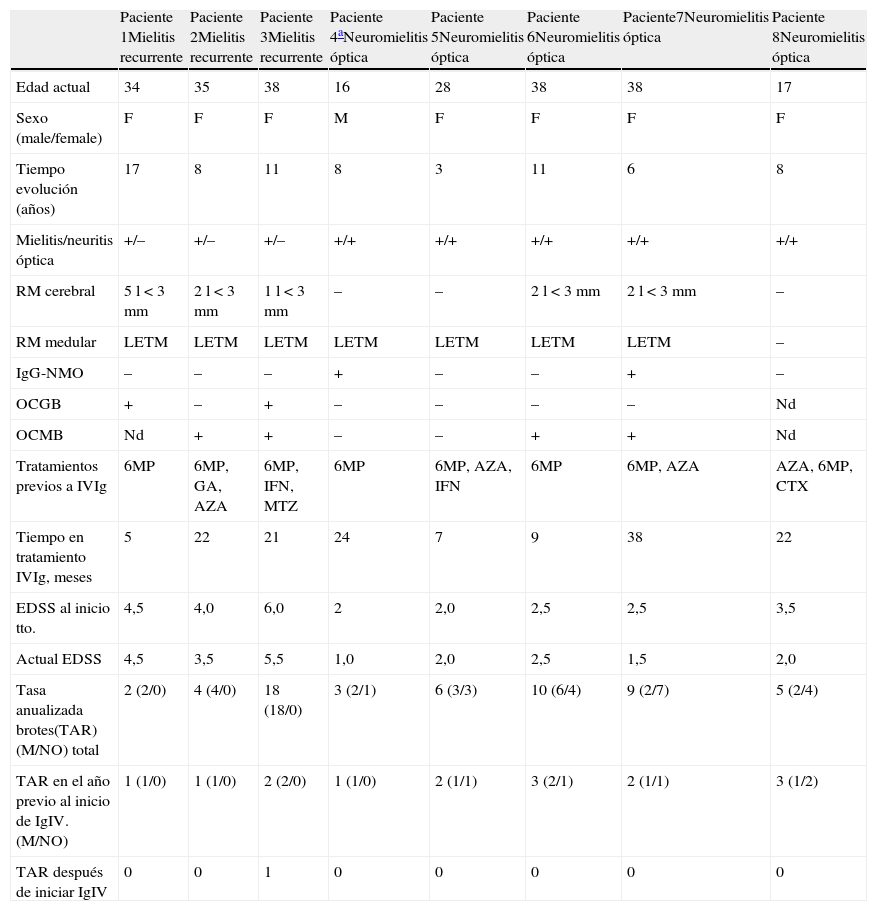
ResultadosCaracterísticas de los pacientesDesde febrero de 2006, 5 pacientes con formas recidivantes de NMO y 3 pacientes con mielitis transversa recurrente longitudinal extensa (LETM) se incluyeron en el estudio. Hubo 7 mujeres (87,5%) y un varón. La edad media al inicio de la enfermedad fue de 20,5 años (rango 8-31 años). Las características clínicas y demográficas se resumen en la tabla 1.
Características clínico-demográficas de los pacientes
| Paciente 1Mielitis recurrente | Paciente 2Mielitis recurrente | Paciente 3Mielitis recurrente | Paciente 4aNeuromielitis óptica | Paciente 5Neuromielitis óptica | Paciente 6Neuromielitis óptica | Paciente7Neuromielitis óptica | Paciente 8Neuromielitis óptica | |
| Edad actual | 34 | 35 | 38 | 16 | 28 | 38 | 38 | 17 |
| Sexo (male/female) | F | F | F | M | F | F | F | F |
| Tiempo evolución (años) | 17 | 8 | 11 | 8 | 3 | 11 | 6 | 8 |
| Mielitis/neuritis óptica | +/– | +/– | +/– | +/+ | +/+ | +/+ | +/+ | +/+ |
| RM cerebral | 5 l < 3 mm | 2 l < 3 mm | 1 l < 3 mm | – | – | 2 l < 3 mm | 2 l < 3 mm | – |
| RM medular | LETM | LETM | LETM | LETM | LETM | LETM | LETM | – |
| IgG-NMO | – | – | – | + | – | – | + | – |
| OCGB | + | – | + | – | – | – | – | Nd |
| OCMB | Nd | + | + | – | – | + | + | Nd |
| Tratamientos previos a IVIg | 6MP | 6MP, GA, AZA | 6MP, IFN, MTZ | 6MP | 6MP, AZA, IFN | 6MP | 6MP, AZA | AZA, 6MP, CTX |
| Tiempo en tratamiento IVIg, meses | 5 | 22 | 21 | 24 | 7 | 9 | 38 | 22 |
| EDSS al inicio tto. | 4,5 | 4,0 | 6,0 | 2 | 2,0 | 2,5 | 2,5 | 3,5 |
| Actual EDSS | 4,5 | 3,5 | 5,5 | 1,0 | 2,0 | 2,5 | 1,5 | 2,0 |
| Tasa anualizada brotes(TAR)(M/NO) total | 2 (2/0) | 4 (4/0) | 18 (18/0) | 3 (2/1) | 6 (3/3) | 10 (6/4) | 9 (2/7) | 5 (2/4) |
| TAR en el año previo al inicio de IgIV. (M/NO) | 1 (1/0) | 1 (1/0) | 2 (2/0) | 1 (1/0) | 2 (1/1) | 3 (2/1) | 2 (1/1) | 3 (1/2) |
| TAR después de iniciar IgIV | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 |
LETM: mielitis transversa longitudinal extensa; IVIg: inmunoglobulinas intravenosas; 6MP: seis metilprednisolona; AG: acetato de glatiramero; IFN-β: interferón beta; AZA: azatioprina; CTX: ciclofosfamida; M/NO: mielitis/neuritis óptica; Tr: tratamiento; Nd: no determinada.
Paciente 1: 34 años de edad, mujer, cuyo primer episodio de mielitis fue hace 17 años y el segundo episodio en 2008, con secuelas moderadas (EDSS 4,5). Los NMO-IgG fueron testados en una fase estable de la enfermedad, con resultado negativo. La paciente rechazó el tratamiento con azatioprina y en noviembre de 2008 inició tratamiento con IgIV.
Paciente 2: 35 años de edad, mujer, cuyo primer brote de mielitis fue hace 8 años y con una segunda mielitis un año después. Inicialmente, se le diagnosticó esclerosis múltiple, y que fue tratada con interferón beta-1a, desde 2002 a 2004 (retirado por efectos adversos), y acetato de glatiramero, en 2005, durante 4 meses. Luego tuvo un nuevo episodio de mielitis. Entonces se consideró el diagnóstico de mielitis recurrente y se cambió el tratamiento a azatioprina. Los NMO-IgG se determinaron durante una fase estable de la enfermedad, mientras estaba en tratamiento con azatioprina, y fueron negativos. El tratamiento con IgIV se inició en junio de 2007, después de haber sufrido una nueva recaída de la mielitis.
Paciente 3: 38 años de edad, mujer, con 18 recaídas de mielitis aguda en los últimos 11 años y un diagnóstico de la EMRR, ya que las bandas IgG oligoclonales estaban presentes en el LCR. Inicialmente, fue tratada con interferón beta 1b 2004 a 2006, posteriormente se cambió a 10mg/m2 de mitoxantrona mensual (MTZ) durante 3 meses seguidos de infusiones cada 3 meses, tras constatar progresión de la discapacidad neurológica con cada brote. A pesar de este tratamiento, tuvo 2 recaídas más, y se le ofreció tratamiento con IgIV. Los NMO-IgG fueron determinados en una fase estable de la enfermedad, después de la terapia con MTZ, y fueron negativos. El tratamiento con IgIV se inició en julio de 2007. Después de 15 meses de tratamiento, la paciente sufriría de nuevo un episodio de mielitis, y se cambió la terapia a rituximab en enero de 2009.
Paciente 4: 16 años de edad, varón, cuyo primer episodio de mielitis fue a la edad de 8 (año 2000), y posteriormente sufrió una neuritis óptica en el año 2001. Dosis bajas de esteroides se iniciaron entonces. En febrero de 2007, sufrió un nuevo episodio de neuritis óptica. Los NMO-IgG fueron testados después de tratamiento con altas dosis de metilprednisolona para la neuritis óptica. El resultado fue positivo. La terapia con IgIV se inició en mayo de 2007.
Paciente 5: 28 años de edad, mujer, cuyo primer episodio de mielitis fue en 2004, un año después sufrió una neuritis óptica. Inicialmente se le diagnosticó esclerosis múltiple y recibió tratamiento con interferón beta-1a. Sufrió 2 recaídas más y la terapia se cambió a los esteroides por vía oral y azatioprina, un año después. A pesar de este tratamiento, experimentó 2 brotes nuevos (mielitis y NO) y las IgIV se iniciaron en septiembre de 2008. Los NMO-IgG se determinaron después del último episodio, mientras estaba bajo tratamiento con azatioprina, con resultados negativos.
Paciente 6: 38 años de edad, mujer, previamente diagnosticados de enfermedad de Chron. Fue remitida a la unidad de EM en 2008 después de varios episodios de mielitis y neuritis óptica desde 1997, y había sufrido un brote de mielitis y 2 de NO en el último año. Hasta entonces, había sido tratado sólo con altas dosis de esteroides solo en las recaídas. Los NMO-IgG se determinaron durante una fase estable de la enfermedad, sin tratamiento de base, y fueron negativos. La paciente rechazó terapia inmunosupresora convencional y el tratamiento con IgIV se inició en junio de 2008.
Paciente 7: 38 años de edad, la mujer; se remitió a nuestra unidad de EM en 2005, con diagnóstico de NMO. Ella presentó una neuritis óptica seguida de mielitis transversa en el año 2002 y fue tratada con esteroides y azatioprina oral. Pese a estos tratamientos continuó con las recaídas y fue remitida para evaluar las terapias no convencionales. Los NMO-IgG se determinaron durante una fase estable de la enfermedad después de suspender la azatioprina y fueron positivos. El tratamiento con IgIV se inició en febrero de 2006. La paciente se ha mantenido estable durante 39 meses de seguimiento.
Paciente 8: 17 años de edad, mujer joven, con antecedentes familiares de enfermedad de Behçet, con un primer episodio de neuritis óptica, a la edad de 8 años. Durante el año siguiente, presentó meningoencefalitis aséptica con convulsiones y coma. Las RM cerebral y espinal fueron normales. Como había una historia previa de úlceras orales, se le diagnosticó entonces de enfermedad de Behçet probable. Se inició tratamiento con esteroides orales, azatioprina y ácido valproico. La paciente se recuperó de la meningoencefalitis aséptica y se mantuvo estable hasta marzo de 2006. Fue entonces cuando tuvo un segundo episodio de neuritis óptica. Al año siguiente, sufrió 2 nuevas neuritis óptica y una mielitis transversa aguda, lo que llevó al diagnóstico de NMO. Los NMO-IgG fueron analizados en una fase estable de la enfermedad, bajo tratamiento con azatioprina y el resultado fue negativo. La terapia con IgIV se inició en septiembre de 2007, después de la interrupción de la azatioprina, el mantenimiento de esteroides, disminuyéndolos lentamente hasta febrero de 2008.
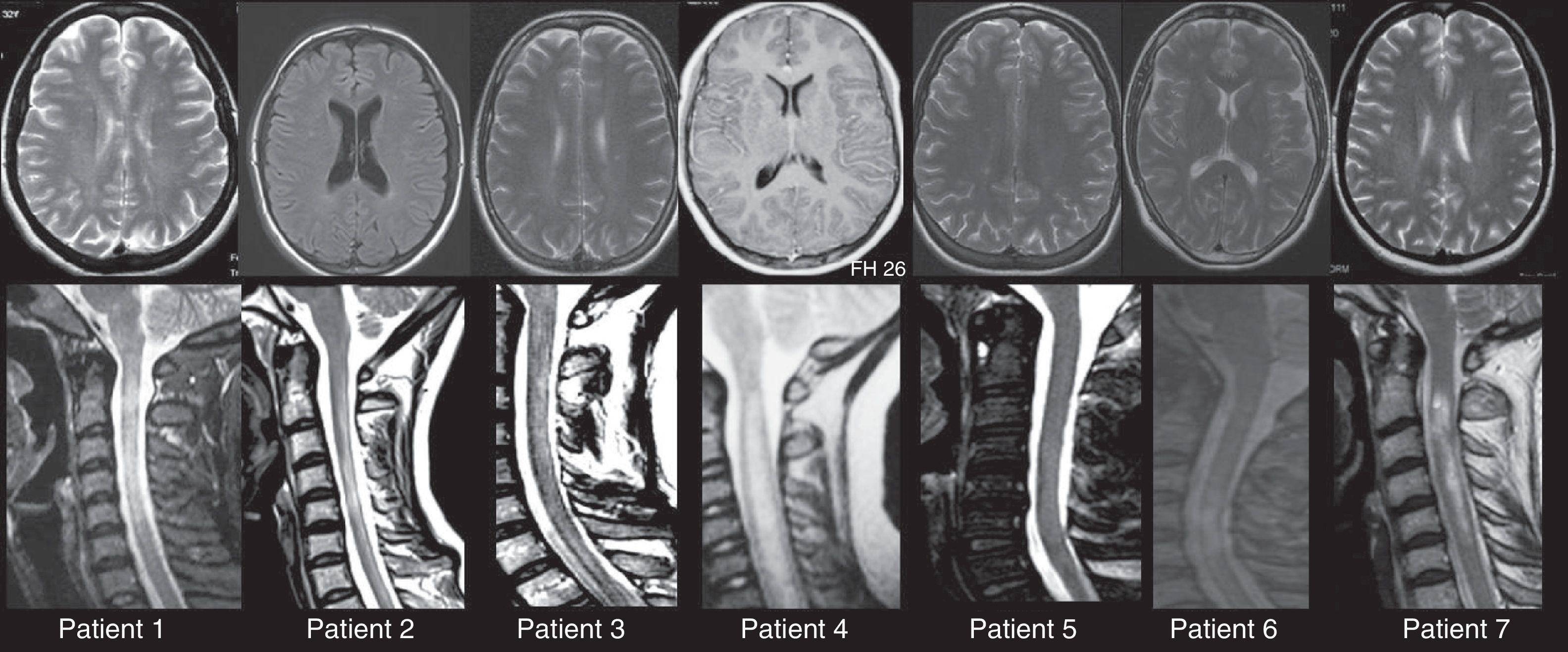
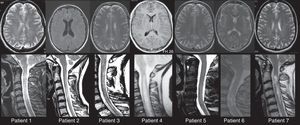
En resumen, los 8 pacientes que cumplían los criterios de los trastornos del espectro de la NMO. Los potenciales evocados visuales estaban gravemente y de forma bilateral alterados en todos los casos. La RM cerebral no mostró anormalidades en 3 pacientes, mientras que 5 pacientes mostraron algunas lesiones menores de 3mm que no cumplían los criterios de resonancia magnética de Paty20 para el diagnóstico de EM. La RM de la médula espinal mostró una lesión medular extensa que afectaba longitudinalmente más de 3 segmentos vertebrales en 7 casos (fig. 1).
Detalle de las RM cerebrales y espinales de los pacientes 1-7. En todos los casos se aprecia una mielitis extensa que afecta más de 3 segmentos vertebrales, con solo mínimos e inespecíficos cambios en la RM cerebral. Los estudios de RMN medular son secuencias potenciadas en T2. Las caracteristicas morfologicas y de hiperintensidad varían porque se trata de estudios realizados en diferentes momentos historicos y con diferentes equipos de resonancia. Los estudios de las RMN encefálicas corresponden a secuencias potenciadas en T2, a excepción del 1 y el 4, que corresponden a secuencias T1 con y sin gadolinio, respectivamente.
Los NMO-IgG fueron analizados en todos los pacientes y fueron positivos en solo 2 pacientes (25%). Muestras pareadas de suero/LCR se analizaron en 7 pacientes; estando presente la OCGB en 2 casos (28,5% de los determinados). En 6 pacientes, la OCMB fue estudiada y estaba presente en 4 casos (66,6%). Las determinaciones en suero de anticuerpos antinucleares, anticuerpos anticitoplasma de neutrófilos, anti-SSA y la determinación de anti-SSB fue negativa en todos los casos.
Administración del tratamiento y efectos adversos registradosUn total de 83 ciclos de IgIV fueron administrados (rango 4-21), para una media de 19,3 meses de seguimiento (rango 6-39). Un paciente (caso 6) experimentó una leve reacción dermatológica con eritema y erupción cutánea, pero sin signos sistémicos. En este paciente Grifols Flebogamma® 5% fue sustituido por KIOVIG®, que es otro producto derivado del plasma, que consta de una preparación altamente purificada de IgG humana con una potencia inmungénica inferior a los preparados de inmunoglobulina convencionales. Cuatro pacientes experimentaron dolor de cabeza leve durante la administración de IgIV y uno de ellos experimentó dolores de cabeza durante semanas después de la administración después de un año de terapia. Un paciente tuvo disgeusia que se asoció al tratamiento. La paciente 8 sufrió una necrosis avascular de la cabeza femoral 3 meses después de la iniciación de IgIV. Este evento adverso fue considerado secundario a la terapia crónica con esteroides, ya que había sido tratada con esteroides por vía oral durante 7 años. Se sometió a una cirugía de remplazo bilateral de cabeza de fémur en 2008. Ningún otro evento adverso serio fue reportado.
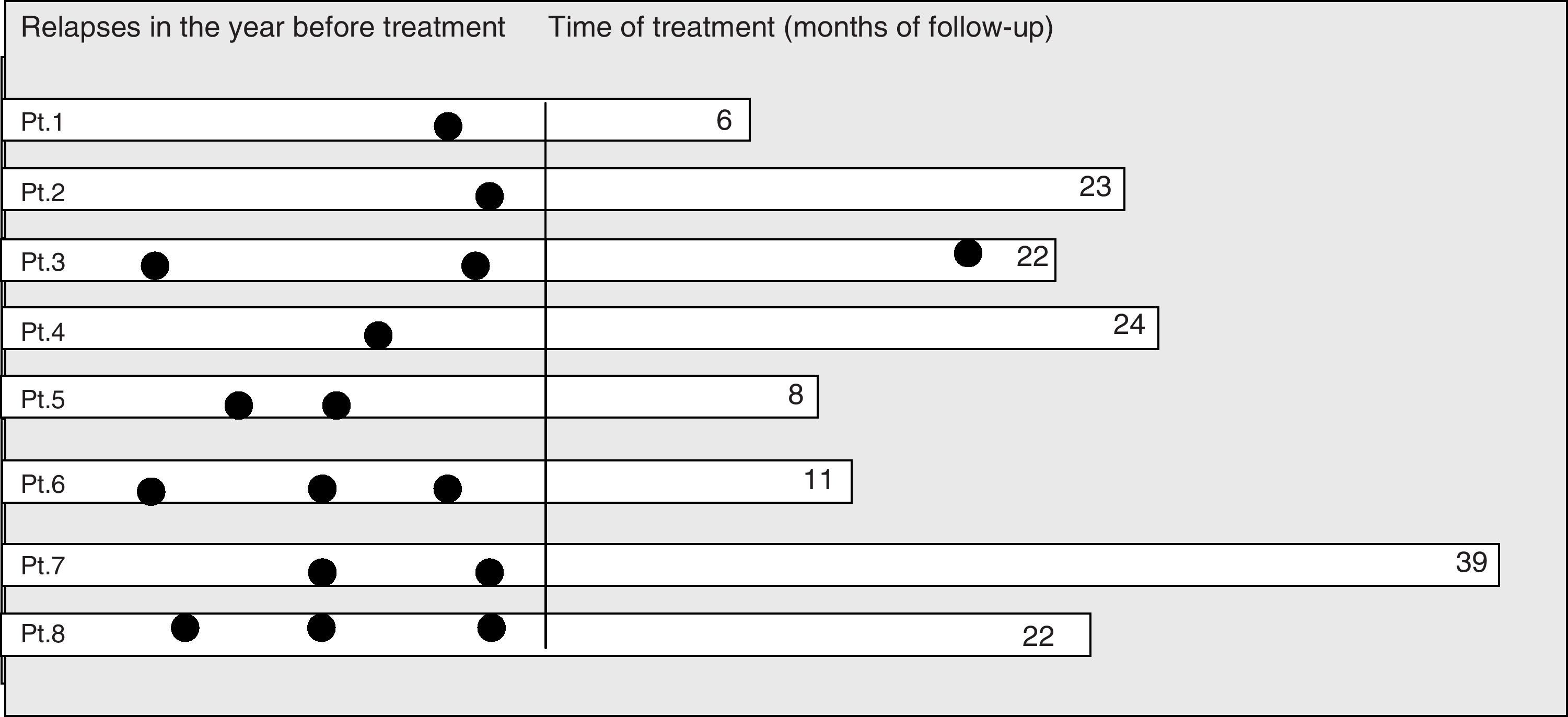
Respuesta al tratamiento con inmunoglobulinas por vía intravenosa en brotes y discapacidadLa media del número de recaídas durante el año antes del tratamiento fue de 1,8 (rango 1-3, DE 0,8). La media de las recaídas totales antes del tratamiento fue de 7,1 (rango 2-18 recaídas, DE 5,2). Después de un seguimiento medio de 19,3 meses solo un paciente (paciente 3) experimentó una recaída tras 15 meses de tratamiento con IgIV. Su EDSS empeoró de 4,5 a 5,5, no respondió a dosis altas de metilprednisolona y por ello se cambió a rituximab (fig. 2). La reducción de la actividad de la enfermedad fue estadísticamente significativa; z=–2,5, p=0,01 (test de Wilcoxon).
La EDSS al inicio del estudio fue de 3,3 (rango 2,0-6,0, DE 1,3) y disminuyó a 2,6 (rango 1,0 a 5,5, DE 1,5). Estas diferencias también fueron estadísticamente significativas, z=–2,0, p=0,04. La EDSS mejoró en 5 de los casos y no hubo cambios de EDSS en 3 casos. La mejora en la EDSS se evidenció por lo general después del segundo ciclo de IgIV.
DiscusiónLos resultados de este estudio sugieren que la terapia con IgIV es segura y bien tolerada en los trastornos del espectro de la NMO.
Después de 83 infusiones, y tras una media de 19 meses de seguimiento (mínimo 6 meses), mínimos eventos adversos menores fueron reportados. A pesar del bajo número de casos y el corto tiempo de seguimiento, la disminución de la tasa de recaídas y la mejora de la discapacidad apuntan a que el tratamiento con IgIV podría ser eficaz como terapia de mantenimiento en la NMO y los trastornos del espectro NMO. Los trastornos del espectro NMO son poco frecuentes y a menudo difíciles de diagnosticar. Algunos de nuestros pacientes fueron inicialmente diagnosticados de esclerosis múltiple y se trataron con terapias inmunomoduladoras. Los 2 casos con inicio infantil cumplen los criterios clínicos de NMO, ya que tenían episodios recurrentes de mielitis y neuritis óptica. Uno de ellos también tuvo un episodio de encefalopatía, que ha sido reportado como un posible síntoma en los niños con NMO21. Hasta la fecha, muy pocos estudios no aleatorizados, con un bajo número de pacientes, se han realizado en NMO, ambos con inmunosupresores de amplio espectro y anticuerpos monoclonales22–25. Estas terapias han demostrado ser parcialmente efectivas, pero se han asociado posibles eventos adversos graves, como infecciones potencialmente mortales o enfermedades malignas, a diferencia de IgIV23,26. Los eventos adversos asociados al tratamiento con IgIV son generalmente leves y transitorios, tales como dolores de cabeza, erupción cutánea y disgeusia, de acuerdo con nuestro estudio. Eventos adversos potencialmente graves son poco frecuentes, tales como necrosis tubular aguda renal, que es a menudo transitoria y reversible, meningitis aséptica o complicaciones trombóticas. Hubo un caso de necrosis avascular de la cabeza femoral, que se considera secundaria al tratamiento crónico de esteroides en nuestra serie. Hay 2 posibles factores de confusión que influyen en el análisis de la eficacia de la IgIV en NMO en nuestro estudio. Por un lado, la regresión a la media. Este fenómeno puede influir en la disminución de la tasa de recaída. La NMO evoluciona, de forma natural, en clústers de brotes o exacerbaciones clínicas, alternando con períodos de menos actividad de la enfermedad. Por lo tanto, sería posible pensar que la administración de IgIV coincidiese con períodos de remisión de la enfermedad, aunque es poco probable que esta coincidente situación se dé en todos los casos. Por otro lado, el 66,6% de los pacientes habían sido tratados previamente con fármacos inmunomoduladores o inmunosupresores, que podrían haber inducido una remisión persistente. Sin embargo, la decisión de tratar con IgIV se estableció por la presencia de recaídas a pesar de los tratamientos anteriores. Además, todos los pacientes permanecieron estables durante el seguimiento. No solo este dato, sino que adicionalmente encontramos una mejora sostenida en la EDSS en 5 pacientes, y la estabilización mantenida en 3 pacientes (5 pacientes seguidos durante más de 22 meses) apoya suficientemente la eficacia de esta terapia en los trastornos del espectro NMO. Otro hallazgo importante de nuestro estudio es la alta frecuencia de OCMB (66,6%), más del doble de la tasa publicada en los pacientes con EM27. La presencia de OCMB podría reflejar en el LCR la existencia de una síntesis intratecal de IgM. Esto se correlacionaría con lo demostrado en estudios de anatomía patológica: la existencia de depósitos de Ig (principalmente IgM) colocalizados con productos iniciales de la cascada de activación del complemento alrededor de los vasos en las lesiones tempranas2,3 de la NMO.
La determinación de los NMO-IgG se llevó a cabo en una fase estable de la enfermedad en 8 casos, y durante o poco tiempo después de la terapia inmunosupresora en 5 casos, y esto puede explicar la baja frecuencia de NMO-IgG en nuestros pacientes (25%)28,29. La eficacia de las IgIV en la NMO está patogénicamente apoyada por los conocidos mecanismos de acción conocidos de las mismas4–7. Las IgIV actúan en los principales mecanismos implicados en la patogénesis de la enfermedad2,3 y algunos de estos resultados positivos ya habían sido previamente reportados en forma de series de casos13,14,22. Decidimos tratar sobre la dosis de una infusión bimensual de de 0,7 g por kg de peso corporal al día durante 3 días, porque estas dosis han demostrado ser bien toleradas y eficaces en otras enfermedades neurológicas, como CIDP30 o miastenia grave31. Las dosis óptimas para la inducción de la remisión y el mantenimiento todavía son objeto de debate y un tema que es necesario explorar32,33. En resumen, el tratamiento con IgIV es seguro y bien tolerado, y parece ser eficaz para prevenir las recaídas en la NMO y en las enfermedades relacionadas, al menos durante los 2 primeros años de tratamiento. Es necesario realizar ensayos controlados que incluyan a más pacientes y con mayor tiempo de seguimiento para confirmar estos resultados y determinar la dosis apropiada y la programación de la administración.
Conflicto de interesesM.J. Magraner ha formado parte del consejo asesor de Biogen Idec.
F. Coret ha formado parte del consejo asesor de TEVA y Sanofi-Aventis.
B. Casanova ha formado parte del consejo asesor de Biogen Idec, Merck-Serono, TEVA, Sanofi-Aventis y Bayer-Schering.