La eslicarbazepina (ESL) es un nuevo fármaco antiepiléptico (FAE) análogo de la carbamazepina (CBZ) y la oxcarbazepina (OXC). Analizamos su respuesta terapéutica inicial y el paso desde CBZ y OXC.
MétodosEvaluamos en un estudio transversal a 61 pacientes con un amplio espectro de epilepsias farmacorresistentes. El cambio desde CBZ y OXC se realizó en una noche con una equivalencia de 1:1,3 y 1:1mg.
ResultadosLa epilepsia más frecuente fue la de lóbulo temporal (62,3%). La etiología más frecuente la esclerosis mesial (26,2%). El seguimiento medio fue de 4,7±3,2 meses. En 40 pacientes con seguimiento mínimo de 3 meses, la frecuencia mediana de crisis se redujo un 63,6% (p<0,001), siendo en un 30% la reducción ≥ 80%. Los efectos adversos (EA) aparecieron en el 54,3% siempre durante la fase de titulación, siendo más frecuentes a dosis superiores a 800mg (73,9% vs. 47,4%; p=0,042) y el más importante el mareo (34,4%), siendo más habitual en asociación con VPA, LTG y/o LCS (19,2% vs. 45,7%; p=0,031). La tasa de retención temprana a los 3 meses fue del 75,4%. En 25 pacientes se cambió desde CBZ o OXC, siendo los EA transitorios (69,2% y 33%; p=0,073). Pasados 3 meses del cambio, la frecuencia mediana de crisis había disminuido un 20% (p<0,075).
ConclusionesLa ESL es eficaz en el tratamiento de epilepsias focales, con una tasa de retención temprana > 70%. Los EA tienen lugar durante la fase de titulación y según los fármamcos antiepilépticos asociados. El cambio rápido desde CBZ y OXC puede realizarse de forma segura.
Eslicarbazepine acetate (ESL) is a new antiepileptic drug (AED) and an analogue to carbamazepine (CBZ) and oxcarbazepine (OXC). In this study, we evaluate initial therapeutic response to ESL and events in the change from CBZ and OXC.
MethodsWe evaluated 61 patients with a broad spectrum of drug-resistant epilepsies in a cross-sectional study. The switch from CBZ and OXC to ESL was carried out in a single night at ratios of 1:1.3 and 1:1mg respectively.
ResultsThe most common form of epilepsy was temporal lobe epilepsy (62.3%). The most common aetiology was mesial temporal sclerosis (26.2%). Mean follow-up time was 4.7±3.2 months. In 40 patients with a minimum follow-up period of 3 months, monthly median seizure frequency dropped by 63.6% (P<.001) and a reduction of 80% or more was recorded in 30%. Adverse events (AEs) occurred in 54%; all appeared during the titration phase. They were more frequent at doses in excess of 800mg (73.9% vs. 47.4%; P=.042). The most common AE was dizziness (34.4%), which was commonly associated with VPA, LTG and/or LCS consumption (19.2% vs. 45.7%; P=.031). The retention rate at 3 months was 75.4%. A total of 25 patients replaced CBZ or OXC treatment with ESL; any AEs were transient (69.2% for CBZ and 33% for OXC; P=.073). At 3 months after the treatment change, median seizure frequency had decreased by 20% (P<.075).
ConclusionsESL is effective in the treatment of focal epilepsies and its early retention rate is > 70%. AEs occurred during the titration phase and corresponded to associated AEDs. A rapid change from CBZ and OXC to ESL treatment can be safely performed.
El acetato de eslicarbazepina (ESL) es un nuevo fármaco antiepiléptico (FAE), derivado de la carbamazepina (CBZ) y oxcarbazepina (OXC), que actúa estabilizando el estado inactivado de los canales de sodio dependientes de voltaje (CSDV)1. Diseñada para evitar la producción de metabolitos tóxicos epóxido y metabolizarse extensamente por hidrólisis a S-licarbazepina, la ESL presenta una mayor tolerancia y eficacia que la CBZ y OXC2.
La utilidad de la ESL ha sido probada, en dosis de 800 y 1.200mg en una sola toma diaria, como terapia adyuvante en pacientes adultos con epilepsia focal farmacorresistente3-6. Su efecto terapéutico mantenido durante el primer año, así como una repercusión positiva en la calidad de vida y estado de ánimo, ha sido corroborado en las fases abiertas de los ensayos3,7-9.
Comercializada en España en febrero del 2011, las experiencias publicadas fuera de los estudios de autorización son aún limitadas. Existe además escasa información sobre si pacientes que no respondieron o presentaron efectos adversos (EA) a CBZ u OXC pueden beneficiarse de la ESL y sobre cómo realizar el cambio desde dichos FAE10.
En relación con esto, en los estudios fase iii se observó que la mejoría era la misma, independientemente del FAE concomitante a ESL, aunque a expensas de efectos adversos más frecuentes al asociarse con CBZ. Por otro lado, se consideró necesario excluir a los pacientes que tomaban OXC de los estudios al compartir este los mismos metabolitos que la ESL4,5,11,12.
Por todo ello, en este estudio pretendemos analizar la experiencia inicial de nuestra Unidad de Epilepsia en el manejo de la ESL y en la substitución de CBZ u OXC por ESL10. Para ello hemos hecho un seguimiento exhaustivo de nuestros pacientes, centrándonos en los cambios en la frecuencia de crisis, aparición de EA e interacciones con otros FAE.
Sujetos y métodosEn este estudio observacional descriptivo transversal se han incluido, de forma consecutiva, los primeros pacientes con epilepsias farmacorresistentes a las que se introdujo tratamiento adyuvante con ESL en nuestra Unidad de Epilepsia. De acuerdo con los criterios de la ILAE, se consideraron como farmacorresistentes aquellos pacientes con epilepsia en las que no obtienen una evolución libre de crisis después de seguir tratamiento con 2 FAE apropiados y tomados de forma adecuada en mono o biterapia, durante un periodo mínimo (el más largo) superior a 12 meses o 3 veces el tiempo más largo entre crisis en el año previo13.
La frecuencia de crisis se cuantificó de forma estandarizada en periodos de 4 semanas (crisis mensuales).
Los tipos de epilepsia y síndromes epilépticos se clasificaron según los criterios de la ILAE14,15, haciendo uso de la información obtenida de estudios de neuroimagen (resonancia magnética de 3 tesla o tomografía computarizada craneal) y electroencefalográficos (vídeo-EEG o EEG simple).
La ESL se inició a dosis de 400mg/día, incrementándose en una o 2 semanas a 800mg/día y, según la respuesta individual, posteriormente hasta 1.200mg/día. Para mantener la concentración total de monohidroxiderivados (MHD) S y R-licarbazepina, se decidió una relación de intercambio OXC:ESL aproximada de 1,1mg10 y teniendo en cuenta la equivalencia de CBZ a OXC, se procuró una equivalencia aproximada de CBZ:ESL de 1:1-1,3mg16 hasta un máximo de 1.600mg/día de ESL. Esta sustitución se realizó de forma directa en una noche, inicialmente en pacientes ingresados en nuestra Unidad de Epilepsia, y a medida que aumentó nuestra experiencia en la seguridad de este cambio, también en los pacientes ambulatorios.
Se anotaron los FAE asociados a la ESL en cada paciente.
Los pacientes fueron visitados al mes, 3 meses y 6 meses, y contactaron telefónicamente en caso de aparición de algún EA. En las visitas se interrogó de forma dirigida sobre la aparición de EA tanto físicos como de perfil psiquiátrico. Se catalogaron como transitorios aquellos EA que remitieron de forma espontánea, al reducir la dosis de ESL o variar el horario de la toma. Se catalogaron como persistentes aquellos EA que no remitieron a pesar del ajuste de dosis o comportaron la suspensión de la ESL.
Se cuantificó la frecuencia de crisis mediante un diario de crisis desde el primer día de tratamiento con ESL. La eficacia se evaluó mediante el cambio en el número de crisis en el periodo estandarizado (4 semanas), así como en función de la variaciones en el porcentaje de pacientes dentro de las siguientes categorías: libertad de crisis (ausencia de crisis durante el seguimiento), disminución ≥ 80% en la frecuencia de crisis, disminución ≥ 50%, disminución ≥ 30%, ausencia de cambios e incremento en la frecuencia de crisis. Debido al limitado tiempo de seguimiento (inferior a un año), se consideraron como libres de crisis solo aquellos pacientes sin crisis durante un periodo de seguimiento superior a 3 meses y se incluyó en el estudio solo a pacientes con una frecuencia de crisis igual o superior a una crisis/mes durante todo el año previo a su inclusión. Entre los pacientes que no quedaron libres de crisis, se evaluó el cambio respecto a los días libres de crisis.
Además, se realizó una analítica programada dentro del primer mes que incluía ionograma, hemograma, perfil hepático y, en casos indicados, niveles de los FAE adyuvantes. Se evaluaron solo alteraciones de laboratorio en rango patológico de nueva aparición y no presentes en analíticas previas.
Los criterios de suspensión del fármaco fueron el empeoramiento del número de crisis a pesar de los ajustes de dosis, la aparición de EA permanentes o graves y/o la aparición de alteraciones analíticas significativas.
Estudio estadísticoSe llevó a cabo con el paquete SPSS versión 17.0 para Windows. Las variables cuantitativas se describen mediante la media ± desviación estándar o la mediana (rango intercuartílico [RI]) y las cualitativas mediante porcentajes. La normalidad para las variables continuas se comprobó con el test de Kolmogorov-Smirnov. El análisis univariante se desarrollo con el test de la χ2 o el test exacto de Fisher para las variables dicotómicas (odds ratio [OR]) con intervalo de confianza (IC) del 95%. Los cambios en la frecuencia de crisis y días libres de crisis antes y después de iniciar el tratamiento con ESL fueron evaluados mediante la prueba de los rangos de Wilcoxon para datos apareados, dada la distribución no normal de dichas variables. Se consideraron significativos los valores de p menores de 0,05.
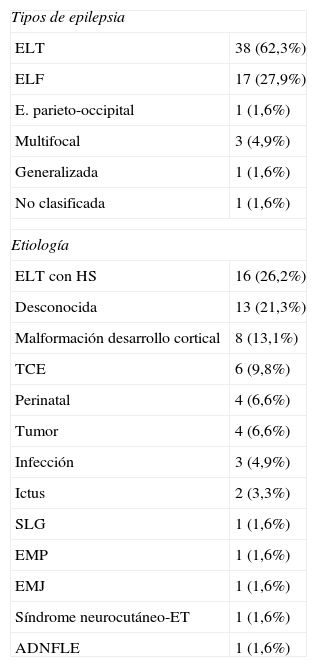
ResultadosCaracterísticas basales de la población estudioLa población a estudio consiste en 19 hombres (31,5%) y 42 mujeres (68,8%), con una edad media de 43,6 ± 14,4 años. El tipo de epilepsia más frecuente fue la epilepsia del lóbulo temporal (ELT) (62,3%). Las etiologías más frecuentes en la cohorte fueron la esclerosis mesial (26,2%), la malformación del desarrollo cortical (13,1%) y el traumatismo craneoencefálico (9,8%) (véase la tabla 1).
Características basales de la población a estudio (n=61)
| Tipos de epilepsia | |
| ELT | 38 (62,3%) |
| ELF | 17 (27,9%) |
| E. parieto-occipital | 1 (1,6%) |
| Multifocal | 3 (4,9%) |
| Generalizada | 1 (1,6%) |
| No clasificada | 1 (1,6%) |
| Etiología | |
| ELT con HS | 16 (26,2%) |
| Desconocida | 13 (21,3%) |
| Malformación desarrollo cortical | 8 (13,1%) |
| TCE | 6 (9,8%) |
| Perinatal | 4 (6,6%) |
| Tumor | 4 (6,6%) |
| Infección | 3 (4,9%) |
| Ictus | 2 (3,3%) |
| SLG | 1 (1,6%) |
| EMP | 1 (1,6%) |
| EMJ | 1 (1,6%) |
| Síndrome neurocutáneo-ET | 1 (1,6%) |
| ADNFLE | 1 (1,6%) |
ADNFLE: epilepsia nocturna del lóbulo frontal autosómica dominante; ELF: epilepsia del lóbulo frontal; ELT: epilepsia del lóbulo temporal; EMJ: epilepsia mioclónica juvenil; EMP: epilepsia mioclónica progresiva; ET: esclerosis tuberosa; HS: esclerosis mesial; SLG: síndrome de Lennox-Gastaut; TCE: traumatismo cráneo-encefálico.
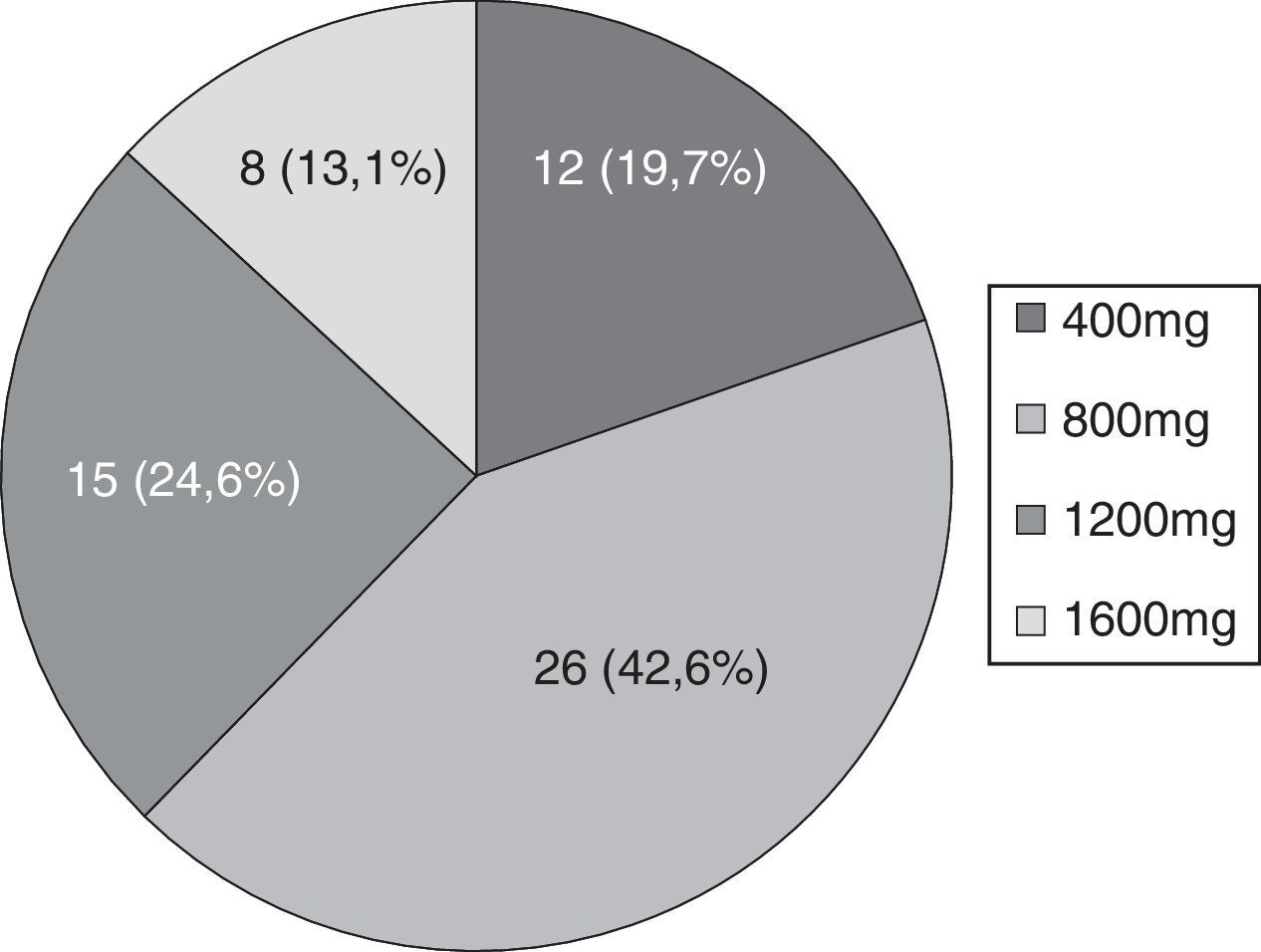
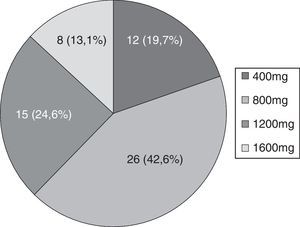
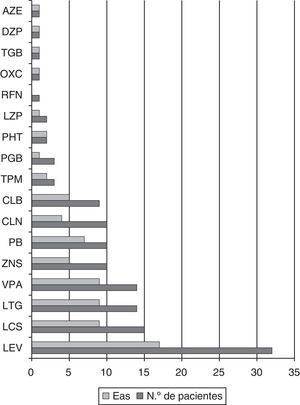
La frecuencia mediana de crisis antes del inicio de ESL fue de 5,5 crisis/mes (RI 1,13-30). La dosis máxima alcanzada fue de 800mg en el 42,6% de los pacientes (véase la figura 1).
Cambio de frecuencia de crisis con eslicarbazepinaEl periodo de seguimiento medio de los pacientes fue de 4,7 ± 3,2 meses.
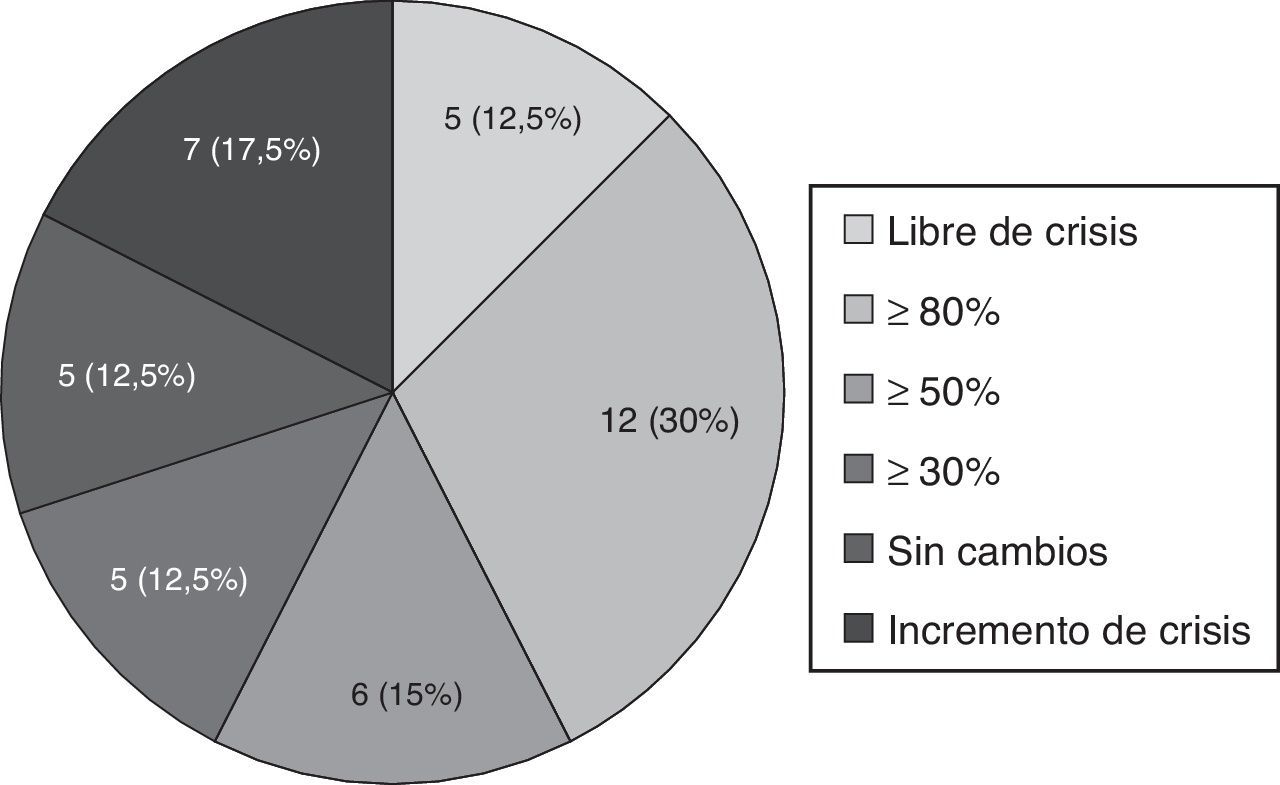
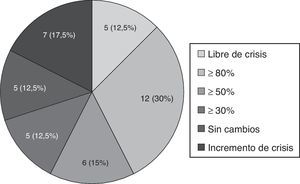
Cuarenta pacientes cumplieron un periodo mínimo de seguimiento de 3 meses, siendo en este grupo el tiempo medio de seguimiento de 6,53 ± 2,49 meses. En ellos, la reducción mediana de crisis/mes fue del 63,6% (de 5,5 [RI 1,5-30] a 2 [RI 1-5,37]; p<0,001), quedando 5 pacientes (12,5%) libres de crisis, 12 (30%) con una disminución igual o superior al 80% de su frecuencia de crisis y 6 (15%) con una disminución igual o mayor al 50%, tal y como se muestra en la figura 2. Además, 5 pacientes (12,5%) no presentaron cambios y 7 (17,5%) presentaron un incremento en la frecuencia de crisis. Entre los pacientes que no quedaron libres de crisis, los días libres de crisis se incrementaron de 5,09 (RI 0,9-18,7) a 9,33 (RI 4,3-18,7), p=0,018.
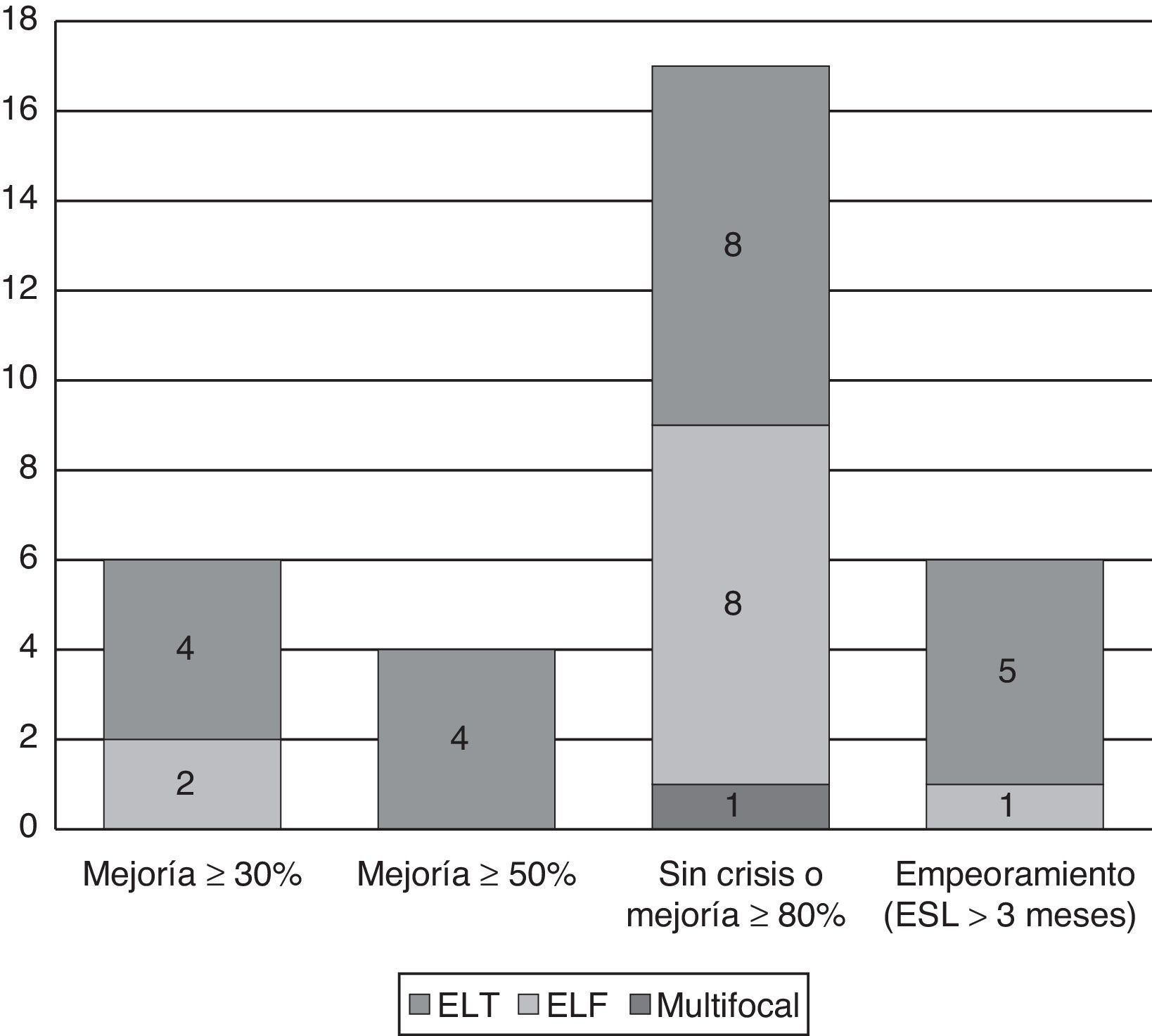
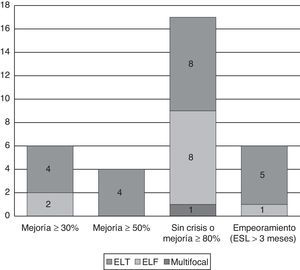
Cambio en la frecuencia de crisis según el tipo de epilepsiaEpilepsias que presentaron una mejoría relevanteDe los 17 pacientes (42,5%) que quedaron libres de crisis o presentaron una reducción superior al 80%, 11 (64,7%) consistían en epilepsias sintomáticas (7 ELT y 4 epilepsias del lóbulo frontal [ELF]; 4 secundarias a traumatismo, 3 a esclerosis hipocampal (HS), una por displasia, una a daño vascular cerebral, 2 a infección del sistema nervioso central) y una multifocal por trastorno de migración tipo paquigiria. Las 5 restantes eran de causa criptogénica/desconocida.
Epilepsia que presentaron un empeoramientoLos 7 pacientes con aumento en la frecuencia crisis, presentaban una epilepsia mioclónica juvenil, diagnosticada erróneamente en un principio como epilepsia focal, una epilepsia frontal nocturna autosómica dominante (ADNFLE) y 5 ELT (una debida a HS, una a displasia y 3 de causa criptogénica/desconocida). Además, otros 6 pacientes presentaron incremento de crisis siendo suspendida la ESL antes de los 3 meses: una epilepsia mioclónica progresiva con crisis frontales a estudio, un síndrome de Lennox-Gastaud (SLG) criptogénico con crisis multifocales, 2 ELF (una secundaria a daño perinatal y otra criptogénica) y 2 ELT (una por HS y otra insular criptogénica) (véase la figura 3).
Alteraciones de laboratorioOnce pacientes (18%) presentaron alteraciones de laboratorio que no estaban presentes en analíticas previas. Estas consistieron en hiponatremia en 4 casos (6,6%) (rango de 128-132 mEq/l), de los cuales ninguno tomaba CBZ ni OXC, elevación de enzimas hepáticas en 4 casos (6,6%) (rango de transaminasa glutamicoxalacética de 42-110 y de gammaglutamil transpeptidasa de 68-331) y elevación de colesterol (rango de 207-235mg/dl) y triglicéridos (rango de 221-359mg/dl) en otros 3. En ningún caso se tuvo que retirar la ESL por este motivo. Finalmente, en un paciente hubo una corrección de la hiponatremia que presentaba con OXC (pasando de 128 a 138mmol/l) y en otro se mantuvo una hiponatremia de 133mmol/l, que ya presentaba previamente con OXC.
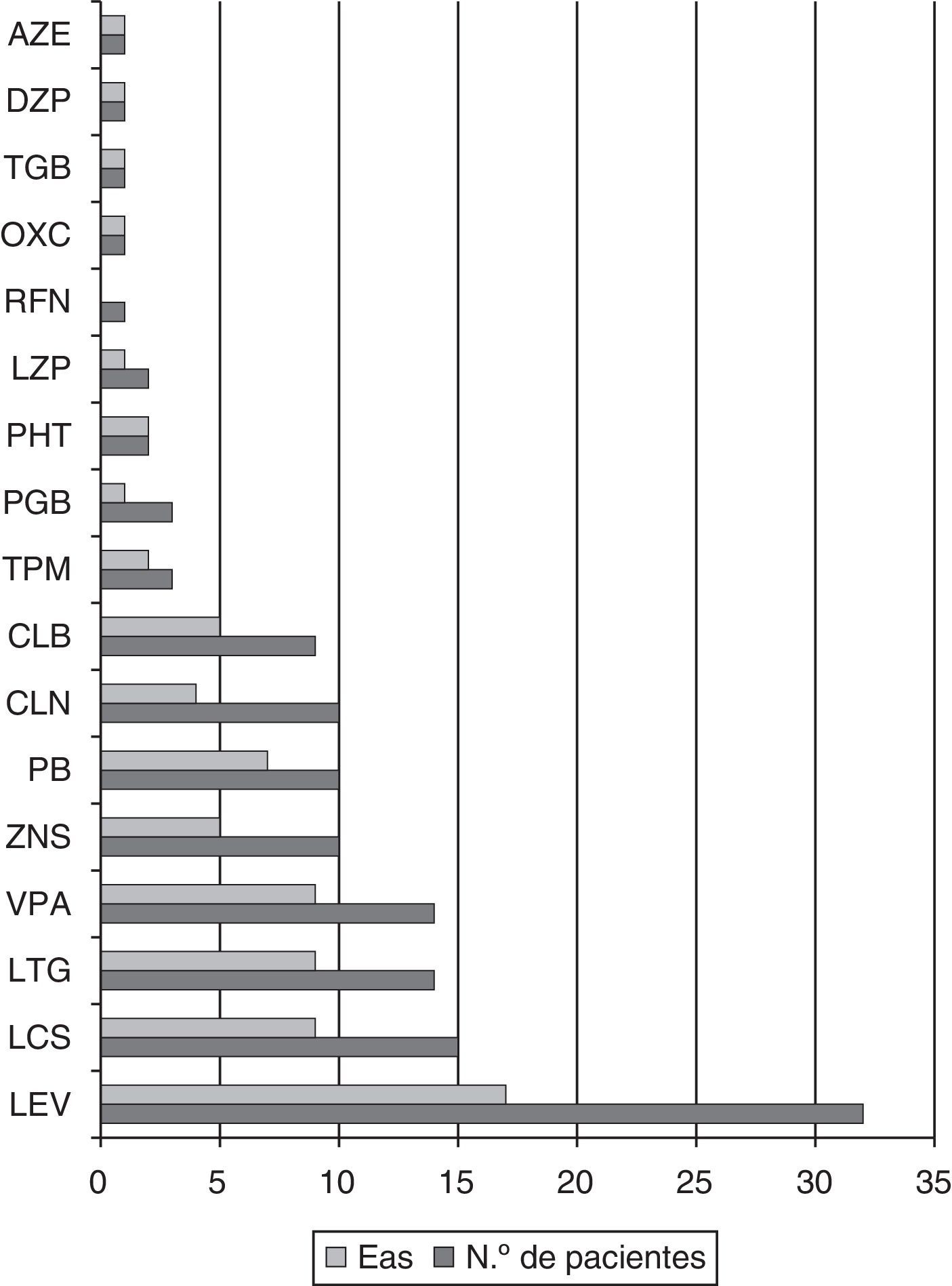
Fármacos antiepilépticos asociados a eslicarbazepinaLos FAE más frecuentemente utilizados en asociación con ESL fueron LEV en 32 pacientes (52,5%), LCS en 15 (24,6%), LTG en 14 (22,9%) y VPA en 14 (22,9%). El número mediano de FAE adyuvantes fue de 2 (RI 1-3), siguiendo la mayoría de los pacientes tratamiento con uno (29,5%) o 2 (32,8%). De los 17 pacientes libres de crisis o con mejoría superior al 80%, 8 (47%) tomaban LEV, 7 (41,2%) LCS, 6 (35,3%) VPA y 4 (23,5%) LTG.
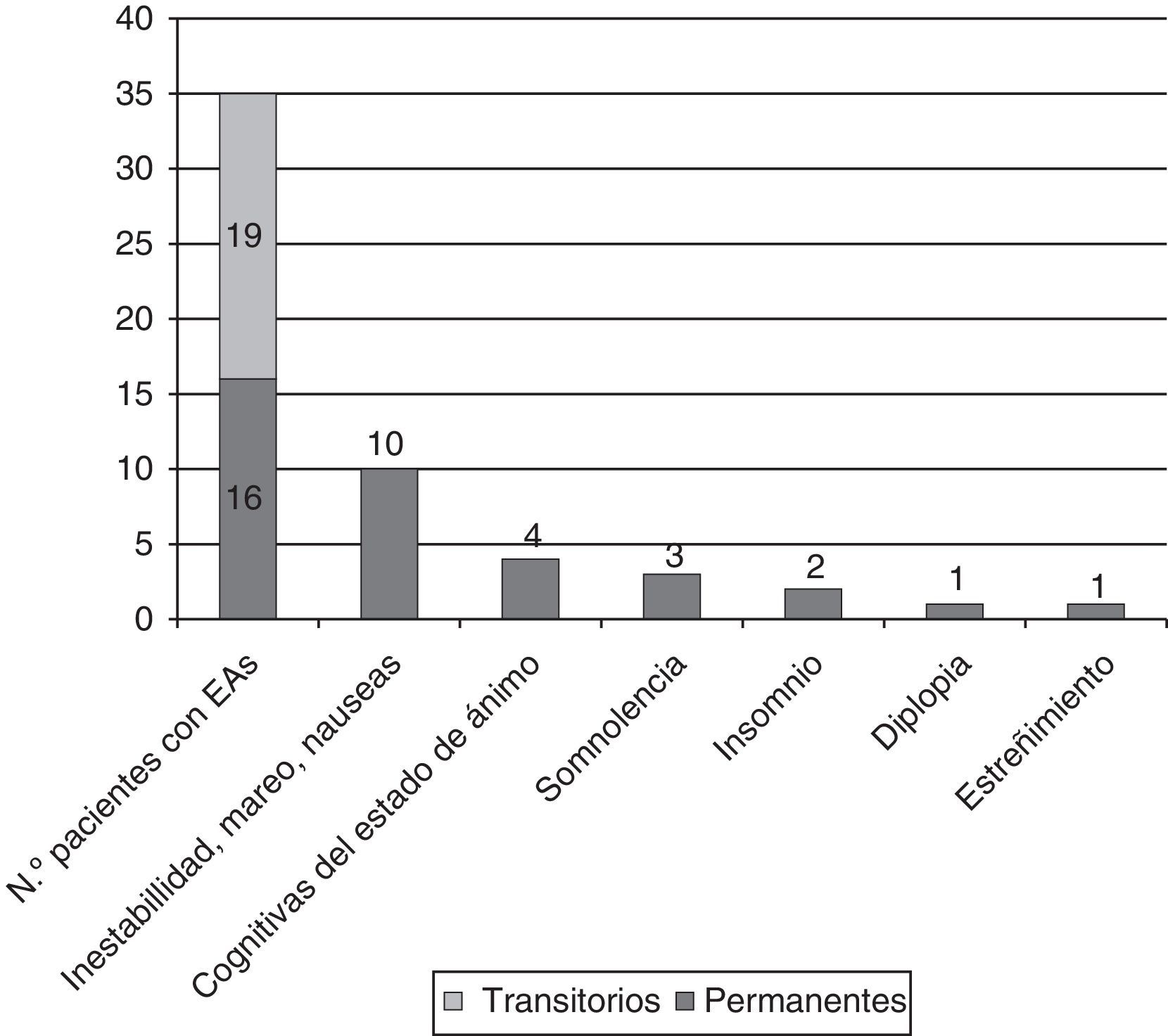
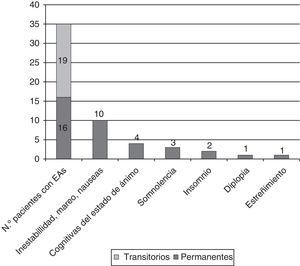
Efectos adversos: asociación a las dosis de eslicarbazepina y a los fármacos antiepilépticos adyuvantesSe registraron EA en 35 pacientes (57,4%), siendo los más frecuentes inestabilidad, mareo y náuseas en 21 pacientes (34,4%), alteraciones cognitivas y del estado de ánimo en 6 (9,8%) (3 [4,9%] bajo estado de ánimo y 3 [4,9%] ansiedad/irritabilidad, uno además con dificultades para concentrarse) y trastornos del sueño en 10 (16,4%; 7 [11,5%] con somnolencia y 3 [4,9%] con insomnio). Los casos de insomnio mejoraron al adelantar la hora de la toma de ESL.
Se debe destacar además 2 casos de reacciones cutáneas exantemáticas (una grave en forma de rash-angioedema y otra leve con eritema pruriginoso).
Los EA fueron transitorios durante la fase de titulación en el 54,3% de los casos y persistente en el resto, siendo la causa de suspensión del tratamiento en 6 casos (9,8%; 4 por mareo y náuseas, y 2 por rash) (véase la figura 4).
El tratamiento se suspendió además en otros 9 pacientes por falta de efectividad o aumento de la frecuencia de crisis, siendo la tasa de retención final del 75,4%.
Presentaron EA el 41,7% de los pacientes que tomaban dosis de ESL de 400mg, el 50% de los que tomaban de 800mg, el 80% de 1.200mg y el 62,5% de 1.600mg. En total, presentaron EA el 73,9% de los pacientes que tomaban dosis superiores a 800mg y el 47,4% de los pacientes con dosis iguales o inferiores a 800mg (OR 3,15; IC del 95%, 1,02-9,72; p=0,042). Entre los FAE adyuvantes más utilizados, el PB presentó EA en el 70% de los pacientes, el VPA en el 64,3%, la LTG en el 64,3%, la LCS en el 60% y el LEV en el 53,1% (véase la figura 5).
No se observaron diferencias estadísticamente significativas en el porcentaje de EA según el FAE adyuvante en el análisis univariante, aunque sí una mayor tendencia a presentar inestabilidad, mareo y náuseas entre los pacientes en tratamiento con VPA, LTG y/o LCS (45,7% vs. 19,2%, OR 3,5; IC del 95%, 1,09-11,5; p=0,031). De los 6 pacientes con quejas de tipo cognitivo o en relación con el estado de ánimo, 4 seguían tratamiento con LEV: 2 referían bajo estado de ánimo, uno nerviosismo-irritabilidad y otro dificultad para concentrarse.
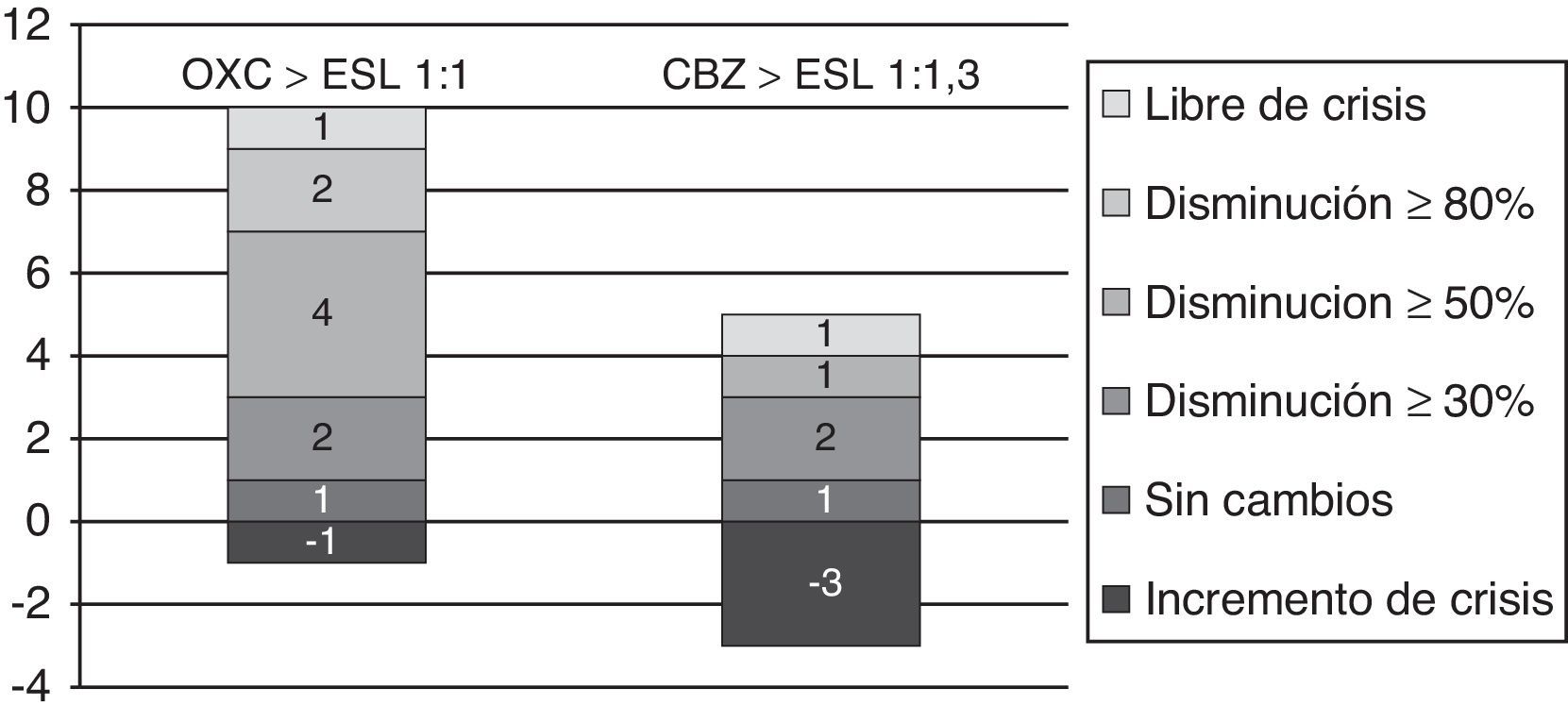
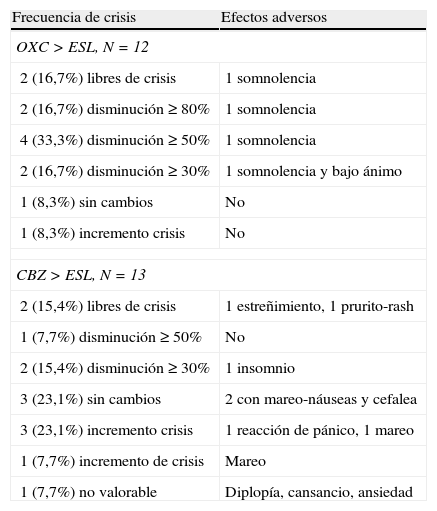
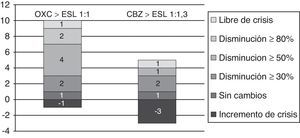
Paso de eslicarbazepina a oxcarbazepina/carbamazepinaEn 12 pacientes (19,7%), se pasó de OXC a ESL y en 13 pacientes (21,3%), de CBZ a ESL según el protocolo descrito. De todos ellos, 19 tuvieron con un seguimiento mínimo de 3 meses, en los cuales la reducción mediana de crisis/mes fue del 20% (de 2,5 [IR 1,5-8] a 2 [IR 0,5-5]; p<0,075).
Por grupos, 11 de los 12 pacientes con el cambio de OXC a ESL tuvieron un seguimiento mínimo de 3 meses; en ellos, la reducción mediana de crisis/mes fue del 66,7% (de 1,5 [IR 1,5-8] a 0,5 [IR 0,5-4,5]; p=0,017), de los cuales uno (9%) quedó libre de crisis, 2 (18%) presentaron una disminución ≥ 80% en el número de crisis, 4 (36,4%) una disminución ≥ 50%, uno (9%) no presentó cambios y otro (9%) presentó un aumento en la frecuencia de crisis.
Igualmente, en 8 de los 13 pacientes en que se realizó el cambio de CBZ a ESL hubo un seguimiento superior a 3 meses; en ellos, la mediana de crisis/mes se incrementó un 33,3% (de 2,25 [1,25-5,38] a 3 [1,25-26,5]; p=0,93), de los cuales un paciente (12,5%) permanece libre de crisis, otro (12,5%) presentó una reducción ≥ 50% en el número de crisis, uno (12,5%) no presentó cambios y 3 (37,5%) presentaron un incremento en la frecuencia de crisis (véase la figura 6).
Con el cambio, mostraron EA 4 de los pacientes que tomaban OXC (todos somnolencia y uno además síntomas depresivos) y 9 de los que tomaban CBZ (4 mareo y náuseas, 2 ansiedad, uno insomnio, uno estreñimiento y otro rash pruriginoso); 69,2% vs. 33%, respectivamente (OR 4,5; IC del 95%, 0,84-24,18; p=0,073). En todos los casos, los EA fueron transitorios. Por otro lado, 2 pacientes refirieron mejoría de los EA que tenían con OXC (mareo y somnolencia) al pasar a ESL (véase la tabla 2).
Variación en la frecuencia de crisis al pasar de CBZ/OXC a ESL con equivalencia de dosis de 1:1,3/1:1mg en el total de los pacientes y aparición de EA
| Frecuencia de crisis | Efectos adversos |
| OXC > ESL, N = 12 | |
| 2 (16,7%) libres de crisis | 1 somnolencia |
| 2 (16,7%) disminución ≥ 80% | 1 somnolencia |
| 4 (33,3%) disminución ≥ 50% | 1 somnolencia |
| 2 (16,7%) disminución ≥ 30% | 1 somnolencia y bajo ánimo |
| 1 (8,3%) sin cambios | No |
| 1 (8,3%) incremento crisis | No |
| CBZ > ESL, N = 13 | |
| 2 (15,4%) libres de crisis | 1 estreñimiento, 1 prurito-rash |
| 1 (7,7%) disminución ≥ 50% | No |
| 2 (15,4%) disminución ≥ 30% | 1 insomnio |
| 3 (23,1%) sin cambios | 2 con mareo-náuseas y cefalea |
| 3 (23,1%) incremento crisis | 1 reacción de pánico, 1 mareo |
| 1 (7,7%) incremento de crisis | Mareo |
| 1 (7,7%) no valorable | Diplopía, cansancio, ansiedad |
La tasa de retención con el paso de OXC a ESL (seguimiento medio 5,25 ± 2,3) fue del 100% y con el paso de CBZ a ESL (seguimiento medio 3,96 ± 3,02) del 69,2% (OR 1,4; IC del 95%, 1,01-2,08; p=0,096). Las diferencias entre los periodos de seguimiento entre estos 2 grupos y respecto al total de pacientes no fueron estadísticamente significativas.
DiscusiónEste estudio muestra un porcentaje elevado de reducción y libertad de crisis (63,6% y 12,5%, respectivamente) en el periodo inicial de tratamiento con ESL como tratamiento adyuvante en epilepsias focales farmacorresistentes de distintas etiologías. Esto no permite descartar un posterior empeoramiento por adquisición de tolerancia al fármaco, aunque los datos de los estudios de extensión muestran resultados similares, con una reducción en la frecuencia de crisis en un 40,6-58% de los pacientes al año de seguimiento7-9. Se debe mencionar como limitación del estudio que la definición de libertad de crisis empleada se refiere a pacientes sin crisis durante un periodo superior a 3 meses y con una frecuencia durante todo el año previo superior a una crisis/mes. El limitado periodo de seguimiento no permite, sin embargo, descartar recurrencias en un periodo superior a un año como también exige la definición oficial de la ILAE13.
Además, a raíz de lo observado en casos puntuales fuera de indicación, parece constatarse un comportamiento similar a la CBZ, con empeoramiento en epilepsias idiopáticas con crisis de ausencia y mioclónicas. También hubo incremento en la frecuencia de crisis en un paciente con ADNFLE17.
Los EA fueron mayoritariamente leves o moderados, así como transitorios, durante la fase de titulación y en función de las dosis de ESL alcanzadas. De forma similar a lo descrito en los estudios de autorización, los EA más frecuentes fueron inestabilidad-mareos (34,4%) y somnolencia (11,5%). En lo referente a otros EA registrados, como insomnio (4,9%), ansiedad (4,9%) y bajo estado de ánimo (4,9%)6-9, consideramos necesario precisar que en los estudios de fase abierta los pacientes presentaron una mejoría significativa en los ítems de depresión, calidad de vida y función cognitiva de las escalas de Montgomery-Asberg y QOLIE-3112,18-21, y que en nuestro estudio no se han aplicado ninguna de estas escalas. También registramos 2 casos de reacciones alérgicas exantemáticas, uno de ellos en una paciente que previamente tomaba CBZ22. La tasa de retirada por EA (AAAT) fue del 9,8%, la cual se encuadraría en el límite alto de los estudios de extensión, en los que varió entre el 3,5 y el 11,4%7-9.
A pesar de la muy baja frecuencia de hiponatremia en los estudios pivotales y de observación abierta a largo plazo4,5,10-12,23,24, en nuestro estudio observamos una disminución de la concentración de sodio en el 6,6% de nuestros pacientes, aunque ninguna inferior a 125mmol/l. No fue, por lo tanto, motivo de retirada, excepto en un caso en que se asoció a mareos e inestabilidad. Además, hubo un paciente que mostró una normalización de la concentración de sodio al pasar OXC a ESL. Aunque estas hiponatremias raramente sean clínicamente relevantes, igual que con la CBZ y OXC, son recomendables controles analíticos.
La ESL puede ser eficaz en casos de resistencia a FAE con mecanismo de acción similar sobre los CSDV, ya que los CSDV de dichos pacientes pueden tener subunidades proteicas alteradas y, por tanto, una sensibilidad disminuida a algunos FAE concretos25. En estos pacientes es posible que los CSDV respondan mejor a diferentes antagonistas de dichos canales, como la ESL. Existen también indicios, en modelo murino, de que la ESL retrasa la aparición de la activación inducida o propagada (kindling)26, que es un efecto que no se produce con la CBZ. En lo referente al paso desde CBZ y OXC, a pesar del bajo número de pacientes analizados, observamos una significativa mejoría en el control de crisis y una menor aparición de EA en el cambio desde OXC a ESL. Así pues, los datos aquí presentados son de importancia práctica, ya que muestran que la transición directa en una noche de ESL a OXC en una proporción de 1:1 puede ser beneficiosa. A pesar de que la ESL tiene una vida media de 20-24h y se requieren 4-5 días para conseguir dosis estables de sus metabolitos en sangre, al conmutar desde OXC la concentración total de MHD (S + R-licarbacepina) no cambia, de forma que no hay que temer una pérdida significativa de eficacia. Además, la mayor proporción de S-licarbazepina, la cual presenta una paso a través de la barrera hematoencefálica de 2:1 respecto la R-licarbazepina, conlleva una potencial mayor eficacia10. Además, hubo 2 casos de mejoría de EA (mareo y somnolencia) al pasar de OXC a ESL. Esto último puede estar relacionado con la evidencia que la OXC no metabolizada, que alcanza aproximadamente un 20% de las dosis en sangre, es más neurotóxica que la ESL o la CBZ27,28.
En cambio, con la conversión desde CBZ a equivalencia 1:1,3 no se observó una mejoría significativa. Esto puede deberse a las diferencias existentes en el metabolismo de la CBZ y la ESL (especialmente respecto al metabolismo oxidativo de la CBZ, que genera un metabolito epóxido frente a la conjugación enzimática en el caso de ESL).
Además, sorprendentemente, hemos observado un mayor número de EA al pasar de CBZ a ESL, a pesar de la teórica reducción de los metabolitos tóxicos epóxido.
La tasa de retención final de los pacientes con ESL fue elevada (75,4%), siendo del 100% en los pacientes que previamente tomaban OXC y del 69,2% de los que previamente tomaban CBZ.
A pesar de que la analogía de las estructuras químicas y los mecanismos de bloqueo sobre los CSDV indican que el cambio de CBZ/OXC a ESL puede realizarse por transición directa en una noche, este paso no ha sido estudiado de forma aleatorizada comparando una transición gradual en una semana con una rápida en una noche. En este sentido, existen incertezas respecto a qué grupos de pacientes tratados con CBZ podrían beneficiarse de un paso abrupto y cuáles no, especialmente en pacientes tratados en politerapia. Un elemento relevante es el grado variable de autoinducción entre paciente y paciente en el tratamiento crónico con CBZ. Esto puede ocasionar que un paso rápido provoque EA en el grupo con autoinducción aumentada con la consiguiente reducción de tolerabilidad y podría explicar parcialmente la menor tasa de retención en el paso de CBZ a ESL observada en nuestra muestra.
Otro aspecto que no ha sido evaluado específicamente es la seguridad de este paso rápido. Como ha sido discutido previamente, la ESL necesita 4-5 días hasta alcanzar dosis terapéuticas, por lo que una suspensión abrupta de CBZ podría teóricamente suponer una pérdida de protección durante 24-48h. No obstante, la suma del efecto de los metabolitos de CBZ en reducción podría sumarse a los MDH (S + R-licarbacepina) en ascenso sin significar una pérdida de eficacia, como se observa en el paso de CBZ a OXC. En este estudio, el menor tiempo de seguimiento y retención observados en los pacientes con paso de CBZ ha sido también en parte debido a un mayor número de suspensiones por incremento de crisis; sin embargo, estos aspectos deberían ser específicamente estudiados en otro trabajo, ya que escapa a los objetivos de este estudio.
Algunos de nuestros pacientes fueron tratados con dosis superiores a las recomendadas según la ficha técnica bajo la premisa que, siempre que haya una buena tolerancia, la administración de una dosis más alta no es solo posible, sino deseable si se quiere conseguir la libertad de crisis en epilepsias particularmente farmacorresistentes. Igualmente, a pesar de que por motivos de comodidad es interesante administrar una única dosis diaria, la distribución en 2 dosis diarias es razonable por motivos de compatibilidad con otros FAE, así como adelantar la toma en casos puntuales de insomnio.
En cuanto a los FAE asociados a ESL, parece presentar un buen perfil de EA el LEV, mientas que el PB, VPA así como FAE de mecanismo de acción similar sobre los CSDV, como la LCS o LTG, presentaron mayor frecuencia de EA de tipo inestabilidad, mareo y náuseas.
En conclusión, en nuestra experiencia preliminar con ELS en pacientes farmacorresistentes, destacamos una disminución relevante en la frecuencia de crisis y un buen perfil de tolerancia, con EA en función de las dosis y los mecanismos de acción de los FAE adyuvantes. Los decrementos de los niveles de sodio en sangre fueron leves, teniendo que prestar especial atención a la aparición de reacciones cutáneas. Constatamos como seguro y eficaz el cambio directo en una noche a dosis equivalentes o algo menores de OXC, pero observamos en comparación una menor eficacia y mayor dificultad al cambiar desde CBZ, lo cual podría hacer recomendable un paso más progresivo. No recomendamos la asociación de ESL con FAE de perfil similar, como la LCS o LTG, por una mayor frecuencia de aparición de EA, mientras que la asociación con LEV parece beneficiosa en este aspecto.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Este artículo ha sido presentado en forma de comunicación oral en la LXIII Reunión Anual de la Sociedad Española de Neurología y no ha recibido financiación por parte de organismos públicos ni entidades privadas.