El concepto de demencia mixta (DMix) se refiere a la demencia por enfermedad de Alzheimer (EA) y la presencia de enfermedad vascular cerebral (EVC). El objetivo del estudio fue identificar los factores clínicos e imagenológicos asociados a la DMix en comparación con la enfermedad de Alzheimer.
Material y métodosEstudio transversal que incluyó a 225 sujetos de 65 años y más, en la clínica de memoria de un hospital de tercer nivel de la Ciudad de México. A todos los pacientes se les realizó una evaluación clínica, neuropsicológica y una imagen cerebral. Se incluyó a pacientes con diagnóstico de DMix y EA. Se realizó un análisis multivariado para determinar factores de asociación a la DMix.
ResultadosSe estudió a 137 sujetos con DMix. En comparación con los pacientes con EA, en los pacientes con DMix los factores asociados fueron mayor edad, diabetes, hipertensión y dislipidemia, así como antecedente de EVC, p<0,05. El análisis multivariado mostró que la hipertensión (OR 1,92, IC: 1,.62-28.82, p<0,05), la enfermedad de sustancia blanca (OR 3,61, IC: 8,55-159,80, p<0,05) e infartos lacunares (OR 3,35, IC: 1,97-412,34, p<0,05) estuvieron asociados a la DMix, mientras que la historia de depresión resuelta tuvo una asociación inversa (OR 0,11, IC: 0,02-0,47, p<0,05).
ConclusionesLa DMix podría ser más frecuente que la EA. Factores de riesgo como la edad avanzada y otros potencialmente modificables se relacionaron con esta forma de demencia. Es necesario conocer y definir a la DMix.
Mixed dementia (DMix) refers to dementia resulting from Alzheimer disease in addition to cerebrovascular disease. The study objectives were to determine the clinical and imaging factors associated with Dmix and compare them to those associated with Alzheimer disease.
Material and methodsCross-sectional study including 225 subjects aged 65 years and over from a memory clinic in a tertiary hospital in Mexico City. All patients underwent clinical, neuropsychological, and brain imaging studies. We included patients diagnosed with DMix or Alzheimer disease (AD). A multivariate analysis was used to determine factors associated with DMix.
ResultsWe studied 137 subjects diagnosed with Dmix. Compared to patients with AD, Dmix patients were older and more likely to present diabetes, hypertension, dyslipidaemia, and history of cerebrovascular disease (P<.05). The multivariate analysis showed that hypertension (OR 1.92, CI 1.62-28.82; P=.009), white matter disease (OR 3.61, CI 8.55-159.80; P<.001), and lacunar infarcts (OR 3.35, CI 1.97-412.34; P=.014) were associated with Dmix, whereas a history of successfully treated depression showed an inverse association (OR 0.11, CI 0.02-0-47; P=.004)
ConclusionsDMix may be more frequent than AD. Risk factors such as advanced age and other potentially modifiable factors were associated with this type of dementia. Clinicians should understand and be able to define Dmix.
La enfermedad de Alzheimer (EA) es la principal causa de demencia a nivel mundial, ya que representa entre el 50 y el 56% de todos los casos. La EA combinada con enfermedad vascular cerebral (EVC) se ha denominado demencia mixta (DMix) (componente cortical y subcortical) y representa entre el 13 y el 17% de los casos a nivel mundial1. En general, tanto la EA como el deterioro cognitivo vascular están fuertemente relacionados con la edad2.
Una revisión de estudios epidemiológicos ha estimado un prevalencia de DMix en un rango entre el 20 y el 40%3. En series de estudios post mortem de demencia, se observó que el 38% de los casos con EA presentaban infartos lacunares4. Es posible que en un futuro identifiquemos menos formas «puras» de demencia, tomando en cuenta que la presencia de algunas enfermedades en el anciano desempeña un papel fundamental en la patogénesis de la demencia. Algunos estudios han demostrado que la combinación de componentes degenerativos y factores de riesgo cardiovascular es la causa más común de deterioro cognitivo en la vejez2,5.
Otros autores han descrito como «demencia mixta» la combinación patogénica de al menos 2 tipos diferentes de demencia (EA, demencia vascular, demencia por cuerpos de Lewy, degeneración lobar frontotemporal, etc.). De manera predominante, se ha considerado la DMix a la combinación, confirmada por estudio histopatológico, de características de la EA (placas seniles por depósito β-amiloide) con lesiones vasculares cerebrales (isquémicas y/o hemorrágicas); sin embargo, tanto el diagnóstico, como su distinción de otras condiciones, aún resulta controversial6.
Clínicamente, la pérdida de memoria, especialmente episódica y semántica, ha sido considerada característica de la EA, mientras que el deterioro en las funciones ejecutivas se ha observado en el deterioro cognitivo vascular. Es por este motivo que el Grupo de Trabajo de la American Heart Association, en conjunto con la American Stroke Association, recomienda una evaluación neuropsicológica completa en la que se incluyan todos los dominios para poder determinar las funciones cognitivas deterioradas y de esta forma caracterizar el tipo de demencia7. Sin embargo, en el caso de la DMix, no se conoce con certeza el perfil cognitivo. La literatura médica sobre la DMix aún es limitada, ya que no existen consensos ni criterios diagnósticos bien establecidos. El objetivo de nuestro estudio fue identificar los factores clínicos e imagenológicos asociados a la DMix, en comparación con la EA.
MetodologíaEstudio retrospectivo realizado durante el periodo de enero del 2010 a septiembre del 2014 en una Clínica de Memoria de un hospital público de tercer nivel en la ciudad de México, que proporciona atención a pacientes ambulatorios referidos por otros especialistas con problemas de memoria. Se incluyó a pacientes con diagnóstico de EA y DMix. El diagnóstico fue realizado por un neurólogo y/o geriatra sobre la base de los criterios de NINCDS-ADRDA8 para la EA probable. El diagnóstico de DMix se estableció a través de la definición de EA posible8, con evidencia imagenológica de enfermedad vascular (gran o pequeño vaso) y un perfil cognitivo cortical y subcortical por pruebas neuropsicológicas. Para determinar el perfil cognoscitivo, todos los sujetos fueron evaluados por una neuropsicóloga experta en el diagnóstico de ambas entidades.
Los criterios de exclusión fueron: sujetos con otro tipo de demencia o con evaluación incompleta, depresión u otro trastorno psiquiátrico, así como enfermedades metabólicas descompensadas.
La evaluación neuropsicológica y funcional consistió en aplicar el Examen Mínimo del Estado Mental (Mini-Mental State Estatement)9, prueba del reloj10, fluidez semántica (evaluación de la función de lóbulos temporales) y fonológica (evaluación de la función de los lóbulos frontales); también se cuantificaron intrusiones y perseveraciones. Se incluyó la prueba de las Cinco palabras para evaluar la memoria episódica verbal mediante el aprendizaje abierto y controlado de 5 palabras con sus respectivas categorías semánticas, y el recuerdo a largo plazo. Esto permite identificar alteraciones en cada una de las fases de la memoria episódica: aprendizaje, almacén y recuperación11,12, y la Batería de evaluación frontal (Frontal Assessment Battery)13.
Para evaluar la funcionalidad se utilizó el índice de Katz14 para actividades básicas de la vida diaria (alimentación, vestido, continencia de esfínteres, uso de sanitario, baño, traslado en casa), índice de Lawton-Brody15 para actividades instrumentales de la vida diaria (finanzas, compras, uso de transporte, lavado de ropa, cocina, actividades domésticas, uso de teléfono y autoadministración de medicamentos). Todos aquellos sujetos con pérdida de al menos una de las 6 funciones básicas y/o una de las actividades instrumentadas por alteración cognitiva, apoyo el diagnóstico de demencia. De los archivos clínicos se obtuvieron las características sociodemográficas y factores de riesgo. Considerando importantes para la descripción de la muestra de estudio el género, la edad, la escolaridad y el nivel de educación medido en años, la presencia o ausencia de hipertensión arterial (HTA) de diabetes mellitus (DM), dislipidemia, EVC y cardiopatías, así como historia de depresión, de consumo de alcohol y tabaco documentada y/o diagnosticada por un especialista en Geriatría. Además, se incluyeron determinaciones séricas de vitamina B12 y ácido fólico. Se consideró el punto de corte anormal de acuerdo con laboratorios del instituto donde se realizó el estudio.
Para definir las características de la imagen (atrofia, leucopatía, infartos lacunares, EVC, etc.), un neurólogo independiente revisó la tomografía computarizada (TC) y/o la imagen por resonancia magnética (IRM) cerebral (1,5 Teslas) y utilizó la denominación de la estandarización de neuroimagen para enfermedad de pequeño y gran vaso16.
Análisis estadísticoPor medio de estadística descriptiva paramétrica y no paramétrica, se analizaron las características de la muestra y se buscaron diferencias clínicas e imagenológicas. Se utilizó la prueba de la ji al cuadrado para las variables categóricas y la prueba de la T de Student y Mann-Whitney para las variables continuas, según su naturaleza. Posteriormente, se realizaron modelos de regresión logística univariado y multivariado para identificar los factores asociados a la DMix, utilizando como grupo de referencia a aquellos con el diagnóstico de EA. Se consideró un valor de significación una p<0,05. Se utilizó el paquete SPSS (SPSS Inc., Chicago, IL, versión 20.0 para Windows). El protocolo fue aprobado por el comité de Ética institucional.
ResultadosSe incluyó a 225 sujetos, 88 (39%) correspondieron a EA y 137 (61%) DMix. La media ± desviación estándar de edad fue de 82,9 ± 6,83 años. El 52% fueron mujeres, la media de escolaridad fue 9,5 ± 6,33 años.
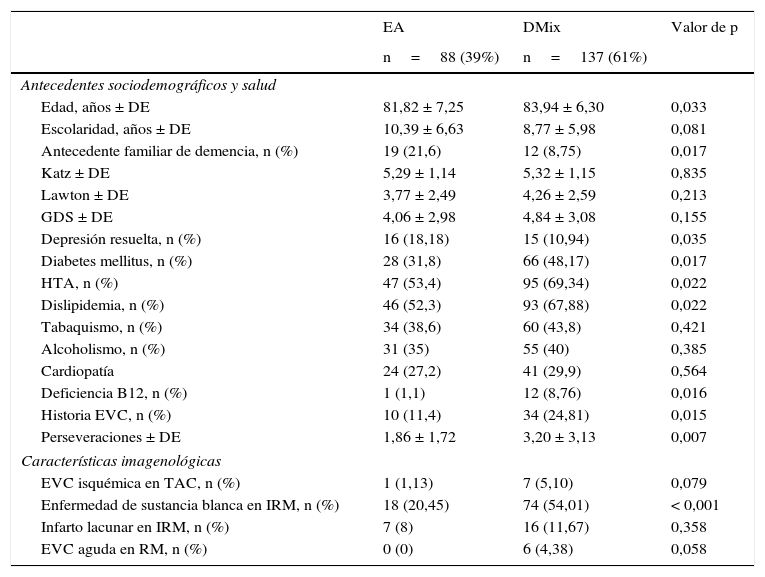
La tabla 1 muestra el análisis comparativo de las características socio-demográficas, de salud, imagen y desempeño cognoscitivo entre los participantes. El grupo con DMix tuvo mayor edad (p=0,033) y mayor frecuencia en: DM (48%; p=0,017), HTA (69%; p=0,022), dislipidemia (68%; p=0,022), deficiencia de vitamina B12 (9%; p=0,016) e historia de EVC (25%; p=0,015). El grupo con DMix tuvo menos sujetos con antecedente de demencia familiar (9%; p=0,017) y depresión resuelta (11%; p=0,035).
Características sociodemográficas, de salud, psicométricas e imagen entre grupos (EA y DMix)
| EA | DMix | Valor de p | |
|---|---|---|---|
| n=88 (39%) | n=137 (61%) | ||
| Antecedentes sociodemográficos y salud | |||
| Edad, años ± DE | 81,82 ± 7,25 | 83,94 ± 6,30 | 0,033 |
| Escolaridad, años ± DE | 10,39 ± 6,63 | 8,77 ± 5,98 | 0,081 |
| Antecedente familiar de demencia, n (%) | 19 (21,6) | 12 (8,75) | 0,017 |
| Katz ± DE | 5,29 ± 1,14 | 5,32 ± 1,15 | 0,835 |
| Lawton ± DE | 3,77 ± 2,49 | 4,26 ± 2,59 | 0,213 |
| GDS ± DE | 4,06 ± 2,98 | 4,84 ± 3,08 | 0,155 |
| Depresión resuelta, n (%) | 16 (18,18) | 15 (10,94) | 0,035 |
| Diabetes mellitus, n (%) | 28 (31,8) | 66 (48,17) | 0,017 |
| HTA, n (%) | 47 (53,4) | 95 (69,34) | 0,022 |
| Dislipidemia, n (%) | 46 (52,3) | 93 (67,88) | 0,022 |
| Tabaquismo, n (%) | 34 (38,6) | 60 (43,8) | 0,421 |
| Alcoholismo, n (%) | 31 (35) | 55 (40) | 0,385 |
| Cardiopatía | 24 (27,2) | 41 (29,9) | 0,564 |
| Deficiencia B12, n (%) | 1 (1,1) | 12 (8,76) | 0,016 |
| Historia EVC, n (%) | 10 (11,4) | 34 (24,81) | 0,015 |
| Perseveraciones ± DE | 1,86 ± 1,72 | 3,20 ± 3,13 | 0,007 |
| Características imagenológicas | |||
| EVC isquémica en TAC, n (%) | 1 (1,13) | 7 (5,10) | 0,079 |
| Enfermedad de sustancia blanca en IRM, n (%) | 18 (20,45) | 74 (54,01) | < 0,001 |
| Infarto lacunar en IRM, n (%) | 7 (8) | 16 (11,67) | 0,358 |
| EVC aguda en RM, n (%) | 0 (0) | 6 (4,38) | 0,058 |
CV: cardiovascular; EA: enfermedad de Alzheimer; EVC: enfermedad vascular cerebral; DE: desviación estándar; DMix: demencia mixta; HTA: hipertensión arterial; IRM: imagen por resonancia magnética; TC: tomografía computarizada.
Con respecto a los hallazgos por imagen, los sujetos con DMix mostraron mayor prevalencia de infartos previos (p=0,079) y enfermedad de sustancia blanca (p<0,001).
En la evaluación neurocognoscitiva global se observó mayor número de perseveraciones (3,2 vs. 1,86, p=0,007) en el grupo DMix vs. EA.
Respecto a las características sociodemográficas y otros factores de riesgo, no se observaron diferencias entre grupos (sexo, escolaridad, estado civil, historia de tabaquismo, etilismo o enfermedad cardiovascular).
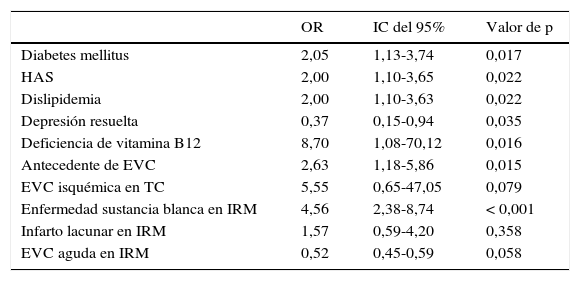
En la tabla 2 se muestra el análisis univariado, donde la deficiencia de vitamina B12 (OR 8,7; IC del 95%, 1,08-70,12, p=0,016), la enfermedad de sustancia blanca (OR 4,56; IC del 95%, 2,38-8,74, p<0,001), el antecedente de EVC (OR 2,63; IC del 95%, 1,18-5,86, p=0,015), DM (OR 2,05; IC del 95%, 1,13-3,74; p=0,017), HTA (OR 2,00; IC del 95%, 1,10-3,65, p=0,022) y dislipidemia (OR 2,00; IC del 95%, 1,10-3,63, p=0,022) fueron factores asociados al diagnóstico de DMix. La depresión resuelta mostró una asociación inversa para DMix (OR 0,37; IC del 95%, 0,15-0,94, p=0,035).
Factores asociados a DMix. Análisis univariado
| OR | IC del 95% | Valor de p | |
|---|---|---|---|
| Diabetes mellitus | 2,05 | 1,13-3,74 | 0,017 |
| HAS | 2,00 | 1,10-3,65 | 0,022 |
| Dislipidemia | 2,00 | 1,10-3,63 | 0,022 |
| Depresión resuelta | 0,37 | 0,15-0,94 | 0,035 |
| Deficiencia de vitamina B12 | 8,70 | 1,08-70,12 | 0,016 |
| Antecedente de EVC | 2,63 | 1,18-5,86 | 0,015 |
| EVC isquémica en TC | 5,55 | 0,65-47,05 | 0,079 |
| Enfermedad sustancia blanca en IRM | 4,56 | 2,38-8,74 | < 0,001 |
| Infarto lacunar en IRM | 1,57 | 0,59-4,20 | 0,358 |
| EVC aguda en IRM | 0,52 | 0,45-0,59 | 0,058 |
CV: cardiovascular; EA: enfermedad de Alzheimer; EVC: enfermedad vascular cerebral; DE: desviación estándar; DMix: demencia mixta; HTA: hipertensión arterial; IRM: imagen por resonancia magnética; TC: tomografía computarizada.
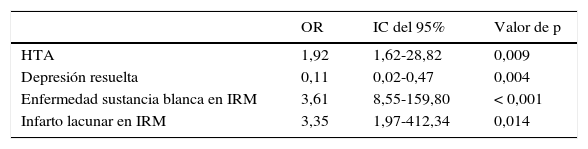
La tabla 3 muestra el análisis de regresión logística multivariado, el cual demostró que la HTA (OR 1,92, IC del 95%, 1,62-28,82; p=0,009), enfermedad de sustancia blanca observada en IRM (OR 3,61, IC del 95%, 8,55-159,80; p<0,001) e infartos lacunares observados en IRM (OR 3,35, IC del 95%, 1,97-412,34; p=0,014) conservaron su asociación en el grupo DMix. El antecedente de depresión resuelta se asoció de forma negativa para el grupo DMix, es decir, que en los sujetos que tuvieron depresión pero esta calificó como resuelta el riesgo de asociación a DMix fue menor (OR 0,11, IC del 95%, 0,02-0,47 p=0,004).
Análisis de regresión logística
| OR | IC del 95% | Valor de p | |
|---|---|---|---|
| HTA | 1,92 | 1,62-28,82 | 0,009 |
| Depresión resuelta | 0,11 | 0,02-0,47 | 0,004 |
| Enfermedad sustancia blanca en IRM | 3,61 | 8,55-159,80 | < 0,001 |
| Infarto lacunar en IRM | 3,35 | 1,97-412,34 | 0,014 |
EVC: enfermedad vascular cerebral; HTA: hipertensión arterial; IC: intervalo de confianza; IRM: imagen por resonancia magnética; OR: razón de momios, por sus iniciales en inglés.
La DMix fue la forma predominante de demencia en los sujetos estudiados, representando el 60% en comparación con la EA (40%). Estos resultados son similares a los reportados en estudios de autopsias, en los que la prevalencia de DMix se encuentra entre el 2 y el 58%, siendo más común en pacientes de edad avanzada (principalmente mayores de 80 años)6. White et al. demostraron en el Honolulu-Asia Aging Study (HAAS)5, en 363 autopsias, una baja correlación entre el diagnóstico clínico y neuropatológico de demencia; el 56% de los casos se habían diagnosticado como posible o probable EA, aunque solo el 19% mostró las lesiones morfológicas típicas; por el contrario, el 16% de los casos diagnosticados clínicamente como DMix se incrementó en un 40%, posterior a la autopsia.
La media de edad observada en los sujetos incluidos en nuestro estudio fue de 82,95 años, lo que indica que nuestra población es longeva y evidentemente propensa a presentar múltiples patologías, que pudieran influir en la fisiopatología de la demencia. El análisis mostró una diferencia estadísticamente significativa entre la edad de ambos grupos, siendo mayor en los sujetos con DMix. James et al.17 reportaron un mayor número de casos de DMix en individuos mayores de 90 años en comparación con sujetos más jóvenes, en los que predominó la EA; en este estudio, los autores indican que a edades más avanzadas la expresión patológica propia de EA queda atenuada por la participación de múltiples patologías, principalmente cardiovasculares. De acuerdo con nuestros resultados, en los que se observa la asociación de la DMix con factores de riesgo vascular, esto podría explicar la participación vascular en la patogenia del deterioro cognitivo. En relación con los factores de riesgo, observamos mayor frecuencia de DM, HTA, dislipidemia y antecedente de EVC en el grupo de DMix; de todos estos factores, la HAS mostró ser la más importante, al observarse una mayor fuerza de asociación. Unverzagt et al.18 analizaron en un estudio prospectivo, en más de 23.000 sujetos, la relación entre factores de riesgo cardiovascular y el deterioro cognitivo; en dicho estudio se observó que la presión sistólica elevada fue el único factor que mantuvo su relación con deterioro cognitivo. Otro estudio realizado por Shah et al.19 demostró la relación entre el antecedente de HTA durante la edad adulta y las concentraciones plasmáticas de β-amiloide; demostrando que la presión arterial alta se relacionó con niveles plasmáticos bajos de β-amiloide-42 y angiopatía amiloide en los estudios post morten. Jellinger et al.20 realizaron un estudio de más de 1.100 autopsias de pacientes con demencia y enfermedades crónicas o factores de riesgo vascular, como el EVC, insuficiencia cardiaca, artritis, DM, enfermedad tiroidea, HTA o dislipidemia, demostrando una asociación entre patología β-amiloide, neurofibrilar, enfermedad cerebral de pequeño vaso, angiopatía amiloide cerebral e inclusive depósitos de α-sinucleína y los factores de riesgo, especialmente en los ancianos mayores.
Un aspecto interesante en nuestro estudio es la asociación con el antecedente de deficiencia de vitamina B12, que resultó un factor asociado en el análisis univariado a DMix. Los trastornos neurológicos asociados a deficiencia de B12 ocurren entre los 40 y 90 años de edad, con un pico máximo entre los 60 y 70 años de edad21. La diabetes ha sido descrita como causa de deficiencia funcional de cobalamina en ancianos diabéticos22, como consecuencia po el uso de metformina23. La edad también representa otro factor de riesgo para su deficiencia24. Es posible que el alto porcentaje de DM (48%) en los pacientes con DMix en nuestro estudio, y en conjunto con la edad, pudiera explicar este hallazgo. Es conveniente realizar estudios longitudinales para confirmar la asociación entre la deficiencia de B12, EA y la DMix25.
Actualmente, el antecedente de la depresión de inicio tardío, o cuando esta es refractaria al tratamiento, representa un factor de riesgo para desarrollar demencia. Taylor et al. describieron la relación entre la depresión y el deterioro cognitivo; esta relación resulta de mayor importancia en la depresión durante la edad avanzada, en la que intervienen múltiples factores de riesgo cardiovascular (denominada depresión vascular). Las principales características de la depresión vascular son mayor frecuencia durante la vejez, mayor duración, poca respuesta al tratamiento farmacológico, mayor recurrencia y disfunción cognitiva, particularmente de tipo ejecutiva; la enfermedad cerebrovascular predispone, precipita o perpetúa la sintomatología depresiva, un ejemplo de esto podría ser lo observado en nuestro estudio, ya que el antecedente de depresión resuelta resultó un factor protector para DMix26.
En relación con las pruebas neuropsicológicas, se observó que el número de perseveraciones fue mayor en el grupo de DMix. La fluidez semántica (FS) y la fluidez fonológica (FF) evalúan predominantemente la memoria y las habilidades ejecutivas. La FS o categórica evalúa principalmente la función de los lóbulos temporales, mientras que la FF evalúa los lóbulos temporales y frontales, ya que requiere mayor automonitorización del individuo al evitar mencionar nombres propios, ciudades, países, números, etc., requiriendo también de la memoria de trabajo. En la EA se deterioran ambas fluideces; sin embargo, típicamente se mantiene desproporcionadamente más deteriorada la FS27,28. Los errores de tipo intrusivo suelen asociarse al campo semántico y a la memoria, por lo que es una prueba complementaria que explora la función de los lóbulos temporales; los errores perseverativos suelen asociarse a la automonitorización, la memoria de trabajo y las habilidades ejecutivas, por lo que puede ser una prueba que explore los circuitos de asociación frontosubcorticales29,30. En nuestro estudio puede observarse la combinación de estas 2 características al observarse errores intrusivos y perseverativos, estos últimos siendo claramente más frecuentes en el grupo de DMix. Este dato podría ser un indicador hacia un patrón cognitivo de etiología mixta.
Las características imagenológicas difirieron claramente entre ambos grupos, observándose enfermedad de pequeño y gran vaso, principalmente por enfermedad lacunar (pequeño vaso). La presencia de lesiones de sustancia blanca observada en la IRM cerebral demostró un riesgo 3 veces mayor para DMix en comparación con el grupo de EA. Esta contribución de la enfermedad de sustancia blanca, identificada en IRM como hiperintensidades en secuencias T2W y fluid attenuated inversion recovery (FLAIR), se ha relacionado con deterioro cognitivo e inclusive con trastorno depresivo. Así mismo, se observa con mayor frecuencia en individuos con comorbilidades como DM, dislipidemia, HTA, aterosclerosis, tabaquismo e inclusive en sujetos de edad avanzada sanos31.
Nuestro estudio tiene limitaciones, por el hecho de tratarse de una población estudiada perteneciente a un hospital de tercer nivel y con múltiples comorbilidades, lo que podría explicar la causa del alto predominio de DMix. Es necesario analizar un mayor número de sujetos y estudiar con mayor detalle, a través de pruebas neuropsicológicas validadas en el idioma español, y completar con estudios histopatológicos y/o biomarcadores. El diseño transversal de este trabajo limita la asociación causal entre los factores de riesgo y el desarrollo de demencia.
Sin embargo, el estudio tiene varias fortalezas; los estudios en relación con la DMix son pocos en comparación con los estudios dirigidos a otros tipos de demencia; en nuestro conocimiento, no existen estudios de DMix en población mexicana. Nuestros hallazgos podrían conducir a futuros estudios en los que pueda caracterizarse mejor este tipo de demencia y conocer mejor el papel de los factores de riesgo potencialmente modificables.
ConclusionesLa DMix es causa frecuente de deterioro cognitivo. El incremento de la expectativa de vida y la presencia de comorbilidad en los sujetos adultos mayores representará un reto para los sistemas de salud en el mundo. Es posible que en poblaciones con alto riesgo cardiovascular se observe con mayor frecuencia patrones cognitivos de tipo mixto. Este aspecto es muy importante, ya que la adecuada identificación de estos factores de riesgo potencialmente modificables podría permitir intervenir en una entidad sin una ruta terapéutica definitiva. Por lo tanto, necesario realizar más estudios en relación al concepto de DMix, ya que esto podría permitir conocer sus características clínicas y establecer medidas conducentes a su diagnóstico oportuno.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.