Los bloqueos anestésicos constituyen un recurso terapéutico para el manejo de distintos dolores de cabeza, de forma aislada o combinado con otros tratamientos. Sin embargo, existe una importante heterogeneidad en los patrones de uso entre los distintos profesionales.
DesarrolloA partir de una exhaustiva revisión y análisis de la bibliografía existente y de nuestra experiencia clínica se ha elaborado este documento de consenso cuyo objetivo es servir como guía para aquellos profesionales que quieran aplicar estas técnicas. Se establecen recomendaciones basadas en los niveles de evidencia que ofrecen los estudios revisados en migraña, cefaleas trigémino-autonómicas, cefalea cervicogénica y neuralgias pericraneales. Se describen los principales aspectos técnicos y formales de los diferentes procedimientos, así como las posibles reacciones adversas que pueden surgir y la actitud recomendada.
ConclusionesEl tratamiento con bloqueos anestésicos del paciente con cefalea debe ser siempre individualizado y basarse en una correcta anamnesis, exploración neurológica y ejecución técnica.
Anaesthetic block, alone or in combination with other treatments, represents a therapeutic resource for treating different types of headaches. However, there is significant heterogeneity in patterns of use among different professionals.
DevelopmentThis consensus document has been drafted after a thorough review and analysis of the existing literature and our own clinical experience. The aim of this document is to serve as guidelines for professionals applying anaesthetic blocks. Recommendations are based on the levels of evidence of published studies on migraine, trigeminal autonomic cephalalgias, cervicogenic headache, and pericranial neuralgias. We describe the main technical and formal considerations of the different procedures, the potential adverse reactions, and the recommended approach.
ConclusionAnaesthetic block in patients with headache should always be individualised and based on a thorough medical history, a complete neurological examination, and expert technical execution.
Los bloqueos anestésicos (BA) constituyen un recurso terapéutico para el manejo de distintos dolores de cabeza, de forma aislada o combinado con otros tratamientos. Hace ya varias décadas comenzaron a realizarse BA de distintos nervios craneales o cervicales en pacientes afectados por diversas cefaleas y neuralgias craneofaciales y la experiencia ha seguido acumulándose en los últimos años. Los anestésicos locales actúan inhibiendo de forma reversible la producción y la conducción del estímulo de cualquier tipo de membrana excitable, especialmente en el tejido nervioso. Cuando contactan con una fibra nerviosa, atraviesan la barrera mielínica y la membrana neuronal en forma no ionizada. Ya en el interior de la célula, se ionizan parcialmente y la fracción ionizada se une a una zona interna del canal de sodio dependiente de voltaje, bloqueando su apertura e impidiendo la iniciación y la propagación del potencial de acción. De esta forma, los anestésicos locales pueden inhibir la conducción del impulso nervioso1.
En la práctica clínica, la técnica más difundida es el bloqueo del nervio occipital mayor (NOM). Cada vez son mayores las evidencias científicas que apoyan el papel modulador de los nervios occipitales sobre las aferencias nociceptivas vehiculizadas por el trigémino. En los segmentos más altos de la médula cervical, las neuronas sensitivas correspondientes a la región occipital se imbrican con las neuronas del núcleo espinal del trigémino; desde el punto de vista funcional, existe además una convergencia de fibras cervicales y trigeminales sobre las mismas neuronas de segundo orden. Al bloquear la llegada de impulsos nociceptivos por los primeros nervios cervicales, el BA puede actuar sobre este complejo trigémino-cervical inhibiendo también la transmisión de las aferencias trigeminales2,3.
Son ya numerosas las referencias de pacientes tratados con BA en nuestra comunidad científica. Sin embargo, existe hoy en día una importante heterogeneidad en cuanto a los patrones de uso entre los diferentes profesionales. En el año 2012 se expusieron en la Reunión Anual de la Sociedad Española de Neurología (SEN) los resultados de una encuesta realizada a miembros del Grupo de Estudio de Cefaleas de la SEN (GECSEN) en relación con la práctica de esta técnica4. Existía una evidente disparidad en aspectos técnicos y formales, hecho que ha determinado la redacción de este documento.
A partir de una exhaustiva revisión y análisis de la bibliografía existente, y de nuestra experiencia clínica, se ha elaborado este documento de consenso cuyo objetivo es servir como guía para aquellos profesionales que quieran aplicar estas técnicas. Los niveles de evidencia y los grados de recomendación se han definido siguiendo los criterios de la Clasificación del Centro de Medicina basada en la evidencia de la Universidad de Oxford5. Las recomendaciones en cada tipo de cefalea y los aspectos más relevantes de cada uno de los procedimientos se han resumido en tablas para favorecer su exposición.
Aplicación de los bloqueos anestésicos en distintas cefaleasMigrañaEl primer ensayo doble ciego y controlado con placebo sobre prevención de la migraña mediante bloqueo del NOM fue el realizado por Piovesan et al.6 en una muestra de 37 pacientes que presentaban migraña episódica, con una frecuencia de ataques relativamente baja o moderada (media: 3,6 por mes; rango: 1-8). Se llevó a cabo un diseño cruzado (cross-over), programando visitas separadas por intervalos de 30 días. Uno de los grupos (n = 20) recibió bupivacaína al 0,5% en una primera sesión y placebo (suero salino) en la visita siguiente, mientras que el otro grupo (n = 17) recibió los 2 tratamientos en el orden inverso. Por tanto, ambos grupos fueron tratados con el fármaco activo, aunque en diferentes momentos. No se detectaron diferencias significativas en cuanto al número o la duración de las crisis a lo largo del estudio, pero en el primer grupo la intensidad de las crisis disminuyó en el último periodo de observación (es decir, 60 días después del BA).
En el año 2015 Ruiz Piñero et al.7 publicaron los resultados de un estudio prospectivo y abierto, no controlado, en 60 pacientes migrañosos (71,7% con migraña crónica [MC]) en los que se había ensayado algún tratamiento preventivo (siempre al menos un betabloqueante o neuromodulador). Para ser incluidos en el estudio, los pacientes debían tener sensibilidad a la palpación en el punto de emergencia de al menos un nervio occipital o supraorbitario, realizándose el BA solo en los nervios sensibles. A los 3 meses, se registró una respuesta completa (periodo libre de dolor durante un mínimo de 2 semanas) en 23 pacientes (38,3%) y parcial (reducción en un 50% de los días de dolor y/o intensidad durante un mínimo de 2 semanas) en 24 (40%). No hubo respuesta en 13 pacientes (21,7%). En el grupo con respuesta completa, la edad y el tiempo de evolución de la migraña eran significativamente inferiores. No se objetivaron efectos adversos significativos.
Ese mismo año, Inan et al.8 plantean la eficacia del BA con bupivacaína del NOM en un ensayo aleatorizado, doble ciego y controlado con placebo en 84 pacientes con MC. Se administró de forma aleatoria bien suero salino (n = 42) o bien bupivacaína (n = 42), una vez a la semana durante 4 semanas. Posteriormente, todos los pacientes fueron tratados con bupivacaína una vez al mes durante 2 meses. Acabaron el estudio un total de 72 pacientes. El bloqueo del NOM demostró ser seguro y eficaz, objetivándose una disminución significativa en el número de días de cefalea al mes, la duración y la intensidad del dolor.
Ashkenazi et al.9 analizaron si la asociación de corticoides al anestésico local podía incrementar la eficacia de los bloqueos del NOM y de las infiltraciones de los puntos gatillo musculares en pacientes con MC. En un total de 37 pacientes con más de 15 días de cefalea al mes inyectaron de forma aleatoria anestésico local (lidocaína al 2% y bupivacaína al 0,5%) con suero salino (n = 18) o con triamcinolona (n = 19). Tras el bloqueo del NOM y el tratamiento de los puntos gatillo con la solución asignada, no hubo diferencias significativas entre los parámetros clínicos de ambos grupos, ni a los 20 minutos de la intervención ni en el periodo de seguimiento de un mes. En un estudio reciente con las mismas características, Saracco et al.10 obtuvieron resultados superponibles.
En 2015, Dilli et al.11 publicaron los resultados de un ensayo aleatorizado, doble ciego y controlado con placebo en pacientes con migraña episódica (más de un ataque a la semana) y crónica que fueron tratados con 2,5 ml de bupivacaína al 0,5% y 20 mg de metilprednisolona (n = 33 pacientes) frente a placebo (2,75ml de suero salino y 0,25ml de lidocaína al 1%) (n = 30 pacientes). En la valoración posterior (4 semanas tras el procedimiento) no se encontraron diferencias significativas en ninguno de los 2 grupos en la frecuencia de días de cefalea de intensidad moderada/grave en relación con la situación basal. Sin embargo, el tamaño muestral fue reducido; se incluyó a pacientes con migraña episódica y crónica en ambos grupos, y el procedimiento tan solo se realizó una vez, frente a la periodicidad de la técnica en otros estudios. Además, en el grupo al que se asignó tratamiento con placebo se administró una cierta cantidad de anestésico.
A partir de los trabajos citados, se concluye que los bloqueos del NOM podrían tener un papel en el tratamiento preventivo de la MC, reduciendo el número, la duración o la intensidad de los ataques en las semanas o meses posteriores a la intervención (nivel de evidencia ii, grado de recomendación B)12. Por otra parte, la adición de corticoides no se ha asociado a un aumento de la eficacia de los BA en esta indicación.
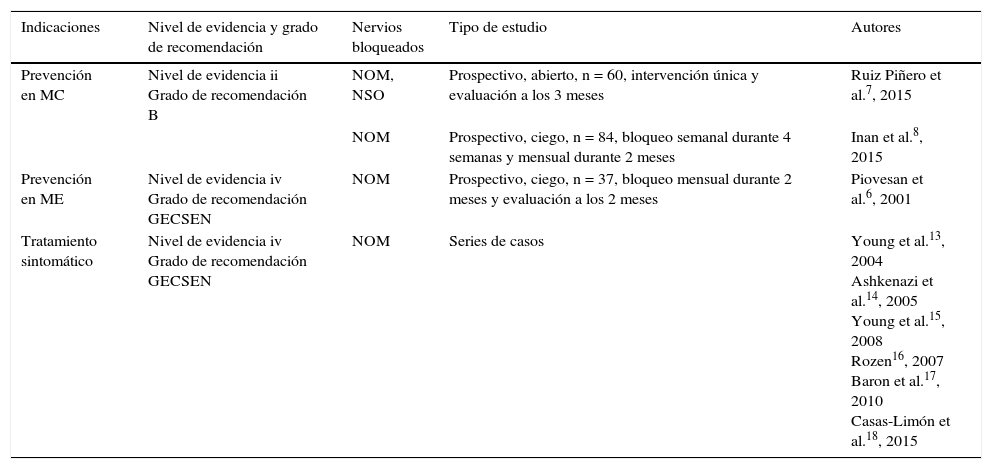
Los bloqueos del NOM parecen tener también un efecto sintomático inmediato cuando se administran durante la crisis de migraña. Se ha registrado una disminución en la intensidad del dolor, alodinia y fotofobia en un número importante de pacientes13-15. Se han comunicado también 3 casos de migraña hemipléjica y un caso de migraña de tronco en los que se consiguió una rápida supresión del aura tras el bloqueo de NOM16-18. En crisis refractarias, el bloqueo del NOM puede ser una alternativa (nivel de evidencia iv, grado de recomendación GECSEN)12. En la tabla 1 aparecen los estudios realizados en migraña y los niveles de evidencia en las distintas indicaciones.
Bloqueo anestésico en migraña
| Indicaciones | Nivel de evidencia y grado de recomendación | Nervios bloqueados | Tipo de estudio | Autores |
|---|---|---|---|---|
| Prevención en MC | Nivel de evidencia ii Grado de recomendación B | NOM, NSO | Prospectivo, abierto, n = 60, intervención única y evaluación a los 3 meses | Ruiz Piñero et al.7, 2015 |
| NOM | Prospectivo, ciego, n = 84, bloqueo semanal durante 4 semanas y mensual durante 2 meses | Inan et al.8, 2015 | ||
| Prevención en ME | Nivel de evidencia iv Grado de recomendación GECSEN | NOM | Prospectivo, ciego, n = 37, bloqueo mensual durante 2 meses y evaluación a los 2 meses | Piovesan et al.6, 2001 |
| Tratamiento sintomático | Nivel de evidencia iv Grado de recomendación GECSEN | NOM | Series de casos | Young et al.13, 2004 Ashkenazi et al.14, 2005 Young et al.15, 2008 Rozen16, 2007 Baron et al.17, 2010 Casas-Limón et al.18, 2015 |
Niveles de evidencia y grados de recomendación.
GECSEN: Grupo de Estudio de Cefaleas de la Sociedad Española de Neurología; ME: migraña episódica; MC: migraña crónica; NOM: nervio occipital mayor; NSO: nervio supraorbitario.
El bloqueo del NOM ha demostrado ser eficaz también en la cefalea en racimos (CR)18-24. Peres et al.19, en el año 2002, trataron a 14 pacientes (5 con CR crónica y 9 con CR episódica) con BA del NOM ipsilateral al dolor con 3ml de lidocaína al 1% y 40mg de triamcinolona. En 4 pacientes (28,5%) la respuesta fue buena (periodo libre de dolor mayor de 2 semanas), moderada (periodo libre de dolor inferior a 2 semanas) en 5 (35,7%) y no respondieron otros 5 pacientes (35,7%). En este último grupo, el número de ataques, la duración y la intensidad de los mismos fue menor. De forma global, la media de días sin dolor tras el procedimiento fue de 13,1 ± 23,6. No se encontraron diferencias en función del carácter crónico o episódico de la cefalea.
Ambrosini et al.20 llevaron a cabo un ensayo clínico doble ciego, inyectando de forma aleatoria una mezcla de 0,5ml de lidocaína al 2% y 2ml de betametasona (13 pacientes) o una mezcla de 0,5ml de lidocaína al 2% y 2ml de suero salino (10 pacientes). En 11 de los pacientes que recibieron corticoides (61%) los ataques se interrumpieron y la remisión se mantuvo un mínimo de 4 semanas. En cambio, los pacientes tratados con suero salino no experimentaron ningún beneficio. Posteriormente, Busch et al.21 inyectaron anestésico local de forma aislada (5ml de prilocaína al 1%) en 15 pacientes con CR, en el mismo lado del dolor. Desde el punto de vista neurofisiológico, sí pudieron comprobar una disminución de la respuesta nociceptiva del reflejo de parpadeo, pero clínicamente solo registraron un alivio parcial del dolor en 9 pacientes. En el año 2011, Leroux et al.22 realizaron un estudio aleatorizado, doble ciego y controlado con placebo en 43 pacientes con CR (15 con CR crónica y 18 con episódica) con al menos 2 ataques al día durante las 72 h previas a ser incluidos en el estudio. Fueron tratados con 3 infiltraciones suboccipitales de cortivazol 3,75mg o placebo separadas 48-72 h. Los pacientes tratados con corticoide presentaron una disminución significativa en el número de ataques, independientemente del carácter crónico o episódico de su cefalea.
Gantenbein et al.23 analizaron de forma retrospectiva en un periodo de 4 años la eficacia y la seguridad de 121 bloqueos de NOM con anestésico local y corticoide depot realizados en una muestra de 60 pacientes con CR episódica o crónica. El 80% de las infiltraciones se tradujeron en una respuesta parcial (mejoría en el número de ataques, duración e intensidad del dolor) y en un 45% la respuesta fue completa. Dicha respuesta se mantuvo una media de 3,5 semanas en los pacientes con formas crónicas y fue más prolongada en aquellos pacientes con cefalea episódica.
Finalmente, Lambru et al.24 recogieron de forma prospectiva y abierta la eficacia del BA del NOM ipsilateral al dolor en una muestra de 83 pacientes con CR crónica (4 ataques al día [rango: 1-12] y un tiempo de evolución de nueve años [rango: 3-69]). Se administró una solución de 2ml de lidocaína al 2% y 80mg de metilprednisolona cada 3 meses. Tras el primer bloqueo registraron una respuesta completa (ausencia de dolor durante al menos 7 días) en el 42% de los pacientes y parcial (reducción ≥ 50% en intensidad y/o frecuencia del dolor durante un mínimo de 7 días) en el 15% con una duración media de 21 días (rango: 7-504 días). El 6% de los pacientes empeoraron inmediatamente después del tratamiento. En el grupo de pacientes con respuesta completa (n = 37), 26 permanecieron sin dolor en el día 15, 12 continuaron asintomáticos en el día 30 y 2 pacientes mantuvieron respuesta en el día 90. Los resultados obtenidos fueron similares tras el segundo, tercer y cuarto bloqueos. No se registraron reacciones adversas significativas.
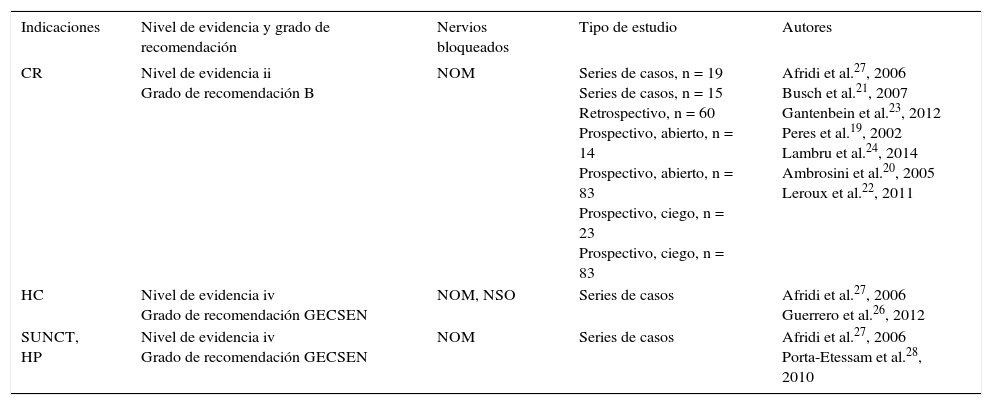
De todo lo revisado (tabla 2) podemos concluir que el BA del NOM es una técnica eficaz en la CR (nivel de evidencia ii, grado de recomendación B). De forma habitual, los estudios publicados hasta la fecha han asociado corticoide (triamcinolona, betametasona, metilprednisolona) al anestésico local25.
Bloqueo anestésico en cefaleas trigémino-autonómicas
| Indicaciones | Nivel de evidencia y grado de recomendación | Nervios bloqueados | Tipo de estudio | Autores |
|---|---|---|---|---|
| CR | Nivel de evidencia ii Grado de recomendación B | NOM | Series de casos, n = 19 Series de casos, n = 15 Retrospectivo, n = 60 Prospectivo, abierto, n = 14 Prospectivo, abierto, n = 83 Prospectivo, ciego, n = 23 Prospectivo, ciego, n = 83 | Afridi et al.27, 2006 Busch et al.21, 2007 Gantenbein et al.23, 2012 Peres et al.19, 2002 Lambru et al.24, 2014 Ambrosini et al.20, 2005 Leroux et al.22, 2011 |
| HC | Nivel de evidencia iv Grado de recomendación GECSEN | NOM, NSO | Series de casos | Afridi et al.27, 2006 Guerrero et al.26, 2012 |
| SUNCT, HP | Nivel de evidencia iv Grado de recomendación GECSEN | NOM | Series de casos | Afridi et al.27, 2006 Porta-Etessam et al.28, 2010 |
Niveles de evidencia y grados de recomendación.
CR: cefalea en racimos; GECSEN: Grupo de Estudio de Cefaleas de la Sociedad Española de Neurología; HC: hemicránea continua; HP: hemicránea paroxística; NOM: nervio occipital mayor; NSO: nervio supraorbitario; SUNCT: cefalea neuralgiforme unilateral de breve duración.
En relación con las otras cefaleas trigémino-autonómicas, Guerrero et al.26 valoraron en un estudio prospectivo y abierto la eficacia del BA del NOM (2ml de bupivacaína al 0,5% y mepivacaína al 2%, ratio 1:1) y del nervio supraorbitario (NSO) (0,5ml de la misma solución activa), de forma aislada, combinada o asociada a la infiltración de la tróclea con 4mg de triamcinolona en 9 pacientes con hemicránea continua e intolerancia a la indometacina. Todos los pacientes tenían sensibilidad a la palpación en al menos uno de los territorios señalados. En 5 pacientes el dolor remitió por completo, siendo la respuesta parcial en los 4 restantes. El alivio del dolor comenzaba inmediatamente después de finalizar el procedimiento y la respuesta se mantuvo una media de 2-10 meses. Se ha comunicado también una respuesta positiva en hemicránea paroxística27 y cefalea neuralgiforme unilateral de breve duración27,28.
Cefalea cervicogénicaLa convergencia de estímulos nociceptivos procedentes de músculos interespinosos, articulaciones facetarias y discos intervertebrales con los derivados del trigémino en el complejo trigémino-cervical es el sustrato biológico de la cefalea cervicogénica (CC). El BA de los nervios occipitales es también una técnica habitual en el manejo de esta cefalea. En varios estudios observacionales se han realizado bloqueos con anestésico asociado o no a corticoide, registrándose respuestas favorables en más del 70% de los casos29-31. El alivio de la cefalea se hace ya patente en los primeros minutos, lo que puede apoyar el diagnóstico de CC. Naja et al.32 pudieron demostrar su eficacia en un ensayo doble ciego, controlado y aleatorizado, con un seguimiento de 2 semanas. Además, en un estudio abierto, los mismos autores comprobaron que las inyecciones repetidas con fármaco activo podían conseguir periodos de remisión más prolongados33. En una serie de 28 pacientes con CC, Inan et al.34 comprobaron que el efecto terapéutico obtenido mediante el BA del NOM era similar al que se lograba bloqueando directamente los nervios C2-C3.
Recientemente, Lauretti et al.35 han comparado la técnica clásica de bloqueo del NOM (40mg de lidocaína y 10mg de dexametasona) con una técnica de bloqueo subcompartimental (40mg de lidocaína, 10mg de dexametasona, contraste iodado no iónico y solución salina) bajo fluoroscopia en 30 pacientes, que aleatoriamente fueron distribuidos en 3 grupos (n = 10) utilizando 5, 10 o 15ml de la solución final. El periodo libre de dolor fue mayor cuando se realizó un bloqueo subcompartimental (24 semanas) frente a la técnica clásica (2 semanas). No se objetivaron diferencias significativas entre grupos en función del volumen administrado.
De todo ello se deduce que el BA occipital produce una abolición inmediata del dolor en estos pacientes y que el procedimiento se puede seguir de un periodo de remisión más o menos prolongado36 (nivel de evidencia ii, grado de recomendación B).
Neuralgia occipital y otras neuralgias pericranealesSegún los criterios diagnósticos de la Sociedad Internacional de Cefaleas (Headache Classification Subcommittee of the International Headache Society, 201337), la neuralgia occipital debe responder, al menos temporalmente, al bloqueo del NOM, por lo que esta técnica es, en este caso, diagnóstica y terapéutica. En 2 estudios retrospectivos se recogieron tasas de respuesta en torno al 85% con una duración media del efecto de 1-2 meses38,39. La anterior Clasificación Internacional de Cefaleas del 200440 reconocía como entidades nosológicas la neuralgia del NSO, del nervio nasociliar y de otras ramas terminales del trigémino, en cuyos criterios diagnósticos figuraba la abolición del dolor con el BA. A pesar de su controvertida ausencia en la última clasificación, es evidente su presencia en la práctica clínica habitual. El BA de estos41,42 y otros nervios pericraneales (supratroclear43, lagrimal44,45, infratroclear46,47, infraorbitario48 y auriculotemporal49) ha demostrado ser eficaz pero requiere una delicada exploración de sus puntos de emergencia y un riguroso conocimiento de su distribución anatómica.
Otras cefaleasCon una casuística menor, se ha descrito una respuesta favorable al BA en la cefalea primaria asociada con actividad sexual, la cefalea pospunción (CPP) y la cefalea postraumática (CPT). Selekler et al.50 publican un caso de cefalea orgásmica con respuesta al bloqueo occipital con 20mg de prilocaína y 125mg de metilprednisolona. En relación con la CPP, Matute et al.51 describieron a 2 pacientes con respuesta inmediata tras la infiltración bilateral de ambos NOM con 4ml de bupivacaína al 0,25% y 20mg de triamcinolona. Dos años más tarde, Takmaz et al.52 publicaron la remisión del dolor a los 2 minutos de la infiltración de ambos nervios occipitales con 2ml de bupivacaína al 0,5% en otro paciente. Naja et al.53 realizaron un estudio prospectivo y ciego simple en 50 pacientes con CPP, comparando el bloqueo bilateral de los nervios occipitales mayor y menor con una solución de 10ml de lidocaína al 2%, lidocaína al 2% con epinefrina (1:200.000), bupivacaína 0,5%, fentanilo y clonidina frente al tratamiento convencional, esto es, reposo en cama, hidratación y analgesia. El 68,4% de los pacientes presentaron un alivio completo del dolor tras uno o 2 bloqueos. De forma global, en este grupo objetivaron además una disminución en la puntuación en la escala visual analógica (EVA), en el consumo de analgésicos y en el número de días de estancia hospitalaria.
En el estudio de Niraj et al.54, realizado con 24 pacientes con CPP en los que había fracasado el tratamiento conservador, el 66% de los tratados con infiltración bilateral occipital con dexametasona tuvieron una respuesta completa y el 33% una respuesta parcial. El trabajo más reciente es de Akyol et al.55, realizado en 21 pacientes con CPP que no habían respondido al tratamiento analgésico convencional durante 48 h. En todos ellos se llevó a cabo un bloqueo bilateral de ambos nervios occipitales con 4ml de levobupivacaína al 0,25%. A las 24 h del procedimiento, todos los pacientes con una puntuación previa en la EVA de 4-6 (n = 12) y tan solo un paciente del grupo con una EVA de 7-9 (n = 9) pasaron a una EVA de 1. En este segundo brazo, la puntuación media en dicha escala fue de 5,56.
Aunque Saadah y Taylor56 solo obtuvieron una tasa de respuesta del 9% en sus pacientes con CPT, algunos autores han comunicado buenos resultados del bloqueo del NOM en este tipo de cefalea. Gawel y Rothbart57, al revisar su serie de 87 pacientes con CPT de características migrañosas, comprobaron que un 72% se había encontrado significativamente mejor después de uno o varios bloqueos del NOM con lidocaína y metilprednisolona. Hecht58 analizó de forma retrospectiva la respuesta al BA con bupivacaína al 0,5% en 10 pacientes con CPT cuya palpación del NOM reproducía el dolor. En 8 de sus pacientes (80%) obtuvo una buena respuesta y los otros 2 (20%) mostraron respuestas parciales. Por su parte, Tobin y Flitman39 bloquearon ambos NOM en 12 pacientes con síndrome postraumático utilizando una mezcla de 1,5ml de bupivacaína y 60mg de metilprednisolona. Todos los pacientes mejoraron tras la inyección, con un descenso global del dolor del 86% y una duración media del efecto de 4,4 semanas.
Técnicas de bloqueo anestésicoConsideraciones generalesLos anestésicos locales son fármacos capaces de interrumpir de manera reversible la conducción del impulso nervioso mediante el bloqueo de los canales de sodio dependientes de voltaje. Su fracción no ionizada, liposoluble, es la que accede al interior del axón y condiciona el tiempo de latencia. Su mecanismo de acción, sin embargo, depende de la fracción ionizada. La asociación con un fármaco vasoconstrictor (epinefrina) reduce la absorción sistémica del anestésico; sin embargo, no es recomendable en nuestros pacientes dicha combinación por el riesgo de necrosis tisular.
La elección de uno u otro anestésico es arbitraria. De forma habitual se utilizan las amidas lidocaína al 1 y 2% (10-20mg/ml), mepivacaína al 2% (20mg/ml) y bupivacaína al 0,25 y 0,5% (2,5-5mg/ml) de corta, media y larga duración, respectivamente, bien de forma aislada o en combinación, siendo en este caso la ratio de elección lidocaína/bupivacaína de 1:1-1:359. Durante la gestación, situación en la que el BA ha demostrado ser una opción terapéutica eficaz60, se recomienda la utilización de lidocaína (Food and Drug Administration [FDA]) categoría B) frente a bupivacaína (FDA categoría C), así como evitar su asociación con corticoides que pueden acelerar el desarrollo del pulmón fetal. Para minimizar la aparición de efectos adversos, no se debe superar la dosis de 300mg de lidocaína, 400mg de mepivacaína o 175mg de bupivacaína por sesión59,61.
La adición de corticoides debe plantearse en pacientes con CR y CC, y en aquellas otras cefaleas que no hayan respondido a la infiltración solo con anestésico local. En todo caso, los corticoides deben evitarse en los bloqueos de ramas trigeminales por el riesgo de trastornos tróficos locales. Los más empleados son triamcinolona, metilprednisolona, betametasona y dexametasona; de ellos, solo metilprednisolona tiene actividad mineralocorticoide. En la tabla 3 figuran sus principales características.
Características de los corticoides utilizados en bloqueo anestésico
| Corticoide | Equivalencia con triamcinolona 1mg (mg) | Vida media (h) | Rango de dosis en BA del NOM (mg) |
|---|---|---|---|
| Triamcinolona | 1 | 18-36 | 5-40 |
| Metilprednisolona | 1 | 18-36 | 20-160 |
| Betametasona | 0,15 | 36-54 | 18 |
| Dexametasona | 0,19 | 36-54 | 4 |
Modificado de Blumenfeld et al.59.
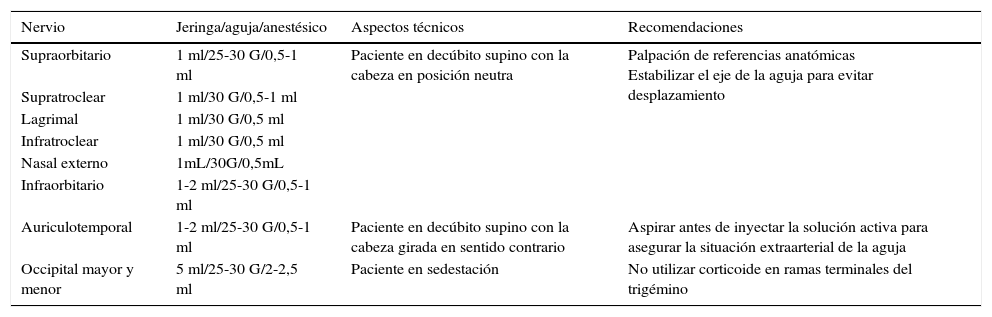
Los aspectos más relevantes de la técnica de BA en cada uno de los territorios aparecen resumidos en la tabla 4.
Principales características de las diferentes técnicas de bloqueo anestésico
| Nervio | Jeringa/aguja/anestésico | Aspectos técnicos | Recomendaciones |
|---|---|---|---|
| Supraorbitario | 1 ml/25-30 G/0,5-1 ml | Paciente en decúbito supino con la cabeza en posición neutra | Palpación de referencias anatómicas Estabilizar el eje de la aguja para evitar desplazamiento |
| Supratroclear | 1 ml/30 G/0,5-1 ml | ||
| Lagrimal | 1 ml/30 G/0,5 ml | ||
| Infratroclear | 1 ml/30 G/0,5 ml | ||
| Nasal externo | 1mL/30G/0,5mL | ||
| Infraorbitario | 1-2 ml/25-30 G/0,5-1 ml | ||
| Auriculotemporal | 1-2 ml/25-30 G/0,5-1 ml | Paciente en decúbito supino con la cabeza girada en sentido contrario | Aspirar antes de inyectar la solución activa para asegurar la situación extraarterial de la aguja |
| Occipital mayor y menor | 5 ml/25-30 G/2-2,5 ml | Paciente en sedestación | No utilizar corticoide en ramas terminales del trigémino |
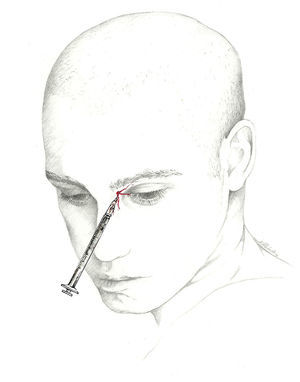
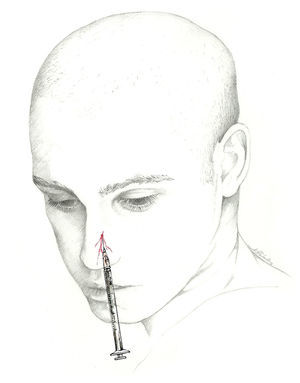
Más que de un nervio, deberíamos hablar del complejo occipital, cuya función es recoger la sensibilidad de la región occipital. El primero es el NOM, rama dorsal del segundo nervio espinal cervical62-64. Sale a través del axis y del atlas, y se sitúa entre los músculos oblicuo inferior y semiespinoso de la cabeza. Posteriormente, atraviesa el músculo trapecio para emerger a la superficie65 en el denominado punto de Arnold, situándose en su recorrido medial a la arteria occipital. El punto de Arnold está localizado en la línea imaginaria que une la apófisis mastoidea con la tuberosidad occipital, en el punto en el que se unen el tercio medial y el tercio medio de dicha línea66.
El nervio occipital menor procede del plexo cervical superficial, del asa formada por las raíces C2 y C3. Sale al exterior por el borde posterior del músculo esternocleidomastoideo y se dirige hacia arriba y hacia atrás, discurriendo por la unión entre el tercio medio y el tercio lateral de la misma línea imaginaria donde se sitúa el punto de Arnold62-64. En más del 50% de los individuos contacta con la arteria occipital67. Finalmente, el tercer nervio occipital es la rama dorsal del tercer nervio espinal cervical. Inerva la piel de la nuca en su línea media62-64.
De estos nervios el que habitualmente se infiltra es el NOM. No existe una técnica estandarizada para el bloqueo de este nervio. En cuanto al punto de inyección, hay 2 localizaciones habituales:
- •
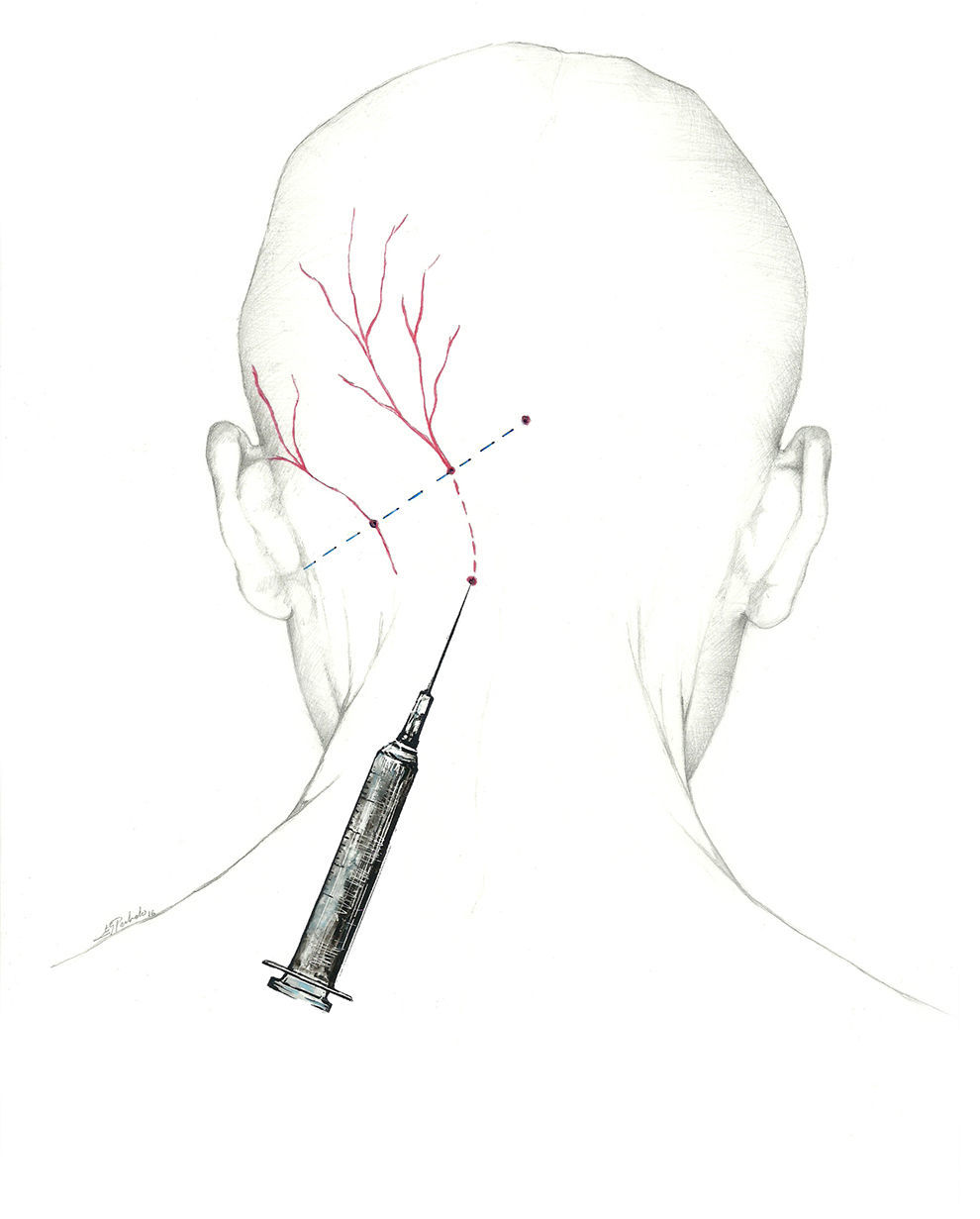
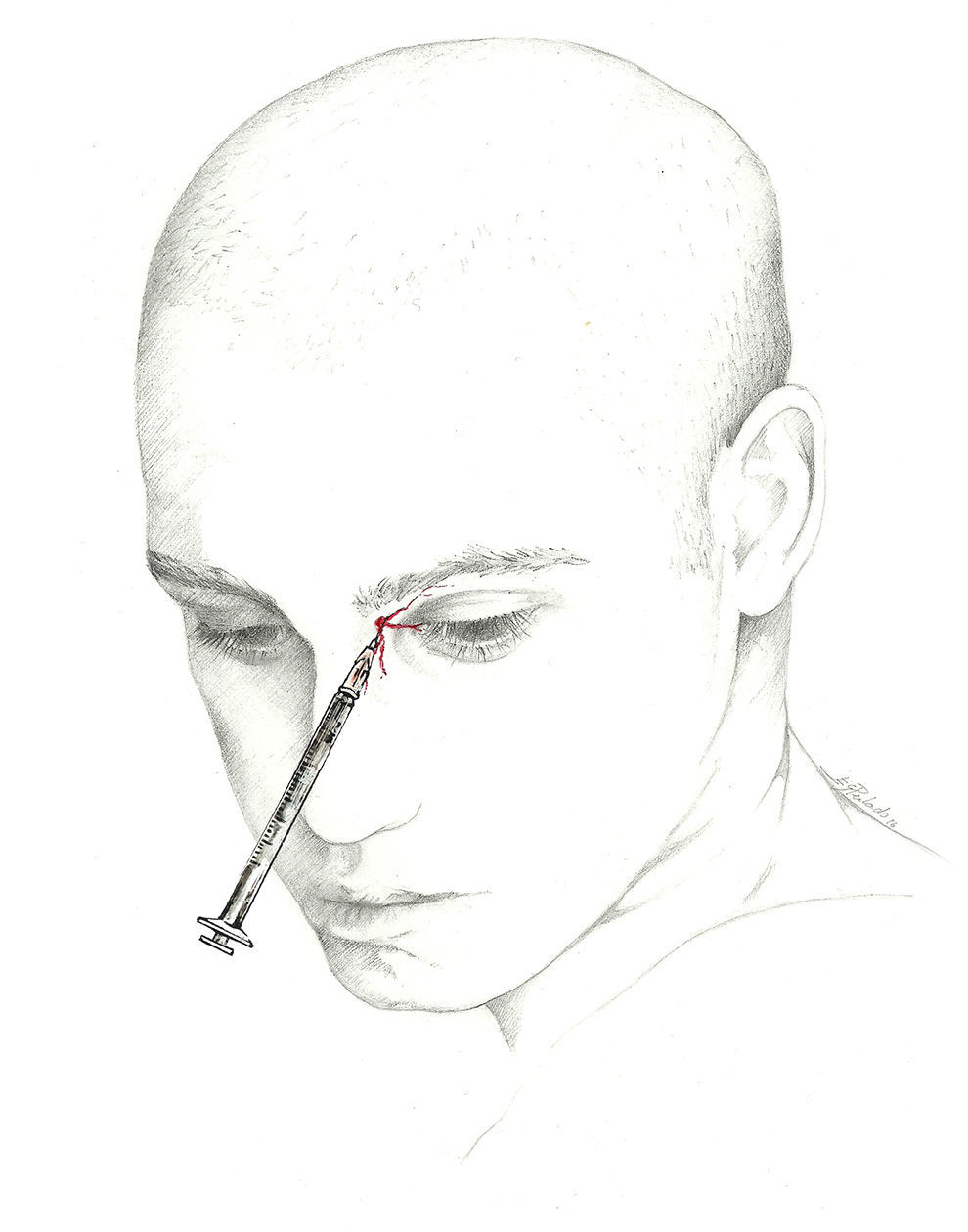
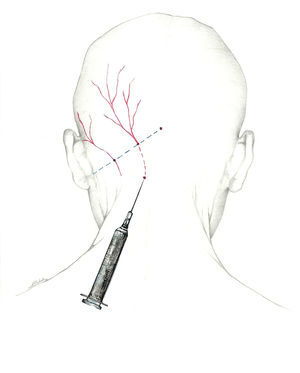
Puede llevarse a cabo un abordaje proximal, buscando el nervio occipital a su salida del músculo a unos 3 cm por debajo y 1,5cm lateral a la tuberosidad occipital; con esta técnica se infiltran los músculos paravertebrales, lo que puede dar una respuesta adicional; permite inyectar un mayor volumen de anestésico68 (fig. 1).
- •
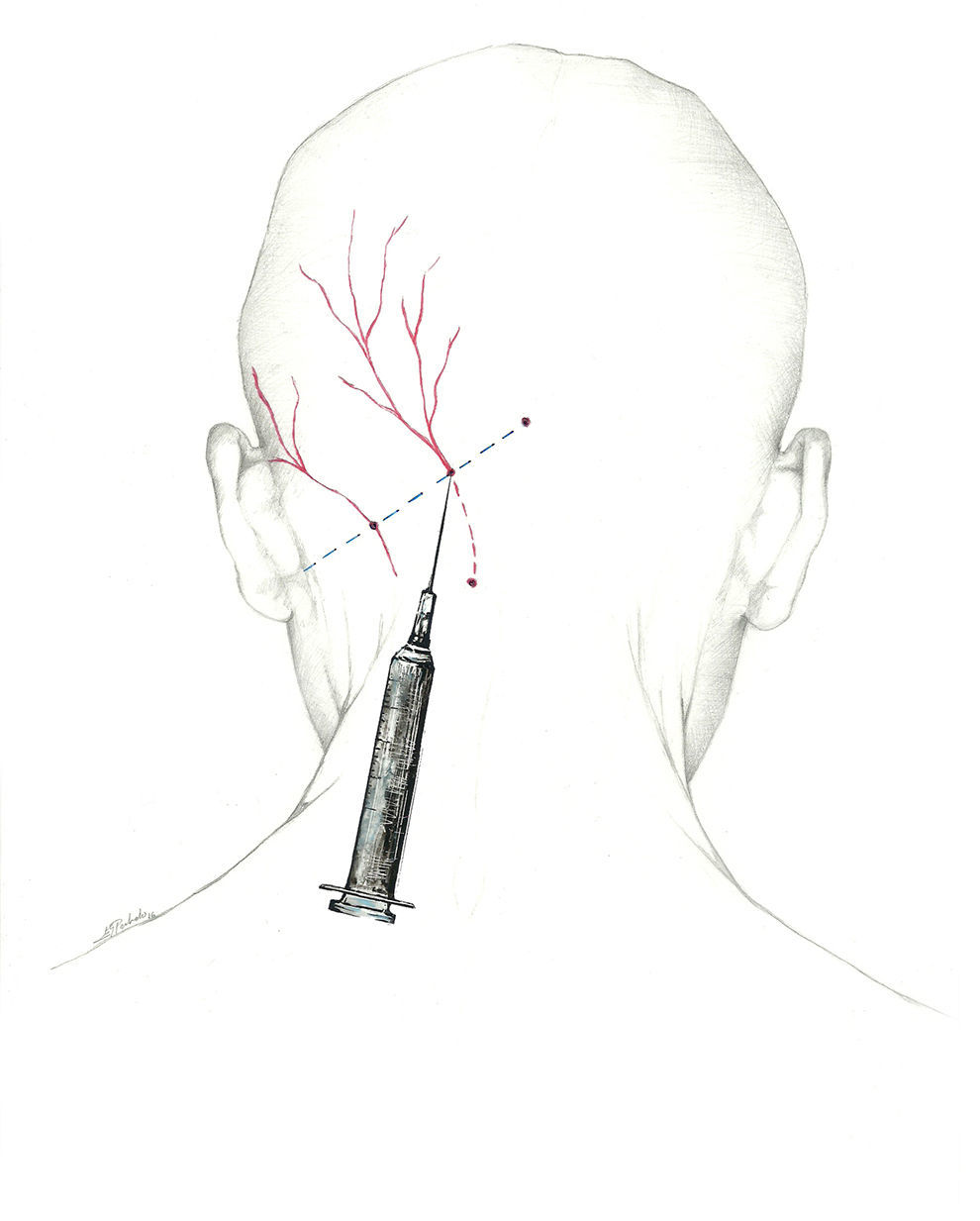
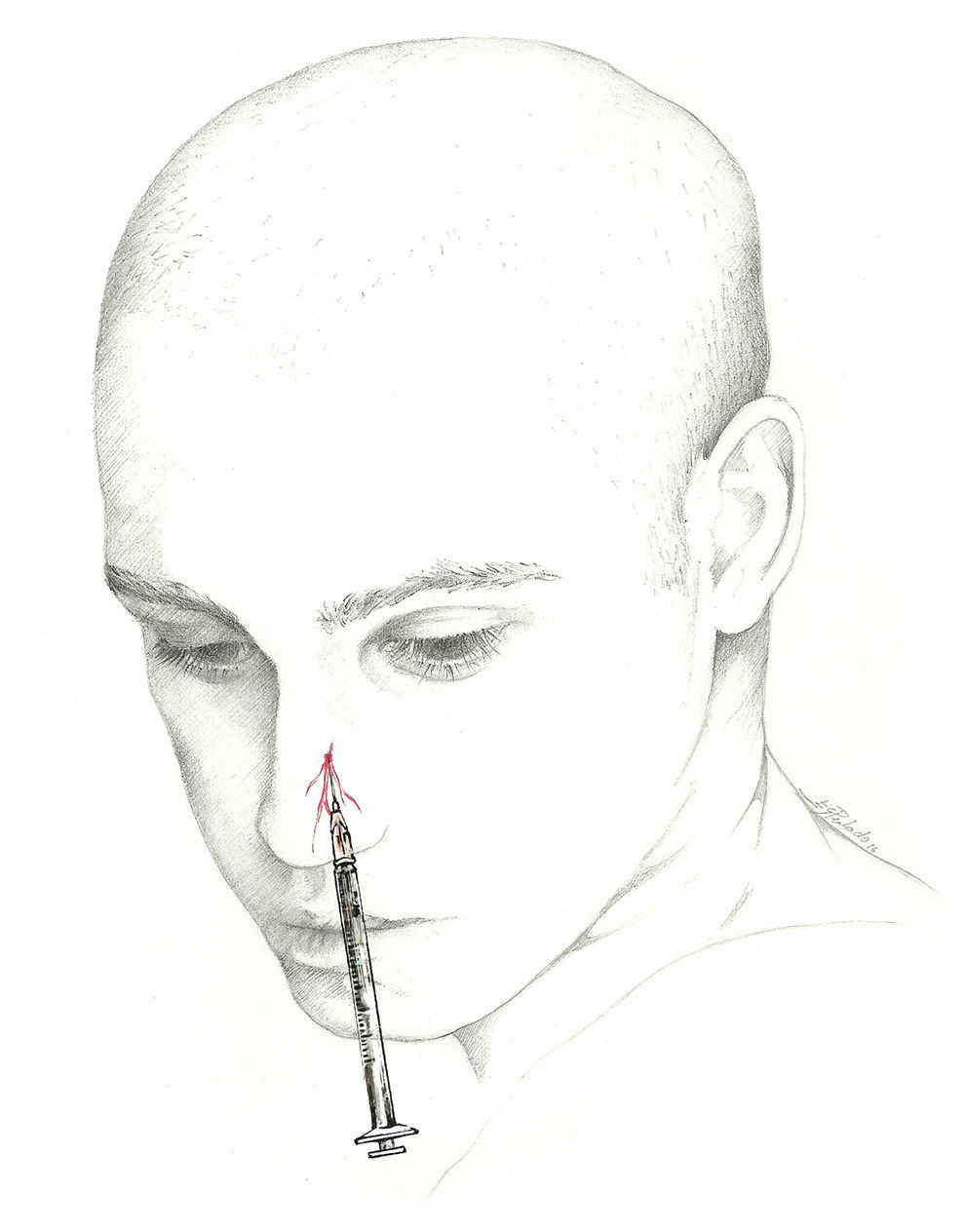
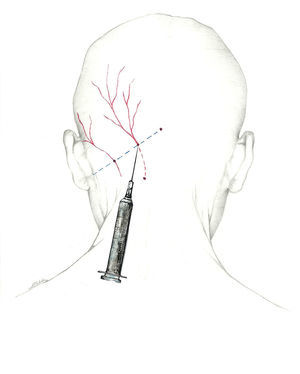
Se puede, asimismo, inyectar distalmente, en el ya descrito punto de Arnold, una vez que el nervio se encuentra libre de tejido muscular. Esta es la localización recomendada por la Sección de Procedimientos Intervencionistas de la Sociedad Americana de Cefaleas1 (fig. 2).
En ocasiones, es necesario inyectar la zona correspondiente al nervio occipital menor, sobre todo cuando en las neuralgias la sensibilidad a la palpación se encuentra fundamentalmente en dicho punto69.
La posición más cómoda para llevar a cabo el bloqueo es con el paciente sentado y el médico a su espalda. Se utilizará una jeringa de 5ml (se inyectan entre 2 y 2,5ml de solución anestésica en cada nervio) y una aguja de 25 a 30 Gauge (G) dirigida en sentido craneal. Dado que la arteria occipital discurre paralela y lateral al NOM, se debe intentar localizarla para evitar su punción. Si bien puede usarse un ecógrafo para localizar el nervio, entendemos que podemos asegurarnos de su bloqueo con un sencillo recurso técnico. Se puede inyectar un tercio de la cantidad total con la aguja insertada en vertical, aspirando previamente para asegurar su situación extraarterial, y posteriormente, tras salir a zona subcutánea, cambiar la orientación 30° a cada lado, inyectando los 2 tercios restantes en cada una de esas localizaciones. De esa forma, nos aseguramos la difusión del anestésico en un arco de 60°.
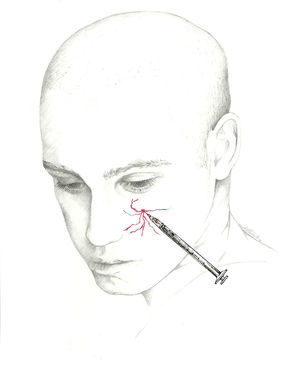
Nervio supraorbitarioEl nervio frontal es una de las 3 ramas terminales del nervio oftálmico (V-1), junto con el nervio lagrimal y el nasociliar. Penetra en la órbita por la hendidura orbitaria superior, lateralmente al anillo de Zinn y se dirige en sentido póstero-anterior entre el músculo elevador del párpado y la bóveda orbitaria. Al llegar al borde orbitario superior se divide en 2 ramas: frontal interna o supratroclear y frontal externa o supraorbitaria. El NSO emerge por la escotadura supraorbitaria para flexionarse, ascender e inervar la región medial de la frente y la parte anterior del cuero cabelludo62-64.
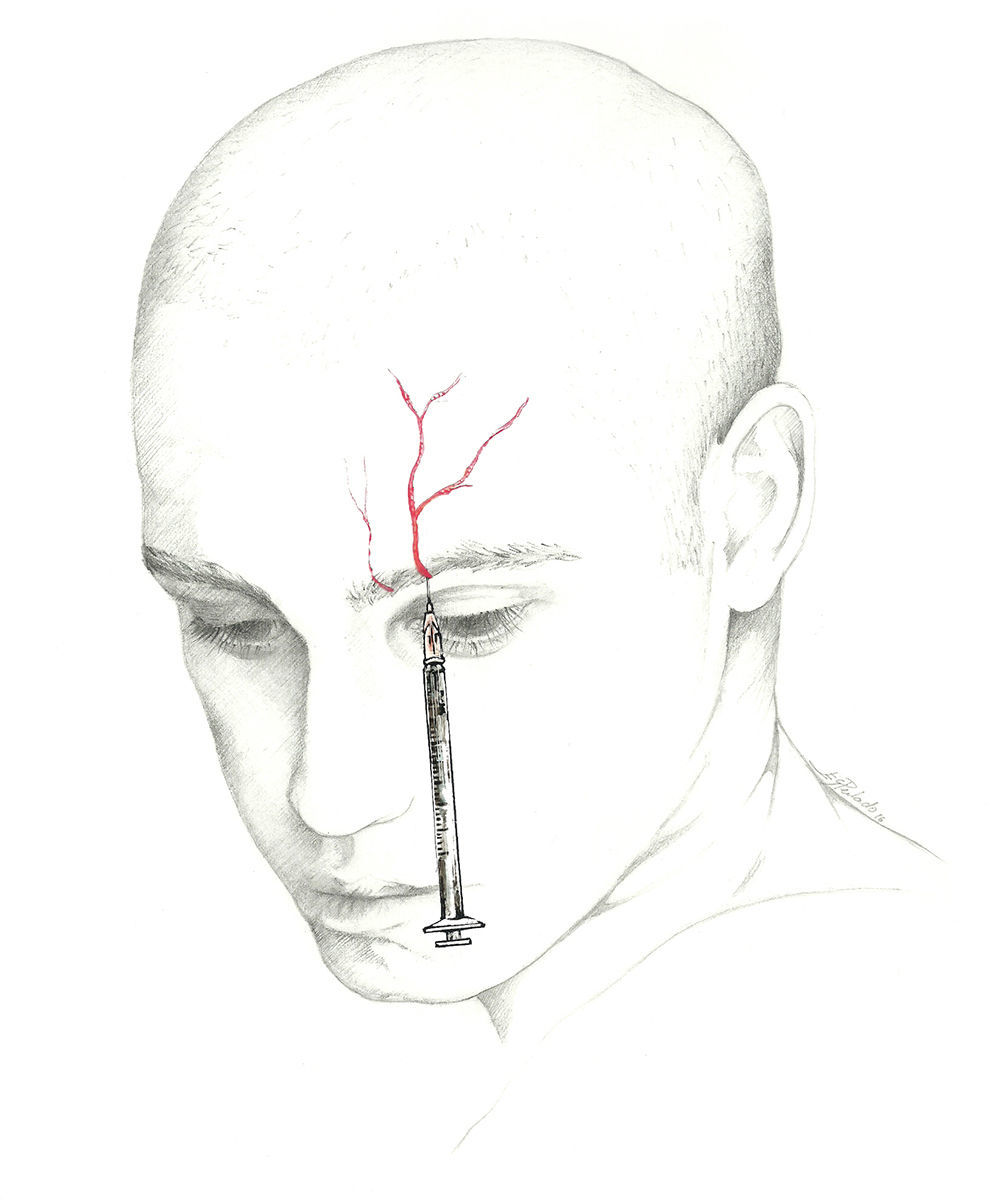
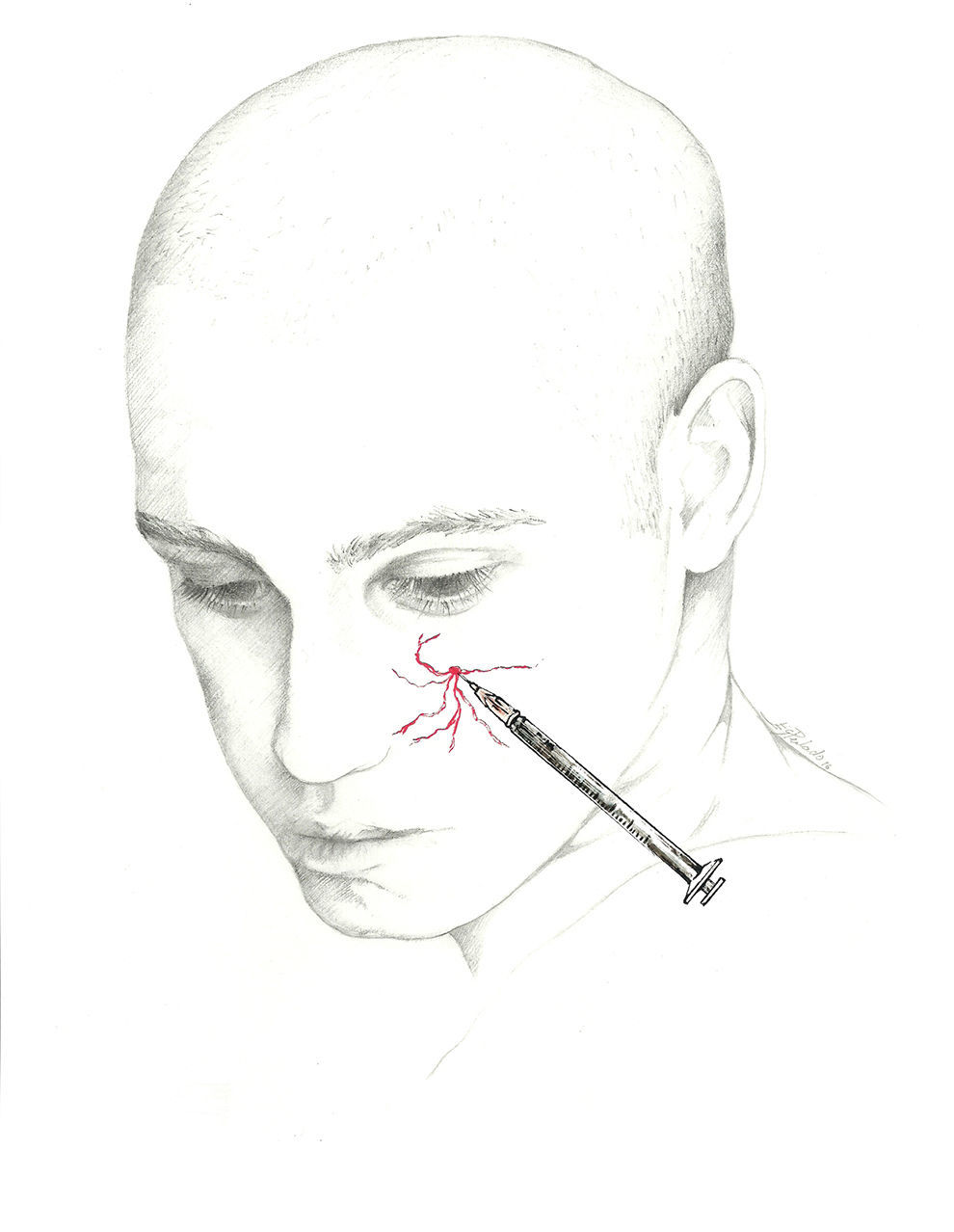
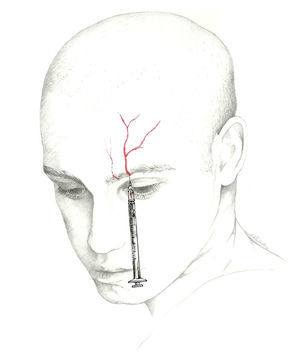
El lugar donde se bloquea el nervio es inmediatamente superior a su salida, existiendo 2 técnicas70. En una de ellas se localiza un punto situado 0,5cm por encima de su salida, en la línea media pupilar y se introduce la aguja en un ángulo de 45° con el bisel en sentido craneal; en la otra se introduce la aguja sobre la escotadura subcutánea en sentido paralelo al hueso, siendo recomendable su realización con técnica de inyección en Z desplazando la ceja del paciente en sentido craneal (fig. 3).
La posición más cómoda es con el paciente en decúbito supino con la cabeza en posición neutra, situándose el médico en su cabecera o en el lado correspondiente al nervio a inyectar. Recomendamos el uso de una jeringa de 1ml con una aguja de 25 o 30 G; es preferible esta última dado que es una zona sensible y susceptible de sangrado41,71. El volumen a inyectar es de 0,5-1ml en cada nervio. Habitualmente, no es necesaria una infiltración en abanico para anestesiarlo. Se debe aspirar dado que es una zona muy vascularizada y estabilizar el eje de la aguja con la mano no dominante durante la instilación para evitar desplazamientos y hematomas72.
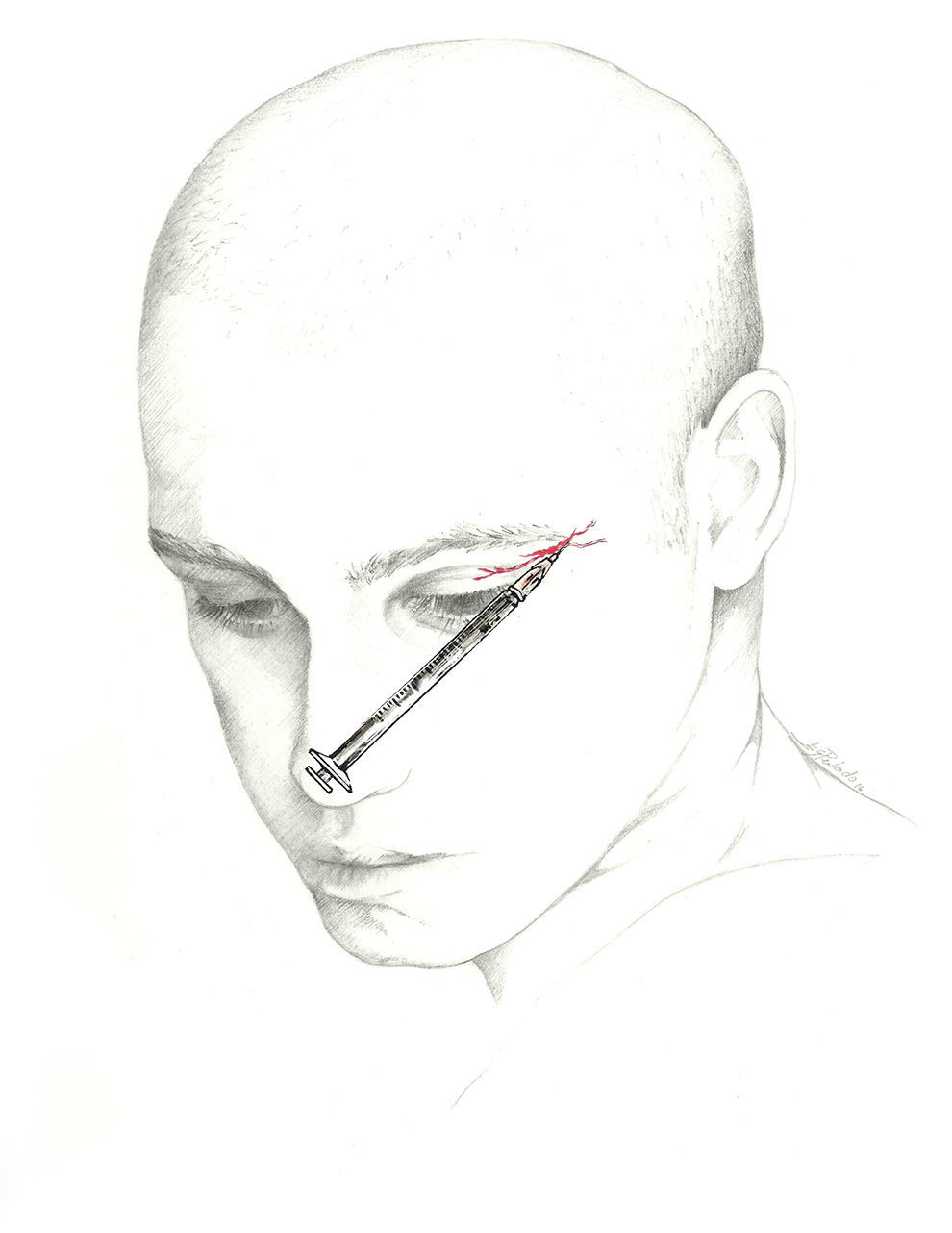
Nervio supratroclearEl nervio frontal interno o supratroclear es rama del nervio frontal, de menor diámetro que el NSO. Transcurre por encima de la polea del oblicuo mayor y suele dar una rama que se une con el nervio nasociliar. Sale de la órbita entre la polea y la escotadura del supraorbitario. Gira en sentido ascendente entre el músculo corrugador de la ceja y el frontal, y recoge la sensibilidad de la región medial frontal, la piel del párpado y la conjuntiva62-64.
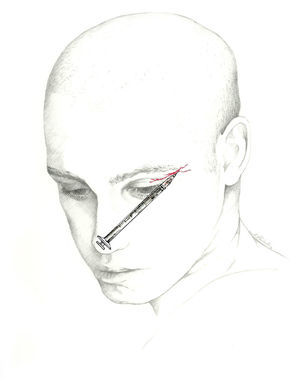
El bloqueo se realizará en la unión de la nariz con la escotadura supraorbitaria. Se introduce la aguja en ángulo de 45° en sentido craneal, preferiblemente por encima de la ceja para evitar el hematoma periorbitario72. La posición del paciente es similar a la utilizada para el NSO. Se recomienda utilizar una jeringa de 1ml con una aguja de 30 G e inyectar 0,5-1ml de solución anestésica en cada nervio (fig. 3).
Nervio lagrimalEl nervio lagrimal es una de las ramas terminales del nervio oftálmico62-64. En la órbita, el nervio lagrimal discurre sobre el borde superior del músculo recto lateral y se divide en 2 ramas. La rama lateral proporciona inervación a la glándula lagrimal, mientras que la rama medial se separa en varios filamentos que recogen la sensibilidad de la parte lateral del párpado superior y el área adyacente de la sien.
El nervio lagrimal se puede bloquear fácilmente en la superficie. El paciente se colocará en decúbito supino. Se emplea una jeringa de 1ml con una aguja fina de 30 G. La aguja se inserta a través del extremo lateral de la ceja y se dirige en sentido superior y lateral hacia la sien. A continuación, se inyectan 0,5ml de la solución anestésica44,73 (fig. 4). También es posible bloquear el nervio lagrimal dentro de la órbita, introduciendo una aguja de 25 G junto a la pared lateral de la cavidad orbitaria, por encima del canto externo, hasta alcanzar unos 2,5cm de profundidad45. No obstante, este tipo de bloqueo es de una mayor complejidad técnica.
Nervio infratroclearEl nervio infratroclear es una de las 2 ramas terminales del nervio nasociliar y continúa su mismo trayecto a lo largo del borde inferior del músculo oblicuo superior62-64. Una vez llega a la parte inferior de la tróclea, el nervio infratroclear da ramas para la mitad medial del párpado superior, la cara lateral de la raíz de la nariz y las vías lagrimales (carúncula y saco lagrimal).
Para bloquear el nervio infratroclear se utiliza una jeringa de 1ml con una aguja de 30 G. El paciente se colocará en decúbito supino. La aguja se introduce unos milímetros en el ángulo interno de la órbita, justo por encima de la carúncula lagrimal. Seguidamente, se inyectan 0,5ml de la solución anestésica46,47 (fig. 5).
Nervio nasal externoAdemás del nervio infratroclear, del nervio nasociliar emerge otra rama terminal, el nervio etmoidal anterior. Este nervio penetra en las fosas nasales por el agujero del mismo nombre y se divide en 2 ramas: el nervio nasal interno y el nervio nasal externo. Mientras que el nervio nasal interno se distribuye por la parte anterior del tabique nasal, el nervio nasal externo desciende por un surco de la cara posterior del hueso nasal, rodea el borde inferior de este hueso y termina en la piel del vértice de la nariz para recoger la sensibilidad de la parte distal del dorso de la nariz, el vértice nasal y la porción medial del ala de la nariz62-64.
El nervio nasal externo se puede bloquear en la superficie, en el punto de salida del nervio. Para ello se emplea una jeringa de 1ml y una aguja de 30 G. El paciente se colocará en decúbito supino. La aguja se inserta entre el hueso nasal y el cartílago nasal lateral, a unos 7 mm de la línea media. A continuación, se introduce en sentido craneal y a través del tejido subcutáneo, por delante del hueso nasal. Finalmente, se inyectan 0,5ml de la solución anestésica42 (fig. 6). El nervio etmoidal anterior y sus ramas también se pueden bloquear mediante la instilación intranasal de un anestésico local74,75. Sin embargo, el efecto de la instilación intranasal puede ser más breve que el de la inyección anestésica.
Nervio infraorbitarioEl nervio infraorbitario es rama terminal del nervio maxilar (V2). Emerge por el foramen infraorbitario y proporciona inervación sensitiva a la piel del párpado inferior, la mejilla, el ala nasal y el labio superior62-64.
El lugar en el que este nervio se bloquea es su salida por el agujero infraorbitario. Este agujero puede palparse unos 6mm por debajo del margen infraorbitario y a 25mm de la línea media76. El paciente se colocará en decúbito supino, con el médico en el lado correspondiente al nervio a inyectar. Recomendamos utilizar una jeringa de 1 o 2ml e inyectar con una aguja de 25-30 G. La aguja se orienta en un ángulo de 45° medial y ligeramente hacia arriba77 (fig. 7); a continuación, se inyecta 0,5 a 1ml de solución anestésica61. Una cantidad excesiva o una orientación demasiado superior de la aguja podrían dar lugar a una difusión orbitaria que conviene evitar.
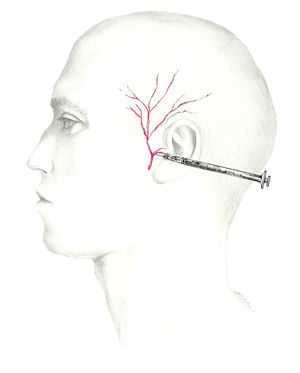
Nervio auriculotemporalEl nervio auriculotemporal o temporal superficial es la rama posterior del nervio mandibular (V3). Se origina a partir de una a 4 raíces, frecuentemente 2, entre las cuales se sitúa la arteria meníngea media. Sale por el foramen precondíleo y queda por dentro del ligamento esfenomandibular, superior a los vasos maxilares. Gira por el cóndilo y se hace vertical emergiendo por la parte superior de la parótida, entre el trago y la articulación témporo-mandibular49. Llega a la región temporal donde da sus ramas: parotídeas, articulares, comunicante con el facial, con el plexo simpático y ambos nervios auriculares. Recoge la sensibilidad de la articulación témporo-mandibular, mucosa del oído medio, membrana timpánica, ligamentos del hueso martillo, superficie anterior de la cóclea, conducto auditivo externo y piel de la región temporal, y parte anterior del pabellón auricular.
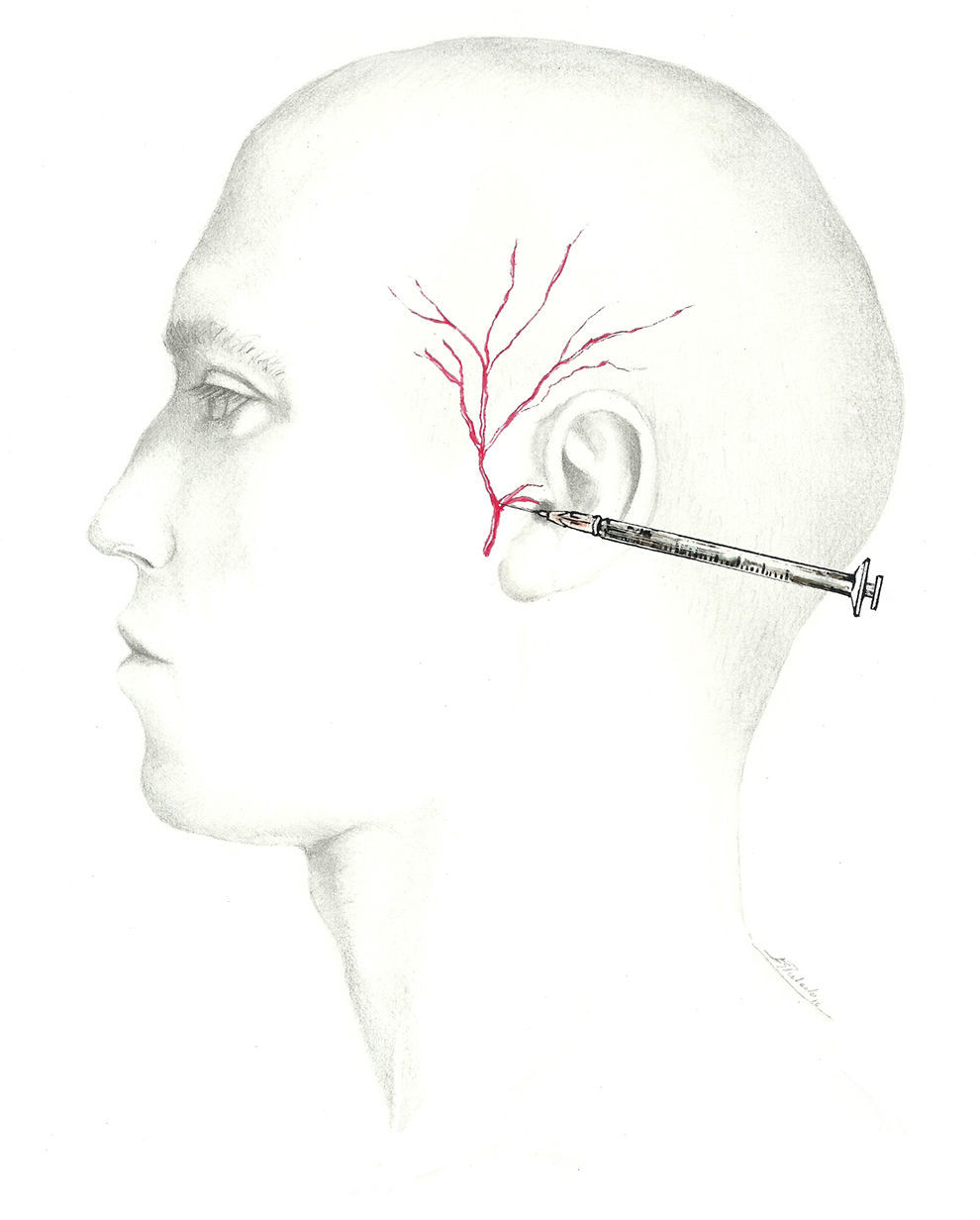
El lugar en el que este nervio se bloquea es justo delante del trago con el bisel orientado hacia el arco cigomático72 (fig. 8). Dada la proximidad de la arteria temporal, anterior a este nervio, se debe palpar la zona cuidadosamente y aspirar previamente para asegurar la situación extraarterial de la aguja72.
La posición más recomendable es con el paciente en decúbito supino, situándose el médico en el lado que se va a tratar y la cabeza girada hacia el lado contrario. Recomendamos utilizar una jeringa de 1 o 2ml e inyectar con una aguja de 25-30 G un volumen de solución anestésica de 0,5-1ml.
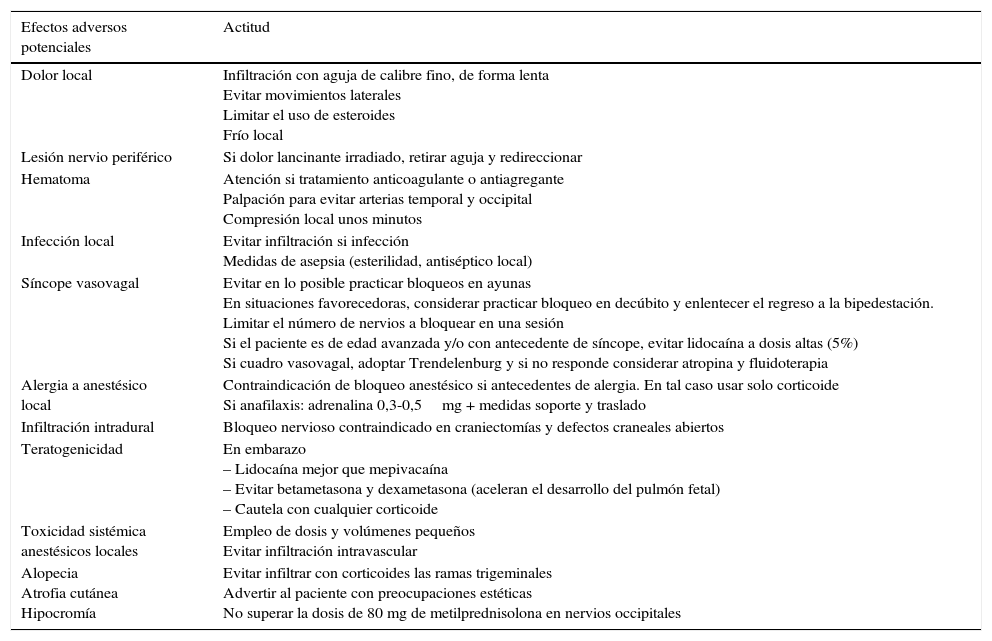
Reacciones adversas y situaciones de riesgoReacciones adversasEl BA es un procedimiento extraordinariamente seguro, de modo que las reacciones adversas suelen ser leves, predecibles y transitorias. En la tabla 5 se describen las más frecuentes y la actitud recomendada. Entre las posibles reacciones adversas, merecen ser consideradas las siguientes:
- •
Síntomas locales: dolor, equimosis o hematomas, raramente infecciones cutáneas, celulitis y lesiones del nervio o estructuras adyacentes59. Para reducir el dolor y las lesiones locales se recomienda adoptar medidas, como el uso de aguja de calibre fino, infiltrar de forma cuidadosa y lenta, evitando múltiples punciones y movimientos laterales. La palpación de las arterias vecinas, occipital y temporal, puede ser útil para evitar su punción accidental, especialmente en pacientes con tratamiento antiagregante o anticoagulante. Baykal considera que la punción de la arteria occipital en los bloqueos del NOM no es infrecuente, causando un hematoma que se soluciona aplicando presión local78. Mantener la presión una vez retirada la aguja puede ayudar a diseminar el anestésico local además del efecto hemostático. Si en el momento de la punción aparece un dolor intenso lancinante o urente y generalmente irradiado, indicativo de lesión directa nerviosa, se recomienda retirar un poco la aguja y redireccionarla hacia otro punto. Un 10% de los pacientes puede experimentar en el caso de la infiltración de esteroides un aumento local de la intensidad del dolor durante 24-48 h. Esto ocurre con menor frecuencia con las soluciones de esteroides más solubles. La inflamación local puede mejorar con la aplicación de frío sobre la zona infiltrada.
- •
Alteración de la presión arterial: generalmente de carácter transitorio. El paciente puede experimentar palidez, sudoración, náuseas, bradicardia, hiperventilación y síncope27,59,79,80. Sahai-Sristava et al.79 detectan en su serie de pacientes con BA del NOM como principales factores de riesgo para desarrollar respuesta vasovagal el ayuno, las infiltraciones bilaterales, la edad avanzada y el empleo de concentraciones altas de anestésico local (lidocaína al 5% más que al 1 o 2%)59,79. Es recomendable colocar al paciente en decúbito, especialmente si existen antecedentes de episodios vasovagales o sincopales previos, o si se trata de pacientes con depleción de volumen por náuseas o vómitos asociados a su cefalea, ansiosos, gestantes o ancianos. En tales casos, puede ralentizarse el regreso del paciente a la posición de bipedestación59. En los casos en que se presente una reacción vasovagal se recomienda adoptar la posición de Trendelenburg. En ausencia de respuesta, se debe plantear la administración de atropina 0,4-0,5mg (1/2 ampolla) subcutánea o por vía intravenosa81. También se ha descrito, especialmente en pacientes de edad avanzada, la elevación transitoria y poco relevante de la presión arterial79.
- •
Cefalea desencadenada por la técnica, empeoramiento de su cefalea previa27 y dolor cervical22.
- •
Reacciones alérgicas al anestésico local: aunque se han descrito, son más raras con las amidas (lidocaína, mepivacaína y bupivacaína) que con los anestésicos locales tipo ésteres1. Pueden producirse reacciones de hipersensibilidad retardada locales generalmente en las 72 h siguientes a la exposición en forma de dermatitis eccematosa en el área de contacto con el alérgeno, que pueden tratarse si es preciso con esteroides tópicos. Las reacciones alérgicas sistémicas (anafilaxia) pueden cursar con urticaria, angioedema, náuseas, vómitos, dolor, diarrea, tos, disnea, y en los casos graves complicarse con edema de glotis, broncoespasmo, hipotensión y shock. La anafilaxia generalmente se desarrolla pocos minutos después de la exposición al antígeno, aunque se han descrito casos hasta una hora más tarde. En caso de aparecer una reacción anafiláctica, se debe administrar inmediatamente adrenalina subcutánea o intramuscular 0,3-0,5mg. Si es preciso, se deben iniciar medidas de soporte vital básico y activar el traslado a una unidad de cuidados agudos81. Dichas reacciones son extremadamente raras y médicos y pacientes deben saber que es una complicación altamente improbable.
- •
Toxicidad sistémica por anestésicos locales: las reacciones por sobredosificación son excepcionales con el uso adecuado de los fármacos, ya que en general se emplean dosis muy pequeñas. Pueden darse por inyección intravascular accidental inadvertida (sobredosificación relativa) o cuando otras medicaciones contribuyen a aumentar los niveles sistémicos del fármaco1. Técnicamente, evitar la inyección intravascular no suele ser un problema si el médico constantemente aspira el émbolo de la jeringa y solo inyecta si no hay retorno de sangre. Sin embargo, estas precauciones podrían ser no completamente fiables si la agujas son demasiado finas (calibre 30 G o menores) o si se aplica después presión con demasiada fuerza3. Los falsos negativos pueden relacionarse con el bloqueo de la punta de la aguja por tejido o coágulo que impida la salida de sangre82. Se considera que, a menor volumen, menor riesgo de absorción sistémica. La clínica se produce por toxicidad sobre el sistema nervioso central (SNC) y cardiovascular. La toxicidad sobre el SNC puede ser leve (acúfenos, sabor metálico, parestesias, náuseas, vómitos, vértigo, inquietud, visión borrosa), moderada (nistagmo, alucinaciones, fasciculaciones, temblor y convulsiones) o grave (apnea y coma). El primer síntoma cardiovascular de la intoxicación es la hipotensión y pueden aparecer arritmias, síncopes, shock y parada cardiaca en asistolia. Estas reacciones adversas infrecuentes pueden generalmente evitarse con el empleo de dosis bajas y una técnica de inyección apropiada.
- •
Los anestésicos locales inducen a nivel local mionecrosis reversible, pero solo se ha descrito un bajo número de casos clínicamente relevantes. La bupivacaína es la que tiene mayor potencial de inducir miotoxicidad en el punto de inyección, por lo que algunos autores limitan la frecuencia de su uso aunque su incidencia no esté bien establecida83. Una vez se interrumpe el tratamiento, la regeneración muscular típicamente ocurre en 3 o 4 semanas84.
- •
La inducción de necrosis tisular se ha relacionado fundamentalmente con el uso de vasoconstrictores asociados al anestésico local. No obstante, se ha comunicado también de forma anecdótica su aparición con lidocaína sin vasoconstrictor por un posible mecanismo embólico85.
- •
Metahemoglobinemia: se han descrito casos con prilocaína, benzocaína, tetracaína y lidocaína (complicación extremadamente rara)86.
- •
Las inyecciones con corticoides pueden asociarse con reacciones adversas locales, como la alopecia, los cambios en la pigmentación y la atrofia cutánea alrededor del punto de inyección (2% de pacientes en la serie de Shields et al.87), que se suele resolver en meses, aunque puede persistir tras más de 2 años87-89. El riesgo de trastornos tróficos es mayor cuando el corticoide empleado es triamcinolona, que cuando se utilizan metilprednisolona o betametasona90. Los corticoides se deben evitar en los BA de ramas trigeminales, por el riesgo de potenciales reacciones locales, incluyendo atrofia cutánea87. En caso de utilizar acetato de metilprednisolona, se recomienda no superar la dosis de 80mg en la infiltración del NOM. Entre los efectos adversos sistémicos destacan el insomnio, la agitación, el flushing facial, síndrome de Cushing y supresión del sistema inmunitario, especialmente con inyecciones frecuentes y dosis altas. En el único caso comunicado de síndrome de Cushing los síntomas comenzaron a mejorar al interrumpir las infiltraciones91. Se recomienda por tanto que el intervalo de infiltración cuando se asocie corticoide no sea inferior a 3 meses59, aunque en determinadas entidades, como la CR, puede ser necesaria una mayor frecuencia.
Potenciales reacciones adversas de los bloqueos anestésicos y actitud recomendada
| Efectos adversos potenciales | Actitud |
|---|---|
| Dolor local | Infiltración con aguja de calibre fino, de forma lenta Evitar movimientos laterales Limitar el uso de esteroides Frío local |
| Lesión nervio periférico | Si dolor lancinante irradiado, retirar aguja y redireccionar |
| Hematoma | Atención si tratamiento anticoagulante o antiagregante Palpación para evitar arterias temporal y occipital Compresión local unos minutos |
| Infección local | Evitar infiltración si infección Medidas de asepsia (esterilidad, antiséptico local) |
| Síncope vasovagal | Evitar en lo posible practicar bloqueos en ayunas En situaciones favorecedoras, considerar practicar bloqueo en decúbito y enlentecer el regreso a la bipedestación. Limitar el número de nervios a bloquear en una sesión Si el paciente es de edad avanzada y/o con antecedente de síncope, evitar lidocaína a dosis altas (5%) Si cuadro vasovagal, adoptar Trendelenburg y si no responde considerar atropina y fluidoterapia |
| Alergia a anestésico local | Contraindicación de bloqueo anestésico si antecedentes de alergia. En tal caso usar solo corticoide Si anafilaxis: adrenalina 0,3-0,5mg + medidas soporte y traslado |
| Infiltración intradural | Bloqueo nervioso contraindicado en craniectomías y defectos craneales abiertos |
| Teratogenicidad | En embarazo – Lidocaína mejor que mepivacaína – Evitar betametasona y dexametasona (aceleran el desarrollo del pulmón fetal) – Cautela con cualquier corticoide |
| Toxicidad sistémica anestésicos locales | Empleo de dosis y volúmenes pequeños Evitar infiltración intravascular |
| Alopecia Atrofia cutánea Hipocromía | Evitar infiltrar con corticoides las ramas trigeminales Advertir al paciente con preocupaciones estéticas No superar la dosis de 80 mg de metilprednisolona en nervios occipitales |
En la tabla 6 se resumen los principales aspectos que deben ser valorados antes de la realización de un BA. A nivel práctico, resulta conveniente establecer algunas consideraciones relativas a posibles situaciones de riesgo:
- •
Antecedente de reacción alérgica a anestésicos locales. En tal caso, queda la alternativa del uso aislado de corticoides de forma no asociada.
- •
Craniectomías o defectos abiertos del cráneo en la fosa posterior por el riesgo de difusión intracraneal del agente anestésico, que puede ocasionar una disminución del nivel de consciencia y coma92,93.
- •
En caso de diabetes o glaucoma se debe ser especialmente cauteloso con el empleo de corticoide.
- •
Infecciones locales en el área de infiltración o sistémicas
- •
En todos los casos, y sobre todo en el paciente anticoagulado, se debe evitar la punción arterial mediante la palpación de las arterias próximas y comprimir localmente tras la infiltración durante unos minutos.
Principales aspectos que deben ser valorados antes de la realización de un bloqueo anestésico
| En relación con el paciente |
| Preguntar siempre por alergias |
| Preguntar siempre por cirugía craneal previa y defectos del hueso occipital |
| Preguntar por uso de medicación antiagregante o anticoagulante |
| Preguntar por embarazo en mujeres en edad fértil |
| Preguntar por antecedente de síncope |
| Evitar el ayuno |
| En relación con la técnica |
| Explicar los posibles efectos adversos al paciente. Es recomendable la obtención de un consentimiento informado |
| Garantizar la esterilidad durante todo el procedimiento |
| Disponer de una camilla |
| Posibilidad de administración inmediata de adrenalina y atropina, así como acceso localizado a material y medicación de reanimación cardiopulmonar |
| El paciente deberá permanecer en observación durante los siguientes 15 min |
Los autores declaran no tener ningún conflicto de intereses.
A Esperanza González Perlado, por su implicación en el proyecto, y la autoría y belleza de sus diseños (figuras 1-8).