La estenosis carotídea tiene una influencia en la TC de perfusión (TCP), que en ocasiones se manifiesta como una falsa penumbra isquémica (FPI). El objetivo de nuestro estudio es estimar la incidencia de FPI en pacientes con estenosis carotídea, establecer su relación con el grado de estenosis y medir los cambios cuantitativos y cualitativos de la TCP después de la angioplastia carotídea y stenting (ACS).
MétodosEntre octubre del 2013 y junio del 2015 se seleccionó prospectivamente a 26 pacientes con estenosis carotídea que fueron sometidos a una ACS, realizándose un TCP 2-10 días antes y después de la ACS.
ResultadosDieciséis pacientes tenían una estenosis unilateral (11 en el subgrupo de < 90% de estenosis y 5 en el de ≥ 90%) y 10 pacientes una estenosis bilateral. La incidencia de FPI en pacientes con estenosis carotídea es del 38,5%. El riesgo de FPI aumenta en relación directa con el grado de estenosis, con un riesgo relativo de 11 en el grupo de ≥ 90% respecto al grupo de < 90% (IC del 95%: 1,7-71,3; p=0,0005). Existen cambios estadísticamente significativos en los parámetros CBF, TTP, MTT y Tmáx de la TCP que revierten tras la ACS. No hay cambios significativos en CBV.
ConclusionesLa estenosis carotídea implica cambios en los parámetros de la TCP, condicionando un alto riesgo de FPI en estenosis ≥ 90% y, por tanto, una posible interpretación equivocada de estos estudios. Estos cambios se revierten tras la ACS.
Carotid artery stenosis influences CT perfusion (CTP) studies, sometimes manifesting as a false ischaemic penumbra (FIP). This study aims to estimate the incidence of FIP in patients with carotid artery stenosis, establish their relationship with the degree of stenosis, and measure quantitative and qualitative changes in CTP after carotid angioplasty and stenting (CAS).
MethodsBetween October 2013 and June 2015, we prospectively selected 26 patients with carotid stenosis who underwent CAS, with CTP being performed 2-10 days before and after CAS.
ResultsSixteen patients had unilateral stenosis (11 in the subgroup displaying < 90% stenosis and 5 in the subgroup with ≥ 90% stenosis) and 10 patients had bilateral stenosis. The incidence of FIP in patients with carotid artery stenosis was 38.5%. Risk of FIP increased in direct relation to degree of stenosis, with a relative risk of 11 in the subgroup with ≥ 90% stenosis with respect to the subgroup displaying < 90% stenosis (95% CI, 1.7-71.3; P=.0005). There were statistically significant changes in the parameters CBF, TTP, MTT, and Tmax CTP, which reverted after angioplasty. No significant changes were found in CBV.
ConclusionsCarotid artery stenosis involves changes in CTP parameters. Patients with ≥ 90% stenosis carry a high risk of FIP; CTP studies may therefore be misinterpreted in these cases. Changes in CTP parameters are reverted after CAS.
La tomografía computarizada (TC) desempeña un papel fundamental en el diagnóstico y en la toma de decisiones terapéuticas en el ictus agudo. Diferentes métodos clínicos y de imagen han sido propuestos para identificar el tejido isquémico de penumbra1,2. Entre ellos, la TC de perfusión (TCP) destaca por su amplia disponibilidad y su sencillez para proveer una medición de la perfusión de forma rápida, lo cual es esencial en el escenario de un evento cerebrovascular agudo3-5.
Por este motivo, y en relación con la generalización de su uso, es importante conocer las posibles limitaciones de la TCP. Una de estas es la dificultad para diferenciar la verdadera penumbra (tejido cerebral en riesgo de convertirse en infarto si la oclusión vascular no se resuelve) de la oligohemia benigna (tejido cerebral ligeramente hipoperfundido, pero sin ese riesgo inminente). La estenosis carotídea hemodinámicamente significativa puede llevar a una alteración en los valores de la TCP que se manifieste de una forma idéntica a la penumbra, llamada en este contexto falsa penumbra isquémica (FPI)6.
Aunque los cambios en la perfusión debidos a la estenosis carotídea son conocidos y tenidos en cuenta en la práctica clínica habitual a la hora de interpretar los estudios de TCP, no existen estudios prospectivos que cuantifiquen su incidencia y su relación con el grado de estenosis ni que analicen este efecto fuera del contexto del ictus agudo7-9. El objetivo de nuestro estudio es estimar la incidencia de FPI en la TCP de pacientes con enfermedad carotídea, establecer su relación con el grado de estenosis y medir los cambios cuantitativos y cualitativos de la TCP después de la angioplastia carotídea con stenting (ACS).
Pacientes y métodosEste estudio está guiado por los principios éticos básicos de la Declaración de Helsinki. La confidencialidad del paciente ha sido asegurada en todo momento de acuerdo con la legislación nacional de protección de datos (Ley orgánica 15/1999 de protección de datos). Todos los pacientes otorgaron el consentimiento informado escrito antes de ser incluidos en el estudio.
Selección de pacientesDesde octubre del 2013 hasta junio del 2015, se recogieron prospectivamente los datos de 45 pacientes a los que se les sometió a ACS en nuestro centro; 19 pacientes fueron excluidos por las siguientes razones: barreras médicas o logísticas para realizar la TCP (n=6) y rechazo a participar (n=13). Seleccionamos a 26 pacientes, que fueron divididos en 3 grupos de acuerdo con el grado de estenosis carotídea: < 90%, ≥ 90% y estenosis bilateral. En los pacientes con estenosis bilateral, la revascularización fue realizada en la arteria carótida sintomática. Ningún paciente presentaba contraindicaciones para el empleo de medios de contraste. En todos los pacientes la TCP se realizó antes (2-10 días) y después (2-10 días) de la ACS, habiendo transcurrido 5 o más días entre el último evento isquémico y la realización de la TCP.
Diagnóstico y tratamiento de la estenosis carotídeaLa estenosis carotídea fue identificada mediante ultrasonografía dúplex y posteriormente medida mediante angiografía de sustracción digital (ASD) de acuerdo con los criterios NASCET10. La presencia de una estenosis intracraneal fue descartada mediante la ASD. Se consideraron como estenosis bilaterales aquellos casos en los que ambas carótidas presentaban más de un 50% de estenosis. Las ACS fueron llevadas a cabo por uno o 2 neurorradiólogos intervencionistas con más de 15 años de experiencia. Los pacientes fueron premedicados con tratamiento antiagregante (combinación de ácido acetil salicílico 300mg y clopidogrel 75mg) durante los 3 días previos al procedimiento. Todos los pacientes fueron tratados con un stent autoexpandible (Zilver vascular stent; Cook Ireland Ltd., Limerick, Irlanda), con un sistema de protección de embolismos (Angioguard J&J Cordis; New Brunswick, NJ, EE. UU.). Los pacientes recibieron anticoagulación sistémica durante la ACS y posteriormente se prescribió ácido acetilsalicílico y clopidogrel durante 3 meses, continuando posteriormente con monoterapia antiagregante con ácido acetilsalicílico.
Análisis de la Tomografía Computarizada de PerfusiónLa TCP fue realizada con un escáner helicoidal de 64 filas de detectores (General Electric Light Speed VCT, EE.UU) al nivel de los ganglios basales. Se usó una colimación de 0,625mm (tiempo de ciclo de 1 s) y 80 Kv en combinación con 120mAs. El índice de dosis para cada escáner individual fue de 1.565,19mGy-cm. Se inyectó un bolo de 50ml de contraste yodado (Ultravist 300; Schering, Berlin, Alemania) seguido de 35ml del 0,9% suero salino fisiológico a un flujo de 4ml/s. Los datos fueron procesados en una estación de trabajo, empleando un software específico (CT Perfusion 4D Neuro, GE Healthcare, EE. UU.), generando mapas que mostraban los valores medios absolutos de flujo sanguíneo cerebral (FSC) expresado en ml/100g/min, volumen sanguíneo cerebral (VSC) expresado en ml/100g y tiempo de tránsito medio (TTM), tiempo al pico (TP) y tiempo máximo (Tmáx) en segundos.
Varios estudios han demostrado que los valores absolutos medidos por la TCP están condicionados por una alta variabilidad inter e intraindividual, influidos por factores fisiológicos como la presión arterial y los pasos del posprocesado11-13. Estas limitaciones son superadas empleando parámetros de perfusión relativos. Por esta razón, calculamos la ratio de valores medidos en el hemisferio ipsolateral respecto al contralateral para los parámetros FSC y VSC (rFSC y rVSC), y la diferencia absoluta entre hemisferios para el TTM, TP y Tmáx (dTTM, dTP y dTmáx), como previamente se ha recomendado14.
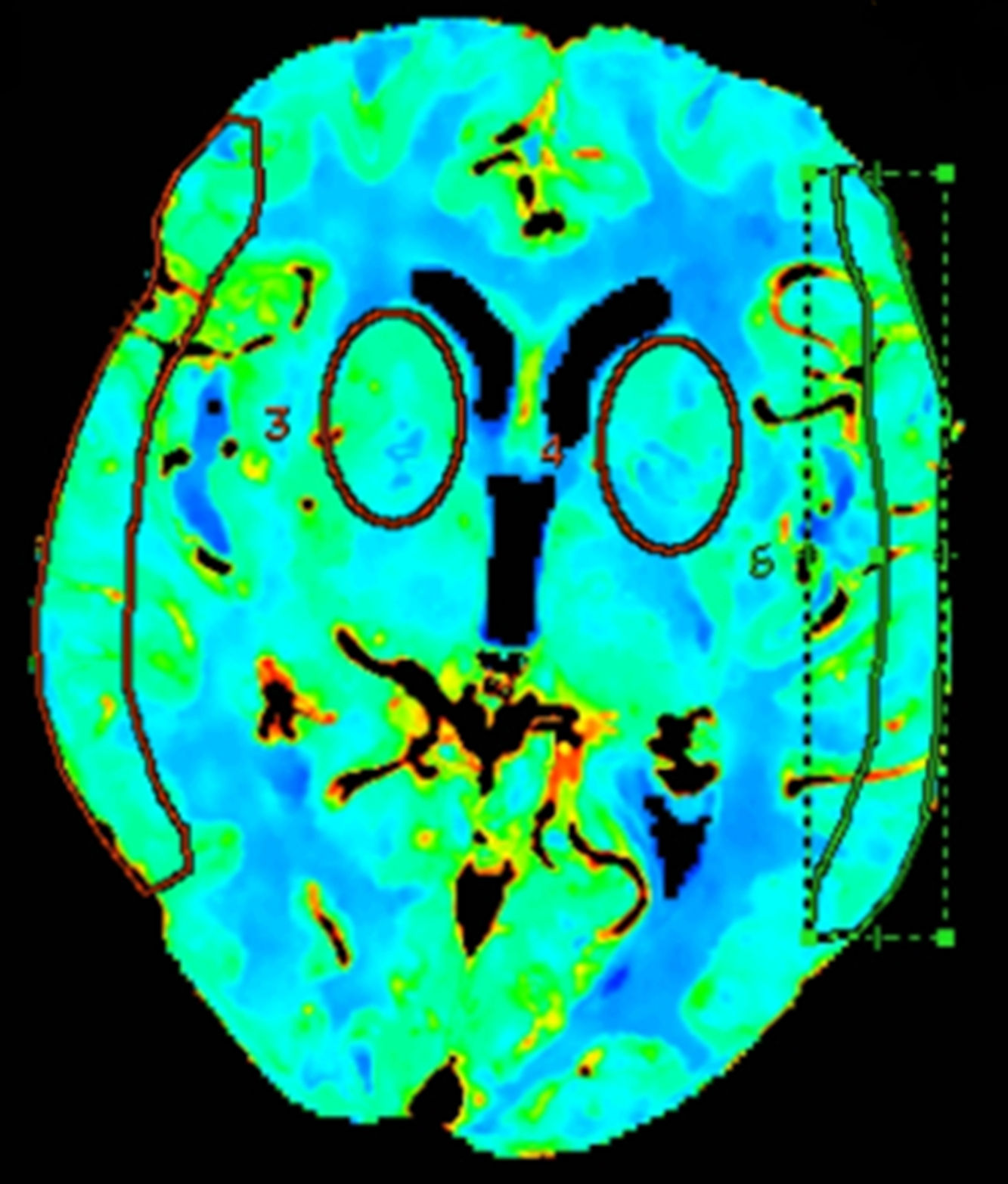
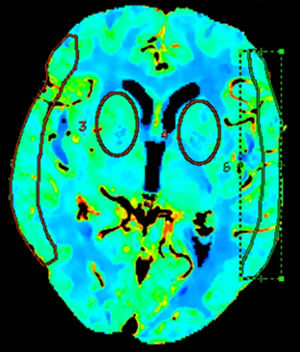
Los análisis cuantitativos se realizaron midiendo los valores medios en las regiones de interés (ROI) en diferentes territorios vasculares del encéfalo mediante su trazo manual15 o mediante ROI circulares13,16. Para evaluar estos mapas, 2 ROI circulares bilaterales fueron posicionadas a nivel de los ganglios de la base, 3cm por encima de la silla turca, en el territorio de la arteria cerebral media (ACM) profundo (pACM), y otras 2 fueron dibujadas manualmente a nivel cortical, en el área de distribución superficial de la ACM (sACM), de acuerdo con los mapas de Damasio17 (fig. 1).
Definición de falsa penumbra y falso coreLa interpretación visual de la TCP se basa en el análisis de los mapas de color de la perfusión, mediante la comparación con el resto del tejido circundante y del hemisferio contralateral18,19. La penumbra fue medida empleando un umbral de Tmáx>6 s20,21 y un umbral de CBV < 1ml/100g22, siguiendo las recomendaciones de la bibliografía más reciente. Aquellas TCP con alteraciones en el Tmáx, pero con valores normales de VSC, en un área superior al 50% del territorio de la ACM fueron clasificadas como FPI. Aquellas TCP con alteraciones tanto en el Tmáx como en el VSC en un área superior al 25% del territorio de la ACM se consideraron falsos core.
Análisis estadísticoPara resumir las características basales de los pacientes se emplearon análisis descriptivos. El test de Student para muestras apareadas fue empleado para determinar las diferencias en pACM y sACM de rFSC, rVSC, dTTM, dTP y dTmáx antes/después de ACS. Para estimar la diferencia de medias entre los grupos < 90%, ≥ 90% y estenosis carotídea bilateral se empleó un análisis de covarianza. La relación entre las FPI y el grado de estenosis carotídea se obtuvo mediante el test de la chi al cuadrado, aplicando el test exacto de Fisher en caso de necesidad. Se utilizó un nivel de significación de 2 colas p < 0,05 para todas las comparaciones. Los análisis estadísticos fueron realizados con STATA, versión 13.1 (STATA/IC 13, Texas, EE. UU.).
ResultadosSe realizó el estudio de TCP antes y después de la ACS (una media de 53, 8 h y 42,2 h, respectivamente) en 26 pacientes. El tiempo medio entre el último evento isquémico y la ACS fue de 21 días. Las características basales, clínicas y de la enfermedad carotídea de los pacientes se muestran en la tabla 1.
Resumen de las características basales, clínicas y de la estenosis carotídea en los pacientes incluidos en el estudio
| Características basales de los pacientes | |
| Edad, años | 69 (54-83) |
| Sexo masculino | 18 (69%) |
| Hipertensión arterial | 19 (73%) |
| Hiperlipidemia | 16 (62%) |
| Diabetes mellitus | 10 (38%) |
| Tabaquismo | 7 (27%) |
| IAM previo | 4 (15%) |
| Arteriopatía periférica | 5 (19%) |
| Características clínicas | |
| NIHSS pre ACS | |
| 0 | 18 (69%) |
| 1-4 | 5 (19%) |
| 5-10 | 3 (11%) |
| > 10 | 0 |
| mRs pre ACS | |
| ≤2 | 19 (73%) |
| 3-4 | 7 (27%) |
| > 4 | 0 |
| Estenosis carotídea | |
| Lateralidad de la estenosis carotídea | |
| Unilateral | 16 (62%) |
| Bilateral | 10 (38%) |
| Lado donde se efectuó la ACS | |
| Izquierdo | 15 (58%) |
| Derecho | 11 (42%) |
| Grado de la estenosis carotídea tratada | |
| Enfermedad unilateral | |
| < 90% | 11 (69%) |
| ≥ 90% | 5 (31%) |
| Enfermedad bilateral | |
| < 90% | 3 (30%) |
| ≥ 90% | 7 (70%) |
| Intervalo entre el inicio de los síntomas y ACS, días (mediana) | 21 |
ACS: angioplastia carotídea y stenting; IAM: infarto agudo de miocardio; mRs: escala de Rankin modificada; NIHSS: National Institute of Health Stroke Scale.
El grado de estenosis en la carótida tratada fue del 50 al 99%; 16 pacientes tenían una estenosis unilateral (11<90% y 5 ≥ 90%) y 10 pacientes tenían una estenosis bilateral. La estenosis tratada en los pacientes con estenosis bilateral fue de ≥ 90% en 3 pacientes y de < 90% en 7 pacientes. El lado no tratado en el grupo de estenosis bilaterales tenía una estenosis de < 90% en 5 pacientes, de 90-99% en un paciente y una oclusión carotídea contralateral en los 4 pacientes restantes.
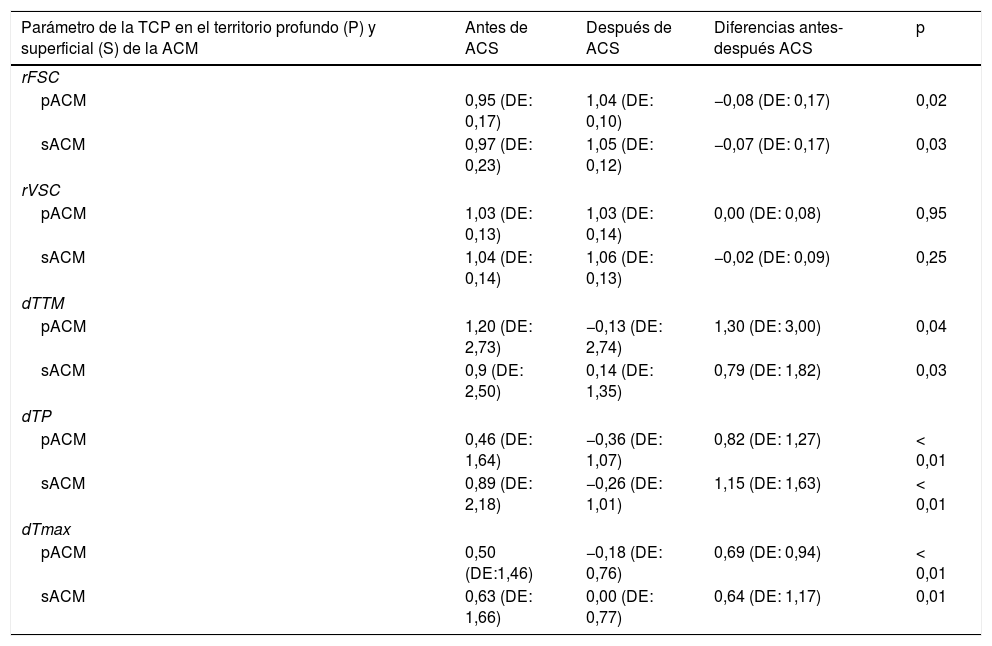
Análisis cuantitativo de la Tomografía Computarizada de Perfusión antes y despúes de la angioplastia carotídea con stentingEn los 26 pacientes del estudio, se realizó un análisis cuantitativo de los diferentes parámetros de la TCP tanto en el territorio sACM como en el pACM, y se midieron las diferencias entre antes y después de la ACS, las cuales fueron estadísticamente significativas para el rFSC, dTTM, dTP y dTmáx (p<0,05). El rVSC no mostró cambios estadísticamente significativos en ninguno de los territorios estudiados (tabla 2).
Comparación de los parámetros de la TCP en el territorio profundo y superficial de la ACM, antes y después de la ACS
| Parámetro de la TCP en el territorio profundo (P) y superficial (S) de la ACM | Antes de ACS | Después de ACS | Diferencias antes-después ACS | p |
|---|---|---|---|---|
| rFSC | ||||
| pACM | 0,95 (DE: 0,17) | 1,04 (DE: 0,10) | −0,08 (DE: 0,17) | 0,02 |
| sACM | 0,97 (DE: 0,23) | 1,05 (DE: 0,12) | −0,07 (DE: 0,17) | 0,03 |
| rVSC | ||||
| pACM | 1,03 (DE: 0,13) | 1,03 (DE: 0,14) | 0,00 (DE: 0,08) | 0,95 |
| sACM | 1,04 (DE: 0,14) | 1,06 (DE: 0,13) | −0,02 (DE: 0,09) | 0,25 |
| dTTM | ||||
| pACM | 1,20 (DE: 2,73) | −0,13 (DE: 2,74) | 1,30 (DE: 3,00) | 0,04 |
| sACM | 0,9 (DE: 2,50) | 0,14 (DE: 1,35) | 0,79 (DE: 1,82) | 0,03 |
| dTP | ||||
| pACM | 0,46 (DE: 1,64) | −0,36 (DE: 1,07) | 0,82 (DE: 1,27) | < 0,01 |
| sACM | 0,89 (DE: 2,18) | −0,26 (DE: 1,01) | 1,15 (DE: 1,63) | < 0,01 |
| dTmax | ||||
| pACM | 0,50 (DE:1,46) | −0,18 (DE: 0,76) | 0,69 (DE: 0,94) | < 0,01 |
| sACM | 0,63 (DE: 1,66) | 0,00 (DE: 0,77) | 0,64 (DE: 1,17) | 0,01 |
Se consideró un nivel de significación de 2 colas p<0,05 para las comparaciones.
ACS: angioplastia carotídea y stenting; DE: desviación estándar; dTmáx: tiempo máximo relativo; dTP: tiempo al pico relativo; dTTM: tiempo de tránsito medio relativo; p: nivel de significación; pACM: territorio profundo de la arteria cerebral media; rFSC: flujo sanguíneo cerebral relativo; rVSC: volumen sanguíneo cerebral relativo; sACM: territorio superficial ACM; TCP: TC de perfusión.
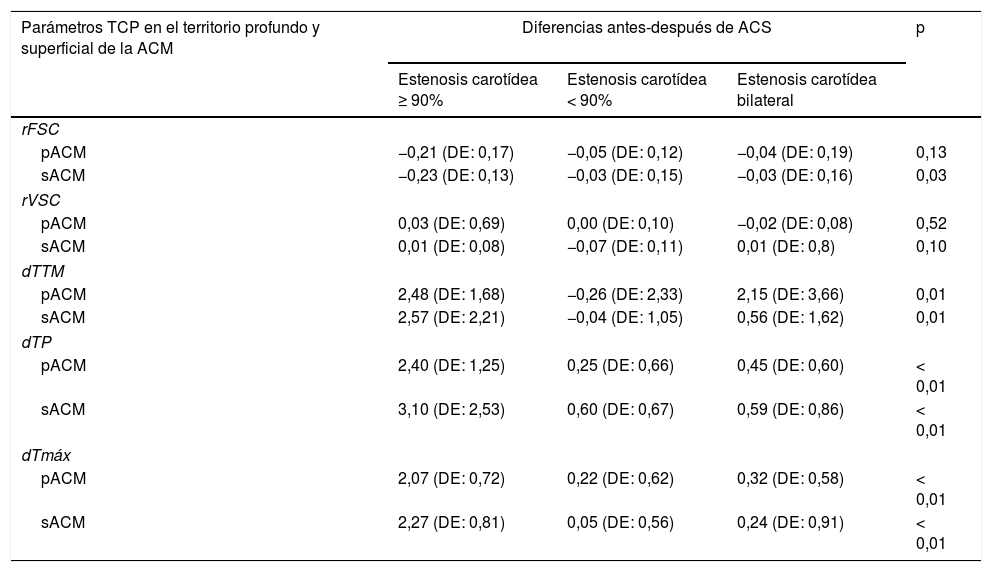
Entre los 3 grupos analizados, el de estenosis carotídea unilateral de ≥ 90% fue el que mostró diferencias de mayor magnitud entre las TCP antes/después de la ACS. Estas diferencias entre grupos fueron todas significativas excepto para el VSC en todos los territorios y para el FSC en el territorio sACM (tabla 3).
Comparación de los parámetros de la TCP en el territorio profundo y superficial de la ACM antes y después de la ACS entre los subgrupos de estenosis carotídea
| Parámetros TCP en el territorio profundo y superficial de la ACM | Diferencias antes-después de ACS | p | ||
|---|---|---|---|---|
| Estenosis carotídea ≥ 90% | Estenosis carotídea < 90% | Estenosis carotídea bilateral | ||
| rFSC | ||||
| pACM | −0,21 (DE: 0,17) | −0,05 (DE: 0,12) | −0,04 (DE: 0,19) | 0,13 |
| sACM | −0,23 (DE: 0,13) | −0,03 (DE: 0,15) | −0,03 (DE: 0,16) | 0,03 |
| rVSC | ||||
| pACM | 0,03 (DE: 0,69) | 0,00 (DE: 0,10) | −0,02 (DE: 0,08) | 0,52 |
| sACM | 0,01 (DE: 0,08) | −0,07 (DE: 0,11) | 0,01 (DE: 0,8) | 0,10 |
| dTTM | ||||
| pACM | 2,48 (DE: 1,68) | −0,26 (DE: 2,33) | 2,15 (DE: 3,66) | 0,01 |
| sACM | 2,57 (DE: 2,21) | −0,04 (DE: 1,05) | 0,56 (DE: 1,62) | 0,01 |
| dTP | ||||
| pACM | 2,40 (DE: 1,25) | 0,25 (DE: 0,66) | 0,45 (DE: 0,60) | < 0,01 |
| sACM | 3,10 (DE: 2,53) | 0,60 (DE: 0,67) | 0,59 (DE: 0,86) | < 0,01 |
| dTmáx | ||||
| pACM | 2,07 (DE: 0,72) | 0,22 (DE: 0,62) | 0,32 (DE: 0,58) | < 0,01 |
| sACM | 2,27 (DE: 0,81) | 0,05 (DE: 0,56) | 0,24 (DE: 0,91) | < 0,01 |
Se utilizó un nivel de significación de 2 colas p<0,05 para las comparaciones.
ACS: angioplastia carotídea y stenting; DE: desviación estándar; dTP: tiempo al pico relativo; dTTM: tiempo de tránsito medio relativo; p: nivel de significación pACM: territorio profundo de la arteria cerebral media; rFSC: flujo sanguíneo cerebral relativo; rVSC: volumen sanguíneo cerebral relativo; sACM: territorio superficial ACM; TCP: TC de perfusión; dTmáx: tiempo máximo relativo.
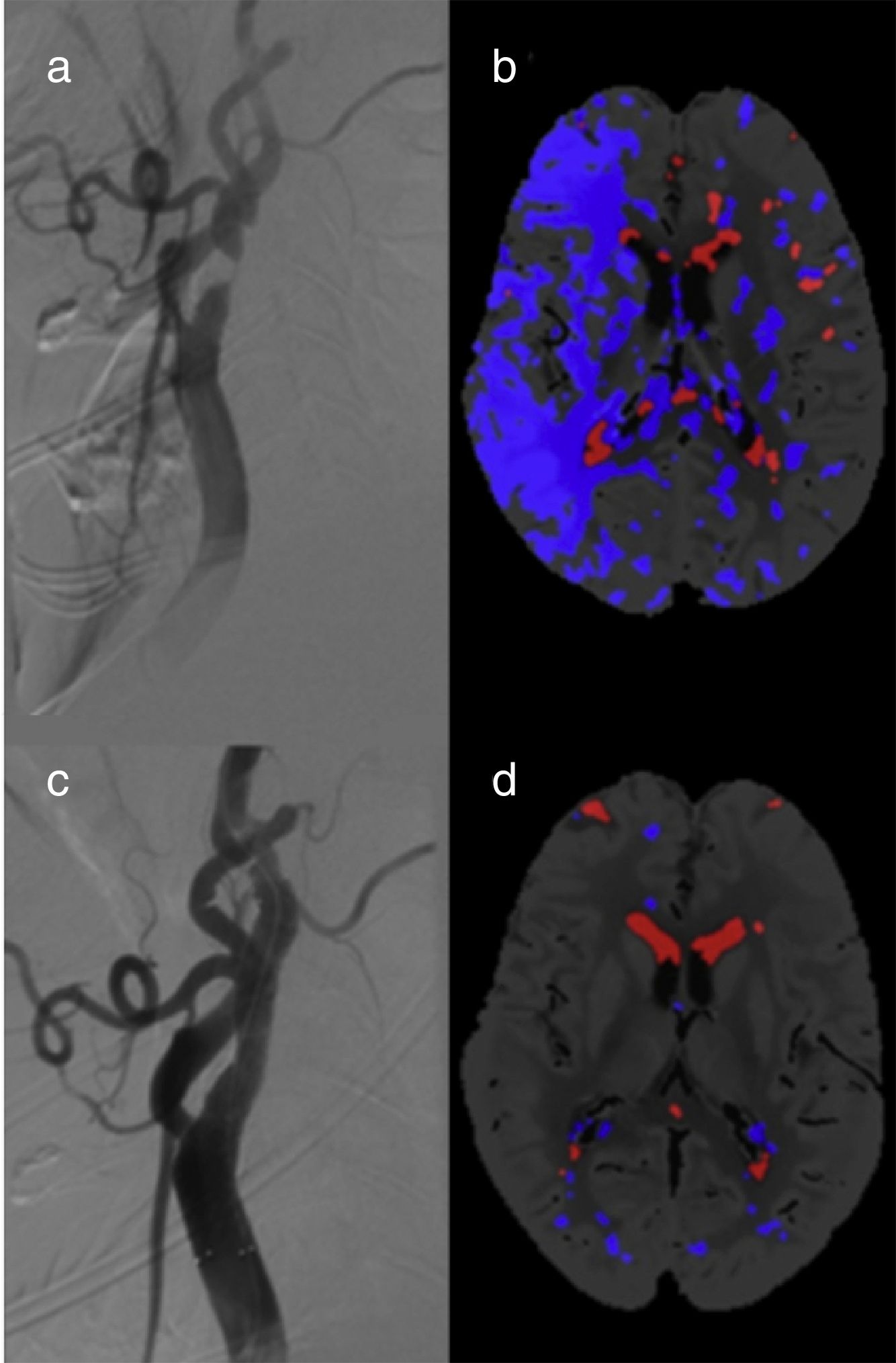
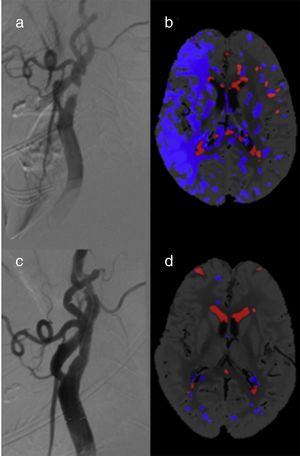
Encontramos un total de 10 pacientes (38,5%) con FPI en la TCP pre ACS (fig. 2) De estos, 6 FPI afectaron a apacientes con estenosis carotídea unilateral (incidencia del 37,5%): 5 casos correspondían al grupo de estenosis ≥ 90% (incidencia del 100%) y solo un FPI al grupo de estenosis < 90% (incidencia del 9,1%). El riesgo relativo de FPI en los pacientes con estenosis unilateral ≥ 90% es de 11 (IC del 95%: 1,70 a 71,3, p=0,0005) respecto al grupo con estenosis < 90%. Todas las FPI se resolvieron en las TCP post-ACS.
En los pacientes con estenosis carotídea bilateral fueron identificadas 4 FPI (40%). En 3 de ellos, la FPI apareció en el hemisferio con mayor grado de estenosis carotídea, que era una oclusión carotídea, En el cuarto paciente, sin embargo, la FPI estaba localizada en el lado con menor estenosis (80% vs. 95%) pero sintomático. En el grupo de estenosis bilaterales no se encontraron cambios en la TCP post-ACS. No encontramos falsos core en ninguno de los pacientes estudiados.
DiscusiónNuestros resultados muestran cambios en los diferentes parámetros de la TCP derivados de la estenosis carotídea. Entre los criterios de inclusión empleados, se ha elegido como imprescindible que hubiesen transcurrido 5 o más días entre el evento isquémico y la angioplastia carotídea. Este criterio permite crear un modelo experimental en el cual, la influencia sobre los cambios medidos en la TCP, está condicionada únicamente por la estenosis carotídea, aislando de ella la influencia de una penumbra isquémica real. Estos cambios observados conllevan una alta incidencia de FPI, pudiendo condicionar errores diagnósticos.
El incremento en el TTM y el TP en el hemisferio ipsolateral a la estenosis es un fenómeno conocido desde hace más de 10 años. Alteraciones en los restantes parámetros de la TCP, como el VSC o el FSC, han sido descritas en estudios más recientes, afectando tanto al territorio profundo como al sACM7,20. Estos cambios en la TCP pueden atribuirse a la estenosis carotídea, puesto que, como también han mostrado estudios similares al nuestro, se normalizan después de realizar la revascularización con ACS7,23. Por otra parte, el hecho de que nuestros pacientes hayan sido estudiados con TCP una vez pasada la fase aguda del ictus isquémico permite aislar la influencia del mismo sobre estos estudios funcionales, siendo en este caso la estenosis el único factor que condiciona cambios en la perfusión.
También, en concordancia con estudios previos, hemos encontrado una fuerte relación entre las alteraciones en la TCP y el grado de estenosis carotídea, especialmente en los pacientes con estenosis de alto grado (≥ 90%)24. Estos resultados son consistentes con estudios que mediante Doppler transcraneal muestran una reducción de la velocidad pico sistólica y el índice de pulsatilidad ipsolaterales a las estenosis carotídeas severas25.
Para el análisis de datos de la TCP hemos usado un software que emplea el modelo matemático de deconvolución, más preciso que otras alternativas26, especialmente a la hora de estimar la perfusión en pacientes con estenosis carotídea27. Sin embargo, nuestros resultados demuestran que, a pesar de utilizar este método, la estenosis carotídea continúa produciendo FPI en la TCP, con la limitación en la práctica clínica que ello implica.
Ninguno de los pacientes estudiados presentó un falso core en la TCP, lo cual es consistente con la ausencia de cambios significativos en el análisis cuantitativo del VSC, el único parámetro que permaneció inalterado tanto antes como después de realizar la ACS. Esto demuestra que el VSC es un parámetro consistente, que no es vulnerable ante los cambios hemodinámicos condicionados por la estenosis carotídea. En este sentido, al contrario que nuestro estudio, Chin et al. encontraron una disminución significativa del VSC en los estudios pre-ACS respecto a los post-ACS, empleando un método de pendiente máxima para su análisis matemático9. Sin embargo, estos resultados, basados únicamente en el análisis cuantitativo de la TCP, podrían no ser clínicamente relevantes ya que las diferencias pre y post-ACS en el VSC, pese a ser estadísticamente significativas, fueron tan solo de 0,03ml/100g, insuficientes para provocar falsos cores con los valores umbrales de referencia.
Establecer unos umbrales válidos para definir el territorio de penumbra y core por medio de la TCP es un problema de enorme controversia en la literatura. A estos 2 conceptos, que pretenden estimar el tejido cerebral en riesgo y el ya infartado, respectivamente, hay que añadir el de oligohemia benigna, que representa aquel tejido hipoperfundido pero sin riesgo de convertirse en área de infarto.
Los límites entre penumbra y oligohemia benigna no están bien definidos. Algunos autores han propuesto que el área de oligohemia benigna podría ser excluido con un umbral de Tmáx>6 s, debido a su buena correlación con estudios mediante RM20,21. Un TTM relativo del 145% ha sido otro de los umbrales propuestos23, aunque goza de menor aceptación20. El hecho de que los pacientes incluidos en nuestro estudio estuvieran estables clínicamente, con síntomas que se habían establecido al menos 5 días antes del estudio de TCP, descarta que los cambios detectados sean debidos a verdaderas penumbras isquémicas.
Hasta donde sabemos, este es el primer estudio que evalúa los cambios en el Tmáx en pacientes con estenosis carotídea, experimentando incrementos cercanos a 0,7 s que se corrigen con la ACS, lo cual pone de manifiesto que el límite entre la penumbra y la oligohemia benigna en estos pacientes todavía no ha sido bien establecido aún en la TCP.
Aunque las alteraciones cuantitativas de la TCP debidas a la estenosis carotídea ya han sido descritas en la literatura, hasta el momento no existen estudios prospectivos hayan evaluado en qué medida estos cambios pueden conllevar errores diagnósticos en la interpretación de la TCP24, siendo este el primer estudio prospectivo que ha demostrado una relación directa entre el grado de estenosis carotídea y la aparición de FPI.
Las FPI son un fenómeno más complejo en los pacientes con estenosis bilaterales. Contrariamente a lo que ocurre con las unilaterales, en este grupo de pacientes las FPI no siempre aparecen en el hemisferio con mayor grado de estenosis carotídea. Aquellos pacientes con estenosis bilateral en el que una de las carótidas se encuentra ocluida presentan habitualmente una FPI ipsolateral a la oclusión, que lógicamente persiste al tratar la carótida no ocluida. El pequeño número de pacientes con estenosis bilateral de nuestro estudio no permite extraer conclusiones sólidas sobre las FPI en estos pacientes.
La estenosis carotídea es responsable de alrededor de un 11% de las enfermedades cerebrovasculares isquémicas28, para las que en fase aguda con frecuencia se emplea la TCP en la toma decisiones. Tomando en consideración la alta incidencia de FPI en este grupo de pacientes, el estudio de los troncos supraaórticos, previo a la interpretación de una TCP, es obligado con el fin de evitar posibles errores diagnósticos en el adecuado manejo del ictus isquémico agudo. En el futuro, sería recomendable no solo conocer esta limitación, sino también contar con algoritmos que permitan corregir la influencia de la estenosis carotídea en los parámetros de la TCP, para estimar así la penumbra con mayor fiabilidad.
Podemos concluir que la estenosis carotídea implica un alto riesgo de FPI, especialmente en pacientes con estenosis de alto grado, que se resuelve tras el tratamiento con ACS. Es fundamental tener en mente los posibles falsos positivos en la TCP que las FPI implican, siendo por ello necesario, mientras no existan métodos diagnósticos más precisos, una adecuada correlación con la clínica y los estudios angiográficos a la hora de interpretar estos estudios.
Limitaciones del estudioNo hemos comparado los valores de TCP con los métodos estándar, tales como la PET o la Xe-TC. Sin embargo, nos hemos apoyado en estudios previos que han mostrado una adecuada correlación entre los valores medidos mediante TCP y estas otras técnicas para la determinación de la penumbra29.
No hemos evaluado los efectos de la configuración del polígono de Willis ni otros mecanismos de suplencia colateral, como pueden ser el sentido del flujo de la arteria oftálmica o las colaterales leptomeníngeas. Estos sistemas de colateralidad, si bien pueden condicionar variaciones en los territorios vasculares, no limitan los resultados una vez definidos los territorios.
De nuestro estudio no se pueden extraer conclusiones acerca de factores pronósticos en la evolución de los pacientes, tales como la probabilidad del síndrome de hiperperfusión, evaluado en otros trabajos pero inexistente en el nuestro9. Estudios prospectivos con mayor número de pacientes y un plazo de seguimiento más largo podrían ser de interés en este sentido.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Los autores agradecen a la Dra. Canneti por su asesoramiento científico y ayuda en la redacción del manuscrito y al Dr. Cuéllar por sus aportaciones durante la redacción del trabajo, enriqueciéndolo en enormemente.
Este estudio forma parte de una tesis doctoral en marcha en la Universidad de Santiago de Compostela.