El síncope neuralmente mediado (SNM) se define como una pérdida súbita y transitoria del estado de alerta debido a una caída brusca de la presión arterial (PA).
ObjetivosDescribir los mecanismos putativos fisiopatológicos responsables del SNM, el papel del barorreflejo (BR) y la interacción de sus variables hemodinámicas principales: frecuencia cardiaca (FC) y PA.
DesarrolloExiste una desregulación episódica en el control de las variables hemodinámicas (FC y PA) mediadas por el barorreflejo. Durante la bipedestación activa existe una caída profunda y transitoria de la PA sistólica (PAS) debida a la acción de la gravedad sobre la columna de sangre y probablemente también a una vasodilatación refleja producida por inhibición del reflejo vasosimpático. Las anormalidades del BR en el SNM pueden ser debidas a una mayor intensidad de la caída de la PA al ponerse de pie o a una vasoconstricción retardada o incompleta debido a un reflejo vasosimpático insuficiente o retardado.
ConclusionesLos pacientes con SNM tienen en reposo y antes del síncope un estado de hiperactividad simpática. Durante el ortostatismo activo o la inclinación pasiva hay taquicardia excesiva seguida de bradicardia e hipotensión severa. La recuperación de la caída de la PAS está retardada o incompleta.
Neurally-mediated syncope (NMS) is defined as a transient loss of consciousness due to an abrupt and intermittent drop in blood pressure (BP).
ObjectivesThis study describes the putative pathophysiological mechanisms giving rise to NMS, the role of baroreflex (BR), and the interaction of its main haemodynamic variables: heart rate (HR) and BP.
DevelopmentEpisodic dysregulation affects control over the haemodynamic variables (HR and BP) mediated by baroreflex mechanisms. During active standing, individuals experience a profound transient drop in systolic BP due to the effect of gravity on the column of blood and probably also because of reflex vasodilation. Abnormalities in the BR in NMS could be due to a more profound drop in BP upon standing, or to delayed or incomplete vasoconstriction resulting from inhibited or delayed sympathetic activity.
ConclusionsSympathetic hyperactivity is present in patients with NMS at rest and before syncope. During active standing or passive tilting, excessive tachycardia may be followed by bradycardia and profound hypotension. Recovery of systolic BP is delayed or incomplete.
Se define al síncope neuralmente mediado (SNM) como una pérdida súbita y transitoria del estado de alerta con recuperación espontánea y que se presenta por hipoperfusión cerebral generalizada como consecuencia de una caída brusca y profunda de la presión arterial (PA)1. La hipotensión ortostática inicial se define como aquella que se inicia 5-10 s después de haber adoptado la bipedestación, de corta duración,20-30 s, asociada a una disminución de la PA sistólica (PAS) inmediata de ∼40mmHg y/o diastólica de ∼20 mmHg2,3. Es muy común en pacientes jóvenes, se describe como causa de síncope en el 3,4% de los pacientes y representa la incidencia más alta entre las distintas causas de síncope situacional4. Su prevalencia es alta en la población general y su incidencia es bimodal y se incrementa durante la adolescencia y en mayores de 25 años. Es ligeramente más prevalente en mujeres, con un pico del 47% vs. 31% en varones adolescentes5,6.
En el estudio Framingham7 la incidencia de síncope demostró un incremento en pacientes mayores de 70 años, tanto en hombres como en mujeres. Así, se reveló un aumento en la incidencia de 5,7 por mil personas/año en hombres entre 60 y 69 años a 11,1 en hombres de 70 a 79 años8,9. Sin embargo, en adultos mayores, la incidencia acumulada de síncope se torna más difícil de obtener, por la dificultad en la recolección de datos7,8.
En el síncope vasovagal o neuralmente mediado, existe una desregulación intermitente y súbita en la actividad del sistema nervioso autónomo, que genera una caída en la PA, la frecuencia cardiaca (FC) y la perfusión cerebral10.
La reducción de la PA ortostática avanza con la edad, ocurriendo en el 14-20% de los pacientes que pertenecen a este grupo etario2,9. Su fisiopatología ha demostrado ser multifactorial, siendo la disfunción del barorreflejo la causa putativa más invocada11. El cortejo sintomático durante la hipotensión ortostática suele ser más común en adultos jóvenes. Esto podría ser explicado porque una caída en la PA sistémica produce un mayor descenso en el flujo sanguíneo cerebral, comparado con el adulto mayor12.
Existe un 5-8% de pérdida de las neuronas preganglionares autonómicas por década, iniciando en la adultez. Esto se torna sintomático cuando existe una pérdida neuronal del 50%. En el adulto mayor, el ortostatismo pasivo (inclinación) induce modificaciones que indican un decremento de la reactividad autonómica central y periférica; durante el ortostatismo activo (bipedestación) los cambios de la PA y de la FC son mucho más marcados que con la inclinación pasiva. La PA cae bruscamente y el aumento de la FC es mayor; se puede observar con toda claridad la actividad barorrefleja, aunque los cambios son menores que en los jóvenes. En los adultos mayores, existe un pobre o nulo incremento de la FC, descenso prematuro de la PA y retardo en el incremento de la resistencia periférica y de la recuperación de la PA; por lo tanto, este grupo etario es más proclive al síncope vasovagal13.
Además, la respuesta humoral al ortostatismo cambia con la edad. El sistema renina-angiotensina-aldosterona parece estar menos activo en la regulación de la PA durante el ortostatismo, aunque los valores de catecolaminas en reposo parecen estar incrementados en el adulto mayor. Se demuestran incrementos similares en individuos jóvenes en respuesta al ortostatismo13.
Clínicamente, se caracteriza de forma inicial por síntomas prodrómicos que pueden ocurrir hasta un minuto previo al evento y que incluyen diaforesis, palidez, náuseas, malestar abdominal y bostezo, y que son seguidos de síntomas visuales o auditivos, y dificultad en la concentración, entre otros10,14.
El SNM representa una causa significativa de morbilidad, siendo responsable del 1 al 2% de las visitas al departamento de urgencias15. Sus costos en el sistema de salud de los Estados Unidos, ascienden a 2,4 billones de dólares anuales en hospitalización16. Su puntuación en escalas de calidad de vida indica un impacto similar a otras enfermedades crónicas mayores, tales como la epilepsia17.
El diagnóstico de SNM se basa inicialmente en la historia clínica y el examen físico incluyendo la medida de la PA durante el ortostatismo. En la actualidad, existen 2 métodos para evaluar la respuesta al cambio postural: la bipedestación activa y la prueba de inclinación. La especificidad y la sensibilidad de la prueba de inclinación son difíciles de determinar dadas las diferencias metodológicas durante su realización. La ausencia de un estándar de oro hace difícil determinar resultados normales y anormales. Sin embargo, en estudios con voluntarios sanos y en pacientes con historia típica de síncope neuralmente mediado, la especificidad reportada es de alrededor del 90% y la sensibilidad varía del 32 al 85%18. Cuando se usa un agente facilitador, la sensibilidad se incrementa mientras la especificidad disminuye. La reproducibilidad de los resultados varía entre el 35 y el 85%. En un estudio reciente que evaluó la reproductibilidad de la prueba de inclinación, utilizando nitroglicerina sublingual como agente provocador, la reproductibilidad de un examen inicialmente negativo fue del 83%, mientras que la de un examen inicialmente positivo fue del 79%. La reproducibilidad promedio fue del 77%19.
Ross et al. reportaron una inducción de síncope dentro de los 11 min posteriores al ortostatismo activo, con una sensibilidad del 44%20. Balaji et al. reportaron una sensibilidad del 61%, con una duración de la prueba de 20 min21. El valor predictivo positivo no parece diferir entre el ortostatismo activo y la prueba de inclinación (el 43 y el 46%, respectivamente). Matsushima et al. reportaron una tasa de inducción de síncope de 27% con el ortostatismo activo y del 18% con la mesa basculante22.
Mecanismos de control del sistema cardiovascularEl control de las fluctuaciones hemodinámicas relaciona diferentes variables, como son las siguientes: 1) control de la FC y la resistencia periférica mediado por el barorreflejo; 2) propiedades del sistema arteriolar; 3) propiedades contráctiles del miocardio, y 4) efectos mecánicos de la respiración y de la gravedad en la PA23.
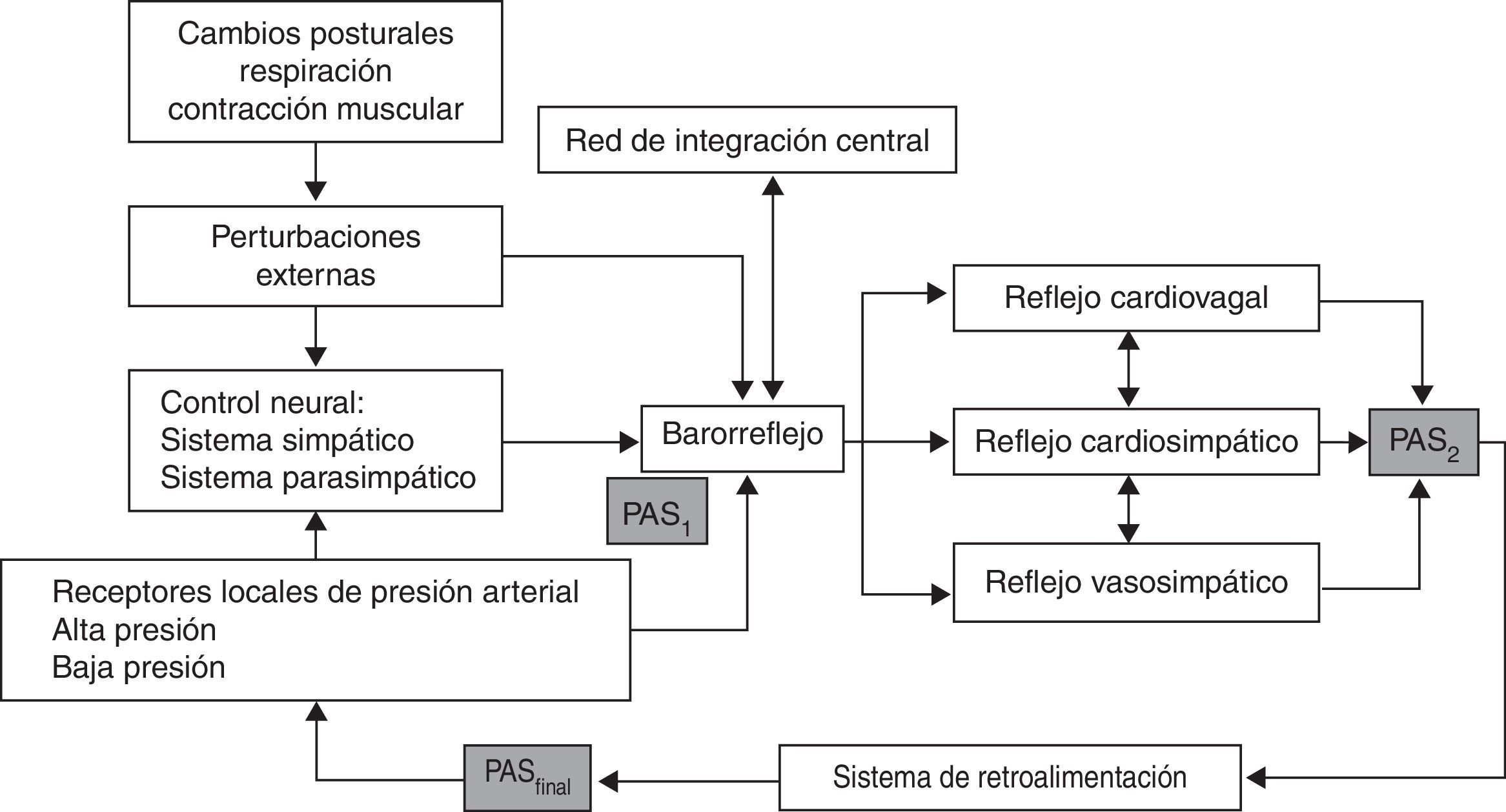
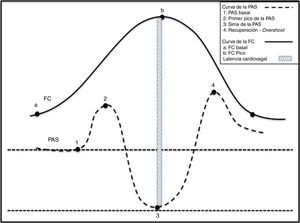
Regulación de la presión arterial y frecuencia cardiacaLa regulación de la PA y del flujo sanguíneo depende básicamente de 2 mecanismos (fig. 1)24:
- 1.
Regulación de órdenes centrales («central command»): genera cambios cardiovasculares que son parte de una respuesta fisiológica adaptativa de mecanismos supranucleares evocados por estímulos como las emociones, la actividad cognitiva y la contracción muscular, y mediados por diversos estructuras cerebrales como el hipotálamo, el sistema límbico, el cíngulo y la ínsula, que actúan sobre los centros cardiovasculares del bulbo raquídeo, tales como el núcleo del tracto solitario (NTS) y el vago.
- 2.
Mecanismo barorreflejo: permite un control latido a latido de la FC y la PA como respuesta a la estimulación de los receptores arteriales de alta y baja presión.
El barorreflejo controla las 2 variables que determinan la PA: el gasto cardiaco y la resistencia periférica total. En respuesta a una reducción de la PA, la disminución de la actividad del barorreceptor resulta en una excitación cardiosimpática, inhibición de la eferencia cardiovagal, que produce un incremento de la resistencia periférica total y taquicardia con aumento del gasto cardiaco. Un aumento de la PA, en contraste, aumenta la actividad del barorreceptor, lo que induce un incremento de la actividad cardiovagal, inhibición de la actividad cardiosimpática y vasosimpática, lo que da como resultado bradicardia e hipotensión23,24.
Este control se ejerce a través de sus efectos sobre las neuronas simpáticas vasoconstrictoras, responsables del mantenimiento de la resistencia total periférica. El componente simpático eferente del barorreflejo está mediado por neuronas preganglionares simpáticas que liberan acetilcolina, generando la excitación rápida de las neuronas noradrenérgicas posganglionares que inervan a la vasculatura responsable de la resistencia periférica24.
Fisiología del barorreflejoControl central y sistema de retroalimentaciónEl sistema nervioso autónomo, a través de sus 2 brazos, simpático (noradrenérgico) y parasimpático (colinérgico), controla las fluctuaciones latido a latido de la PAS. Las estructuras límbicas, corticales y mesencefálicas son las responsables de los cambios inmediatos en el tono simpático. Los cambios fisiológicos adaptativos, del sistema circulatorio, pues son componentes de una respuesta autonómica global y sus patrones de respuesta son menester del sistema nervioso central (SNC).
Los eferentes simpáticos barosensibles presentan un tono simpático, que es constante y está altamente sincronizado con las variaciones del pulso y la respiración. Estas neuronas, son las responsables de la regulación de la PAS a corto plazo y ejercen un control sobre los sistemas vascular y renal. Además, son sujeto de numerosas regulaciones reflejas que responden a sistemas de retroalimentación: ventilación, estiramiento muscular, receptores nociceptivos y quimiorreceptores, entre otros.
La región rostral ventrolateral del bulbo posee neuronas barosensibles que contribuyen al tono simpático, a través de su respuesta a impulsos cronotrópicos e inotrópicos, además de responder a la liberación de neurotransmisores. El NTS es un centro principal de la regulación del control circulatorio. Recibe aferencias cardiopulmonares (barorreceptores arteriales, receptores de volumen y quimiorreceptores periféricos) y polisinápticas de aferentes somáticos y simpáticos. Los barorreceptores arteriales son un brazo aferente del barorreflejo, responsable de la regulación de la PAS a corto plazo25,26.
El barorreflejo es un asa de retroalimentación continua que involucra mecanorreceptores activados por la distensión de la pared arterial. El incremento de la PAS excita estos barorreceptores, causando una inhibición refleja de los eferentes simpáticos cardiacos, renales y vasomotores, que generan la restauración de la PAS basal y, al mismo tiempo, un aumento en la actividad cardiovagal. Sin embargo, el barorreflejo es capaz de autocalibrarse para lograr un incremento de la PAS en respuesta a variaciones fisiológicas, sin reducir su sensibilidad. Este reajuste involucra mecanismos neurales y humorales25-27.
Sistema de retroalimentaciónEl modelo del efecto cronotrópico de la autorregulación negativa del barorreflejo divide el sistema en 2 partes: la primera se refiere a la actividad neural («frecuencia de disparo») en las terminaciones nerviosas que se dirigen hacia el corazón y que corresponde a la función de la PA. Este efecto es secundario a la regulación cardiaca de la presión por aumento del volumen latido. La segunda parte se refiere a la variación de la FC como función del sistema simpático y parasimpático.
Las mediciones en los controles sanos demuestran que existe un retardo en el tiempo de respuesta en el orden de los 10 s para la respuesta máxima mediada por el sistema nervioso simpático y de menos de 1 s para el sistema parasimpático. Este hecho puede ser explicado por la rápida hidrólisis de la acetilcolina liberada por el sistema parasimpático comparado con la recaptación y la depuración lenta de la norepinefrina liberada por el estímulo simpático del corazón14.
El efecto inotrópico de la autorregulación del barorreflejo es menos conocido, pero parece ser que el volumen sistólico se incrementa ligeramente con la PA media, a través del sistema nervioso simpático, dentro de un rango fisiológico considerable. Existen entonces diferencias significativas en el retardo de la respuesta mediada por los eferentes simpáticos y parasimpáticos. Así pues, después de un incremento súbito de la PA, la respuesta parasimpática produce una reacción inmediata (0,2-1,0 s). Contrariamente a lo que ocurre con la activación simpática a nivel cardiaco y vasomotor, cuya activación ocurre con un retardo de 2 a 3 s, y que alcanza su efecto máximo más lentamente26,27. Además, se ha observado una respuesta aún más lenta en el control reflejo del retorno venoso20.
Otras estructuras del SNC, además de factores humorales, conductuales y ambientales, están involucrados en la regulación del sistema cardiovascular y contribuyen al funcionamiento del barorreflejo. La respiración, por ejemplo, interactúa constantemente con la modulación del barorreflejo a través de sus efectos hemodinámicos y en la FC21.
Los mecanismos de control de la PA tienen como objetivo mantenerla en un estado estable, oscilando alrededor de un promedio («set point»), determinado por parámetros fisiológicos hacia los cuales converge el valor de la PA. Las fluctuaciones de la PAS y el intervalo de pulso (intervalo entre latidos [IBI, por sus siglas en inglés]) pueden cambiar en la misma dirección (mediada por el barorreflejo) o en dirección opuesta (mediada directamente por el sistema nervioso simpático).
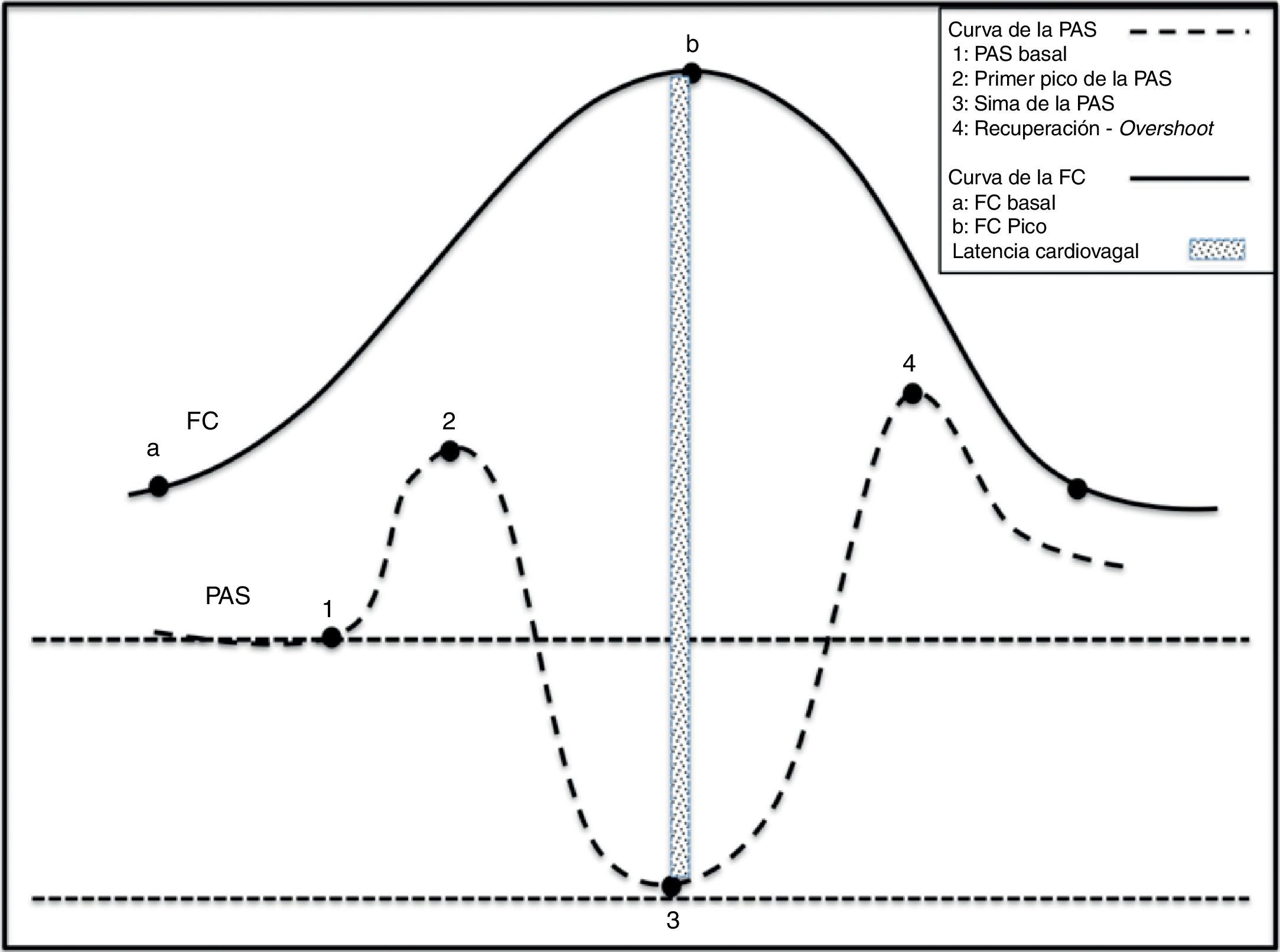
Fisiología de la bipedestación en relación a la presión arterial y la frecuencia cardiacaEvolutivamente, la bipedestación representó un cambio y un reto en la regulación de la PA, que se desarrolló para cumplir las necesidades del animal humano evolucionado a tener la cabeza por encima del corazón. En condiciones normales, el 25% del volumen sanguíneo circulante se encuentra en el tórax. Inmediatamente después de asumir la bipedestación, la gravedad produce un desplazamiento de 500ml de sangre al abdomen y a las extremidades inferiores. Aproximadamente, el 50% de este volumen se redistribuye en segundos. Este proceso genera un decremento del retorno venoso al corazón, así como de las presiones del llenado cardiaco, con la consiguiente reducción del gasto cardiaco izquierdo en un 40%. Normalmente, se alcanza una estabilización ortostática en menos de un minuto. Ocurre entonces antes de la estabilización una disminución de la PA y del retorno venoso a las cavidades derechas y después a las izquierdas. Este hecho genera una disminución súbita en la descarga de los receptores de alta presión del seno carotídeo y el arco aórtico, y de los receptores de baja presión localizados en el corazón y los pulmones (fenómeno conocido como unloading del barorreceptor). La desactivación del receptor induce taquicardia y vasoconstricción refleja para compensar la caída de la PA (fig. 2)28.
Cambios fisiológicos en las variables hemodinámicas durante la bipedestación activa. 1) Momento de la sedestación con incremento simultáneo de la PAS y de la FC. 2) Caída abrupta de la PAS y elevación de la FC. La taquicardia es refleja y consecuencia de la caída de la PAS. 3) Elevación gradual de la PAS y normalización de la FC. 4) Overshoot de la PAS.
El descenso del retorno venoso, de aproximadamente el 40%, también produce un menor estiramiento de los mecanorreceptores cardiacos, que están relacionados con aferentes vagales no mielinizados en las aurículas y ventrículos25,28.
Como resultado, las tasas de descarga disminuyen y el cambio en la entrada del estímulo al tronco cerebral incrementa el flujo de salida simpático, resultando así en vasoconstricción sistémica. Simultáneamente, la disminución de la PA durante la bipedestación activa los receptores de PA del seno carotídeo, estimulando un incremento de la FC. Esta caída de la PAS resulta en un aumento de la FC de 10 a 15 latidos por minuto y de 10mmHg en la presión diastólica, sin cambios significativos en la PAS.
Además, se activa una respuesta neurohumoral que es dependiente de volumen: mientras más pequeño sea este, mayor activación del sistema renina-angiotensina-aldosterona.
La disfunción de alguno de estos procesos puede resultar en un fallo de respuestas normales a los cambios posturales. La subsecuente hipotensión puede generar hipoperfusión cerebral, hipoxia y pérdida del estado de alerta.
La bipedestación activa genera en el momento de sentarse después de estar en decúbito una contracción muscular abdominal y en los miembros inferiores, que contribuye al incremento del retorno venoso y del flujo sanguíneo, que resultan en un aumento abrupto de la FC y de la PA con pico a los 12 s (aproximadamente 15 latidos) posteriores a la bipedestación. El incremento inicial de la FC se atribuye a una súbita inhibición del tono vagal, mientras el incremento posterior, más gradual, se debe a una inhibición vagal adicional y a un incremento de la actividad cardiosimpática. La taquicardia inicial se ha explicado por un «reflejo de ejercicio» («exercise reflex»)29, evocado, probablemente, por la integración de señales aferentes derivadas de la contracción muscular con señales del SNC, tales como la ínsula y la corteza del cíngulo. Este hecho resulta en una respuesta directamente proporcional a la intensidad del ejercicio. La desactivación del barorreflejo por hipotensión transitoria causa el incremento posterior de la FC30. Durante este primer momento de la sedestación el barorreflejo se desactiva porque de otra manera, la hipertensión aboliría la taquicardia refleja, lo que no ocurre muy probablemente por ser una orden central («central command»). Posterior a esta primera elevación de la presión con taquicardia, sobreviene en los individuos sanos una caída brusca de la PA. Se ha postulado que este descenso no solo es debido a la acción de la gravedad, sino a un mecanismo reflejo de vasodilatación producido por la desactivación de los barorreceptores de baja presión cardiopulmonares. La FC y la PA retornan a una nueva línea de base en 30 s aproximadamente31. Este proceso se esquematiza en la figura 2.
Esta adaptación fisiológica a la bipedestación demuestra que el barorreflejo es capaz de adaptarse rápidamente al estrés postural, en condiciones normales32,33.
En resumen, se proponen entonces varios mecanismos fisiológicos para explicar el fenómeno y que están en relación con la fisiopatología del síncope durante la bipedestación activa; estos son:
- 1.
Contracción muscular con activación de reflejos de origen muscular.
- 2.
Presencia de mediadores de vasodilatación local.
- 3.
Retiro del sistema simpático mediado por receptores cardiopulmonares con inhibición vasosimpática y desactivación de los barorreceptores: primero los cardiopulmonares de baja presión y posteriormente los receptores carotídeos y aórticos de alta presión.
- 4.
Efecto de la gravedad al ponerse de pie: disminución del retorno venoso y bajo gasto cardiaco.
Durante la bipedestación activa existe una caída de la presión en la aurícula derecha, del retorno venoso y del gasto cardiaco, por la acción de la aceleración gravitatoria sobre la columna de sangre arterial y venosa. Cuando la sangre de los miembros inferiores es impulsada hacia abajo, se expone al segmento inferior del cuerpo a una presión negativa de –10 a –15mmHg. La caída de la presión venosa central no se asocia inmediatamente a taquicardia, pero se mantiene la PA asociada a vasoconstricción que puede ser medida en el antebrazo. Este hecho indica que existen otros reflejos que contribuyen a la homeostasis circulatoria, como los receptores cardiopulmonares de baja presión, además de la respuesta de los distintos lechos vasculares a este reflejo34,35.
Por otro lado, se conoce que el incremento de la presión auricular por el aumento del retorno venoso en ciertas circunstancias, como acostarse, levantar las piernas o la inspiración brusca, también aumenta la FC, a veces hasta en un 75%. Una parte de este incremento (15%) se debe al efecto directo del aumento de volumen sobre el nodo sinusal. La fracción restante se debe al reflejo auricular de Bainbridge. Este reflejo explica que los receptores de estiramiento de las aurículas transmiten señales aferentes a través de los nervios vagos al bulbo raquídeo. Posteriormente, las señales eferentes se transmiten a través de los nervios vagos y simpáticos para generar taquicardia e inotropismo.
Comportamiento del barorreflejo en el síncope vasovagalEn el SNM, después de un periodo de incremento del tono simpático, se desencadena un retiro súbito de este, lo que genera hipotensión y vasodilatación paradójica. La activación cardiovagal mediada por el retiro cardiosimpático produce bradicardia. Al mismo tiempo ocurre un retiro de la actividad cardiosimpática con caída de las resistencias periféricas y, por lo tanto, de la PAS. Si la perfusión cerebral cae lo suficiente, resultará en una pérdida del estado de alerta.
Se ha asumido desde hace tiempo que el mecanismo responsable de la vasodilatación y la bradicardia se debe a una estimulación excesiva de los mecanorreceptores mediada por la contracción intensa de un ventrículo izquierdo insuficientemente lleno, generando señales paradójicas al SNC (reflejo de Bezoldt-Jarisch). Sin embargo, actualmente existe evidencia de otros mecanismos, tales como una regulación autonómica aberrante, presencia de vasodilatadores endógenos, compromiso funcional del barorreflejo y regulación paradójica del SNC. Todos ellos pueden desempeñar un papel importante y convertirse en el objetivo de futuros abordajes terapéuticos.
Recientemente, se ha demostrado en pacientes con SNM un incremento de la sensibilidad vascular tanto central como periférica al CO2, hecho que podría explicar, en parte, el hecho de que algunos individuos son más susceptibles a este fenómeno36.
Aunque no se reconocen con certeza los factores que contribuyen a la diferencia existente entre la respuesta normal del barorreceptor a la bipedestación y la respuesta durante el síncope inducido por la prueba de inclinación pasiva o la bipedestación activa, la magnitud del estrés hemodinámico puede desempeñar un papel importante.
Los factores neurohumorales también son determinantes en la sensibilidad del barorreflejo durante el síncope vasovagal. Durante el síncope, existe una gran liberación neurohumoral a pesar de la ausencia concomitante del influjo simpático37. Se han identificado 4 fases que describen el comportamiento de las variables hemodinámicas y, consiguientemente, del barorreflejo en los momentos previos inmediatos al desarrollo del SNM: la primera fase de compensación se refiere a la hipotensión transitoria, que retorna a la basal en 30 s aproximadamente, con una presión diastólica que permanece por encima de la línea de base. La taquicardia concomitante y que persiste posteriormente, con una duración promedio de 4 min, pertenece a una segunda fase que responde a una inhibición abrupta de la actividad cardiovagal. Este bloqueo se atribuye al «reflejo del ejercicio» («exercise reflex»). En pacientes que desarrollarán SNM se describe una tercera fase de inestabilidad, con oscilaciones de la FC y la PA. Aunque la FC se incrementa, este incremento no alcanza los valores previos e igualmente el decremento de la PAS no alcanza los valores de la fase de compensación. Esta fase se relaciona con el inicio del cortejo clínico sintomático del presíncope y tiene una duración promedio aproximada de 2,1 min. Finalmente, se desarrolla el presíncope que se asocia hemodinámicamente a una caída súbita de la PA y bradicardia, con la posterior recuperación o desarrollo del síncope37.
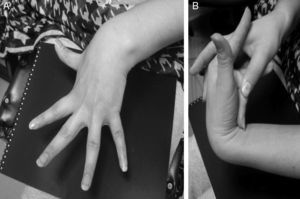
Un mecanismo adicional, que puede explicar el papel de la disautonomía en la génesis del SNM, inicialmente descrito en pacientes con taquicardia postural ortostática (POTS, por sus siglas en inglés), es la denervación autonómica regional usualmente encontrada en las extremidades inferiores (teoría neuropática). Este hecho puede ser responsable de la respuesta anormal a la maniobra de Valsalva como la reducción del incremento de la PA, por disminución de la respuesta simpática vasoconstrictora. Además, se ha descrito la disminución de la secreción de acetilcolina en respuesta a maniobras fisiológicas y a estímulos farmacológicos38. Por otro lado, parece ser que algunos pacientes presentan una acumulación excesiva de sangre en los miembros inferiores durante la bipedestación, que puede ser explicado por una excesiva distensibilidad («compliance») y un incremento de la capacitancia de la vasculatura venosa durante el ortostatismo. Este hecho puede explicar el incremento de incidencia del síncope en pacientes con síndromes de hipermovilidad articular o síndrome de Ehlers-Danlos tipo iii (fig. 3)38.
El barorreflejo tiene, por lo menos, 2 aferencias: los receptores de alta presión localizados en las arterias carótidas y aorta, y los receptores de baja presión, localizados en las cavidades derechas y la circulación pulmonar, y 3 eferencias: el reflejo cardiovagal, el reflejo cardiosimpático y el reflejo vasosimpático26,30,38-41. Además, una red de integración central localizada en el núcleo del tracto solitario (NTS), el núcleo ambiguo, la región ventrolateral del bulbo y la columna intermediolateral de la médula espinal40,42. Es un reflejo polisináptico, con influencia de estructuras supranucleares como el hipotálamo, el sistema límbico y la corteza insular26,39,43. Esta influencia supranuclear no es bien entendida aún, pero se relaciona con alteraciones de la PA atribuidas a mecanismos o comandos centrales y está asociada a emociones, actividades cognitivas y contracción muscular voluntaria26,38,43. El propósito del barorreflejo es estabilizar la PA a corto plazo ante las múltiples variaciones generadas por estímulos internos o externos a los que se expone de manera constante39. Los 2 cambios externos principales que inducen alteraciones hemodinámicas conocidos son el estrés gravitacional y los movimientos respiratorios (fig. 1)42,44,45.
Durante el ortostatismo activo se genera una caída profunda de la PA durante los primeros 30 s (40mmHg), además de un incremento significativo de la FC (∼15 latidos) y del gasto cardiaco acompañado de una disminución significativa de la resistencia periférica22. Se ha demostrado en pacientes con síncope neuralmente mediado una reducción marcada de la sensibilidad del barorreflejo. El análisis de la fluctuación espontánea de la FC indica que los pacientes con pobre tolerancia ortostática tienen una latencia prolongada de la respuesta cardiaca al barorreflejo. El análisis de pacientes sanos demuestra que la sensibilidad decrece proporcionalmente al ángulo de inclinación corporal y que la adaptación dinámica del barorreflejo a una alteración fisiológica ocurre de manera rápida. El que el incremento de la latencia del barorreflejo sea proporcional al ángulo de inclinación indica que el compromiso funcional del barorreflejo resulta de una actividad vagal reducida y un incremento del tono simpático32,46. Así pues, se conoce que los cambios vagales mediados por el barorreflejo inducidos por el cambio postural, además de los efectos vagotónicos y vagolíticos de la atropina, están asociados con el retardo en el tiempo entre el estímulo del barorreceptor y la respuesta de la FC46,47.
Se ha demostrado que en pacientes con síncope vasovagal la disminución del reflejo cardiosimpático y vasosimpático, con la consecuente inestabilidad hemodinámica, se asocia significativa e independientemente a la recurrencia del síncope47.
ConclusionesEl SNM es un trastorno frecuente que puede ocurrir a cualquier edad y tiene una predisposición genética y familiar, habiéndose observado en pacientes con síndrome de Ehlers-Danlos tipo iii con hipermotilidad articular. Generalmente, ocurre en individuos que no tienen una afección cardiaca o neurológica. Desde el punto de vista fisiopatológico, se caracteriza por un estado inicial de hiperactividad simpática que clínicamente se traduce en taquicardia, sudoración, temblor y vasoconstricción cutánea. En el momento del síncope, la hiperactividad simpática, tanto a nivel del corazón como de los vasos resistentes, bruscamente se retira y se instala un incremento de la actividad cardiovagal que puede producir asistolia o bradicardia marcada; además, la retirada de la actividad simpática a los vasos sanguíneos (el reflejo vasosimpático) puede producir vasodilatación marcada con hipotensión severa. Su carácter intermitente permanece enigmático y lo ha hecho difícil de estudiar. La hipótesis más plausible se basa en la presencia de una disfunción intermitente del control barorreflejo de la PA y de la FC, que puede ocurrir a nivel periférico o central.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.