Actualizar las guías terapéuticas del Comité ad hoc del Grupo de Estudio de Enfermedades Cerebrovasculares de la SEN en el tratamiento preventivo de ictus isquémico (II) y ataque isquémico transitorio (AIT).
MétodosRevisión de evidencias disponibles sobre la prevención del ictus isquémico y AIT en función del subtipo etiológico. Los niveles de evidencia y grados de recomendación se han basado en la clasificación del Centro de Medicina Basada en la Evidencia.
ResultadosEn el II de origen aterotrombótico reducen el riesgo de recurrencias el tratamiento antiagregante y los procedimientos revascularizadores en casos seleccionados de estenosis carotidea ipsilateral (70-99%). La prevención de II de origen cardioembólico (fibrilación auricular, valvulopatías, prótesis valvulares y en infarto de miocardio con trombo mural) se basa en el uso de anticoagulantes orales. En el II de origen inhabitual, las terapias preventivas dependerán de la etiología; en la trombosis venosa cerebral la anticoagulación oral es eficaz.
ConclusionesSe concluye con recomendaciones de práctica clínica en prevención de ictus isquémico y AIT adaptadas al subtipo etiológico de II que ha presentado el paciente.
To update the ad hoc Committee of the Cerebrovascular Diseases Study Group of The Spanish Neurological Society guidelines on prevention of ischaemic stroke (IS) and Transient Ischaemic Attack (TIA).
MethodsWe reviewed the available evidence on ischaemic stroke and TIA prevention according to aetiological subtype. Levels of evidence and recommendation levels are based on the classification of the Centre for Evidence-Based Medicine.
ResultsIn atherothrombotic IS, antiplatelet therapy and revascularization procedures in selected cases of ipsilateral carotid stenosis (70%-90%) reduce the risk of recurrences. In cardioembolic IS (atrial fibrillation, valvular diseases, prosthetic valves and myocardial infarction with mural thrombus) prevention is based on the use of oral anticoagulants. Preventive therapies for uncommon causes of IS will depend on the aetiology. In the case of cerebral venous thrombosis oral anticoagulation is effective.
ConclusionsWe conclude with recommendations for clinical practice in prevention of IS according to the aetiological subtype presented by the patient.
Las enfermedades cerebrovasculares (ECV) constituyen la 1.ª causa de muerte en mujeres y la 3.ª en varones en España1 y representan el mayor motivo de incapacidad. Las medidas de prevención que vamos a exponer aquí están encaminadas tanto a prevenir un primer episodio de ictus isquémico (II) como las recurrencias en aquellos pacientes que ya han sufrido algún episodio. Además tendremos que considerar también medidas destinadas a reducir el riego vascular global en estos pacientes2. Dada la extensión de este capítulo se ha considerado conveniente publicarlo en dos partes. En una primera parte se han revisado los factores de riesgo3 y la oportunidad de su modificación para prevenir un II, y en esta segunda parte detallaremos las diferentes opciones de tratamiento preventivo según el subtipo de ictus. Las recomendaciones de cada apartado se han resumido en tablas para favorecer su exposición. Los niveles de evidencia y grados de recomendación se han basado en la clasificación del Centro de Medicina basada en la evidencia de la Universidad de Oxford4 (tabla 1). Para facilitar la lectura, y de acuerdo a los criterios actuales, se ha optado por incluir en la denominación de ictus isquémico al AIT. Por tanto, todas las recomendaciones recogidas en esta guía de práctica clínica se refieren a la prevención de la isquemia cerebral focal en general, sin distinciones entre infarto cerebral o AIT
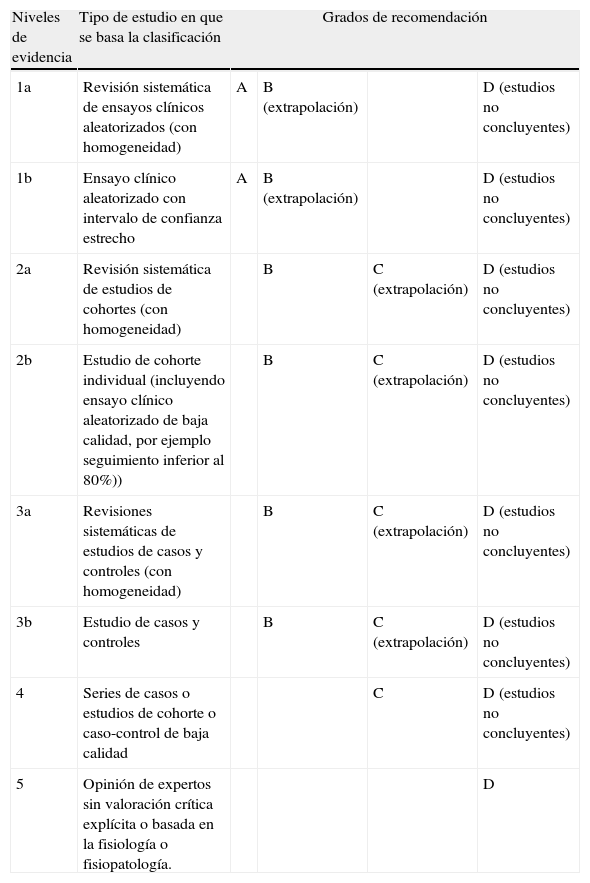
Niveles de evidencia y grados de recomendación
| Niveles de evidencia | Tipo de estudio en que se basa la clasificación | Grados de recomendación | |||
| 1a | Revisión sistemática de ensayos clínicos aleatorizados (con homogeneidad) | A | B (extrapolación) | D (estudios no concluyentes) | |
| 1b | Ensayo clínico aleatorizado con intervalo de confianza estrecho | A | B (extrapolación) | D (estudios no concluyentes) | |
| 2a | Revisión sistemática de estudios de cohortes (con homogeneidad) | B | C (extrapolación) | D (estudios no concluyentes) | |
| 2b | Estudio de cohorte individual (incluyendo ensayo clínico aleatorizado de baja calidad, por ejemplo seguimiento inferior al 80%)) | B | C (extrapolación) | D (estudios no concluyentes) | |
| 3a | Revisiones sistemáticas de estudios de casos y controles (con homogeneidad) | B | C (extrapolación) | D (estudios no concluyentes) | |
| 3b | Estudio de casos y controles | B | C (extrapolación) | D (estudios no concluyentes) | |
| 4 | Series de casos o estudios de cohorte o caso-control de baja calidad | C | D (estudios no concluyentes) | ||
| 5 | Opinión de expertos sin valoración crítica explícita o basada en la fisiología o fisiopatología. | D | |||
Fuente: Adaptación de Centre for Evidence Based Medicine (CEBM)1
Además de la modificación de los FR, se recomienda el uso de antiagregantes plaquetarios y en pacientes seleccionados endarterectomía carotídea o angioplastia transluminal percutánea.
Recomendaciones. Prevención de ictus isquémico asociado a arterioesclerosis de gran vaso y enfermedad de pequeño vaso
| Recomendaciones | Nivel de evidencia y clase de recomendación | |
| Antiagregantes plaquetarios | -Se recomienda tratamiento con fármacos antiagregantes para prevenir recurrencias | Nivel de evidencia 1a; recomendación grado A |
| -AAS (dosis 50-300mg al día) reduce el riesgo absoluto de ictus, IAM o muerte vascular respecto a placebo, considerándose un fármaco de primera elección. | Nivel de evidencia 1a; recomendación grado A | |
| -Clopidogrel (75 mg/d) en pacientes con enfermedad aterosclerótica (IAM, Ictus o enfermedad arterial periférica), es discretamente superior al AAS en la reducción del riesgo de ictus, IAM y muerte vascular, considerándose un fármaco de primera elección. | Nivel de evidencia 1b; recomendación grado A | |
| -Triflusal 600 mg/d ha demostrado eficacia similar al AAS con menores complicaciones hemorrágicas, considerándose un fármaco de primera elección. | Nivel de evidencia 1a; recomendación grado A | |
| -La combinación AAS (25 mg)/Dipiridamol (200mg en liberación retardada), dos veces al día reduce el riesgo de ictus de forma similar al clopidogrel | Nivel de evidencia 1b; recomendación grado A | |
| -No se recomienda la combinación de AAS y clopidogrel en prevención de ictus por arterioesclerosis de gran vaso o por enfermedad de pequeño vaso | Nivel de evidencia 1b; recomendación grado A | |
| Anticoagulantes orales | -No se recomienda la anticoagulación oral en la prevención de ictus por arterioesclerosis de gran vaso, por enfermedad de pequeño vaso, ni en la estenosis de arterias intracraneales, salvo en pacientes con intolerancia o contraindicación a antiplaquetarios o coexistencia con cardiopatía embolígena | Nivel de evidencia 1a; recomendación grado A |
| Endarterectomía carotídea | -Se recomienda la endarterectomía carotídea en los pacientes con estenosis carotidea ipsilateral del 70-99% que hayan presentado AIT, amaurosis fugax o IC con secuelas menores en los 6 meses anteriores y en centros con una tasa de morbimortalidad quirúrgica inferior a 6% | Nivel de evidencia 1a; recomendación grado A |
| -Podría recomendarse en pacientes con estenosis 50-69%, varones con factores de riesgo y con síntomas hemisféricos recientes | Nivel de evidencia 1b; recomendación grado A | |
| -Estenosis inferiores a 50% no deben someterse a este tratamiento | Nivel de evidencia 1b; recomendación grado A | |
| -En el caso de AIT o ictus menores debería realizarse dentro de las 2 primeras semanas tras el episodio | Nivel de evidencia 1a; recomendación grado A | |
| Angioplastia transluminal percutánea de carótida | -La angioplastia transluminal percutánea puede indicarse como alternativa a la endarterectomia carotidea en casos sintomáticos de estenosis carotídea superior al 50% por arteriografía o ≥70% por medio de estudios no invasivos, especialmente en pacientes con alto riesgo para endarterectomía dificultades técnicas, re-estenosis tras endarterectomía, estenosis post-radioterapia, o contraindicaciones médicas como la enfermedad coronaria grave. | Nivel de evidencia 1b; recomendación grado A |
| Anastomosis extra-intracerebral | -No se recomienda la anastomosis extra-intra cerebral | Nivel de evidencia 1b; recomendación grado B |
| Tratamiento endovascular intracraneal | -En pacientes con estenosis intracraneal sintomática se recomienda tratamiento médico que incluya antiagregación plaquetaria, estatinas y modificación de factores de riesgo. No se recomienda el tratamiento endovascular. | Nivel de evidencia 2b; recomendación grado B |
Reduce el riesgo absoluto de ictus, IAM o muerte vascular respecto a placebo en un 13-25%5-7. Es un antiagregante de primera elección y la dosis recomendada es de 100-300mg/d8,9.
ClopidogrelEn pacientes con enfermedad aterosclerótica (IAM, ictus o enfermedad arterial periférica), es discretamente superior al AAS en la reducción del riesgo de ictus, IAM y muerte vascular (reducción del riesgo relativo del 8,7%), con menos hemorragias digestivas y con idéntico riesgo de neutropenia10. Subanálisis del estudio CAPRIE constataron que en pacientes con ictus previo, clopidogrel no fue más eficaz que AAS10, aunque sí lo fue en el subgrupo de pacientes con historia previa de aterosclerosis sintomática (II o IAM previos)11. Estas observaciones deben considerarse con cautela ya que el estudio CAPRIE no fue diseñado para analizar subgrupos. Clopidogrel a dosis de 75mg/d, se considera un fármaco de primera elección, especialmente en casos de intolerancia al AAS.
TriflusalSu administración a dosis de 600mg/d ha demostrado eficacia similar al AAS con menores complicaciones hemorrágicas12–14, considerándose también de primera elección.
DipiridamolAunque reduce las recurrencias de ictus en un 18% en relación al placebo, no se usa en monoterapia ya que no tiene efecto sobre la muerte de origen vascular15.
CilostazolEl estudio Second Cilostazol Stroke Prevention Study (CSPS2) en pacientes asiáticos con II mostró que cilostazol (100mg/12h) no era inferior, e incluso podría ser superior al AAS (81mg/d) en prevención de recurrencias de ictus, con menor frecuencia de complicaciones hemorrágicas16. Un reciente meta-análisis Cochrane confirma la superioridad de cilostazol frente a AAS en la prevención de recurrencias en pacientes con II17.
Otros antiagregantes en investigación:SarpogrelatoTiene una eficacia similar al AAS en la prevención secundaria de ictus con una menor tasa de complicaciones hemorrágicas18.
SCH 530348El estudio TRA-TIMI50ha tenido que interrumpir prematuramente el seguimiento de los pacientes con ictus por un incremento en el riesgo de hemorragias, y continúa en investigación en pacientes con cardiopatía isquémica o enfermedad arterial periférica.
PrasugrelPresenta una reducción significativa de episodios cardiovasculares comparados con clopidogrel en pacientes con riesgo moderado-alto de síndrome coronario agudo tratados con intervención coronaria percutánea, aunque con mayor número de complicaciones hemorrágicas mayores y con una mortalidad similar en ambos grupos19. No se recomienda su uso en pacientes con ictus o AIT reciente y no hay ensayos de prevención secundaria de ictus.
TicagrelorEn pacientes con síndrome coronario agudo reduce, comparado con clopidogrel, el número de IAM y de muerte vascular o de cualquier causa, pero no el número de ictus. No hay diferencias en el número global de complicaciones hemorrágicas mayores, pero sí en el porcentaje de hemorragias cerebrales fatales20. No hay estudios específicos de prevención secundaria en pacientes con ictus.
Asociación de antiagregantes:AAS y dipiridamolLos estudios ESPS2 y ESPRIT fueron los primeros en señalar la superioridad de la combinación de AAS y dipiridamol (AAS/DPR) en la prevención de episodios vasculares frente al AAS21,22, aunque la validez de estos resultados se cuestionó por problemas metodológicos. Una revisión sistemática mostró que la combinación AAS/DPR, en comparación con AAS, reduce el riesgo de un nuevo ictus no fatal en un 23%23. Sin embargo, la comparación frente a clopidogrel en el estudio PRoFESS mostró que la combinación AAS 25mg/DPR 200mg de liberación prolongada administrada dos veces al día no es superior a clopidogrel 75mg/d en la prevención de recurrencias de ictus24, ni en términos de recuperación funcional25 o de desarrollo de deterioro cognitivo26.
AAS y clopidogrelEl estudio MATCH comparó la eficacia de la combinación de AAS 75mg/d y clopidogrel 75mg/día (AAS/CLP) frente a clopidogrel en pacientes con antecedentes de ictus o AIT, sin mostrar beneficio con la combinación y sí un incremento significativo de riesgo hemorrágico27. El estudio CHARISMA28 en pacientes con enfermedad vascular clínicamente evidente o con múltiples FR tampoco consiguió mostrar mayor eficacia en reducción de ictus con AAS/CLP frente a AAS en monoterapia. Está en marcha el estudio Secondary Prevention of Small Subcortical Strokes (SPS3), que entre otros objetivos trata de evaluar la eficacia de la asociación AAS/CLP en la reducción de recurrencias de ictus en pacientes con enfermedad de pequeño vaso cerebral.
OtrasSe han ensayado otras combinaciones de antiagregantes plaquetarios, incluyendo AAS/DPR/CLP, así como la combinación de AAS/CLP con inhibidores de la Gp IIb/IIIA, pero en ninguno de estos casos existen datos suficientes como para realizar recomendaciones de prevención de ictus29.
Anticoagulantes orales:El estudio SPIRIT30 comparó la anticoagulación oral de alta intensidad (INR, 3,0 a 4,5) con AAS (30mg/d) y fue interrumpido prematuramente debido a un exceso de complicaciones hemorrágicas en el grupo de anticoagulación. El estudio WARSS31 utilizó warfarina ajustada para un INR de 1,4 a 2,8 versus 325mg/d de AAS, sin demostrarse diferencias a 2 años. El estudio ESPRIT concluyó que la anticoagulación oral de intensidad media (INR 2-3) no era más efectiva que AAS en la prevención secundaria de II y que el posible efecto protector se contrarrestaba por el exceso de complicaciones hemorrágicas32. Una revisión sistemática mostró que los anticoagulantes (INR hasta 2,6) no presentaban ventajas frente al tratamiento antiagregante ni en el riesgo de muerte de origen vascular ni para la mortalidad global. Además, el tratamiento anticoagulante intenso (INR 3 a 4,5) se asoció a un aumento significativo de la mortalidad total y los episodios hemorrágicos graves33.
Los datos referentes a determinados casos particulares de ictus no cardioembólicos son:
Estenosis de arterias intracranealesEl estudio WASID en estenosis intracraneal sintomática fue interrumpido prematuramente por mayores tasas de complicaciones hemorrágicas con warfarina y sin beneficio sobre 1.300mg/día de AAS34.
Estenosis de la arteria basilarUn análisis del estudio WASID sugirió que estos pacientes podrían beneficiarse del tratamiento anticoagulante, aunque sin diferencias significativas35.
Ictus recurrentes a pesar de tratamiento antiagreganteNo se ha encontrado beneficio con la anticoagulación oral en estos pacientes35.
Procedimientos de intervención vascularEstenosis de arteria carótida extracranealEndarterectomía carotídeaEn la estenosis carotídea sintomática >70%, la endarterectomía ofrece mayor beneficio que el tratamiento médico. En el NASCET el beneficio fue de un 17% a los dos años36 y de 14% a los tres años en el ECST37. En las estenosis moderadas (50-69%) el beneficio de la endarterectomía carotídea es menor (reducción absoluta de riesgo 4,5% a los 5 años)38 y sin beneficio significativo en las estenosis <50%38,39. Por otra parte, un meta-análisis que incluye los estudios ECST y NASCET señaló mayor beneficio de la endarterectomía en varones, mayores de 75 años y si se realiza en las dos primeras semanas tras el ictus o AIT, perdiendo eficacia posteriormente40. Actualmente se considera indicada en los pacientes con estenosis carotídea 70-99% sintomática, con expectativa de vida mayor de 5 años y tasa de morbimortalidad quirúrgica del centro inferior a 6%41–43. En los pacientes con estenosis carotídea 50-69% sintomática se podría considerar la endarterectomía, pero teniendo en cuenta variables que pueden condicionar la relación riesgo beneficio: sexo femenino (sin claro beneficio en los ensayos clínicos); la manifestación inicial como II hemisférico (mejores resultados que la isquemia retiniana); o la presencia de una oclusión carotídea contralateral que asocia un mayor riesgo perioperatorio aunque mantiene el beneficio42,43. En los pacientes con estenosis carotídea <50% está indicado el tratamiento médico sin endarterectomía41–43.
Angioplastia transluminal percutáneaEsta técnica ha tenido buenos resultados en pacientes con displasia fibromuscular, lesiones por radioterapia o reestenosis postendarterectomía y se ha planteado como alternativa de tratamiento en la enfermedad estenosante arterioesclerótica. El estudio CAVATAS mostró resultados similares a la endarterectomía, tanto en eficacia como en seguridad44. Los avances técnicos han introducido balones específicos de dilatación, stent y finalmente filtros de protección distal. Utilizando angioplastia carotídea y stent, el estudio SAPPHIRE mostró un beneficio superior a la endarterectomía en pacientes de alto riesgo quirúrgico y con estenosis carotídea sintomática o asintomática45. La interrupción prematura del estudio EVA-3S por un exceso de ictus o muerte a los 30 días en el grupo de angioplastia carotídea46 y el fracaso del estudio SPACE en demostrar la no inferioridad de esta técnica frente a la endarterectomía carotídea47, cuestionaron la angioplastia carotídea como una alternativa segura. Sin embargo, el seguimiento a largo plazo (2-4 años) ha mostrado una equivalencia en la reducción de II ipsilaterales entre ambas técnicas, si bien se insiste en la necesidad de mejorar la seguridad a corto plazo de la angioplastia carotídea con stent48,49. Un meta-análisis señala que el tratamiento endovascular se asocia a un discreto incremento de ictus o muerte en los 30 días tras el procedimiento, sin diferencias significativas entre los dos grupos en las tasas de ictus incapacitante o muerte en los 30 días. Por otra parte, el tratamiento quirúrgico se asoció a un incremento significativo de paresia de nervio craneal y de IAM50. El estudio ICSS51 mostró una diferencia de riesgo absoluto de ictus, muerte o IAM a los 120 días del 3,3% favorable a la endarterectomía. El estudio CAVATAS52 mostró una mayor incidencia de ictus no perioperatorio en pacientes asignados al tratamiento endovascular (21,1%) frente a los sometidos a la endarteretomía (15,4%). Esta diferencia se observó más allá de los dos años de la randomización y podría ser explicada por la mayor incidencia de reestenosis después de la angioplastia. En el CAVATAS únicamente un pequeño grupo de pacientes fueron tratados con stent (22%). No se conoce la verdadera incidencia a largo plazo de reestenosis pos-stent. En el estudio CREST en pacientes con estenosis carotídea de alto grado sintomática (53%) y asintomática (47%) no se observaron diferencias significativas respecto al objetivo primario del estudio, pero durante el periodo periprocedimiento, hubo un mayor riesgo de ictus no incapacitante con el stent y un mayor riesgo de IAM con la endarterectomía53. Un aspecto importante es que a largo plazo (cuatro años), las tasas de ictus recurrente fueron muy bajas para ambas opciones terapéuticas, lo que podría explicarse en parte por el alto porcentaje de pacientes asintomáticos incluidos. Entre los factores asociados a un mayor riesgo de ictus o muerte periprocedimiento en la angioplastia carotídea con stent destacan el sexo masculino, la edad >70 años, ictus previo y el haber presentado un ictus frente a un AIT48,54.
En el caso de estenosis sintomática de arteria carótida común, la revascularización mediante angioplastia carotídea, reconstrucción arterial directa o bypass extra-anatómico se consideran opciones razonables, aunque sin evidencias que permitan establecer recomendaciones55.
Estenosis de arteria vertebral extracraneal o de la arteria subclaviaLas indicaciones de revascularización en la estenosis de la arteria vertebral proximal son poco frecuentes ya que la arteria contralateral generalmente suple suficiente flujo a la arteria basilar. En los casos con recurrencias a pesar del adecuado tratamiento médico, podría considerarse el tratamiento quirúrgico o endovascular, aunque no hay evidencias suficientes para hacer una recomendación en relación con éstas42,55. Las opciones de cirugía incluyen la endarterectomía vertebral trans-subclavia, trasposición de la arteria vertebral a la arteria carótida común ipsilateral, y la reimplantación de la arteria vertebral con extensión mediante injerto venoso a la arteria subclavia. Con respecto al tratamiento endovascular, el único estudio aleatorizado en pacientes con estenosis de la arteria vertebral fue el CAVATAS que aleatorizó 16 pacientes a tratamiento endovascular con tratamiento médico o tratamiento médico solo56. En los casos de isquemia cerebral en territorio cerebral posterior por estenosis de la arteria subclavia, podría considerarse la realización de un by-pass extra-anatómico carótido-subclavia en los casos de bajo riesgo quirúrgico o la angioplastia percutánea con colocación de stent en los casos de alto riesgo de complicaciones quirúrgicas55.
Estenosis arterial intracranealEl ensayo WASID demostró un riesgo anual de ictus del 11% a pesar del mejor tratamiento médico, y del 19% en el subgrupo con estenosis ≥70%34. Estos pacientes presentan un alto riesgo de recurrencia isquémica en el territorio de la arteria estenosada observado igualmente en el territorio vertebrobasilar (12% tras 1 año y 15% tras 2 años)57. En 2005 la FDA aprobó la utilización del dispositivo wingspan, eficaz en el 96,7- 98,8% de los casos con una incidencia de complicaciones a los 30 días del 6,1-9,6%58. En un registro Europeo el 25-30% de los pacientes presentaron reestenosis, la mayoría asintomáticas, 4,8% ictus discapacitante y mortalidad del 2,2%59. Muy recientemente ha sido interrumpido el estudio Stenting vs. Aggressive Medical Management for Preventing Recurrent Stroke in Intracranial Stenosis (SAMMPRIS) que comparaba el tratamiento con angioplastia y stent wingspan asociado al tratamiento médico (modificación de factores de factores de riesgo y combinación AAS/CLP) frente a este último en estenosis intracraneal sintomática >70% con II dentro de los primeros 30 días, tras haber reclutado 451 pacientes frente a los 764 previstos, al observar de forma significativa mejores resultados en el grupo de tratamiento médico, con menor tasa de ictus o muerte dentro de los 30 días (14% en grupo wingspan vs 5,8% del grupo de solo tratamiento médico).
Anastomosis arterial extra-intracranealAlrededor del 10% de los pacientes con ictus no incapacitante presentan una oclusión o estenosis de la arteria carótida interna o de la arteria cerebral media. Sus efectos podrían ser reducidos mediante la anastomosis de la rama temporal superficial de la arteria carótida externa, a un bypass extra-intracraneal, aunque el único ensayo clínico realizado fue negativo60. Con independencia de la eficacia de esta técnica en pacientes seleccionados con aneurisma gigante de la arteria carótida interna y en la enfermedad de Moya-Moya en el sujeto joven, en la actualidad no existe indicación para la anastomosis extra-intra en la prevención de ictus61. Los resultados del ensayo clínico Carotid Occlusion Surgery Study presentados en la ISC 2011 no han demostrado beneficio de la cirugía a los dos años en la prevención de recurrencias de ictus debido a la baja tasa de recurrencias en el grupo no quirúrgico.
Ictus isquémico de etiología cardioembólica (tabla 3)FA no valvularEl tratamiento actual incluye dos estrategias: la prevención de tromboembolia, basada en el uso de antitrombóticos, y el tratamiento de la propia FA considerando tanto el control de la frecuencia como del ritmo. Además, se están desarrollando nuevas terapias no farmacológicas para disminuir el riesgo de ictus en pacientes con FA no valvular62–64.
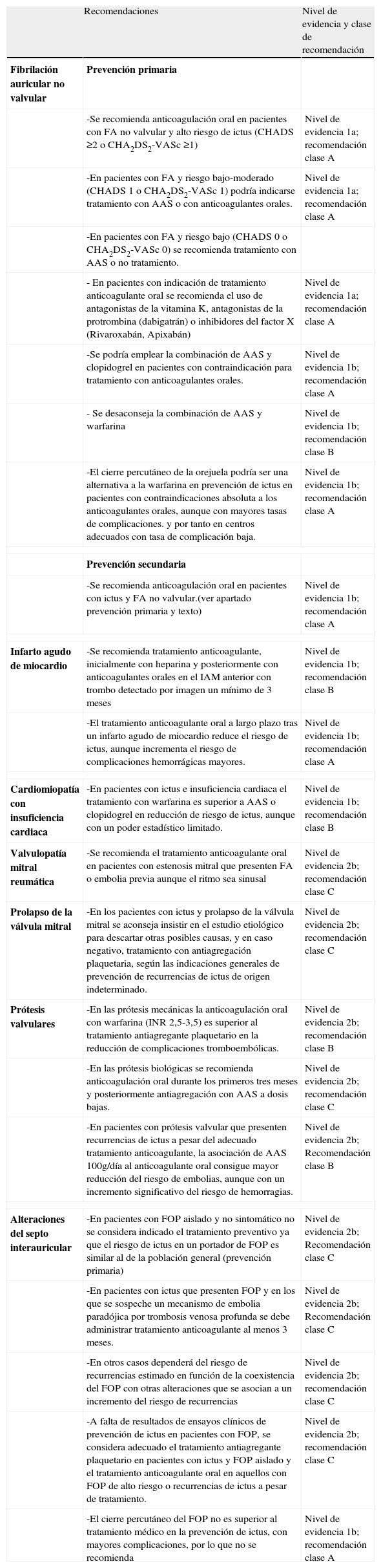
Recomendaciones para la prevención del ictus isquémico de etiología cardioembólica
| Recomendaciones | Nivel de evidencia y clase de recomendación | |
| Fibrilación auricular no valvular | Prevención primaria | |
| -Se recomienda anticoagulación oral en pacientes con FA no valvular y alto riesgo de ictus (CHADS ≥2 o CHA2DS2-VASc ≥1) | Nivel de evidencia 1a; recomendación clase A | |
| -En pacientes con FA y riesgo bajo-moderado (CHADS 1 o CHA2DS2-VASc 1) podría indicarse tratamiento con AAS o con anticoagulantes orales. | Nivel de evidencia 1a; recomendación clase A | |
| -En pacientes con FA y riesgo bajo (CHADS 0 o CHA2DS2-VASc 0) se recomienda tratamiento con AAS o no tratamiento. | ||
| - En pacientes con indicación de tratamiento anticoagulante oral se recomienda el uso de antagonistas de la vitamina K, antagonistas de la protrombina (dabigatrán) o inhibidores del factor X (Rivaroxabán, Apixabán) | Nivel de evidencia 1a; recomendación clase A | |
| -Se podría emplear la combinación de AAS y clopidogrel en pacientes con contraindicación para tratamiento con anticoagulantes orales. | Nivel de evidencia 1b; recomendación clase A | |
| - Se desaconseja la combinación de AAS y warfarina | Nivel de evidencia 1b; recomendación clase B | |
| -El cierre percutáneo de la orejuela podría ser una alternativa a la warfarina en prevención de ictus en pacientes con contraindicaciones absoluta a los anticoagulantes orales, aunque con mayores tasas de complicaciones. y por tanto en centros adecuados con tasa de complicación baja. | Nivel de evidencia 1b; recomendación clase A | |
| Prevención secundaria | ||
| -Se recomienda anticoagulación oral en pacientes con ictus y FA no valvular.(ver apartado prevención primaria y texto) | Nivel de evidencia 1b; recomendación clase A | |
| Infarto agudo de miocardio | -Se recomienda tratamiento anticoagulante, inicialmente con heparina y posteriormente con anticoagulantes orales en el IAM anterior con trombo detectado por imagen un mínimo de 3 meses | Nivel de evidencia 1b; recomendación clase B |
| -El tratamiento anticoagulante oral a largo plazo tras un infarto agudo de miocardio reduce el riesgo de ictus, aunque incrementa el riesgo de complicaciones hemorrágicas mayores. | Nivel de evidencia 1b; recomendación clase A | |
| Cardiomiopatía con insuficiencia cardiaca | -En pacientes con ictus e insuficiencia cardiaca el tratamiento con warfarina es superior a AAS o clopidogrel en reducción de riesgo de ictus, aunque con un poder estadístico limitado. | Nivel de evidencia 1b; recomendación clase B |
| Valvulopatía mitral reumática | -Se recomienda el tratamiento anticoagulante oral en pacientes con estenosis mitral que presenten FA o embolia previa aunque el ritmo sea sinusal | Nivel de evidencia 2b; recomendación clase C |
| Prolapso de la válvula mitral | -En los pacientes con ictus y prolapso de la válvula mitral se aconseja insistir en el estudio etiológico para descartar otras posibles causas, y en caso negativo, tratamiento con antiagregación plaquetaria, según las indicaciones generales de prevención de recurrencias de ictus de origen indeterminado. | Nivel de evidencia 2b; recomendación clase C |
| Prótesis valvulares | -En las prótesis mecánicas la anticoagulación oral con warfarina (INR 2,5-3,5) es superior al tratamiento antiagregante plaquetario en la reducción de complicaciones tromboembólicas. | Nivel de evidencia 2b; recomendación clase B |
| -En las prótesis biológicas se recomienda anticoagulación oral durante los primeros tres meses y posteriormente antiagregación con AAS a dosis bajas. | Nivel de evidencia 2b; recomendación clase C | |
| -En pacientes con prótesis valvular que presenten recurrencias de ictus a pesar del adecuado tratamiento anticoagulante, la asociación de AAS 100g/día al anticoagulante oral consigue mayor reducción del riesgo de embolias, aunque con un incremento significativo del riesgo de hemorragias. | Nivel de evidencia 2b; Recomendación clase B | |
| Alteraciones del septo interauricular | -En pacientes con FOP aislado y no sintomático no se considera indicado el tratamiento preventivo ya que el riesgo de ictus en un portador de FOP es similar al de la población general (prevención primaria) | Nivel de evidencia 2b; Recomendación clase C |
| -En pacientes con ictus que presenten FOP y en los que se sospeche un mecanismo de embolia paradójica por trombosis venosa profunda se debe administrar tratamiento anticoagulante al menos 3 meses. | Nivel de evidencia 2b; Recomendación clase C | |
| -En otros casos dependerá del riesgo de recurrencias estimado en función de la coexistencia del FOP con otras alteraciones que se asocian a un incremento del riesgo de recurrencias | Nivel de evidencia 2b; recomendación clase C | |
| -A falta de resultados de ensayos clínicos de prevención de ictus en pacientes con FOP, se considera adecuado el tratamiento antiagregante plaquetario en pacientes con ictus y FOP aislado y el tratamiento anticoagulante oral en aquellos con FOP de alto riesgo o recurrencias de ictus a pesar de tratamiento. | Nivel de evidencia 2b; recomendación clase C | |
| -El cierre percutáneo del FOP no es superior al tratamiento médico en la prevención de ictus, con mayores complicaciones, por lo que no se recomienda | Nivel de evidencia 1b; recomendación clase A | |
El European Atrial Fibrillation Trial (EAFT) en pacientes con ictus y FA no valvular mostró una reducción de la tasa de recurrencia de II en un 66% en el grupo warfarina frente al 15% del grupo AAS (300mg)65. El número necesario para tratar (NNT) para evitar un ictus al año es 14 para warfarina y 50 para AAS66. Los antagonistas de la vitamina-K (AVK) aunque eficaces tienen importantes problemas en la práctica clínica, lo que lleva a que sean infrautilizados o con un rango terapéutico inadecuado, debido a un comienzo lento en la actuación y metabolización, al margen terapéutico estrecho, a la amplia variación de su metabolismo con numerosas interacciones con alimentos y fármacos, existencia de polimorfismos genéticos que afectan al requerimiento de dosis, la necesidad de monitorizar la coagulación de una manera regular y con frecuentes ajustes de dosis, con el coste añadido62. Así, solo el 10-18% de los pacientes tienen un rango de INR adecuado67,68. El riesgo hemorrágico es otro grave problema de los AVK. Éste se puede minimizar tratando la HTA y monitorizando el INR62. Si se consigue un rango adecuado (INR 2-3), el riesgo de hemorragia cerebral es del 0,5% anual con un NNT de 200, aceptable si se compara con el NNT de 14 para evitar un ictus66. Para valorar el riesgo/beneficio de la anticoagulación oral, se recomienda la escala de riesgo de hemorragia grave HASBLED, considerándose alto riesgo puntuaciones ≥369. Por otra parte, a pesar del riesgo hemorrágico, los anticoagulantes orales muestran un claro beneficio en mayores de 85 años con FA70.
Actualmente existen nuevos fármacos anticoagulantes (inhibidores de la trombina y del factor X) que tienen la ventaja de no requerir monitorización de los niveles de INR. Dabigatrán a dosis de 110mg/12h ha mostrado una eficacia similar a warfarina en la reducción de ictus, con menor frecuencia de hemorragias mayores y a dosis de 150mg/12h es superior a warfarina en reducción de ictus con tasas similares de hemorragias71. Es un fármaco de fácil administración, con dosis fijas y que no requiere monitorización. Un análisis del subgrupo con II previo mostró unos resultados de eficacia para dabigatrán similares al estudio global con una tendencia a la superioridad frente a warfarina y con significativo menor riesgo de hemorragia intracraneal e ictus hemorrágico para las dos dosis de dabigatran72. En un estudio de coste-efectividad en pacientes mayores de 65 años y CHADS2 ≥2, dabigatrán mostró ser una alternativa a warfarina en base a los precios de EE.UU.73. Dabigatrán ha sido aprobado por la FDA y en Canadá, y está en trámite en Europa. Las guías europeas y las de la AHA63,74 equiparan dabigatrán a AVK en la prevención de ictus en pacientes con FA. Las dosis de 110mg/12h estarían indicada en pacientes con menor riesgo cardioembólico o con mayor riesgo hemorrágico (edad muy avanzada, HTA mal controlada, hemorragia cerebral previa, presencia en neuroimagen de leucoaraiosis o microhemorragias cerebrales, o una puntación de la escala HASBLEB ≥3). Las dosis de 150mg/12h estarían indicadas en pacientes con mayor riesgo cardioembólico o en pacientes con un rango del INR infraterapeútico a pesar de los AVK, o por otros problemas con los AVK. En prevención secundaria de ictus cardioembólico, la dosis de 150mg/12h sería la apropiada en pacientes con HASBLEB <3 o con recurrencias a pesar de tratamiento correcto con AVK y la dosis de 110mg/12h con HASBLEB ≥ 3. El estudio AVERROES75 en pacientes con FA y contraindicación para los AVK mostró beneficio significativo de apixabán frente a AAS en la tasa anual ictus o embolia sistémica (1,6 vs 3,6%) con una tasa de hemorragias similar. El estudio ROCKET AF76,77 ha mostrado que rivaroxaban a dosis de 20mg cada 24 horas no es inferior a warfarina en la prevención de ictus y embolias periféricas sin incrementar el riesgo de hemorragias. En el analisis de población en tratamiento mostraba diferencias significativa (1,71% frente a 2,16%) a favor de rivoroxaban. Otros anticoagulantes en desarrollo son edoxabán y betrixabán.
Antiagregantes plaquetariosEl estudio EAFT65 demostró la clara superioridad del tratamiento anticoagulante oral frente a AAS 300mg en prevención secundaria de ictus. La combinación de dos antiagregantes plaquetarios AAS 75-100mg/CLP 75mg en pacientes con contraindicaciones para los AVK consiguió una reducción del riesgo de ictus del 28% en comparación con AAS (75-100mg) en el estudio ACTIVE-A, pero con un incremento significativo en el riesgo de complicaciones hemorrágicas mayores78. Por otra parte, el estudio ACTIVE W demostró la superioridad de la anticoagulación oral frente a la combinación AAS 75-100mg/CLP 75mg en la reducción de ictus, embolia sistémica, IAM y muerte vascular79.
Combinación de anticoagulantes orales y antiagregantes plaquetariosEn los casos de embolia recurrente a pesar del correcto tratamiento anticoagulante se ha planteado de forma empírica la asociación con AAS. Sin embargo, no se han demostrado diferencias en la reducción de ictus o embolias sistémicas con la combinación de warfarina y AAS frente a warfarina sola, y sí un incremento significativo de las complicaciones hemorrágicas80. Por otra parte, se ha observando una reducción significativa del riesgo de muerte de origen vascular, AIT, ictus no fatal y embolia sistémica, sin un incremento significativo de las complicaciones hemorrágicas con la combinación de triflusal 600mg/día y anticoagulación de intensidad moderada81. Un análisis a largo plazo de un subgrupo de pacientes mostró la superioridad de la combinación de triflusal 600mg/día y anticoagulante oral frente al anticoagulante sólo82.
AntiarrítmicosUn análisis poshoc del estudio ATHENA83 en pacientes con FA persistente o paroxística señaló que dronedarona redujo el riesgo de ictus en un 36%, independientemente del uso de tratamiento antitrombótico84. Tras control del ritmo en pacientes con alto riesgo cardioembólico (CHADS2 ≥2) se debe mantener los anticoagulantes85. Tras la ablación la tasa de recurrencia de FA es 13% a 2 años, 21,8% a 3 años, 35% a 4 años, 46,8% a 5 años y 54,6% a 6 años, incluso pacientes que no recurren en 1 año no se pueden considerar curados pues en el seguimiento recurren un 40%86.
Otros tratamientos farmacológicos:La utilización de estatinas puede prevenir la aparición de FA y sus recurrencias87. También el bloqueo del sistema renina angiotensina con fármacos IECA o ARA II muestra una reducción del riesgo de FA de novo88.
Terapias no farmacológicasEn la mayoría de los pacientes con FA no valvular los trombos se localizan en la orejuela por lo que un posible abordaje sería la exclusión de la misma en pacientes seleccionados con contraindicación absoluta para anticoagulantes orales. En el estudio PROTECT AF, el cierre percutáneo de la orejuela no fue inferior a la warfarina en cuanto a prevención de ictus, aunque presentó mayor tasa de complicaciones periprocedimiento89.
Otras fuentes de cardioemboliaLas evidencias en el riesgo y en las recomendaciones en la prevención de ictus por otras fuentes cardioembólicas no son tan claras como en la FA no valvular, ni tampoco en ciertas situaciones especiales.
Infarto agudo de miocardio (IAM)El inicio precoz de heparina seguida de anticoagulantes orales ha mostrado una reducción del 1-3% en el riesgo de II y >50% en la presencia de trombos42. Se recomiendan anticoagulantes orales en el IAM anterior con trombo detectado por imagen un mínimo de 3 meses90. Un meta-análisis que comparó el tratamiento anticoagulante oral asociado o no a AAS, AAS o placebo, mostró que la warfarina no redujo la mortalidad o reinfarto, pero sí el riesgo de ictus, aunque con incremento de hemorragias mayores91.
Cardiomiopatía con insuficiencia cardiacaEn el estudio Warfarin and Antiplatelet Therapy in Chronic Heart Failure trial (WATCH)92 la warfarina se asoció de forma significativa a menos ictus (0,6%) que AAS (162mg/día) o clopidogrel (75mg/día) (2,3%). Sin embargo, el estudio no consiguió suficiente poder estadístico para aclarar que tratamiento es mejor. Se encuentra en desarrollo el estudio Warfarin versus aspirin in Reduced Cardiac Ejection Fraction (WARCEF), en pacientes con FEVI≤ 35%93.
Valvulopatía mitral reumáticaSe recomienda el tratamiento anticoagulante oral en pacientes con estenosis mitral que presenten FA, o embolia previa aunque el ritmo sea sinusal94.
Prolapso de la válvula mitralNo se dispone de ensayos clínicos en pacientes con ictus y prolapso de la válvula mitral. En estos casos se aconseja insistir en el estudio etiológico para descartar otras posibles causas, y en caso negativo, tratamiento con antiagregación plaquetaria, según las indicaciones generales de prevención de recurrencias de ictus de origen indeterminado. Se administrarán anticoagulantes orales cuando exista recidiva a pesar del tratamiento con AAS o evidencia de embolia sistémica previa o FA asociada.
Prótesis valvularesLa indicación de tratamiento antitrombótico depende del tipo de prótesis y de los FR asociados. Se ha demostrado la superioridad de la warfarina frente a dos regímenes de antiagregantes plaquetarios (AAS a dosis de 650mg/d o de 990mg/d + dipiridamol 150-225mg/d ó AAS 650mg/d + pentoxifilina 800mg/d) en la reducción de complicaciones tromboembólicas95. En las prótesis mecánicas está indicada la anticoagulación oral, aunque pese a conseguir niveles de INR adecuados (2,5-3,5) existe un riesgo de tromboembolia del 1-2% anual. Las válvulas en posición mitral tienen mayor riesgo que las situadas en posición aórtica. Así, se recomienda un INR entre 2,5 y 3,5 para válvulas protésicas en posición mitral y menor, entre 2,0 y 3,0, para las aórticas si son prótesis bivalva o Medtronic Hall y si no coexisten los factores antes mencionados. En las prótesis biológicas se recomienda la anticoagulación oral los 3 primeros meses tras la intervención, ya que es el periodo con mayor probabilidad de embolias (hasta que se produce la completa endotelialización de la válvula). Posteriormente se considerará la antiagregación con AAS a dosis bajas (75-100mg) a largo plazo, siempre y cuando, el paciente no tenga FR asociados como FA, antecedente de tromboembolia, disfunción ventricular izquierda o estado de hipercoagulabilidad. En estos casos se recomienda la anticoagulación oral94. En pacientes con prótesis valvular que presenten recurrencias de ictus a pesar del adecuado tratamiento anticoagulante, la asociación de AAS a bajas dosis (100mg) o dipiridamol al anticoagulante oral se asocia a una mayor reducción del riesgo de embolias, aunque con un incremento significativo del riesgo de hemorragias96.
FOP y ASAEn el FOP aislado y no sintomático no se considera indicado el tratamiento preventivo ya que el riesgo de ictus es similar al de la población general90,97. En pacientes con ictus que presenten FOP y en los que se sospeche un mecanismo de embolia paradójica por trombosis venosa profunda se debe administrar tratamiento anticoagulante al menos 3 meses. En otros casos dependerá del riesgo de recurrencias estimado en función de la coexistencia del FOP con otras alteraciones que se asocian a un incremento del riesgo anual de recurrencias como un estado de hipercoagulabilidad o la coexistencia con un ASA, aspecto más debatido98–100. El subestudio PICSS del ensayo clínico WARSS no observó diferencias en la tasa de recurrencias en los pacientes con ictus criptogénico y FOP en tratamiento con aspirina o con anticoagulantes orales101. A falta de resultados de ensayos clínicos diseñados para el estudio de prevención de ictus en pacientes con FOP, se considera adecuado el tratamiento antiagregante plaquetario en pacientes con ictus criptogénico y FOP aislado y el tratamiento anticoagulante oral en aquellos con FOP de alto riesgo o recurrencias de ictus a pesar de tratamiento. Con respecto al cierre percutáneo del FOP, los resultados del estudio CLOSURE-I102 muestran su no superioridad al tratamiento médico en la prevención de ictus, con mayor tasa de complicaciones. Continúan en marcha los estudios RESPECT y REDUCE, por tanto no se recomienda el cierre percutáneo de FOP, salvo en ensayos clínicos103.
Infarto de causa inhabitual (tabla 4)Se van a considerar aquí únicamente las principales etiologías en el II de causa inhabitual en nuestro medio, como la disección arterial, estados protrombóticos, placas de ateroma en cayado aórtico, y finalmente la trombosis de senos durales.
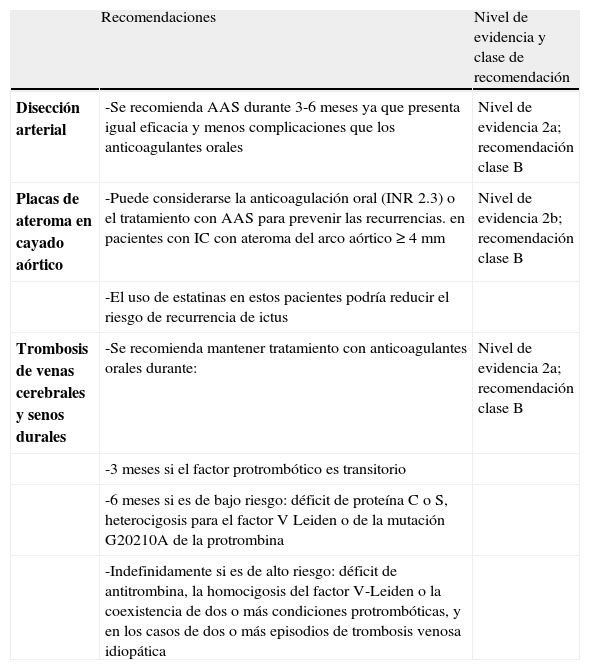
Recomendaciones para la prevención de ictus isquémico de causa inhabitual
| Recomendaciones | Nivel de evidencia y clase de recomendación | |
| Disección arterial | -Se recomienda AAS durante 3-6 meses ya que presenta igual eficacia y menos complicaciones que los anticoagulantes orales | Nivel de evidencia 2a; recomendación clase B |
| Placas de ateroma en cayado aórtico | -Puede considerarse la anticoagulación oral (INR 2.3) o el tratamiento con AAS para prevenir las recurrencias. en pacientes con IC con ateroma del arco aórtico ≥ 4 mm | Nivel de evidencia 2b; recomendación clase B |
| -El uso de estatinas en estos pacientes podría reducir el riesgo de recurrencia de ictus | ||
| Trombosis de venas cerebrales y senos durales | -Se recomienda mantener tratamiento con anticoagulantes orales durante: | Nivel de evidencia 2a; recomendación clase B |
| -3 meses si el factor protrombótico es transitorio | ||
| -6 meses si es de bajo riesgo: déficit de proteína C o S, heterocigosis para el factor V Leiden o de la mutación G20210A de la protrombina | ||
| -Indefinidamente si es de alto riesgo: déficit de antitrombina, la homocigosis del factor V-Leiden o la coexistencia de dos o más condiciones protrombóticas, y en los casos de dos o más episodios de trombosis venosa idiopática |
No existen evidencias en el tratamiento de la disección carotídea o vertebral extracraneal y el análisis de los estudios realizados con AAS o con anticoagulantes orales no demuestra diferencias significativas entre ellos104–106. Un estudio prospectivo observó mayor frecuencia de hemorragias mayores con el tratamiento antitrombótico (antiagregante [1%] o anticoagulante [2%]) que de II (0,3%)104. Por tanto, a similar eficacia parece razonable utilizar el fármaco con menor riesgo hemorrágico, es decir, los antiagregantes plaquetarios. Se considera adecuado mantener este tratamiento durante 3 a 6 meses, aunque no hay estudios que lo avalen42. Una revisión sistemática de casos de disección arterial carotidea o vertebral tratados con angioplastia y stent concluye que esta técnica es segura107, aunque no se pueden establecer conclusiones sobre su eficacia, ya que no hay estudios comparativos con tratamiento médico.
Estados protrombóticos:La trombosis venosa profunda es una indicación para terapia anticoagulante de corto o largo plazo, dependiendo de las circunstancias clínicas y hematológicas108. Aunque hay guías para establecer recomendaciones generales en estados de hipercoagulabilidad adquiridos, no existen evidencias específicas para la prevención secundaria del ictus42. En el déficit de proteína C, S y antitrombina III se recomienda el tratamiento anticoagulante oral sobre todo en las situaciones de mayor riesgo, así como en prevención secundaria. En el caso de anticoagulante lúpico en prevención secundaria se indica el tratamiento anticoagulante, si bien no existen estudios adecuadamente diseñados que evalúen su eficacia frente al tratamiento antiagregante. El estudio APASS mostró que la presencia de anticuerpos antifosfolípidos no se asoció a un incremento del riesgo de ictus recurrente ni a una respuesta diferente al tratamiento con AAS 325mg/día o warfarina con INR 1,4-2,8109. Basándose en estos datos, en pacientes con un primer ictus isquémico y anticuerpos antifosfolípidos positivos el tratamiento preventivo a considerar podría ser AAS o anticoagulación de baja intensidad. En el caso del síndrome antifosfolípido se aconseja la anticoagulación oral para mantener INR 2-342.
Placas de ateroma en cayado aórticoLas placas de ateroma en el arco aórtico se asocian a mayor riesgo de recurrencias de ictus y de muerte, especialmente si son ≥4mm o complejas (con ulceración o componentes móviles), a pesar del tratamiento con AAS o anticoagulantes orales110,111. En un estudio retrospectivo el uso de estatinas se asoció de forma independiente a menor recurrencia de ictus112. Se encuentra en desarrollo el Aortic Arch Related Cerebral Hazard Trial (ARCH), que compara warfarina frente a la combinación de AAS/CLP113. Puede considerarse la anticoagulación oral o el tratamiento con AAS en pacientes con II con ateroma del arco aórtico de 4mm o más para prevenir las recurrencias114.
Trombosis de venas cerebrales y senos duralesPara evitar retrombosis tras el tratamiento anticoagulante en la fase inicial115, se aconseja mantener tratamiento con anticoagulantes orales durante al menos 3 meses116. La decisión de continuar o no el tratamiento a más largo plazo dependerá de si se detecta un factor protrombótico. Si éste es transitorio, se podrá suspender la anticoagulación a los 3 meses. Si es de bajo riesgo como el déficit de proteína C o S, heterocigosis para el factor V Leiden o de la mutación G20210A de la protrombina, se podrá mantener durante 6 meses. En cambio, si es de alto riesgo como déficit de antitrombina, la homocigosis del factor V Leiden o la coexistencia de dos o más condiciones protrombóticas, se aconseja anticoagulación de forma indefinida, al igual que en los casos de dos o más episodios de trombosis venosa idiopática117,118.
Ictus isquémico de etiología indeterminadaEn el II criptogénico se recomienda la antiagregación plaquetaria como primera medida terapéutica. Algunos autores aconsejan el tratamiento anticoagulante cuando se producen recurrencias a pesar de la antiagregación. En el II de etiología indeterminada por estudio incompleto se deberá completar éste para poder iniciar el tratamiento más adecuado, y en el caso del II con varias etiologías posibles, se aplicará el tratamiento según la etiología de mayor riesgo de recurrencia y, si es posible, actuar sobre todos ellos.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Comitéad hocdel Grupo de estudio de ECV de la SEN para la redacción de las Guías de actuación clínica en el ictus.
Coordinador: Exuperio Díez-Tejedor, Hospital Universitario La Paz, Madrid.
A.1. Comisión de Redacción
Exuperio Díez-Tejedor (Coord), Hospital Universitario La Paz, Madrid; Blanca Fuentes (Secretaría), Hospital Universitario La Paz, Madrid; María Alonso de Leciñana, Hospital Universitario Ramón y Cajal, Madrid; José Álvarez-Sabin, Hospital Universitario Valle de Hebron, Barcelona; Juan Arenillas, Hospital Universitario Clínico de Valladolid; Sergio Calleja, Hospital Universitario Central de Asturias, Oviedo; Ignacio Casado, Hospital San Pedro, Cáceres; Mar Castellanos, Hospital Josep Trueta, Gerona; José Castillo, Hospital Clínico Universitario, Santiago de Compostela; Antonio Dávalos, Hospital Universitario German Trias i Pujol, Badalona; Fernando Díaz-Otero, Hospital Universitario Gregorio Marañón, Madrid; Exuperio Díez-Tejedor, Hospital Universitario La Paz, Madrid; José Antonio Egido, Hospital Clínico Universitario San Carlos, Madrid; Juan Carlos Fernández, Hospital Universitario Dr. Negrín, Las Palmas; Mar Freijo, Hospital Universitario de Basurto, Bilbao; Blanca Fuentes, Hospital Universitario La Paz, Madrid; Jaime Gallego, Hospital General de Navarra, Pamplona; Andrés García Pastor, Hospital Universitario Gregorio Marañón, Madrid; Antonio Gil-Núñez, Hospital Universitario Gregorio Marañón, Madrid; Francisco Gilo, Hospital Universitario La Princesa, Madrid; Pablo Irimia, Clínica Universitaria de Navarra, Pamplona; Aida Lago, Hospital Universitario La Fe, Valencia; José Maestre, Hospital Universitario Virgen de las Nieves, Granada; Jaime Masjuan, Hospital Universitario Ramón y Cajal, Madrid; Joan Martí-Fábregas, Hospital de la Santa Cruz y San Pablo, Barcelona; Patricia Martínez-Sánchez, Hospital Universitario La Paz, Madrid; Eduardo Martínez-Vila, Clínica Universitaria de Navarra, Pamplona; Carlos Molina, Hospital Universitario Valle de Hebron, Barcelona; Ana Morales, Hospital Universitario Virgen de la Arrixaca, Murcia; Florentino Nombela, Hospital Universitario La Princesa, Madrid; Francisco Purroy, Hospital Universitario Arnau de Vilanova, Lérida; Marc Ribó, Hospital Universitario Valle de Hebron, Barcelona; Manuel Rodríguez-Yañez, Hospital Clínico Universitario, Santiago de Compostela; Jaime Roquer, Hospital del Mar, Barcelona; Francisco Rubio, Hospital Universitario de Bellvitge, Barcelona; Tomás Segura, Hospital Universitario de Albacete, Albacete; Joaquín Serena, Hospital Joseph Trueta, Gerona; Patricia Simal, Hospital Clínico Universitario San Carlos, Madrid; Javier Tejada, Hospital Universitario de León, León; José Vivancos, Hospital Universitario La Princesa, Madrid.
A.2. Comisión de Revisión o Institucional
José Álvarez-Sabín, Hospital Universitario Valle de Hebron, Barcelona; José Castillo, Hospital Clínico Universitario, Santiago de Compostela; Exuperio Díez-Tejedor, Hospital Universitario La Paz, Madrid; Antonio Gil-Núñez, Hospital Universitario Gregorio Marañón, Madrid; José Larracoechea, Hospital de Cruces, Bilbao; Eduardo Martínez-Vila, Clínica Universitaria de Navarra, Pamplona; Jaime Masjuan, Hospital Universitario Ramón y Cajal, Madrid; Jorge Matías-Guiu, Hospital Clínico Universitario San Carlos, Madrid; Francisco Rubio, Hospital de Belltige, Barcelona.
Granger CB, Alexander JH, McMurray JJ, Lopes RD, Hylek EM, Hanna M, Al-Khalidi HR, Ansell J, Atar D, Avezum A, Bahit MC, Diaz R, Easton JD, Ezekowitz JA, Flaker G, Garcia D, Geraldes M, Gersh BJ, Golitsyn S, Goto S, Hermosillo AG, Hohnloser SH, Horowitz J, Mohan P, Jansky P, Lewis BS, Lopez-Sendon JL, Pais P, ParkhomenkoA, Verheugt FW, Zhu J, Wallentin L; ARISTOTLE Committees and Investigators.Apixaban versus warfarin in patients with atrial fibrillation. N Engl J Med. 2011 Sep 15;365(11):981-92.
Chimowitz MI, Lynn MJ, Derdeyn CP, Turan TN, Fiorella D, Lane BF, Janis LS, Lutsep HL, Barnwell SL, Waters MF, Hoh BL, Hourihane JM, Levy EI, Alexandrov AV, Harrigan MR, Chiu D, Klucznik RP, Clark JM, McDougall CG, Johnson MD, Pride GLJr, Torbey MT, Zaidat OO, Rumboldt Z, Cloft HJ; SAMMPRIS Trial Investigators. Stenting versus aggressive medical therapy for intracranial arterial stenosis. N Engl J Med. 2011 Sep 15;365(11):993-1003.
Las filiaciones de los autores y composición del comité se relacionan en el addendum.