Los ensayos clínicos llevados a cabo con el interferón beta (INFB) en esclerosis múltiple remitente recidivante (EMRR) han mostrado que reducen la tasa de brotes. Sin embargo, no todos los pacientes responden a este tratamiento, si bien aún no hay un absoluto consenso a propósito de la definición de respuesta al tratamiento. Las razones para este fracaso terapéutico no son conocidas, y probablemente hay factores genéticos implicados, como se ha mostrado con los polimorfismos de los genes que codifican la interleuquina 10 o el interferón gamma. El papel del gen de la apolipoproteína E (APOE) en la EM ha sido investigado en los últimos años y no parece aumentar el riesgo de aparición de la enfermedad ni influir en su severidad. Variaciones en este gen influyen en la respuesta al tratamiento con inhibidores de la colinesterasa en la enfermedad de Alzheimer o a las estatinas en la hipercolesterolemia. Esto podría tener implicaciones futuras en la EM.
Material y métodosHemos revisado retrospectivamente 38 pacientes diagnosticados de EMRR (32 mujeres y 6 varones) tratados con INFB durante al menos dos años. Los criterios para llevar a cabo el tratamiento eran uniformes de acuerdo con las indicaciones del Comité asesor para el tratamiento de la EM. Recogimos datos acerca de la edad y tiempo de evolución de la enfermedad. Al cabo de dos años del inicio del tratamiento los pacientes fueron clasificados como respondedores o no-respondedores de acuerdo con los criterios clínicos disponibles, basados en la presencia de brotes, evolución de la discapacidad, o ambos. El genotipo APOE se determinó de muestras sanguíneas utilizando métodos validados de reacción en cadena de la polimerasa. Se estudió la correlación entre la condición de respondedor o no respondedor y la presencia de los alelos E2 o E4.
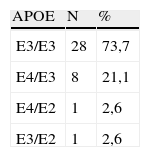
ResultadosVeinte pacientes (52,6%) recibían INFB1b subcutáneo (Betaferón®), 13 (34,2%) INFB1a intramuscular (Avonex®) y 5 (13,2%) INFB1a subcutáneo (Rebif®). Dos pacientes (5,2%) eran heterocigotos para el alelo E2 y 9 (23,7%) para el alelo E4. Ningún paciente era homocigoto para E2 o E4. La presencia o no de estos alelos no se correlacionó con la respuesta al tratamiento de acuerdo con las 10 variables estudiadas.
ConclusiónTras los resultados de un metanálisis que no muestran influencia del gen APOE en la susceptibilidad o severidad de la EM, no hemos encontrado en nuestra serie influencia de este gen en la respuesta de pacientes con EMRR al INFB. En cualquier caso, series más extensas son necesarias para validar estos resultados.
Clinical trials with interferon beta in relapsing remitting multiple sclerosis (RRMS) have demonstrated a reduction in the relapse rate. Nevertheless, not all patients respond to this treatment, although there is no consensus regarding the definition of response to therapy. The reasons for this failure are not known but genetic factors probably influence this, as has been previously shown with Interleukin 10 or Interferon gamma polymorphisms.
The role of apolipoprotein E (APOE) gene in MS has been investigated and does not appear to increase risk for MS or influence disease severity. Interestingly APOE variation influences response to cholinesterase inhibitor treatment in Alzheimer disease or to statins in hypercholesterolemia. This might have future implications for MS.
Material and methodsWe retrospectively reviewed 38 RRMS patients (32 females and 6 males) treated with interferon beta (INFbeta) over at least two years. Criteria for treatment were uniform accordingly to an “Advisory Committee for the Treatment of Multiple Sclerosis”. We collected data variables including age, age of onset, clinical type or disease duration. Patients were classified, two years after the start of treatment, as responders and non-responders based upon clinical criteria available in the literature, which rely on the presence of relapses, increase of disability, or both. APOE genotype was determined from blood samples using validated polymerase chain reaction methods. Correlation between patient responding status with allele E2 or E4 was tested.
ResultsA total of 20 patients (52.6%) received subcutaneous INFbeta1b (Betaferón®), 13 (34.2%) INFbeta1a intramuscular (Avonex®), and 5 (13.2%) subcutaneous INFbeta1a (Rebif®). We found 2 patients (5.2%) heterozygous for the E2 allele and 9 (23.7%) for the E4 allele. No patient was homozygous for E2 or E4. Comparison of patients with and without E2 or E4 allele showed no significant differences in any of the ten therapy response variables assessed.
ConclusionFindings of a recent meta-analysis have not supported a role for APOE in MS susceptibility or severity. We have not found, in our data, any influence of this gene in the RRMS response to INFbeta. However, larger series would be required to validate these results.
El interferón-beta (INFB) es uno de los tratamientos de elección en la esclerosis múltiple remitente recidivante (EMRR). Los ensayos clínicos han mostrado que disminuyen la tasa de brotes respecto a placebo en aproximadamente un 30%. Se ha propuesto, asimismo, que estos fármacos pueden retrasar la progresión de la discapacidad. Pese a estos beneficios conocidos, hay un porcentaje significativo de pacientes que no responden al tratamiento o lo hacen de forma subóptima1–3.
Sin embargo, es difícil establecer si un paciente en concreto está respondiendo al tratamiento y en qué medida, y el tiempo necesario para evidenciar dicha respuesta puede ser prolongado; de hecho, aún no disponemos de una clara definición aceptada por todos los autores de ausencia de respuesta al INFB en la EMRR4,5. La heterogeneidad genética o determinados factores ambientales dan lugar a variaciones en los patrones clínicos de la EM y, probablemente, contribuyen a las diferencias en la respuesta al tratamiento entre los distintos pacientes. Sin embargo, no se han conseguido avances concluyentes6.
Un número importante de estudios ha investigado el papel del gen de la APOE en la EM. De acuerdo con un reciente metanálisis, los polimorfismos del gen de la APOE no influyen en la susceptibilidad a padecer EM, su curso clínico o su severidad7. Se ha descrito un efecto del genotipo APOE en la respuesta al tratamiento con inhibidores de la colinesterasa en la enfermedad de Alzheimer o de las estatinas en la hipercolesterolemia8. Ello nos ha animado a explorar si la presencia de los alelos E2 o E4 del gen de la APOE pueden influir en la respuesta al tratamiento con INFB en una población homogénea de pacientes con EMRR.
Pacientes y métodosHemos revisado retrospectivamente 38 pacientes (32 mujeres/6 varones) seguidos en nuestra sección de Neurología como consecuencia de una EMRR tratada con INFB durante, al menos, 2 años.
El tratamiento fue iniciado siguiendo los criterios marcados por el Comité Asesor del Ministerio de Sanidad y Consumo de España, quien finalmente aprobó la utilización de estos fármacos; de esta forma se inició el tratamiento con cualquiera de las tres formas de INFB (INFB 1a [Avonex®] 30 mcg intramuscular una vez por semana, INFB 1a [Rebif®] 22 o 44 mcg subcutáneos 3 veces por semana o INFB 1b [Betaferón®] 8 MUI subcutáneos cada 48 horas) en pacientes diagnosticados de EMRR de al menos 6 meses de evolución, edad superior a 18 años, una puntuación en la escala EDSS de 0 a 6,5 y al menos dos brotes agudos de la enfermedad confirmados por un neurólogo durante los 3 años precedentes. Se definió brote como “aparición o reaparición de uno o más síntomas atribuibles a EM, de una duración mínima de 24 horas, con afectación objetiva en la exploración neurológica, en ausencia de fiebre, y precedida de estabilidad neurológica durante al menos 30 días”.
En cada paciente se recogieron datos a propósito del sexo, o la edad de inicio de la enfermedad. Consideramos la puntuación en la escala EDSS al inicio del tratamiento, así como la tasa de brotes en los dos años anteriores. Durante los primeros dos años de tratamiento evaluamos la evolución en la puntuación de la escala EDSS, así como la tasa de brotes. Cuando se determinaba una progresión de la discapacidad esta debía ser confirmada a los 6 meses. En 15 pacientes se había completado un tiempo de seguimiento de 6 años y consideramos la escala EDSS al final de este periodo.
Definimos la respuesta al tratamiento a dos años de cada uno de los pacientes de acuerdo con 10 criterios de respuesta4, considerándose en cada uno de ellos a un paciente como no respondedor si cumplía:
- 1.
Criterio A: aumento de EDSS de al menos 1 paso.
- 2.
Criterio B: un brote en 2 años.
- 3.
Criterio C: dos o más brotes en 2 años.
- 4.
Criterio D: disminución de la tasa de brotes menor del 30% comparando con los 2 años anteriores al tratamiento.
- 5.
Criterio E: disminución de la tasa de brotes menor del 50% comparando con los 2 años anteriores al tratamiento.
- 6.
Criterio F: ausencia de descenso de la tasa de brotes comparando con los 2 años anteriores al tratamiento.
- 7.
Criterio G: presencia del criterio A o el criterio B.
- 8.
Criterio H: presencia del criterio A o el criterio E.
- 9.
Criterio I: presencia de los criterios A y B.
- 10.
Criterio J: presencia de los criterios A y E.
Se consideró como paso en el aumento de discapacidad un incremento de 1,5 en la puntuación en la escala EDSS si su valor inicial era 0, un incremento de 1,0 si el EDSS inicial se encontraba entre 1,0 y 5,0, o de únicamente 0,5 si el EDSS inicial era mayor de 5,04.
El genotipo APOE se determinó de muestras de sangre usando métodos validados de reacción en cadena de la polimerasa. Se exploró la influencia la presencia de los alelos E2 o E4 en la respuesta al tratamiento con INFB de acuerdo con estos criterios citados, así como con la existencia de una puntuación de 6,0 o superior a los 6 años del inicio del tratamiento en los pacientes en los que se había alcanzado ese tiempo de seguimiento. El estudio estadístico se llevó a cabo usando el test de la Chi cuadrado en el estudio de variables categóricas y la “t” de Student en variables cuantitativas. Un valor de p inferior a 0,05 se consideró estadísticamente significativo. Los investigadores eran ciegos a los datos sobre el polimorfismo del gen de la APOE al establecer las variables clínicas.
ResultadosIncluimos 38 pacientes tratados con INFB; 20 (52,6%) recibían Betaferón®, 13 (34,2%) Avonex® y 5 (13,2%) Rebif® (cuatro de ellos 44 mcg y uno 22 mcg).
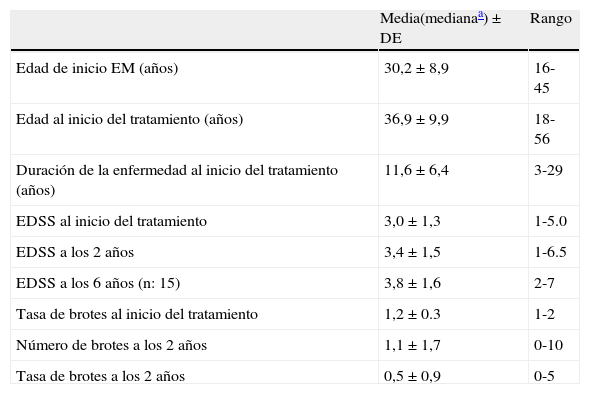
Las características basales y relacionadas con el tratamiento de estos pacientes se muestran en la tabla 1.
Características clínicas y demográficas de los 38 pacientes con esclerosis múltiple remitente recidivante
| Media(medianaa)±DE | Rango | |
| Edad de inicio EM (años) | 30,2±8,9 | 16-45 |
| Edad al inicio del tratamiento (años) | 36,9±9,9 | 18-56 |
| Duración de la enfermedad al inicio del tratamiento (años) | 11,6±6,4 | 3-29 |
| EDSS al inicio del tratamiento | 3,0±1,3 | 1-5.0 |
| EDSS a los 2 años | 3,4±1,5 | 1-6.5 |
| EDSS a los 6 años (n: 15) | 3,8±1,6 | 2-7 |
| Tasa de brotes al inicio del tratamiento | 1,2±0.3 | 1-2 |
| Número de brotes a los 2 años | 1,1±1,7 | 0-10 |
| Tasa de brotes a los 2 años | 0,5±0,9 | 0-5 |
La tabla 2 recoge la distribución de los genotipos de APOE. Ningún paciente era homocigoto para E2 o E4.
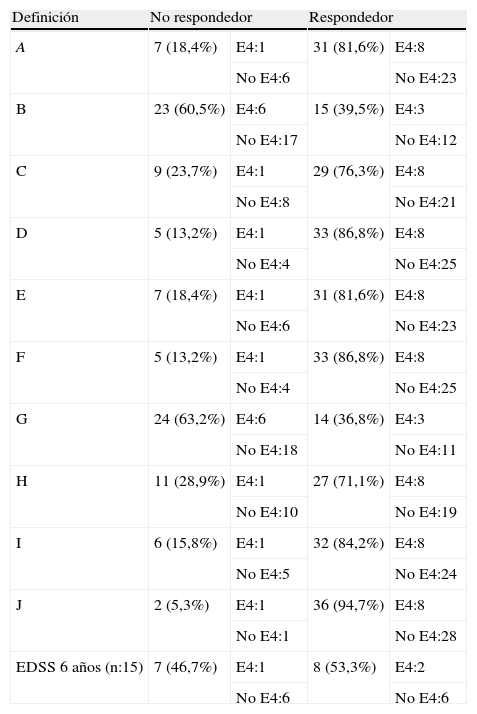
La evolución clínica de los pacientes de acuerdo con el estatus de respondedor o no respondedor se muestra en la tabla 3. En ella se muestra cómo el hecho de presentar el alelo E4 no se correlacionó significativamente con el estatus del paciente como respondedor o no respondedor de acuerdo con los 11 criterios utilizados: los 10 a dos años combinando reducción del número de brotes y progresión de la discapacidad, y la progresión de la discapacidad a 6 años en los 15 pacientes en los que disponíamos de ese dato.
Estatus de respondedor o no respondedor de acuerdo con las diferentes definiciones y el alelo E4
| Definición | No respondedor | Respondedor | ||
| A | 7 (18,4%) | E4:1 | 31 (81,6%) | E4:8 |
| No E4:6 | No E4:23 | |||
| B | 23 (60,5%) | E4:6 | 15 (39,5%) | E4:3 |
| No E4:17 | No E4:12 | |||
| C | 9 (23,7%) | E4:1 | 29 (76,3%) | E4:8 |
| No E4:8 | No E4:21 | |||
| D | 5 (13,2%) | E4:1 | 33 (86,8%) | E4:8 |
| No E4:4 | No E4:25 | |||
| E | 7 (18,4%) | E4:1 | 31 (81,6%) | E4:8 |
| No E4:6 | No E4:23 | |||
| F | 5 (13,2%) | E4:1 | 33 (86,8%) | E4:8 |
| No E4:4 | No E4:25 | |||
| G | 24 (63,2%) | E4:6 | 14 (36,8%) | E4:3 |
| No E4:18 | No E4:11 | |||
| H | 11 (28,9%) | E4:1 | 27 (71,1%) | E4:8 |
| No E4:10 | No E4:19 | |||
| I | 6 (15,8%) | E4:1 | 32 (84,2%) | E4:8 |
| No E4:5 | No E4:24 | |||
| J | 2 (5,3%) | E4:1 | 36 (94,7%) | E4:8 |
| No E4:1 | No E4:28 | |||
| EDSS 6 años (n:15) | 7 (46,7%) | E4:1 | 8 (53,3%) | E4:2 |
| No E4:6 | No E4:6 | |||
No existe una definición consensuada de la respuesta al tratamiento con INFB en la EMRR. Disponer de una forma de clasificar adecuadamente pacientes individuales de acuerdo con su respuesta al tratamiento facilitaría decisiones terapéuticas racionales, permitiría el diseño de ensayos clínicos futuros y posibilitaría la realización de estudios que correlacionaran marcadores biológicos, como por ejemplo polimorfismos genéticos con la respuesta terapéutica1,5.
Para empezar, no existe acuerdo acerca del tiempo de seguimiento necesario para evaluar la respuesta terapéutica, oscilando este entre 1 y 6 años en los estudios publicados hasta la fecha. Clínicamente, a la hora de evaluar la respuesta al INFB pueden considerarse la disminución de la tasa de brotes, la ausencia de la progresión de discapacidad, o la ausencia de conversión a la fase secundaria progresiva de la enfermedad. El número de brotes y la progresión de la discapacidad son los dos fenómenos clínicos básicos en la EM, y ambos pueden tenerse en cuenta a la hora de determinar la respuesta al tratamiento inmunomodulador. La disminución de la tasa de brotes es el objetivo principal de la mayoría de los ensayos clínicos realizados con INFB en los últimos años; sin embargo, brotes sensitivos u otros brotes con recuperación completa pueden ser considerados cualitativamente de forma diferente a brotes motores o polirregionales. Además, la tasa de brotes puede verse influida por la regresión a la media9. Así, podría considerarse en este punto la severidad funcional de los síntomas agudos o la discapacidad residual para tener en cuenta la respuesta terapéutica10.
Por otro lado, la progresión de la discapacidad puede tenerse en cuenta como marcador de respuesta al tratamiento. Esta estrategia tiene menor fundamento en cuanto a los resultados de los ensayos clínicos, pero mayor realismo en tanto que la discapacidad es, lo que al fin y al cabo, influye en el desempeño por parte del paciente de sus actividades cotidianas y su consideración parece de especial interés a la hora de evaluar la situación a largo plazo3,11-13. No hay acuerdo acerca de cuál es el tiempo de observación necesario para confirmar la progresión de la discapacidad, o cómo considerar otros factores que pueden influir en ella como la presencia de depresión, fatiga, espasticidad u otras enfermedades intercurrentes10,14. De la misma manera es importante, además, definir un criterio de progresión de la discapacidad dependiendo de la puntuación basal en la escala EDSS; en nuestro análisis hemos utilizado los propuestos por Río et al4. Así, un paso de discapacidad sería un aumento de 1,5 de EDSS si el EDSS es inicialmente de 0, un aumento de 1,0 si el EDSS inicial se encuentra entre 1,0 y 5,0, o de únicamente 0,5 si el EDSS es mayor de 5,0. De acuerdo con estos autores, los criterios de respuesta al tratamiento con INFB usando la progresión de la discapacidad son clínicamente más relevantes que aquellos basados sólo en la tasa de brotes, y muestran un elevado valor predictivo positivo de discapacidad significativa al cabo de 6 años del inicio del tratamiento. Así las dos terceras partes de los pacientes con una puntuación de 6,0 o mayor a los 6 años de tratamiento se habrían catalogado como respondedores a dos años basándose únicamente en el número de brotes, y sólo el 3% de los pacientes con aumento de la discapacidad a 2 años presentan un EDSS menor de 6,0 a los 6 años4,15.
Basándonos en todo esto, y en la dificultad para acordar un modelo homogéneo que defina la respuesta al tratamiento16,17, en el análisis de nuestra serie decidimos el abordaje mixto propuesto por Río et al4. Una forma de simplificar la lectura de nuestros resultados es optar por utilizar el criterio de respuesta al tratamiento que se ha seguido en el reciente estudio de farmacogenética en EM publicado por Comabella et al18, esto es, ausencia de brotes y de progresión de discapacidad, que correspondería al criterio I de nuestro análisis.
Entendemos que hubiese incrementado el interés de nuestro estudio evaluar los patrones de respuesta en resonancia magnética nuclear (RMN)19. El diseño retrospectivo y la heterogeneidad en el número de estudios y aparataje para realizar las RMN no nos ha permitido disponer de ese análisis.
Como hemos mencionado, un número significativo de pacientes no tienen la respuesta esperada al tratamiento inmunomodulador. Las causas de esta ausencia ocasional de respuesta no son completamente conocidas, pero podemos vislumbrar que tanto factores ambientales como genéticos podrían contribuir a la refractariedad de algunos pacientes al tratamiento con INFB10,20. Varias variables clínicas y demográficas como la duración de la enfermedad, la edad al inicio del tratamiento, las puntuaciones basales en la escala EDSS o la tasa de brotes anterior al inicio del tratamiento pueden influir en esta respuesta12. Se han propuesto varios marcadores biológicos como posibles predictores de la respuesta al tratamiento, como la expresión del ligando inductor de la apoptosis relacionados con el TNF (TRAIL) o los niveles séricos de INFgamma, o el receptor 1 soluble del factor de necrosis tumoral (sTNF-R1)5,12,21-23. La posible influencia de los polimorfismos de los genes del promotor de la IL-10, del INFgamma, del glipicano 5, de la subunidad 1 del receptor del INF (IFNAR), o los alelos del gen HLA en la respuesta al tratamiento con INFB en pacientes con EM también se ha sugerido13,16,24–29, aunque probablemente esta influencia, de existir, será poligénica influyendo en la misma otros sistemas no únicamente implicados en la respuesta inmune18.
La APOE, codificada en el cromosoma 19q13 es un ligando para el transporte lipídico, inicialmente reconocido como un determinante mayor en el metabolismo de las lipoproteínas y la enfermedad cardiovascular. Se ha sugerido que la captación de lipoproteínas dependiente de la APOE puede desempeñar un importante papel en el desarrollo, mantenimiento y respuesta al daño en el sistema nervioso central. La APOE se expresa en humanos en 3 isoformas codificadas por los alelos E2, E3 y E4. El alelo E4 es un factor de riesgo para la edad de inicio y el desarrollo de una enfermedad de Alzheimer; se ha estudiado también su influencia en otras enfermedades neurológicas como el Parkinson o la esclerosis lateral amiotrófica, o su relación con la recuperación tras un ictus o un daño traumático en el sistema nervioso central7.
Un gran número de estudios, alguno de ellos muy recientemente30–32, han investigado el papel del gen de la APOE en la EM. Así, se ha sugerido que portadores del alelo E4 presentan una forma más severa de la enfermedad, mientras que aquellos con el alelo E2 cursan de forma más leve; algunos autores han limitado esta última influencia sólo al sexo femenino. Sin embargo, un metanálisis llevado a cabo sobre 4.048 pacientes con EM no ha mostrado influencia del polimorfismo del gen de la APOE en la severidad de la enfermedad7. Los resultados de nuestro grupo han evidenciado que esa ausencia de influencia del genotipo APOE en la severidad de la EM se aprecia también al considerar la Multiple Sclerosis Score (MSSS)33, probablemente el mejor método para determinar la severidad con una única medida de discapacidad34.
Factores genéticos con influencia en determinados pasos del desarrollo de una enfermedad pueden tener un importante papel en la respuesta diferente de los pacientes a ciertos tratamientos; así, estudios farmacogenéticos han establecido que el alelo APOE4 predice una pobre respuesta al tratamiento con inhibidores de la colinesterasa en la enfermedad de Alzheimer26. Asimismo, el polimorfismo del gen APOE puede influir en la respuesta a estatinas, lo que también puede tener influencia en la EM debido al perfil inmunomodulador que muestran esos fármacos35,36. Por ejemplo, se ha mostrado que el genotipo APOE predice de forma significativa el descenso del colesterol LDL o los triglicéridos al tratar a varones hiperlipidémicos con atorvastatina8.
ConclusiónLos resultados de un reciente metanálisis no sustentan la posible influencia del gen de la APOE en la susceptibilidad o la severidad de la EM.
Aunque el número de pacientes de nuestro estudio es reducido de cara a obtener significaciones estadísticas, no encontramos influencia de este gen en la respuesta al tratamiento con INFB en pacientes con EMRR. En cualquier caso, estudios con mayor número de pacientes deberán ser llevados a cabo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Presentado parcialmente como póster en el XVII Congreso de la European Neurological Society (ENS). Rhodes, Greece, junio 2007.