La infección por el virus de Epstein-Barr (VEB) es muy frecuente en la edad pediátrica, siendo su principal manifestación clínica la mononucleosis infecciosa (MNI)1,2. La edad de primoinfección varía según la región: en países en desarrollo, entre el 80 y el 100% de los niños afectados tienen entre 3 a 6 años, siendo mayoritariamente asintomáticos1. Una vez que la infección primaria ocurre, puede permanecer en estado latente en el huésped humano de por vida1,2.
La MNI se describe clásicamente en niños mayores y adolescentes, con síntomas característicos como fiebre, decaimiento, malestar general, faringitis aguda, linfadenopatías y hepatoesplenomegalia. En huéspedes inmunocompetentes habitualmente es de curso autolimitado, y rara vez se asocia a complicaciones1,2. Las complicaciones neurológicas pueden ocurrir entre el 1 y el 18% de las personas con MNI, siendo más frecuentes en la etapa aguda de enfermedad y más raramente durante la convalecencia1-3.
En la edad pediátrica la forma de presentación de la MNI puede incluir el compromiso del sistema nervioso central (meningitis aséptica, meningoencefalitis y encefalitis), previo al desarrollo de MNI o como única sintomatología. Es por ello que el VEB debe ser considerado como posible causa de encefalitis aguda independientemente de síntomas asociados1,4-7. Sin embargo, otras complicaciones han sido descritas: cerebelitis, parálisis de nervios craneales, neuritis óptica, síndrome de Guillain-Barré, hemiplejía y mielitis transversa1,3.
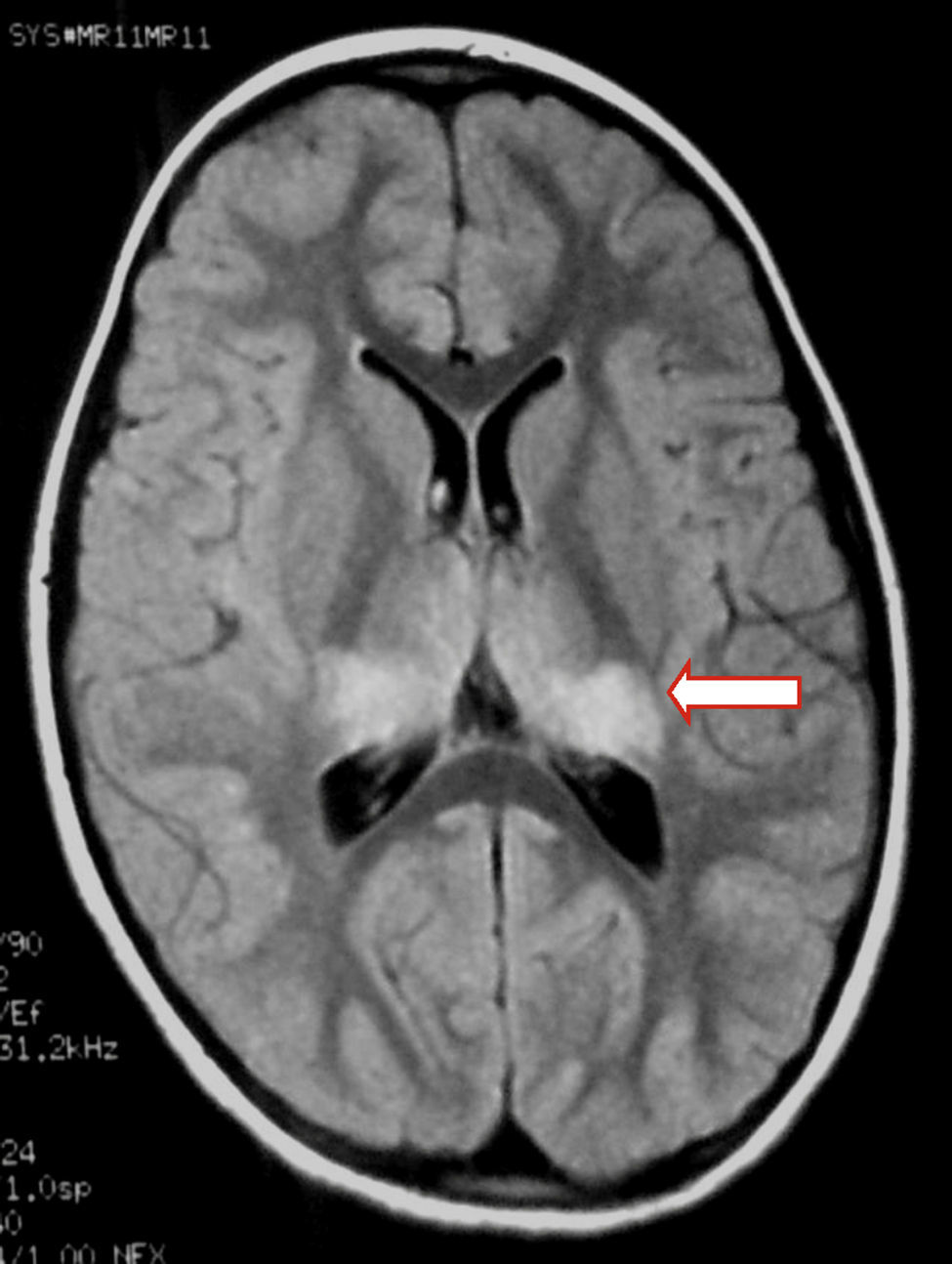
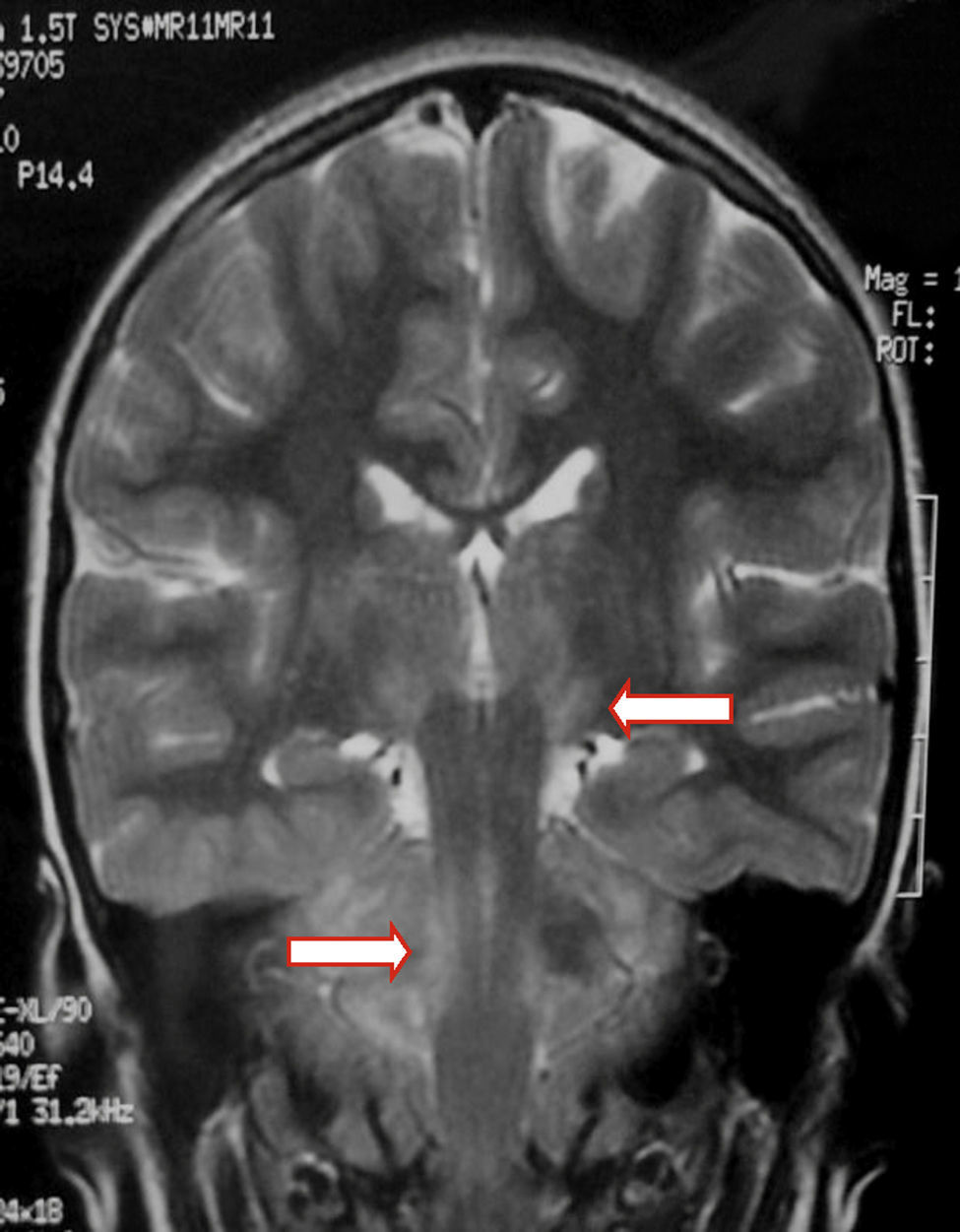
Presentamos a una paciente de 6 años, sana. Cursa síndrome febril prolongado de 20 días de evolución, con diagnóstico inicial de faringo y gingivoestomatitis. Agrega cefaleas persistentes, fotofobia, somnolencia excesiva y trastorno de la marcha. Se presenta lúcida, sin signos meníngeos, con hiperreflexia generalizada y ataxia cerebelosa. Del laboratorio se destaca: leucocitosis de 25.300/mm3 (60% neutrófilos) sin linfocitos activados, anticuerpos heterófilos para VEB (Paul Bunnell) negativos y citoquímico de líquido cefalorraquídeo (LCR): glóbulos rojos 20/mm3 conservados, glóbulos blancos 40/mm3 (60% polimorfonucleares), glucosa 0,45g/l, proteínas totales 0,46g/l. Bacteriológico, sin desarrollo. Reacción de cadena de polimerasa (PCR) positiva para VEB; enterovirus, herpes virus 1, 2 y 6 negativos. Se realizan una tomografía computarizada de cráneo (TC) normal y un electroencefalograma (EEG) evidencia sufrimiento cortical difuso y subcortical con actividad periódica. Resonancia magnética (RM) de cráneo que muestra hiperintensidad en T2 y FLAIR a nivel talámico bilateral, mesencefálico y cerebeloso. No muestra realce con contraste ni restricción en difusión (figs. 1 y 2).
Se solicitan anticuerpos anticápside VEB (VCA) IgG positivos, IgM negativos. Se reitera PCR para VEB en LCR, con resultado positivo. Se diagnostica encefalitis por VEB. Inicia tratamiento con aciclovir durante 21 días y dexametasona por 72 h. Al mes del episodio descrito, pérdida de visión bilateral con fondo de ojo normal y potenciales evocados visuales con ausencia de respuesta. Con diagnóstico de neuritis óptica retrobulbar postinfecciosa, se administran bolos de metilprednisolona a 30mg/kg/día, completando 4 semanas de tratamiento con prednisona, con excelente evolución.
La encefalitis VEB frecuentemente es de inicio agudo y de rápida progresión, y usualmente se acompaña de recuperación completa5. La paciente presentó la sintomatología más frecuentemente descrita, con fiebre, cefaleas, compromiso de la consciencia y alteración en la marcha, todos ellos elementos indicativos de encefalitis clínica8.
En cuadros clínicos típicos de MNI, la detección de anticuerpos heterófilos es suficiente para su diagnóstico. No obstante, su resultado puede ser negativo en la etapa precoz de la enfermedad, particularmente en menores de 4 años1,2. La detección de anticuerpos específicos para VEB debe ser reservada para aquellos pacientes con alta sospecha y falta de respuesta de anticuerpos heterófilos, presentación clínica atípica o severa. Dentro de ellos se incluyen anticuerpos IgG e IgM para la cápside viral (VCA) e IgG para ácidos nucleicos del virus (EBNA). El diagnóstico serológico de infección aguda o reciente incluye detección de anticuerpos IgM e IgG para VCA, y la ausencia de IgG EBNA. La detección de Ac IgG VCA y Ac IgG EBNA persisten de por vida y son indicativos de estado crónico de portador, con eventual posibilidad de reactivación1,9. En nuestro caso, pensamos que cursó una primoinfección por VEB, no confirmado por serología específica por su realización tardía.
El estudio del LCR en todo paciente en quien se sospeche encefalitis es obligatorio. El análisis citoquímico no muestra elementos específicos, siendo en un 10% normal4. El desarrollo de amplificación de ácidos nucleicos virales por PCR en LCR debe ser utilizado en un adecuado escenario clínico para intentar encontrar al agente etiológico responsable4,10. El VEB puede ser detectado por PCR en LCR, aunque un resultado positivo no necesariamente denota infección del sistema nervioso central, debido a que las células mononucleares infectadas en estado latente pueden causar un resultado falso positivo10-13. Es por ello que el resultado debe acompañarse de un adecuado contexto clínico, evidencia serológica e imagenológica4,11,14-16, como sucedió en el caso presentado.
El EEG es un indicador sensible de disfunción cerebral y puede evidenciar compromiso del sistema nervioso central durante etapas precoces de la enfermedad. En general, los hallazgos son inespecíficos, como sucede en el caso analizado. La severidad de las alteraciones evidenciadas en el EEG no se relacionan con gravedad de la enfermedad en su fase aguda, pero una rápida mejoría del trazado frecuentemente indica buen pronóstico3,9.
En niños con encefalitis por VEB, las alteraciones en los estudios de neuroimagen presentan una frecuencia variable1,4,6,17. Debido a la posibilidad de detección de cambios precoces, la RM es considerada el estudio imagenológico de elección4. Hallazgos heterogéneos en la RM son: edema difuso, daño cortico-subcortical, periventricular y compromiso gangliobasal. El VEB afecta a todas las áreas del cerebro, incluyendo núcleos de la base, con peor pronóstico si la región límbica o talámica se ve afectada6,9,17-19. En el seguimiento, habitualmente la RM se normaliza19.
El VEB es susceptible in vitro al aciclovir, pero su eficacia in vivo es mínima y no reduce la severidad o la duración, y no altera el pronóstico de la enfermedad. El uso de corticoides está avalado frente a determinadas complicaciones, especialmente en alteraciones desmielinizantes postinfecciosas del sistema nervioso central, como ocurrió en nuestro caso2,4,6,14,20-22.
El pronóstico de la MNI en personas sanas es excelente, siendo la muerte reportada como un evento excepcional22,23. En el momento actual, luego de un año de seguimiento, la paciente ha presentado una recuperación completa: sin déficits neurológicos, con visión y RM normal.
En conclusión, presentamos a una paciente que en el curso de MNI presenta compromiso del sistema nervioso central directo con encefalitis, y posteriormente manifestaciones postinfecciosas desmielinizantes a forma de neuritis óptica. Con el tratamiento realizado, desapareció su sintomatología, con recuperación completa al año de seguimiento. La encefalitis asociada a la infección por VEB no es frecuente en pediatría. La búsqueda de serología de VEB, así como la detección de PCR en el LCR, en un contexto clínico e imagenológico adecuado, permiten confirmar el diagnóstico.
Conflicto de interesesNo existieron conflictos de intereses con ninguno de los autores.
Agradezco a los familiares de la paciente, por la paciencia y la comprensión a la hora de realizar la publicación.