El deterioro cognitivo es una entidad clínica en la que las funciones intelectuales están parcial o totalmente alteradas y supone un problema de salud pública y un reto para los servicios sanitarios y sociales. El objetivo de este trabajo es estimar la prevalencia de estos trastornos en la población mayor de 65 años que consulta en atención primaria en 5 redes centinelas sanitarias.
MétodoSe realizó el test Mini-Cog de cribado de deterioro cognitivo en una muestra de pacientes que acudieron a su médico de familia en 4 días seleccionados al azar. La confirmación se hizo con el test Mini-Mental y el Alzheimer's Questionnaire. Se estimaron tasas brutas y ajustadas por las variables demográficas y sociales.
ResultadosSe estudiaron 4.624 pacientes, que representan a una población de 1.723.216 personas de 5 comunidades autónomas. La prevalencia ajustada para el conjunto de la población estudiada fue del 18,5% (IC 95% 17,3-19,7), con diferencias entre las redes centinelas. Las mujeres presentan tasas ajustadas significativamente más elevadas que los hombres: 18,5 y 14,3%, respectivamente. La prevalencia por grupo de edad alcanza el 45,3% por encima de los 85 años y presenta diferencias por nivel de estudios alcanzado y tipo de convivencia.
ConclusionesEl deterioro cognitivo es un motivo de consulta frecuente en atención primaria. Es mayor en mujeres y aumenta exponencialmente con la edad. Tanto la sospecha como la confirmación del deterioro cognitivo pueden realizarse por el médico de familia con instrumentos sensibles y validados, lo que permite iniciar un tratamiento precoz.
Cognitive impairment, a clinical entity causing complete or partial intellectual dysfunction, is a major public health concern that poses a challenge for health and social services. The purpose of this study is to estimate the prevalence of this disorder in people aged 65 and older visiting the primary care physician in 5 health sentinel networks.
MethodA sample of patients visiting their primary care doctor on 4 randomly selected days completed the Mini-Cog screening test. Diagnosis of cognitive impairment was confirmed with the Mini-Mental State Examination and the Alzheimer's Questionnaire. We estimated raw and adjusted rates using demographic and social variables.
ResultsWe included 4,624 patients from 5 autonomous communities and representing a population of 1,723,216 inhabitants. The adjusted prevalence rate was 18.5% (95% CI 17.3-19.7], with differences between sentinel networks. Women showed higher adjusted rates than men: 18.5 vs. 14.3%. The highest prevalence rate was observed in people aged 85 and older (45.3%); prevalence rates vary depending on education level and marital status.
ConclusionsCognitive impairment is a frequent reason for consultations in primary care. Its prevalence is higher in women and increases exponentially with age. A number of sensitive, validated tools have been proven useful in screening for and confirming cognitive impairment. Using these tools in primary care settings enables early treatment of these patients.
Se define deterioro cognitivo (DC) como la entidad clínica en la que se observa una alteración parcial o total de las funciones intelectuales: memoria, juicio, orientación, etc., que se adquiere a lo largo de la vida. El grado de alteración cognitiva de los pacientes va desde un deterioro leve a la demencia franca (enfermedad de Alzheimer u otro tipo de demencia)1.
Este síndrome puede acompañar a otros problemas de salud, como depresiones, alteraciones del estado de ánimo, enfermedades tumorales, metabólicas y vasculocerebrales.
El DC leve representa un estadio intermedio en la función cognitiva entre los cambios que se producen con la edad y aquellos que cumplen los criterios de demencia, y que no interfieren significativamente con las actividades de la vida diaria. Se define como un declive cognitivo mayor que el esperado para la edad y el nivel de educación del paciente2, objetivable, persistente y que no alcanza la intensidad de la demencia3.
El DC leve es un motivo frecuente de consulta en atención primaria, con una prevalencia estimada del 15-20% de las personas mayores de 60 años4. En un estudio longitudinal desarrollado en Leipzig se encontró una tasa global de deterioro cognitivo leve de 7,6% y se observó que este problema de salud estaba significativamente asociado a la edad, las quejas subjetivas de memoria, el deterioro en actividades instrumentales de la vida diaria y antecedentes de un menor rendimiento cognitivo5.
Diversas estimaciones realizadas en España describen una prevalencia para personas mayores de 65 años entre el 14,5% (12,4-16,8)6 y el 17,6% (14,3-20,9%)7, que aumenta según se incrementa la edad; el estudio DERIVA describe una prevalencia del 11,6% (4,0-19,1%) en personas de 65 a 69 años, que aumenta al 22,9% (11,0-34,8%) entre las personas con 85 años o más8. Por último, un metaanálisis de 9 estudios españoles sobre los distintos tipos de demencia, con notables diferencias metodológicas, mostraba una prevalencia en mayores de 70 años de entre el 3,2 y el 12,3%, mayor en mujeres y aumentado con la edad9.
Entre los factores de riesgo de DC descritos se encuentran la edad, el bajo nivel cultural (analfabetismo) y el deterioro de la vida social de los pacientes. Los antecedentes familiares se asocian con el DC y se han descrito factores genéticos como las mutaciones del gen de la proteína precursora de amiloide y el gen de épsilon 4 de APOE, entre otros. El DC leve está relacionado con el riesgo vascular elevado10 y las microhemorragias cerebrales11, así como con algunos trastornos endocrinos, metabólicos y enfermedades infecciosas. Las lesiones neurológicas como los depósitos de placas neuríticas, anillos y atrofias, así como la enfermedad vascular franca, aparecen en pacientes con la enfermedad más avanzada12.
La evolución de los trastornos cognitivos depende de la entidad nosológica que los esté provocando. Tras un diagnóstico de DC leve, entre el 8-15% evolucionan cada año a demencia4,13 y más de la mitad revierten a un estado normal, aunque algunos autores limitan la recuperación solamente al 20%14.
La progresión se asocia al bajo nivel educativo15, a una mayor edad y a la presencia de múltiples enfermedades crónicas y de depresión16, frecuente en población anciana.
La detección de DC en ciertos grupos de edad es especialmente importante ya que existen cada vez más pruebas de los beneficios del tratamiento precoz, que pueden influir en la historia natural de la demencia17. Se ha demostrado que la prevención de riesgos vasculares puede suponer una reducción del 50% en la prevalencia de demencia en personas con 65 años o más. Los factores de riesgo vascular también contribuyen a las deficiencias observadas en los estadios preclínicos del deterioro cognitivo11.
La detección de DC se realiza con la exploración del estado de la memoria, de la orientación, del lenguaje y de la capacidad para comunicarse. Para ello se han planteado múltiples pruebas que van desde los test cortos, como el Mini-Cog –que consiste en la repetición de 3 palabras, el dibujo del reloj y el recuerdo de las 3 palabras–18, a complejas exploraciones y entrevistas que buscan llegar a un diagnóstico tanto del deterioro como del problema subyacente. Una de ellas es el Alzheimer's Questionnaire (AQ)19,20, que explora síntomas clínicos que se conoce tienen un alto valor predictivo para la detección de enfermedad de Alzheimer.
Una reciente revisión sistemática de 149 estudios identificó una gran variedad de test para detectar demencia, siendo el más utilizado el Mini-Mental, que ofrecía una sensibilidad de 0,81 y una especificidad de 0,8921. Entre los test breves evaluados, la sensibilidad y la especificidad del Mini-Cog (0,91 y 0,86, respectivamente) y del Addenbrooke's Cognitive Examination-Revised (0,92 y 0,89) eran comparables.
El conjunto del estudio Gómez de Caso tiene por objetivos estimar la prevalencia de DC en la población mayor de 65 años que acude a las consultas de atención primaria, analizar los posibles factores asociados y establecer valores predictivos de DC leve del test Mini-Cog en atención primaria. En este trabajo se presentan únicamente los principales resultados obtenidos con los test empleados en las 2 fases del estudio y se realizan estimaciones de la prevalencia de DC conocido y no conocido en la población de estudio.
Pacientes y métodosLos datos proceden del estudio Gómez de Caso sobre prevalencia y factores asociados al deterioro cognitivo adquirido, estudio observacional descriptivo en la población de 65 años o más que consultó en atención primaria por cualquier motivo en el periodo de estudio y en la población de referencia. En este estudio participaron 179 médicos de familia y enfermeras de las redes centinelas de Castilla y León, Ceuta, Extremadura, Melilla y la Comunitat Valenciana, que han utilizado una metodología común y los estándares de organización y funcionamiento de las redes centinelas sanitarias22. De manera simplificada, la población que tienen asignada los profesionales centinelas es representativa de la población cubierta por el sistema de salud de la comunidad autónoma, de acuerdo con la edad, el sexo y el área urbana/rural. El estudio se llevó a cabo entre febrero de 2014 y marzo de 2015.
Sujetos de estudioEl marco muestral lo constituían todas las personas con 65 años o más que acudían a la consulta de los médicos de las redes centinelas. Se muestrearon 4 días (días azules) en el periodo de un año, un día por trimestre natural, en el que se debía recoger información de un máximo de 15 pacientes al día. Se seleccionaron días azules alternativos para evitar que se produjeran pérdidas de muestra potencial cuando no había consulta o se producían otras circunstancias como la ausencia del médico, fiesta local, no tener citas programadas, consulta de tarde que pudiese sesgar la población, etc. En estos casos el estudio se hacía el día anterior o posterior. Para obviar los periodos de vacaciones se seleccionaron otros 4 días azules adicionales en diferentes meses.
La población de referencia del conjunto de profesionales centinelas participantes fue de 45.967 personas de 65 años o más, que representa una cobertura del 2,7% de las más de 1.700.000 personas de esa edad residentes en las comunidades y ciudades autónomas del estudio.
Criterios de inclusiónPacientes con 65 años o más cumplidos y que el día azul:
- •
Acude a una consulta programada.
- •
Acude a una consulta a demanda.
- •
Recibe una visita domiciliaria del médico de familia.
- •
Una tercera persona consulta por él (recetas, etc.).
Se utilizaron los mismos formularios estándar en cada red centinela para recoger la información clínica epidemiológica de cada paciente (cuestionario de salud) y realizar los test de DC.
El médico centinela explicó a cada paciente en qué consistía el test y le solicitaba el consentimiento oral. Si no había consentimiento, se anotaba en el cuestionario de salud para disponer de un denominador adecuado que permitiera estimar prevalencias en la población.
El estudio tuvo 2 fases:
- 1.
Primera:
El profesional centinela cumplimentaba el cuestionario de salud y realizaba el test Mini-Cog al paciente.
El test Mini-Cog puntúa de 0 a 5. Se consideró positivo cuando el valor era menor de 3.
- 2.
Segunda:
El mismo profesional centinela, a los pacientes en los que el Mini-Cog fue positivo, les pasaba el test Mini-Mental y el AQ (que se realiza a un informador) con el objetivo de detectar DC de cualquier grado.
El test Mini-Mental puntúa de 0 a 30. Se consideró positivo cuando el valor era menor de 24.
El AQ puntúa de 0 a 27. Se consideró negativo cuando el valor era menor de 5, indicativo de DC entre 5 y 14, y de enfermedad de Alzheimer por encima de 14 puntos.
La fase segunda de confirmación de la detección podía ser realizada en esa misma consulta o en una nueva cita o visita del paciente (acompañado por el informador para cumplimentar el AQ) acordada con el profesional centinela.
Todos los datos fueron informatizados en una base de datos disponible en Epi Info y validados en una primera fase en cada centro coordinador de cada red centinela, y en una segunda fase en el centro coordinador general.
Se consideró que una persona de la muestra estudiada presentaba DC cuando tenía un test Mini-Cog positivo y se confirmaba con el test Mini-Mental o el AQ.
Para el cálculo de la prevalencia de la muestra se tuvieron en cuenta los pacientes con registros de antecedentes de demencia en la historia clínica, aunque no se les hubiera realizado el test Mini-Cog o no fuesen confirmados en la segunda fase, ya que muchos pacientes con enfermedad de Alzheimer u otro tipo de demencia no eran capaces de realizar alguno de los test utilizados. Se calculó también una prevalencia bruta para el total de la población ponderando por la población de referencia de cada red centinela.
Se calcularon las prevalencias predichas y sus intervalos de confianza al 95% por red centinela, sexo y edad usando un modelo de regresión de Poisson. Para el cálculo de las prevalencias predichas por estado civil, nivel de estudios y convivencia, el modelo de Poisson incluía la edad y el sexo. Para el análisis estadístico se utilizó The SAS System v9.3.
El proyecto fue aprobado por la Comisión de Investigación y el Comité Ético de Investigación Clínica del Área de Salud de Valladolid Oeste.
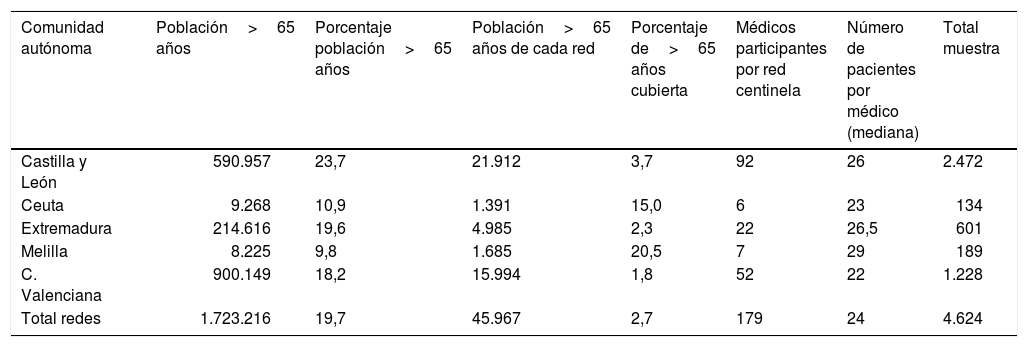
ResultadosLa muestra estaba constituida por 4.624 pacientes con 65 o más años de edad, una vez eliminadas las consultas repetidas en días azules sucesivos a través de un control de identificación del paciente y el médico. La distribución de la muestra por red centinela fue heterogénea, como corresponde a poblaciones de tamaño muy distinto y de estructura de edad diferente. La tabla 1 muestra la población total representada por este estudio de 1.723.216 habitantes, con porcentajes de mayores de 65 años que varían del 23,7% en Castilla y León al 9,8% de la ciudad autónoma de Melilla. Cada médico centinela recogió una mediana de 24 casos, con pocas variaciones entre las distintas redes centinelas.
Características de la población, participación y muestra del estudio por comunidad autónoma de la red centinela
| Comunidad autónoma | Población>65 años | Porcentaje población>65 años | Población>65 años de cada red | Porcentaje de>65 años cubierta | Médicos participantes por red centinela | Número de pacientes por médico (mediana) | Total muestra |
|---|---|---|---|---|---|---|---|
| Castilla y León | 590.957 | 23,7 | 21.912 | 3,7 | 92 | 26 | 2.472 |
| Ceuta | 9.268 | 10,9 | 1.391 | 15,0 | 6 | 23 | 134 |
| Extremadura | 214.616 | 19,6 | 4.985 | 2,3 | 22 | 26,5 | 601 |
| Melilla | 8.225 | 9,8 | 1.685 | 20,5 | 7 | 29 | 189 |
| C. Valenciana | 900.149 | 18,2 | 15.994 | 1,8 | 52 | 22 | 1.228 |
| Total redes | 1.723.216 | 19,7 | 45.967 | 2,7 | 179 | 24 | 4.624 |
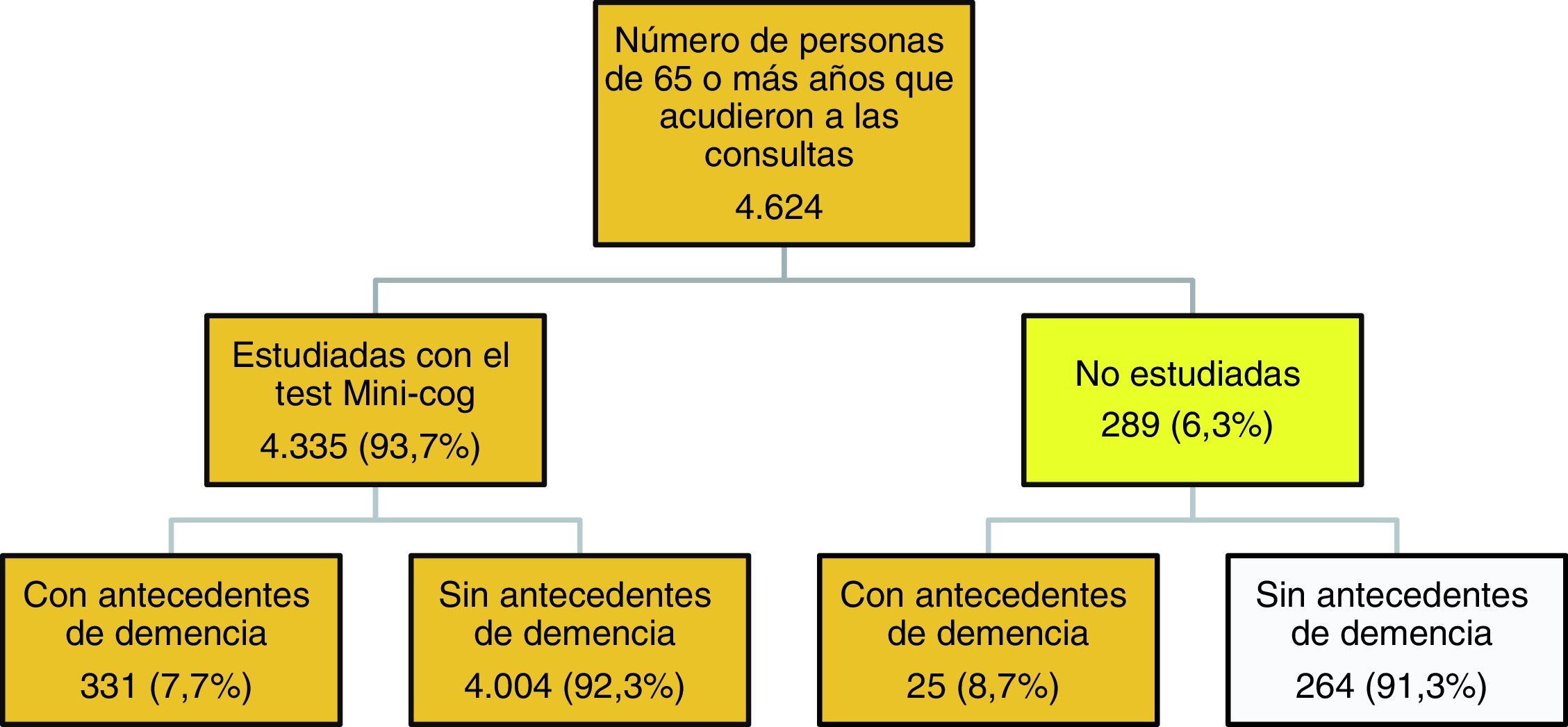
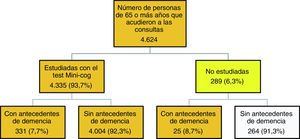
La figura 1 describe el algoritmo de estudio y selección de casos. En 289 pacientes (6,3%) no se pudo realizar el test Mini-Cog, 25 de ellos por padecer una demencia avanzada. El resto de los motivos por los que estos pacientes no fueron estudiados se distribuyó de la siguiente manera: no acudió a la consulta el paciente sino un familiar (12,8%), no hubo consentimiento (20,8%), existía un problema de salud físico, como ceguera, estaban inmovilizados o encamados, fueron derivados al hospital o padecían una enfermedad grave que impedía realizar el test (19,6%), presentaban un problema de salud psíquico (6,4%) u otros motivos como no entender el idioma, analfabetismo, desplazados, etc. (40,4%).
Se consideraron válidas para el estudio de la prevalencia 4.360 personas: 331 estudiadas con antecedentes de demencia, 4.004 estudiadas sin antecedentes de demencia y los 25 pacientes con antecedentes de demencia confirmada que no pudieron ser estudiados con el Mini-Cog.
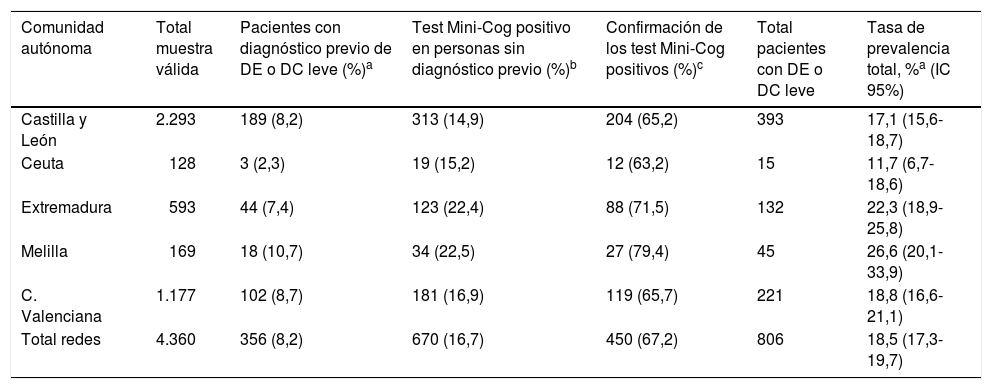
El número de pacientes con un diagnóstico previo de demencia o DC leve ascendió a 356, lo que representa una prevalencia conocida de un 8,2% para el total de la muestra, con importantes diferencias entre redes centinelas (tabla 2). El porcentaje de positividad al test Mini-Cog entre los pacientes sin diagnóstico previo de demencia fue de 16,7% para el conjunto de redes centinelas, con los mínimos en Castilla y León y la ciudad de Ceuta (14,9 y 15,2%, respectivamente) y los máximos en la ciudad de Melilla y Extremadura (22,5 y 22,4%, respectivamente). El porcentaje de confirmación del DC con el test Mini-Mental o el AQ se situó en el 67,2%, más alto en las redes centinelas donde había más Mini-Cog positivos: en Melilla y Extremadura.
Prevalencia de deterioro cognitivo en la muestra por comunidad autónoma
| Comunidad autónoma | Total muestra válida | Pacientes con diagnóstico previo de DE o DC leve (%)a | Test Mini-Cog positivo en personas sin diagnóstico previo (%)b | Confirmación de los test Mini-Cog positivos (%)c | Total pacientes con DE o DC leve | Tasa de prevalencia total, %a (IC 95%) |
|---|---|---|---|---|---|---|
| Castilla y León | 2.293 | 189 (8,2) | 313 (14,9) | 204 (65,2) | 393 | 17,1 (15,6-18,7) |
| Ceuta | 128 | 3 (2,3) | 19 (15,2) | 12 (63,2) | 15 | 11,7 (6,7-18,6) |
| Extremadura | 593 | 44 (7,4) | 123 (22,4) | 88 (71,5) | 132 | 22,3 (18,9-25,8) |
| Melilla | 169 | 18 (10,7) | 34 (22,5) | 27 (79,4) | 45 | 26,6 (20,1-33,9) |
| C. Valenciana | 1.177 | 102 (8,7) | 181 (16,9) | 119 (65,7) | 221 | 18,8 (16,6-21,1) |
| Total redes | 4.360 | 356 (8,2) | 670 (16,7) | 450 (67,2) | 806 | 18,5 (17,3-19,7) |
DC: deterioro cognitivo; DE: demencia.
El número total de casos ya conocidos más los casos confirmados en el estudio fue de 806, lo que representa una tasa bruta de prevalencia del 18,5% (IC 95% 17,3-19,7) de la muestra (18,7% cuando ponderamos por el tamaño de población de la comunidad autónoma). La tasa más alta corresponde a Melilla, con el 26,6%, y la más baja a Ceuta, con el 11,7%.
Las mujeres presentaban una tasa bruta del 21,3% (IC 95% 19,7-23,0) frente al 14,8% (IC 95% 13,2-16,5) de los hombres. La prevalencia aumenta con la edad, alcanzando el máximo a partir de los 85 años, con una prevalencia del 42,3% (IC 95% 38,6-46,1).
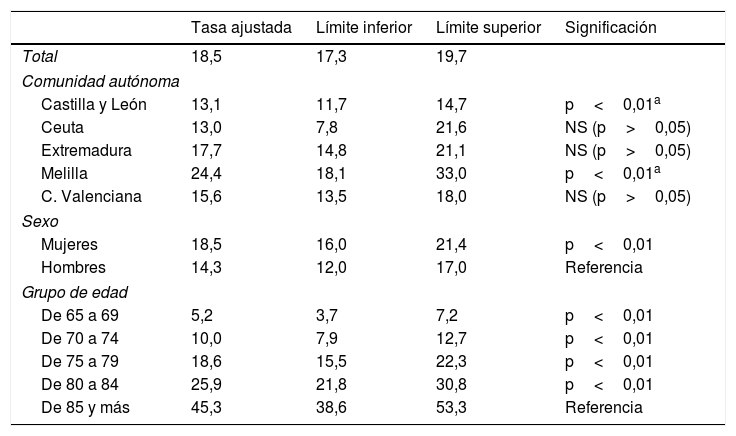
La tabla 3 muestra las tasas ajustadas por comunidad autónoma, sexo y edad del modelo de Poisson. La red de Melilla sigue manteniendo la tasa más elevada, 24,4% (IC 95% 18,1-33,0), y la más baja Ceuta, con un 13,0% (IC 95% 7,8-21,6). Las tasas ajustadas de las redes de Extremadura y, sobre todo, de Castilla y León, con un 13,1% (IC 95% 11,7-14,7), descienden con respecto a las brutas. Solo las redes de Melilla y Castilla y León presentaron diferencias estadísticamente significativas con respecto al valor medio de todas las redes centinelas.
Tasas ajustadas de prevalencia por red, sexo y edad
| Tasa ajustada | Límite inferior | Límite superior | Significación | |
|---|---|---|---|---|
| Total | 18,5 | 17,3 | 19,7 | |
| Comunidad autónoma | ||||
| Castilla y León | 13,1 | 11,7 | 14,7 | p<0,01a |
| Ceuta | 13,0 | 7,8 | 21,6 | NS (p>0,05) |
| Extremadura | 17,7 | 14,8 | 21,1 | NS (p>0,05) |
| Melilla | 24,4 | 18,1 | 33,0 | p<0,01a |
| C. Valenciana | 15,6 | 13,5 | 18,0 | NS (p>0,05) |
| Sexo | ||||
| Mujeres | 18,5 | 16,0 | 21,4 | p<0,01 |
| Hombres | 14,3 | 12,0 | 17,0 | Referencia |
| Grupo de edad | ||||
| De 65 a 69 | 5,2 | 3,7 | 7,2 | p<0,01 |
| De 70 a 74 | 10,0 | 7,9 | 12,7 | p<0,01 |
| De 75 a 79 | 18,6 | 15,5 | 22,3 | p<0,01 |
| De 80 a 84 | 25,9 | 21,8 | 30,8 | p<0,01 |
| De 85 y más | 45,3 | 38,6 | 53,3 | Referencia |
NS: no significativo.
Por sexo, el ajuste del modelo hace descender también la diferencia entre mujeres (18,5%; IC 95% 16,0-21,4) y hombres (14,3%; IC 95% 12,0-17,0), pero esta diferencia es estadísticamente significativa.
Por último, el aumento de la incidencia a medida que aumenta la edad se mantiene cuando se ajusta por comunidad autónoma y sexo, con un incremento significativo que dobla prácticamente la tasa cada 5 años desde los 65. Todas las tasas presentan diferencias estadísticamente significativas con respecto al grupo de mayor edad.
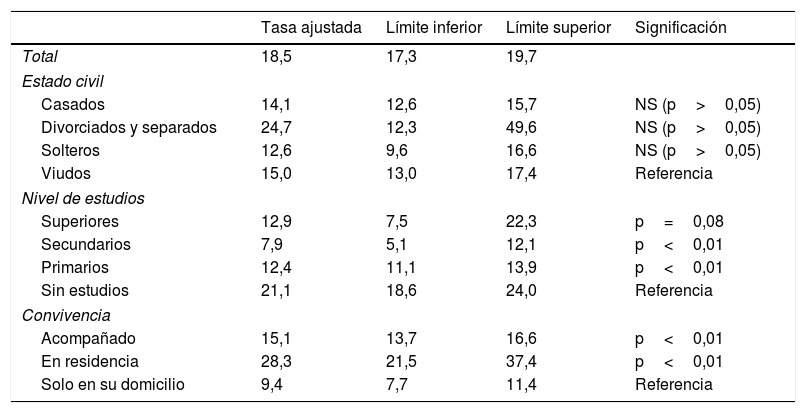
El ajuste del modelo de Poisson de la tabla 4 muestra una alta prevalencia en las personas divorciadas o separadas (24,7%) frente a las solteras (12,6%), esto ajustado por edad y sexo, pero sin ser estadísticamente significativo. También se aprecia una mayor prevalencia estadísticamente significativa entre las personas que no tienen estudios (21,1%), frente a los que poseen estudios primarios o secundarios, y en el límite de la significación con respecto a los que poseen estudios superiores. Por último, como era de esperar, las personas que viven solas en su domicilio presentan prevalencias más bajas que las que están en residencias (28,3%; IC 95% 21,5-37,4) o las que viven acompañadas (15,1%; IC 95% 13,7-16,6%), con diferencias estadísticamente significativas.
Tasas ajustadas de prevalencia por estado civil, nivel de estudios y tipo de convivencia
| Tasa ajustada | Límite inferior | Límite superior | Significación | |
|---|---|---|---|---|
| Total | 18,5 | 17,3 | 19,7 | |
| Estado civil | ||||
| Casados | 14,1 | 12,6 | 15,7 | NS (p>0,05) |
| Divorciados y separados | 24,7 | 12,3 | 49,6 | NS (p>0,05) |
| Solteros | 12,6 | 9,6 | 16,6 | NS (p>0,05) |
| Viudos | 15,0 | 13,0 | 17,4 | Referencia |
| Nivel de estudios | ||||
| Superiores | 12,9 | 7,5 | 22,3 | p=0,08 |
| Secundarios | 7,9 | 5,1 | 12,1 | p<0,01 |
| Primarios | 12,4 | 11,1 | 13,9 | p<0,01 |
| Sin estudios | 21,1 | 18,6 | 24,0 | Referencia |
| Convivencia | ||||
| Acompañado | 15,1 | 13,7 | 16,6 | p<0,01 |
| En residencia | 28,3 | 21,5 | 37,4 | p<0,01 |
| Solo en su domicilio | 9,4 | 7,7 | 11,4 | Referencia |
NS: no significativo.
El DC leve y la demencia suponen un grave problema de salud púbica y un reto para el sistema sanitario y social. Se estima que la prevalencia de este tipo de enfermedades experimentará un incremento exponencial en los próximos años hasta triplicar la cifra actual en 2050, pasando de los 35,6 millones de afectados en la actualidad a los 115,4 millones en tan solo 4 décadas. Además, los datos recogidos permiten constatar que la demencia no es solo un problema asociado a los países desarrollados, sino que también está experimentando un gran aumento en los países en desarrollo23.
La prevalencia global de DC estimada por este estudio, 18,5% de las personas mayores de 65 años que acuden a una consulta de atención primaria, es mayor que la estimada por Luck et al. en Leipzig5 y Gavrila et al. en España6, y similar a lo que recoge Petersen como DC leve4 y al estudio DERIVA8. También es consistente con la literatura el significativo aumento con la edad y la mayor prevalencia en mujeres9. En este estudio, la prevalencia se multiplica por 8 del grupo de edad de 65 a 69 años a los mayores de 85. El exceso de prevalencia de mujeres frente a hombres es del 29%.
Una de las limitaciones de este estudio es que las estimaciones se basan en una muestra de pacientes que acuden a las consultas de atención primaria y no de la población general. El hecho de que la población mayor de 65 años tenga una frecuentación de más de 5 consultas por persona al año24 supone que la práctica totalidad de la población de estos grupos de edad avanzada pasa al menos una vez por la consulta de su médico de familia y, por lo tanto, formaría parte del marco muestral. Se ha puesto especial atención con la selección de los días para cubrir diferentes patrones de consulta a lo largo de un año. La distribución de la muestra por cada día azul ha sido muy homogénea: 28,6% el día primero, 28,1% el segundo, 22,0% el tercero y 21,3% el cuarto. También el número de registros por médico participante ha sido muy parecido, entre 22 y 29 por participante. Por último, aunque la participación territorial en este estudio está limitada a 3 comunidades y 2 ciudades autónomas, la diversidad geográfica, social, económica y cultural de más de 1,7 millones de pacientes mayores de 65 años asegura una heterogeneidad de la población que no debiera diferir en exceso de una muestra nacional más amplia.
El número de casos con antecedentes de demencia fue especialmente comprobado a través de la revisión de los motivos de no respuesta y de aquellos que no consintieron hacer el estudio. Se verificó que los casos en los que el médico manifestaba no tener antecedentes de demencia, en efecto no tenían ninguna información sobre el tipo de demencia, y que aquellos en los que el médico señalaba un diagnóstico previo de demencia, tenían consignado el tipo de demencia.
La evaluación cognitiva breve en atención primaria supone un reto, pues se requiere la adaptación y la validación de instrumentos adaptados a la población en la que se trabaja, el uso de test con la sensibilidad adecuada para detectar pacientes con DC leve y la búsqueda de medidas que tengan una validez transcultural adecuada25.
Ante la ausencia de un patrón oro que permita la detección de DC, este se realiza con test cortos, como el Mini-Cog, que permiten una primera aproximación diagnóstica de forma rápida, y se confirma con complejas exploraciones y entrevistas como el AQ, que explora síntomas clínicos que tienen una alta sensibilidad y especificidad para la detección de enfermedad de Alzheimer (98 y 96%, respectivamente) y para el DC leve (87 y 94%, respectivamente)19. En atención primaria se ha utilizado clásicamente la versión española de Lobo del Mini-Mental de Folstein, utilizada en la segunda fase de este estudio, pero se ha criticado mucho que es una prueba muy dependiente del nivel educativo de los pacientes. En la actualidad se proponen pruebas más breves, como el Mini-Cog, que valoren fundamentalmente recuerdo y lenguaje26,27.
El test Mini-Cog, usado en la primera fase de este estudio, requiere una interpretación lingüística muy básica, puede usarse con cualquier lenguaje, en cualquier etnia y nivel socioeconómico. La necesidad de entrenamiento del entrevistador es mínima, por lo que podría ser incorporado como prueba rutinaria en atención primaria. El Mini-Cog usa 3 ítems de recuerdo de memoria y un test de dibujo de un reloj que es utilizado como información discriminante que ayuda a clarificar puntuaciones intermedias tanto en epidemiología como en la práctica clínica, y detecta desde deterioros cognitivos moderados hasta demencias francas. En este estudio, de los pacientes detectados como positivos con el Mini-Cog, se confirmaron el 67,2% con el test Mini-Mental y/o el AQ. No se ha podido verificar si el 32,8% restante son falsos positivos, están en una fase muy precoz de la evolución de la enfermedad o los test de confirmación fallan a la hora de detectarlos.
La práctica del cribado indiscriminado no está exenta de controversia por la ansiedad o depresión que puede provocar un test positivo en personas sin demencia. Y en algunas situaciones, como señalan Panegyres et al.17, puede abocar a una pérdida de status social, de empleo, la retirada del carné de conducir o a una estigmatización que disminuya la calidad de vida.
La tasa anual de progresión de DC leve a demencia está entre el 8-15%. Sin embargo, no todos los DC leves son debidos a la enfermedad de Alzheimer, por lo que una detección precoz puede resultar en un abordaje temprano de la enfermedad subyacente y una mejora de las posibilidades de recuperación o de mantenimiento de las funciones cognitivas4.
Este estudio colaborativo entre varias redes centinelas españolas pone de manifiesto el grave problema de salud pública al que se enfrenta una población envejecida como la española, y el importante papel que juegan los profesionales sanitarios de atención primaria en la detección precoz y la atención sanitaria y social que deben recibir estos pacientes desde el inicio de los síntomas. Se necesitan más estudios que avalen la implantación de guías con el mejor procedimiento de detección precoz y de confirmación, y un seguimiento de la trayectoria de los pacientes con riesgo elevado de evolución a demencia.
FinanciaciónEste trabajo ha sido financiado con fondos propios de las administraciones sanitarias implicadas.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
En primer lugar queremos agradecer la participación de la población estudiada, sin cuyo consentimiento no se hubiera podido realizar este trabajo.
A todos los médicos de familia y enfermeras de atención primaria que colaboraron en este estudio por su esfuerzo, dedicación y compromiso con la investigación.
Al resto de participantes, técnicos, administrativos y auxiliares que se encargaron de la gestión y coordinación en cada una de las comunidades autónomas y en la coordinación general.
Esta investigación llevará el sobretítulo de Estudio Gómez de Caso, en recuerdo del Dr. José Ángel Gómez de Caso, epidemiólogo, Jefe de la Sección de Epidemiología del Servicio Territorial de Sanidad y Bienestar Social de Segovia, fallecido en 2013. Él fue el principal impulsor de este proyecto y trabajó en la definición de los objetivos y el desarrollo del protocolo. Sin su dedicación y entusiasmo este estudio no hubiera sido posible.