La neurodegeneración en enfermedad de Alzheimer (EA) empieza décadas antes que la demencia y algunos pacientes con deterioro cognitivo leve presentan una importante carga lesional. La ausencia de información sobre la fisiopatología temprana de la enfermedad dificulta la búsqueda de estrategias terapéuticas.
La queja cognitiva subjetiva (QCS) agrupa a sujetos con quejas mnésicas sin déficits significativos en test neuropsicológicos. Es un síndrome heterogéneo sobre el que no existe consenso, pero algunos de estos pacientes podrían representar el estadio más precoz de EA.
MétodoRealizamos una revisión bibliográfica para resumir el estado del conocimiento actual sobre quejas cognitivas subjetivas.
ResultadosAunque a nivel individual no presenten enfermedad objetivable, a nivel de grupo los pacientes con QCS rinden peor en test neuropsicológicos que la población general y tienen mayor incidencia de declive cognitivo futuro. La depresión y la comorbilidad psiquiátrica desempeñan un papel pero no son la única causa de quejas cognitivas. Estudios con resonancia magnética muestran un patrón de atrofia hipocampal similar al del deterioro cognitivo leve amnésico y en resonancia funcional hay aumento de activación en tareas cognitivas que podrían representar una compensación ante pérdida de función. Los pacientes con QCS presentan un patrón tipo EA de marcadores betaamiloide (Aβ42) y tau con mayor frecuencia que la población general.
ConclusionesLas quejas mnésicas son un síntoma relevante y podrían predecir EA. La heterogeneidad de los pacientes y de los ensayos clínicos ha dificultado la definición del síndrome. En el futuro, una definición estandarizada y estudios longitudinales con un seguimiento suficiente, y centrados en variables cuantificables, podrían clarificar aspectos tempranos de la EA.
Neurodegeneration in Alzheimer disease (AD) begins decades before dementia and patients with mild cognitive impairment (MCI) already demonstrate significant lesion loads. Lack of information about the early pathophysiology in AD complicates the search for therapeutic strategies.Subjective cognitive impairment is the description given to subjects who have memory-related complaints without pathological results on neuropsychological tests. There is no consensus regarding this heterogeneous syndrome, but at least some of these patients may represent the earliest stage in AD.
MethodWe reviewed available literature in order to summarise current knowledge on subjective cognitive impairment.
ResultsAlthough they may not present detectable signs of disease, SCI patients as a group score lower on neuropsychological tests than the general population does, and they also have a higher incidence of future cognitive decline. Depression and psychiatric co-morbidity play a role but cannot account for all cognitive complaints. Magnetic resonance imaging studies in these patients reveal a pattern of hippocampal atrophy similar to that of amnestic mild cognitive impairment and functional MRI shows increased activation during cognitive tasks which might indicate compensation for loss of function. Prevalence of an AD-like pattern of beta-amyloid (Aβ42) and tau proteins in cerebrospinal fluid is higher in SCI patients than in the general population.
ConclusionsMemory complaints are relevant symptoms and may predict AD. Interpatient variability and methodological differences between clinical studies make it difficult to assign a definition to this syndrome. In the future, having a standard definition and longitudinal studies with sufficient follow-up times and an emphasis on quantifiable variables may clarify aspects of early AD.
Las quejas cognitivas subjetivas (QSC) agrupan a un conjunto heterogéneo de pacientes que presentan quejas cognitivas sin evidencia de enfermedad neurodegenerativa. Los albores del concepto se encuentran en el estadio 2 de la GDS descrito por Reisberg1 y ha ido perfilándose como un posible estadio inicial en enfermedades neurodegenerativas con evolución hacia demencia, en especial en enfermedad de Alzheimer (EA)2. Más allá de su utilidad epidemiológica o conceptual, tiene su reflejo en la gran proporción de pacientes que reciben un diagnóstico de QSC en la práctica clínica habitual3,4. Sin embargo, la heterogeneidad metodológica entre estudios y la ausencia de una definición inequívoca y estandarizada dificultan la caracterización de este grupo. El empleo de biomarcadores y las consideraciones de la NIA5 para la definición de un estadio preclínico en la EA son un buen comienzo, aunque el paso desde un concepto epidemiológico o de investigación hasta un paciente individual en la clínica aún no se haya concretado.
La EA causa el 60-80% de todas las demencias. La prevalencia mundial era de 24,3 millones en 20056 y se cuadruplicará para el 20507. La búsqueda de tratamientos curativos se ha visto entorpecida por el diagnóstico tardío, las dificultades técnicas de los tratamientos y la fisiopatología de la enfermedad8-11. Los criterios de Dubois12,13, las recomendaciones de la NIA5 y el concepto de deterioro cognitivo leve (DCL) tienen, entre otros objetivos, adelantar el diagnóstico a estadios previos a la fase de demencia. Si la neurodegeneración empieza décadas antes que la demencia14,15 y la fase de DCL dura 7-10 años, con una tasa de conversión del 16% anual16, es previsible que exista un grupo de pacientes con EA sin deterioro cognitivo objetivable13. Parece razonable buscar los casos más precoces entre los sujetos que presentan quejas cognitivas pero que no presentan signos clínicos de enfermedad.
La identificación de un grupo de individuos en estadio preclínico tendría una doble utilidad. Primero, el desarrollo de nuevas estrategias terapéuticas. Retrasar tan solo un año el inicio de la enfermedad supondría una reducción en la prevalencia mundial de 9 millones de casos en los próximos 40 años7. Los tratamientos neuroprotectores llegan tarde en la demencia tipo Alzheimer y probablemente también en el DCL16-20. El tratamiento sería más efectivo en pacientes con menor carga amiloide y podría atacar mecanismos fisiopatológicos exclusivos de esta fase de la enfermedad12.
A nivel poblacional, factores como la depresión, el bajo nivel educativo, la hipertensión o la diabetes aumentan el riesgo de EA. El riesgo poblacional atribuible es del 10-25%, de forma que 1,1-3 millones de casos serían evitables21,22. La identificación de individuos en riesgo permitiría concentrar el esfuerzo preventivo.
En el presente artículo realizamos una revisión de la base bibliográfica PubMed empleando como criterios de búsqueda «subjective cognitive impairment», «subjective cognitive complaints» y «subjective memory impairment». La heterogeneidad de estudios y la amplitud del tema impidieron realizar una revisión sistemática.
Pretendemos resumir el estado del conocimiento actual sobre este síndrome y descubrir áreas susceptibles de investigación en el futuro.
DesarrolloDificultades en la definición de un nuevo síndromeLa EA sigue presentando retos diagnósticos y abarca un espectro heterogéneo, desde los pacientes con anatomopatología compatible con EA sin síntomas de la enfermedad, pasando por las formas atípicas e incluyendo a pacientes asintomáticos con biomarcadores de EA en líquido cefalorraquídeo (LCR). En el DCL aumenta la complejidad, con cohortes heterogéneas entre ensayos clínicos, tal como evidencian las distintas tasas de conversión a EA16,17,19,20,23. Es esperable que la QCS suponga un reto aun mayor, al ser una entidad en la que, por definición, no hay hallazgos clínicos relevantes.
Heterogeneidad metodológica entre estudios y sus consecuencias sobre los resultados obtenidos en la prevalencia de quejas cognitivas subjetivasLas quejas cognitivas son un motivo de consulta frecuente y representan un porcentaje importante de los pacientes atendidos en unidades de memoria a nivel mundial. Jonker et al. (2000)3 encontraron una incidencia del 25-56%. En Karolinska Memory Clinic (Huddinge, Suecia), el porcentaje de QSC fue del 38% en 20054. En la Unidad de Estudio de la Cognición y la Conducta del Hospital Clínico San Carlos, el porcentaje desde el año 2008 al 2011 fue del 7,52% (Manzano, observaciones personales no publicadas). Probablemente, esta cifra sea tan baja porque no se trata de una Unidad de Memoria enfocada al diagnóstico precoz. Es necesario precisar qué se entiende por QCS dado el alto volumen de pacientes que reciben este diagnóstico.
Sin embargo, no existe una definición establecida de QCS. En ocasiones, se emplea el término como síntoma o conjunto de síntomas; en otras, como entidad independiente distinta de la EA o el DCL. En muchos estudios no se realiza una batería neuropsicológica óptima y en algunos se llegan a asimilar los pacientes con quejas subjetivas a controles sanos24.
No hay un criterio homogéneo de selección de pacientes. Algunos estudios toman sujetos de la población general y preguntan por quejas cognitivas25-34. Otros reclutan pacientes que acuden a unidades de memoria y en los que no se evidencian déficits relevantes en el estudio neuropsicológico35-39. Dado que los pacientes que acuden a consulta lo hacen motu proprio, preocupados por su deterioro, probablemente ambos grupos no sean equivalentes.
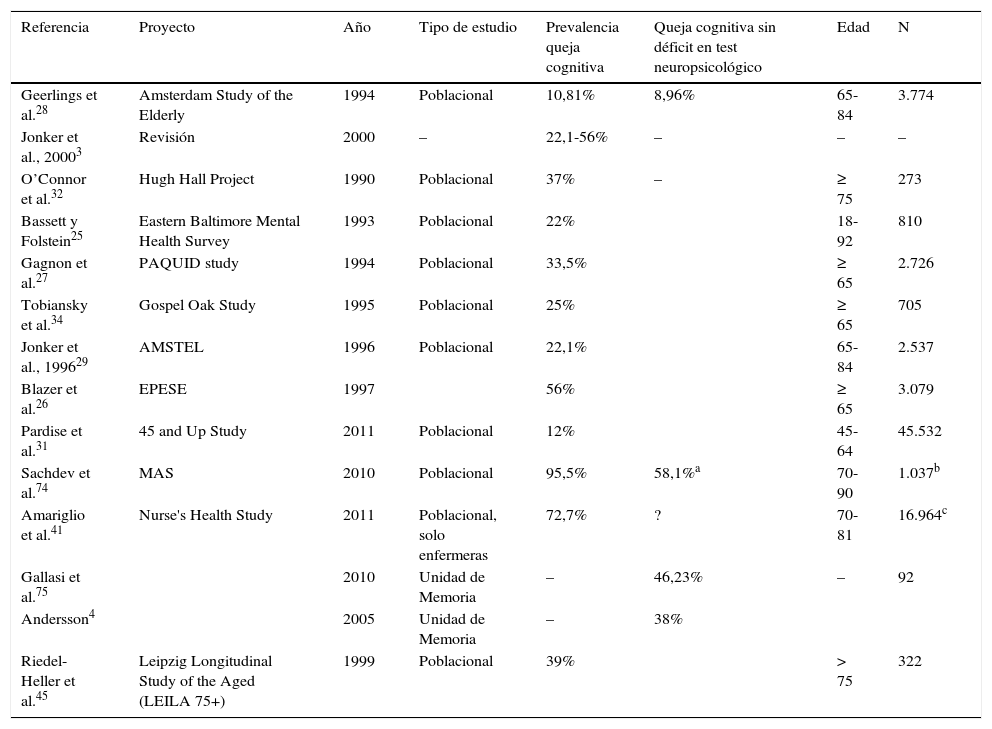
En los estudios en los que se realizó un cribado entre la población general, no hubo una pregunta o preguntas estandarizadas ni validadas. Geerlings et al.28 emplearon: «¿Tiene usted quejas sobre su memoria?»b, que se codificó como «no», «a veces pero no es un problema», «sí y es un problema», «sí y es un problema serio». En el estudio Rotterdam emplearon la misma pregunta, pero con respuesta dicotómica40. En el Eastern Baltimore Mental Health Survey25 y el PAQUID27 se preguntó «¿Encuentra usted que su memoria le dé problemas?» que se codificó como «sí/no». En los estudios, AMSTEL29, Hugh Hall Project32 y Gospel Oak Study34 se usaron preguntas similares al CAMDEX. En el estudio EPESE se preguntó únicamente «¿Está empeorando su memoria?» y la prevalencia de QCS fue lógicamente superior, situándose en un 56%26. Paradise et al.31 emplearon una escala Likert de funcionamiento mnésico y Jorm et al. (2001)30 emplearon 4 preguntas con una escala de 0-4. El subestudio del Nurse's Health Study de Amariglio et al.41 empleó 7 preguntas, algunas claramente relacionadas con envejecimiento normal y no con enfermedad, por lo que la incidencia de quejas cognitivas fue muy alta. El único estudio realizado en nuestro medio fue el de Montejo et al.33, quienes encuadraron su cribado dentro de la Encuesta de Salud de la Ciudad de Madrid (ESCM 05) y usaron 3 preguntas del SCAN42 y CAMDEX43: «¿Tiene problemas de memoria?», «¿Se le olvida dónde pone las cosas?» y «¿Se le olvidan los nombres de familiares y conocidos?»44.
La heterogeneidad metodológica también explica las diferencias entre incidencias en distintos estudios, que se resumen en la tabla 1.
Trabajos que evalúan la prevalencia de quejas cognitivas subjetivas
| Referencia | Proyecto | Año | Tipo de estudio | Prevalencia queja cognitiva | Queja cognitiva sin déficit en test neuropsicológico | Edad | N |
|---|---|---|---|---|---|---|---|
| Geerlings et al.28 | Amsterdam Study of the Elderly | 1994 | Poblacional | 10,81% | 8,96% | 65-84 | 3.774 |
| Jonker et al., 20003 | Revisión | 2000 | – | 22,1-56% | – | – | – |
| O’Connor et al.32 | Hugh Hall Project | 1990 | Poblacional | 37% | – | ≥ 75 | 273 |
| Bassett y Folstein25 | Eastern Baltimore Mental Health Survey | 1993 | Poblacional | 22% | 18-92 | 810 | |
| Gagnon et al.27 | PAQUID study | 1994 | Poblacional | 33,5% | ≥ 65 | 2.726 | |
| Tobiansky et al.34 | Gospel Oak Study | 1995 | Poblacional | 25% | ≥ 65 | 705 | |
| Jonker et al., 199629 | AMSTEL | 1996 | Poblacional | 22,1% | 65-84 | 2.537 | |
| Blazer et al.26 | EPESE | 1997 | 56% | ≥ 65 | 3.079 | ||
| Pardise et al.31 | 45 and Up Study | 2011 | Poblacional | 12% | 45-64 | 45.532 | |
| Sachdev et al.74 | MAS | 2010 | Poblacional | 95,5% | 58,1%a | 70-90 | 1.037b |
| Amariglio et al.41 | Nurse's Health Study | 2011 | Poblacional, solo enfermeras | 72,7% | ? | 70-81 | 16.964c |
| Gallasi et al.75 | 2010 | Unidad de Memoria | – | 46,23% | – | 92 | |
| Andersson4 | 2005 | Unidad de Memoria | – | 38% | |||
| Riedel-Heller et al.45 | Leipzig Longitudinal Study of the Aged (LEILA 75+) | 1999 | Poblacional | 39% | > 75 | 322 |
Existe la duda de si las quejas cognitivas en adultos predicen el deterioro cognitivo o son solo reflejo de estados depresivos y comorbilidad psiquiátrica. Sin embargo, y a pesar de que este síntoma es frecuente entre pacientes con depresión, la literatura señala diferencias a nivel de grupo entre aquellos con QCS y la población general, no solo en comorbilidad psiquiátrica, sino también en resultados de test neuropsicológicos, declive cognitivo futuro, pruebas de neuroimagen y neuroimagen funcional, y marcadores de LCR. En los siguientes apartados, analizaremos estos puntos en detalle.
Relación entre quejas cognitivas y rendimiento cognitivoLos estudios sobre la relación entre quejas y funcionamiento cognitivo muestran resultados contradictorios2,27,29,32. La depresión es un factor de confusión3,29-32,41,45-47. El Mini-Mental State Exam de Folstein (MMSE) podría ser un instrumento demasiado simple para demostrar deterioro en estos pacientes que, sin embargo, sí presentan alteraciones en otros tests45. En la mayoría de las evaluaciones, las quejas cognitivas se relacionan con peor rendimiento cognitivo27,29,33,35,41,48 y mayor deterioro en los 4 años previos46. Sin embargo, existen resultados discordantes y otros estudios no revelan esta asociación27,29-32,49.
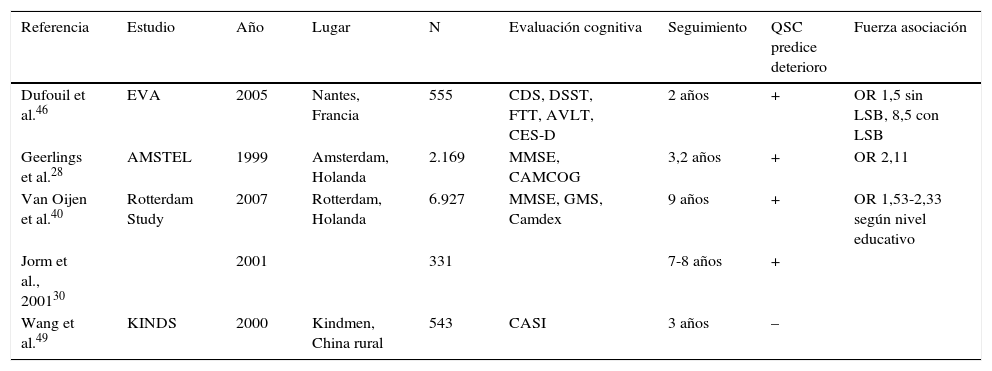
Los estudios longitudinales arrojan algo de luz sobre la cuestión, aunque persisten los resultados contradictorios, probablemente debido a diferencias metodológicas y a un tiempo de seguimiento insuficiente (tabla 2). Jorm et al. (2001)30 no encontraron relación entre quejas cognitivas y rendimiento cognitivo basal, pero sí con deterioro en el seguimiento. Tobianski et al.34, Geerlins et al.28 y otros41 encontraron que los individuos con quejas cognitivas sin evidencia de deterioro presentaban una incidencia mayor de EA en el seguimiento, después de controlar factores de confusión como la depresión. Schmand et al.47,50 encontraron asociación entre quejas cognitivas e incidencia de demencia, aunque no distinguieron a los sujetos cognitivamente indemnes de los ya deteriorados.
Estudios longitudinales. Relación entre quejas cognitivas y deterioro en el seguimiento
| Referencia | Estudio | Año | Lugar | N | Evaluación cognitiva | Seguimiento | QSC predice deterioro | Fuerza asociación |
|---|---|---|---|---|---|---|---|---|
| Dufouil et al.46 | EVA | 2005 | Nantes, Francia | 555 | CDS, DSST, FTT, AVLT, CES-D | 2 años | + | OR 1,5 sin LSB, 8,5 con LSB |
| Geerlings et al.28 | AMSTEL | 1999 | Amsterdam, Holanda | 2.169 | MMSE, CAMCOG | 3,2 años | + | OR 2,11 |
| Van Oijen et al.40 | Rotterdam Study | 2007 | Rotterdam, Holanda | 6.927 | MMSE, GMS, Camdex | 9 años | + | OR 1,53-2,33 según nivel educativo |
| Jorm et al., 200130 | 2001 | 331 | 7-8 años | + | ||||
| Wang et al.49 | KINDS | 2000 | Kindmen, China rural | 543 | CASI | 3 años | – |
AVLT: auditory verbal learning test; Camcog: Cambridge cognitive exam; Camdex: Cambridge examination for mental disorders of the elderly; CASI: cognitive abilities screening instrument; CES-D: Center for Epidemiologic Studies Depression Scale; CSD: cognitive difficulties scale; DSST: digit symbol substitution test; FTT: finger tapping test; GDS-S: geriatric depression scale short form; GMS: Geriatric Mental State schedule; KINDS: Kinmen Neurological Disorders Survey; LSB: lesiones de sustancia blanca; MMSE: mini-mental state examination.
El estudio de Geerlings et al.28 incluyó población anciana seleccionada aleatoriamente de los listados de atención primaria de la región de Ámsterdam. Examinaron a 3.774 sujetos. Analizaron datos demográficos, quejas cognitivas y un total de 4 test de estatus cognitivo, entre ellos el MMSE. Excluyeron a los sujetos con demencia y diferenciaron los que presentaban cognición normal (MMSE 26-30) y borderline MMSE (21-25). El 10,8% de los pacientes refirieron quejas cognitivas en la primera evaluación. El tiempo medio de evolución hasta la segunda evaluación fue de 3,2 años, al cabo de los cuales 77 pacientes habían progresado a EA. Quejas cognitivas, edad avanzada, sexo femenino, depresión, nivel educativo y nivel cognitivo de base fueron significativos en el análisis univariante, siendo el factor más relevante la edad (odds ratio [OR] de 6,17), la presencia de deterioro cognitivo basal con MMSE < 26 comparado con 26-30 (OR 3,77) y sexo femenino (OR 2,22). Las quejas cognitivas se asociaron a evolución hacia EA, con una OR de 2,11. En el análisis multivariante, las quejas cognitivas se asociaban a EA en pacientes con MMSE > 26 en la evaluación inicial, pero no en aquellos con demencia o con cognición borderline, aunque este resultado podría estar influido por la alta frecuencia de pérdidas de seguimiento entre los pacientes con demencia y borderline. Ni la depresión ni el nivel educativo modificaban el resultado. Schofield et al.51 encontraron asociación entre EA y quejas cognitivas solo entre los sujetos que ya estaban deteriorados en la primera evaluación, pero no sujetos con QCS. Sin embargo, la duración de la observación fue tan solo de un año, comparado con los 3,2 años del estudio de Geerlings28.
Dufouil et al.46 también encontraron relación entre quejas cognitivas y deterioro en varios tests, con una OR mayor para pacientes que además presentaban lesiones de sustancia blanca.
Van Oijen et al.40 realizaron un estudio longitudinal con 6.927 sujetos, encuadrado dentro del Rotterdam Study. La hipótesis era que, debido a un efecto techo de los test neuropsicológicos, las quejas cognitivas tendrían mayor valor y serían más predictivas de deterioro en pacientes con alto nivel educativo. El seguimiento fue largo, de 10,8 años. Se encontró que la educación protegía de EA, sobre todo en varones. Las quejas cognitivas eran factor de riesgo para demencia, incluso después de ajustar por nivel educativo, MMSE basal, alelo ApoE y depresión. Tal como habían previsto, la asociación variaba con la educación, siendo mayor en pacientes con mayor nivel educativo. Tomaron como grupo de referencia a pacientes con bajo nivel educativo sin quejas cognitivas: comparados con ellos, los sujetos con bajo nivel educativo y quejas cognitivas tenían un riesgo 1,53 veces mayor de desarrollar EA y el grupo de alto nivel educativo, 2,33.
Por el contrario, Wang et al.49 no encontraron relación entre QCS y demencia. Estudiaron a 543 individuos procedentes de una zona rural a los que se administraron 2 evaluaciones, espaciadas 3 años. En ambas evaluaciones, las quejas cognitivas se correlacionaron con peor rendimiento en los tests neuropsicológicos, pero no encontraron deterioro longitudinal. Poniendo estos resultados en contexto del estudio Rotterdam, es posible que el tipo de población, rural y con bajo nivel educativo, redujera el valor predictivo de las quejas cognitivas.
En general, la mayoría de los estudios longitudinales indican una asociación positiva, aunque modesta, entre quejas cognitivas y deterioro futuro (tabla 2).
El papel de la depresiónSe ha postulado que rasgos de personalidad o depresión podrían ser la causa de las quejas cognitivas2. La depresión se asocia a quejas cognitivas29,32. La depresión en sí misma disminuye el rendimiento cognitivo y es factor de riesgo de deterioro futuro52, actuando como factor de riesgo y como síntoma prodrómico de EA53. Es más, a partir de los 65 años, los pacientes deprimidos presentan un deterioro acelerado que deja de ser paralelo al de controles sanos54.
El perfil de deterioro en depresión, centrado en la capacidad atencional y la función ejecutiva, así como la atrofia, de predominio frontal, no corresponden al patrón amnésico de EA. Sin embargo, se han descrito alteraciones del hipocampo en pacientes deprimidos55 y la depresión es factor de riesgo para EA56. Kramberger et al.57 evaluaron marcadores de EA en el LCR en QCS y EA, y los correlacionaron con sus resultados en la escala Cornell de depresión. Los sujetos con EA y depresión presentaron una tau total (T-tau) significativamente más baja que aquellos sin depresión, aunque no hubo diferencias en tau fosforilada (P-tau) ni β-amiloide. En el grupo QSC, T-tau y P-tau eran menores en el grupo con depresión, mientras que no se hallaron diferencias en β-amiloide. Estos hallazgos irían en contra de la hipótesis que asocia patología EA con depresión.
En el estudio longitudinal de 7 años de Jorm et al. (2001)30, se describió una relación entre afectividad negativa y quejas cognitivas al inicio del estudio, pero las quejas cognitivas eran un factor independiente de deterioro cognitivo en el seguimiento, una vez controlada la depresión. Amariglio et al.41 también ajustaron para depresión y encontraron asociación entre quejas cognitivas y peor rendimiento. Otros estudios corroboran que la depresión actúa como factor de confusión en la evaluación de quejas cognitivas29,33,46.
Es imprescindible que los estudios sobre pacientes con QCS realicen un control estadístico de este factor.
Pruebas de imagenEl grupo con QCS difiere de la población general en pruebas de imagen58,59. Van der Flier et al.59 compararon a 20 pacientes con QCS con 28 controles, encontrando una reducción significativa en volumen hipocampal izquierdo en el primer grupo. Saykin et al.58 describen una reducción volumétrica temporal medial, frontotemporal y en otras áreas neocorticales similar a la del DCL amnésico, pero de menor intensidad (n = 40). El grado de atrofia se relacionó con el grado de deterioro mnésico y las quejas cognitivas.
Las lesiones en la sustancia blanca inciden en la curva de aprendizaje de QCS, pero no de DCL ni controles sanos35, y potencian el riesgo de deterioro cognitivo en presencia de QCS46.
Grambaite et al.60 analizaron a 45 sujetos, comparando volumen hipocampal y difusividad de la sustancia blanca entre sujetos con QCS y DCL con T-tau alta en el LCR, y sujetos con QCS y DCL con T-tau normal. Encontraron una reducción de la memoria visual y el volumen hipocampal en el primer grupo y una correlación entre rendimiento mnésico y difusión de sustancia blanca entre los sujetos con T-tau normal.
Neuroimagen funcionalVarios estudios de RMN funcional (fMRI) han demostrado alteraciones en la codificación de memoria episódica en demencia por EA y DCL, tanto en la corteza temporal medial como en estructuras neocorticales. En sujetos cognitivamente normales homocigotos para ApoE4 aparece un aumento de activación de córtex prefrontal izquierdo, hipocampo izquierdo y biparietal comparado con homocigotos ApoE361,62. Además, los sujetos con mayor activación presentaron mayor declive en los 2 años siguientes61. En DCL se ha observado tanto un aumento como una disminución de activación en regiones prefrontales y temporales mediales. Estas inconsistencias podrían deberse a la heterogeneidad del grupo, o la inclusión de individuos en distintos estadios de la enfermedad. En un primer momento, se produciría una hiperactivación compensatoria que posteriormente fracasaría y daría lugar a una hipoactivación en fases más avanzadas de la enfermedad38,63. Esto se correlaciona con la teoría del engrosamiento cortical en fase DCL previo a la atrofia de la EA, descrita también por autores españoles del grupo de Molinuevo36 desde un punto de vista estructural.
Rodda et al. (2009)38 compararon el perfil de fMRI en 10 sujetos con quejas cognitivas y 10 controles sanos durante una tarea de codificación mnésica. No encontraron diferencias entre los grupos en el estudio cognitivo basal. El grupo QCS no realizó una codificación menos eficaz ni cometió más errores que los controles, pero sí aparecía una mayor activación de corteza prefrontal dorsolateral y premotora izquierdas. Esto podría reflejar una hiperactivación compensatoria en el grupo QCS, similar a la que ocurriría en el DCL.
En otro estudio similar pero evaluando esta vez tareas de atención dividida, Roda et al. (2010)39, constataron un aumento de activación en tálamo, cíngulo posterior y caudado bilateral, y formación hipocampal y parahipocampal izquierdas. Como en su estudio anterior, no encontraron diferencias en rendimiento entre los 2 grupos.
La tomografía computarizada por emisión de fotones simples de perfusión distingue DCL amnésicos de no amnésicos, pero no distingue QCS de controles64.
La tomografía de emisión de positrones con 18-F desoxiglucosa aporta datos interesantes. Comparados con controles, en QCS aparece un metabolismo reducido en regiones parahipocampales, parieto-temporales, frontales inferiores, giro fusiforme y tálamo. Estos hallazgos replican los encontrados en sujetos sanos con riesgo genético de EA (EA familiar autosómico-dominante, alta carga familiar o homocigotos ApoE4) y en DCL15.
AnatomopatologíaLas quejas cognitivas presentes cerca del momento de la muerte se relacionan con la anatomopatología de EA, tal como demuestra un trabajo integrado dentro del Rush Memory and Aging Project65. Examinaron 90 cerebros y la asociación se mantuvo tras ajustar por edad, sexo, estado de salud, depresión e intervalo entre evaluación y autopsia. En pacientes sin demencia, la anatomopatología tipo EA (evaluación histoquímica) y la carga amiloide y T-tau (evaluación inmunohistoquímica por anticuerpos) se correlacionaban con quejas cognitivas. En pacientes con demencia, sólo el T-tau se correlacionaba significativamente con el nivel de quejas. En ambos grupos el nivel de quejas cognitivas se correlacionó con resultado de tests neuropsicológicos. Estos resultados corroboran los hallazgos de un estudio previo66.
BiomarcadoresLa combinación de β-amiloide 1-42 (Aβ42) baja con T-tau y P-tau altas en el LCR ayuda a distinguir a los pacientes con EA de los controles. En la EA, el Aβ42 en el LCR descendería precozmente, mientras que el aumento de T-tau y P-tau sería más tardío37. Antonell et al.37 no encontraron diferencias en biomarcadores en el LCR entre sujetos con QCS y controles, aunque la muestra era pequeña. El estudio DESCRIPA, que incluyó a más pacientes, sí encontró mayor frecuencia de biomarcadores tipo EA en el grupo QCS comparados con controles67.
Además, en el estudio DESCRIPA, los niveles de Aβ42 predecían el rendimiento en tests de memoria semántica y de trabajo en controles y sujetos con QCS, mientras que tau reflejaba mejor el rendimiento de los individuos con DCL68. Otro estudio corroboró estos hallazgos69, indicando que el descenso precoz de Aβ42 iría ligado a los primeros cambios cognitivos, pero que otros mecanismos relacionados con tau explicarían mejor el declive en estadios intermedios de la enfermedad. Curiosamente, en estadio de demencia el rendimiento cognitivo se hacía independiente de los biomarcadores69.
En población añosa sana, un mayor depósito amiloide demostrado por PiB-PET en regiones prefrontal derecha, corteza cingulada anterior, precuneus derecho y corteza cingulada posterior se correlacionó con menor confianza de los sujetos en sus propias capacidades mnésicas. Son estas áreas cerebrales las que muestran depósito amiloide precoz en la EA. Aunque el rendimiento cognitivo en este estudio no fue distinto entre sujetos con bajo y alto depósito de PiB, los autores concluyen que la percepción subjetiva de los participantes es válida y puede predecir EA incipiente, dado que se correlaciona con un marcador temprano de la enfermedad70.
Chételat et al.71 encontraron una correlación entre depósito PiB y atrofia en sujetos con QCS pero no en controles sanos. En un estudio corolario vieron que sujetos sanos con depósito PiB alto tenían mayores volúmenes temporales mediales que sujetos con QCS y PiB alto72. Los sujetos sanos con PiB alto tenían volúmenes temporales mayores que los sujetos sanos con PiB bajo, así que no se trata de que los sujetos QCS tengan atrofia con respecto a los controles. Más bien estos temporales agrandados podrían corresponder a una fase de edema o reacción al depósito amiloide. O bien reflejarían reserva cognitiva y únicamente los sujetos que constitucionalmente tuvieran temporales voluminosos serían capaces de mantenerse intactos con ese nivel de carga amiloide. El estudio de Fortea et al.36 encontró una relación en U invertida entre niveles Aβ42 y volumen cortical. Pero serían necesarios estudios longitudinales para dirimir si se trata de la evolución de la enfermedad o del comportamiento de grupos de sujetos distintos.
ConclusionesLa mayoría de los estudios encuentran peor funcionamiento cognitivo basal en el grupo de pacientes con quejas cognitivas. El Hughes Hall Project32 es la excepción, aunque solo aplicaron un estudio neuropsicológico completo a pacientes con MMSE menor de 25, por lo que pudieron no detectar déficits en pacientes con MMSE poco afectado.
La mayoría de los estudios poblacionales longitudinales demuestran asociación entre quejas cognitivas y deterioro cognitivo en el seguimiento, aunque con un incremento modesto del riesgo28,30,40,46. Es posible que cohortes clínicas de individuos que buscan ayuda preocupados por su memoria demuestren una asociación más fuerte con EA, comparados con muestras aleatorias de la población general. Es interesante que el alto nivel educativo aumente la fuerza de la asociación, reflejando quizás un efecto techo en los tests neuropsicológicos. Los sujetos con alto nivel educativo podrían evaluar mejor su propio rendimiento cognitivo que los tests40. Casualmente, el único estudio revisado de diseño longitudinal que no encontró asociación entre QCS y demencia fue el de Wang et al.49, realizado con población rural iletrada.
Queda por desentrañar el papel de la depresión en el rendimiento cognitivo, queja cognitiva y demencia. Parece que actuaría mediante un mecanismo multifactorial: causando directamente un peor rendimiento por déficit atencional y motivacional, generando quejas cognitivas, participando en la génesis del deterioro como factor de riesgo de demencia y apareciendo como síntoma acompañante en pacientes con demencia establecida.
Los pacientes con QCS difieren de la población general en pruebas de imagen, presentando reducción de volumen hipocampal y un patrón de atrofia similar a la de los sujetos con DCL tipo amnésico58,59. Además, presentan anatomopatología compatible con EA65,66.
Los estudios con neuroimagen funcional son más difíciles de interpretar pero indican que el grupo QCS difiere de los controles sanos en los patrones de activación cerebral al realizar tareas cognitivas. La heterogeneidad etiopatológica y los distintos estadios evolutivos del grupo podrían explicar las diferencias entre estudios, pero es probable que estos aumentos de activación correspondan a un mecanismo de compensación ante una pérdida de función.
Aβ42, T-tau y P-tau son marcadores interesantes en la QCS, que presentan con mayor frecuencia que los controles un patrón típico de EA. Aβ42 descendería de forma precoz y estaría ligado a los primeros trastornos cognitivos, mientras que tau intervendría en estadios intermedios de EA. Es posible que hagan falta seguimientos largos, superiores a los 2 años, para apreciar la evolución de estos parámetros37,67,68,73.
La QCS podría corresponder a un estadio preclínico de EA, más precoz que el DCL. Es un grupo interesante, tanto por lo que tiene en común con EA establecida como en lo que difiere. Algunos de estos individuos representarían un equilibro inestable donde factores de compensación y reserva cognitiva comenzarían a claudicar ante el avance de la enfermedad.
Con estos hallazgos, se podría aventurar una hipótesis fisiopatológica que incluiría la QCS en el espectro de la EA. La caída de Aβ42 y el depósito de amiloide aparecerían en primera instancia acompañados de aumento de activación cerebral en tareas mnésicas como compensación ante la pérdida de rendimiento. Quizás en este momento empiecen las primeras quejas cognitivas, probablemente en sujetos con altos requerimientos funcionales. Los lóbulos temporales pasarían por una fase de aumento de volumen previo a la atrofia. El aumento de tau aparecería a la vez que el deterioro objetivable, marcando el paso al DCL.
El grupo QCS es heterogéneo. Las diferencias metodológicas entre ensayos dificultan la definición de las características y la evolución de estos pacientes. En el futuro, quizás dispongamos de fármacos que frenen la EA en sus fases precoces, pero para ello sería necesario determinar qué grupo de individuos serían candidatos a una intervención precoz.
Conflicto de interesesLos autores declaran que no existe ningún conflicto de intereses.