Se han reportado casos de trombosis venosas cerebrales en personas vacunadas frente a COVID-19 con vacunas vectorizadas con adenovirus no replicantes. Aportamos recomendaciones sobre el diagnóstico y manejo de pacientes con esta complicación.
MétodoEl grupo de trabajo multidisciplinar, liderado por la Federación de Asociaciones Científico Médicas Españolas y representado por distintas sociedades científicas, revisó la evidencia disponible publicada en la literatura y en los informes de la Agencia Europea de Medicamentos. Se estableció una definición de caso sospechoso y recomendaciones diagnóstico-terapéuticas de la trombocitopenia trombótica inducida por la vacunación.
ResultadosSe considera caso sospechoso aquella trombosis venosa cerebral ocurrida entre 3 y 21 días tras la administración de vacunas no replicantes de adenovirus que presenten un valor de plaquetas inferior a 150.000 plaquetas por μL o un descenso del 50% respecto de la cifra previa. Los datos indicativos de trombocitopenia trombótica inducida por la vacunación incluyen la presencia de anticuerpos antifactor plaquetario tipo 4, la elevación de dímero-D 4 veces por encima del límite superior de la normalidad o la ausencia de justificación de la trombosis. En su tratamiento, se recomienda administrar inmunoglobulina humana inespecífica intravenosa o realizar plasmaféresis en su defecto, evitar el uso de heparina, empleando como anticoagulantes argatroban, bivalirudina, fondaparinux, rivaroxabán o apixabán, y evitar la transfusión de plaquetas.
ConclusionesLas vacunas de vectores no replicantes de adenovirus pueden asociarse a trombosis venosas cerebrales con trombocitopenia, en cuyo manejo es importante el tratamiento del fenómeno disinmune y de la trombosis venosa cerebral.
Cases of cerebral venous sinus thrombosis have been reported in individuals vaccinated against COVID-19 with non-replicating adenoviral vector vaccines. We issue our recommendations on the diagnosis and management of patients presenting this complication.
MethodThe multidisciplinary working group, led by the Spanish Federation of Medical and Scientific Associations and including representatives of several scientific societies, reviewed the available evidence from the literature and reports of the European Medicines Agency. We establish a definition for suspected cases and issue diagnostic and treatment recommendations regarding vaccine-induced immune thrombotic thrombocytopaenia.
ResultsWe define suspected cases as those cases of cerebral venous sinus thrombosis occurring between 3 and 21 days after the administration of non-replicating adenoviral vector vaccines, in patients with a platelet count below 150,000/μL or presenting a decrease of 50% with respect to the previous value. Findings suggestive of vaccine-induced immune thrombotic thrombocytopaenia include the presence of antibodies to platelet factor 4, D-dimer levels 4 times greater than the upper limit of normal, and unexplained thrombosis. The recommended treatment includes intravenous administration of non-specific human immunoglobulin or alternatively plasmapheresis, avoiding the use of heparin, instead employing argatroban, bivalirudin, fondaparinux, rivaroxaban, or apixaban for anticoagulation, and avoiding platelet transfusion.
ConclusionsNon-replicating adenoviral vector vaccines may be associated with cerebral venous sinus thrombosis with thrombocytopaenia; it is important to treat the dysimmune phenomenon and the cerebral venous sinus thrombosis.
La pandemia causada por la enfermedad por coronavirus 2019 (COVID-19) ha provocado más de 3 millones de muertes a nivel mundial1 y más de 77.000 en España2, junto con un exceso de mortalidad de hasta un 65% respecto de las cifras de los 10 años previos3. El insuficiente beneficio demostrado por los distintos tratamientos estudiados4–6 ha hecho que se ponga toda la esperanza en las vacunas. Los beneficios demostrados en los ensayos clínicos realizados hasta la fecha7–13 y los datos procedentes de la situación epidemiológica actual invitan al optimismo14.
El 7 de marzo de 2021 se notificaron en Austria los 2 primeros casos de trombosis venosas con presentación clínica atípica en pacientes que habían recibido la vacuna de AstraZeneca (Vaxzevria). El 14 de marzo de 2021 se comunicó el primer caso en España. Tras revisar la evidencia disponible en dicho momento, el Comité para la Evaluación de Riesgos en Farmacovigilancia europeo concluyó el 29 de marzo de 2021 que el número de eventos tromboembólicos reportados en personas expuestas a la vacunación era inferior al esperado en la población general, si bien Vaxzevria podría asociarse a casos de trombosis atípicas, como coagulación intravascular diseminada o trombosis de senos venosos cerebrales, con un hecho distintivo: su presentación junto a trombocitopenia15. Una segunda evaluación del Comité para la Evaluación de Riesgos en Farmacovigilancia, cuyas conclusiones fueron publicadas con fecha de 14 de abril, concluyó que dicha asociación causal parecía probada, pero dada la escasa evidencia, no se pudieron identificar factores de riesgo en los casos notificados ni hubo recomendaciones prácticas de manejo clínico16.
El beneficio poblacional de la vacunación está fuera de toda duda. No obstante, es de vital importancia que los profesionales sanitarios estén preparados para la detección y el manejo adecuados de efectos adversos poco frecuentes pero graves como es la trombosis venosa cerebral con trombocitopenia. El objetivo del presente documento es aportar recomendaciones prácticas sobre el diagnóstico y manejo de pacientes con trombosis venosa cerebral con trombocitopenia tras la vacunación con vacunas recombinantes de adenovirus (Vaxzevria, de AstraZeneca, y Janssen), pese a que la asociación parece por el momento superior con la primera17. Dado lo cambiante de la situación y la aparición constante de nueva información, es importante consultar los documentos de recomendaciones prácticas, cuya actualización será más regular que el presente documento18.
DesarrolloDefinición de caso sospechosoAdemás del patrón homogéneo de presentación en las 3 primeras semanas tras la vacunación, las características que han motivado la consideración de estos fenómenos como relacionados con la vacunación son: 1) una frecuencia observada 4,94 (intervalo de confianza al 95% 2,63-8,45) veces superior a la frecuencia esperada para dicha población y periodo de tiempo19; 2) la gravedad superior a los casos no relacionados con la vacunación, alcanzando hasta un 36,4% de mortalidad17,19,20; 3) la asociación con trombocitopenia en un porcentaje significativo de los casos15,17,19; 4) la plausibilidad biológica al considerarse un fenómeno de origen inmunológico y la existencia de mecanismos fisiopatogénicos que pueden explicar parte del fenómeno, y 5) la ausencia de hipótesis alternativas que puedan justificar la aparición de los cuadros.
Hipótesis fisiopatogénicaLa asociación con trombocitopenia y la gravedad de los eventos guarda cierta similitud con el síndrome de trombocitopenia inducida por heparina (HIT por sus siglas en inglés21,22, con la salvedad de que los pacientes no habían sido expuestos a esta16. Se desconoce qué factor sería el desencadenante de este cuadro en los pacientes que han recibido la vacuna. Se ha descrito trombocitopenia tras la administración de vacunas vectorizadas por adenovirus23,24 y autoinmunidad en primates y roedores tras la administración de vacunas basadas en adenovirus, si bien tras administración intravenosa23,25–27. Se ha descrito la presencia de anticuerpos frente al factor plaquetario 4 (anti-PF4) en personas con eventos trombóticos tras la vacunación con Vaxzevria28,29.
Trombosis asociada a trombocitopeniaSe han empleado diversos términos, como: trombocitopenia inmune protrombótica inducida por la vacunación, trombocitopenia trombótica inducida por la vacuna (VITT por sus siglas en inglés)28–30, trombocitopenia inducida por heparina atípica o síndrome de trombosis con trombocitopenia31. No obstante, en algunos de los casos reportados no se describía la presencia de trombocitopenia16. Esto podría deberse a: 1) que no se hubiera detectado o informado la trombocitopenia, pese a estar presente (por ejemplo, no haber realizado ninguna analítica); 2) que el paciente hubiera presentado un descenso en los niveles de plaquetas respecto de su cifra basal, pero sin llegar a disminuir por debajo de las 150.000 plaquetas/μL, y 3) que se trate de un fenómeno diferente.
Definición operativaDesde el punto de vista práctico, se recomienda considerar un evento tromboembólico venoso en cualquier localización, que ocurra en un plazo de entre 3 y 21 días tras la administración de una vacuna de vectores no replicantes de adenovirus (Vaxzevria o Janssen)18,31.
Ante un caso sospechoso se debe realizar un hemograma. La trombocitopenia queda definida por una cifra por debajo de 150.000 plaquetas/μL o un descenso del 50% respecto de la cifra previa, siempre y cuando esta se conozca y sea razonablemente reciente (3 meses previos). En caso de trombocitopenia, es recomendable realizar un frotis sanguíneo para excluir una pseudotrombocitopenia por agregación plaquetaria.
En caso de trombocitopenia confirmada, se debe realizar determinación de anticuerpos anti-PF4, cuya presencia se ha descrito en pacientes afectos de VITT30,32,33, e implicaría el diagnóstico de VITT y como tal debería manejarse18,34. La sensibilidad de la determinación de anticuerpos mediante técnica de ELISA es superior a la de las pruebas de cribado más comúnmente empleadas en el HIT (inmunopartículas en gel, quimioluminiscencia), si bien puede no estar disponible en todos los centros. Se recomienda congelar una muestra de suero del paciente o de plasma para poder realizar estudios funcionales de activación plaquetaria a posteriori en algún laboratorio de referencia18,34.
Se ha descrito también una elevación marcada de dímero-D18,34. En este contexto, una cifra por encima de 4 veces el límite superior de la normalidad debe alertar sobre una posible VITT18. En caso de negatividad de los anticuerpos anti-PF4 (sobre todo si no se dispone de la técnica ELISA) y normalidad del dímero-D, en ausencia de otras causas que justifiquen la trombocitopenia, parece prudente el manejo de la complicación trombótica como en los pacientes con VITT. En caso de que las cifras plaquetarias sean normales, todavía no existe información suficiente como para saber si se trata de un VITT o no; por ello, deberá hacerse vigilancia estrecha de la cifra de plaquetas18.
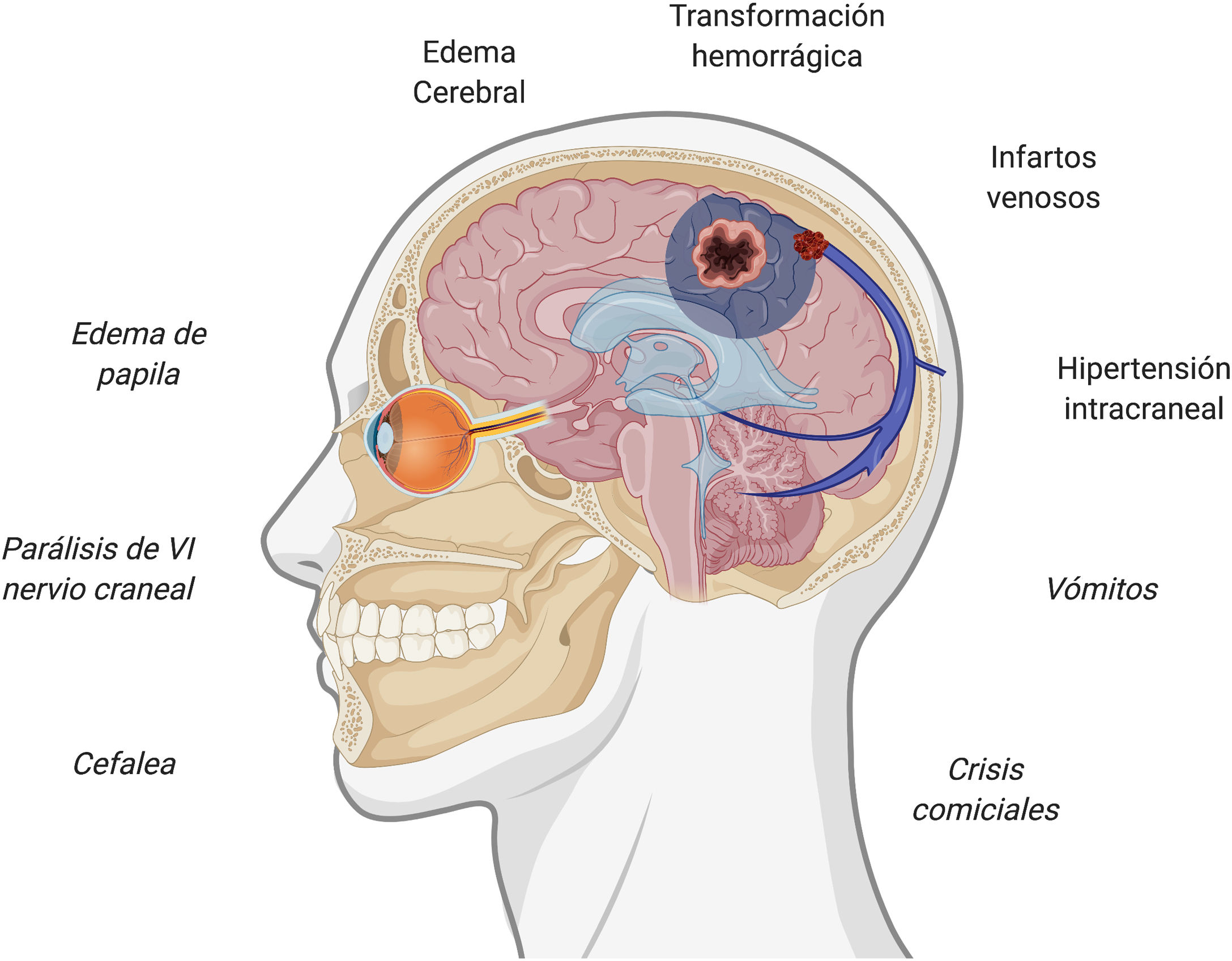
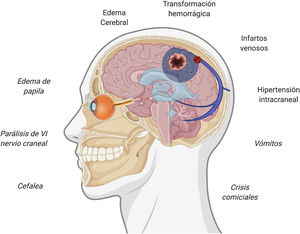
Presentación clínica de la trombosis venosa cerebralEl sistema venoso intracraneal drena la sangre del encéfalo y contribuye a la reabsorción del líquido cefalorraquídeo a través de las granulaciones aracnoideas35. La interrupción de su flujo puede provocar diversos síntomas, siendo la presentación clínica variable en función de la localización de la trombosis y de la eficacia de vías de drenaje alternativas. Existe cierta concordancia entre los síntomas clínicos y su correlato a nivel intracraneal, siendo los fenómenos que explican los síntomas la presencia de hipertensión intracraneal, los infartos venosos y la presencia de hemorragias subyacentes36,37. La figura 1 resume los síntomas y eventos fisiopatogénicos implicados en la trombosis de senos venosos cerebrales.
En cuanto a los datos de alarma, debe descartarse una trombosis de senos venosos cerebrales ante la presencia de alguno de ellos en el contexto clínico adecuado38. El síntoma más frecuente de la trombosis de senos es la cefalea, ocurriendo en hasta un 88% de los pacientes38–40. La cefalea es uno de los síntomas más frecuentemente reportados tras la vacunación7–13, con una frecuencia de hasta el 67% de las personas vacunadas, no obstante, su aparición suele ser inmediata. El valor predictivo de los datos de alarma en esta entidad no está establecido, por lo que, en caso de ausencia de todos ellos, si existe algún dato atípico o preocupante a juicio del médico responsable, también deberá evaluarse esta posibilidad. La tabla 1 resume los principales datos de alarma de la trombosis de senos venosos cerebrales38–40.
Datos de alarma para considerar una posible trombosis de senos venosos cerebrales posvacunación
| Ítem | Datos de alarma |
|---|---|
| Datos de alarma de la cefalea | Inicio súbitoAparición de manera diferida respecto del momento en que se recibe la vacunación (aparición>72h tras la vacunación)Empeoramiento al tumbarse y mejoría al ponerse en pieResistencia a tratamiento sintomáticoLocalización unilateral estrictaEmpeoramiento con maniobras que impliquen ValsalvaEmpeoramiento progresivo |
| Síntomas asociados | Crisis comicialesVómitos de repeticiónAlteración del comportamientoEpisodios confusionalesSíntomas visuales persistentesAlteración de la marchaPérdida de fuerza o sensibilidadBajo nivel de conciencia |
| Parámetros analíticos | Trombocitopenia (<150.000/μL o <50% de la cifra basal)Elevación de dímero-D (>4 veces el límite superior de la normalidad) |
| Signos exploratorios | Edema de papilaFocalidad neurológica en la exploraciónBajo nivel de concienciaAparición de petequias |
Se recomienda la determinación de anticuerpos anti-PF4, cuya extracción deberá realizarse antes de administrar inmunoglobulinas18,30,32–35. Su positividad resulta indicativa de una VITT, aunque su negatividad, sobre todo si no se dispone de la técnica ELISA, no la descarta.
Diagnóstico de la trombosis venosa cerebralLa evaluación radiológica de la trombosis venosa cerebral puede variar según la presentación del paciente y la disponibilidad de las técnicas radiológicas (tomografía computarizada [TC], resonancia magnética [RM]).
En la presentación aguda, la TC sin contraste es con frecuencia la prueba que se realiza de forma inicial. Sin embargo, esta prueba es poco sensible, ya que únicamente muestra alteraciones indicativas e indirectas de trombosis venosa cerebral en el 30% de los pacientes. Así, si existe sospecha de trombosis venosa cerebral, la TC sin contraste debe complementarse con una TC con contraste y con reconstrucción tridimensional venosa (venografía por TC)41–46.
En pacientes con presentación subaguda, la RM es la prueba de primera elección siempre que esté disponible de forma inmediata y el paciente no presente contraindicaciones a su obtención. El protocolo técnico adecuado incluye secuencias sin y con contraste complementadas con una RM venográfica. La RM es además útil para valorar las posibles complicaciones de la trombosis venosa cerebral, como el infarto venoso, la hemorragia y el edema.
Dadas la alta sensibilidad y especificidad diagnóstica de las pruebas no invasivas en el diagnóstico de la trombosis venosa cerebral, la venografía directa a través de catéter rara vez se requiere y debe reservarse para los casos en que se considere necesario tratamiento intravascular.
Pese a su baja sensibilidad, en la TC cerebral simple pueden observarse ciertos signos indicativos de trombosis venosa cerebral. Su presencia obliga a considerar este diagnóstico de no haberse hecho antes. La tabla 2 resume los principales signos radiológicos de la trombosis venosa cerebral41–49.
Signos radiológicos directos e indirectos de utilidad y certeza en el diagnóstico de la trombosis de senos venosos cerebrales
| Prueba | Signo radiológico |
|---|---|
| TC craneal simple | Aumento de atenuación (hiperdensidad) a nivel de seno venoso o vena cortical (signo del triángulo denso cuando afecta el seno longitudinal superior), especialmente si:Asimétrico respecto del contralateral (en trombosis de senos laterales o de venas corticales)Disminución de atenuación (hipodensidad) parenquimatosa indicativa de infarto venoso, especialmente si:No correspondiente a territorio arterialBilateralCon componente de hemorragia subaracnoidea o intraparenquimatosaSignos de edema cerebral:Disminución de tamaño ventricularColapso de surcosTortuosidad de nervio ópticoAplanamiento de la esclera posteriorProtrusión de la papila en globo ocular |
| Venografía por TC | Defecto de repleción en el interior de seno venoso o vena cortical afectos |
| RM cerebral | Isohiperintensidad en secuencias potenciadas en T1 e hipo/hiperintensidad en secuencias potenciadas en T2 del seno venoso o vena cortical (fase aguda/subaguda)Edema cerebralHiperintensidad en secuencias potenciadas en T2-FLAIR y en difusión del seno o vena cortical afectos |
| Angio-RM venosa | Ausencia de flujo en seno venoso |
RM: resonancia magnética; TC: tomografía computarizada.
En negrita las modalidades que suponen el diagnóstico de certeza.
Toda persona con un evento trombótico en relación temporal con la vacunación con vacunas de vectores no replicantes de adenovirus debe ser hospitalizada, aunque su situación clínica sea estable y paucisintomática, ya que se ha descrito una mayor gravedad que en las formas convencionales y casos de rápido empeoramiento clínico18. El manejo debe ser multidisciplinar y debe aunar a la especialidad responsable de dicho tipo de trombosis en el centro y a un hematólogo con experiencia en HIT. El tratamiento consta de 2 pilares: el fenómeno disinmune y la trombosis cerebral.
Tratamiento de la trombocitopenia trombótica inducida por la vacunaEn caso de que se realice un diagnóstico de VITT o exista una duda razonable sobre dicha posibilidad, la administración de plaquetas queda contraindicada salvo que haya un sangrado activo clínicamente relevante o sea necesario practicar algún procedimiento invasivo con alto riesgo de sangrado18,34. Además, se recomienda el bloqueo de la activación y agregación plaquetaria por los anticuerpos anti-PF4 con inmunoglobulina humana inespecífica intravenosa, pudiendo emplearse la pauta de 1g/kg/día durante 2 días o bien de 0,4g/kg/día durante 5 días, sin que sea necesaria la determinación previa del nivel sérico de inmunoglobulinas en el paciente. Se ha descrito su empleo en varios casos hasta la fecha29,30,32,33,50. Alternativamente, se puede emplear plasmaféresis con reposición con albúmina en caso de contraindicación para las inmunoglobulinas. Pese a que la trombosis es un riesgo conocido tras la administración de inmunoglobulinas, la frecuencia es baja y el beneficio parece superar el riesgo51,52.
Tratamiento de la trombosis venosa cerebralLa evidencia actual sobre el manejo de la trombosis venosa cerebral de cualquier causa es mejorable53. En el contexto que nos ocupa, el tratamiento se decidirá en función de si existe sospecha de posible VITT o no. En caso de haberla, atendiendo a los criterios operativos definidos más arriba, no se recomienda la administración de heparina, no solo como tratamiento, sino en procedimientos como heparinización de vías centrales18,34.
Tratamiento anticoagulante de la trombosis venosa cerebral en ausencia de sospecha de trombocitopenia trombótica inducida por la vacunaLas principales guías son las europeas de 201054, las americanas de 201155 y las europeas de 201756. Los fármacos con una mayor evidencia son la heparina de bajo peso molecular (HBPM) y la heparina no fraccionada57–63. La HBPM demostró en un estudio una menor tasa de mortalidad, una mayor tasa de recuperación completa y una menor tasa de sangrado60. Otro estudio mostró una menor tasa de mortalidad o dependencia en pacientes tratados con HBPM frente a heparina no fraccionada, así como una menor tasa de aparición de nuevas hemorragias cerebrales61. Un tercer estudio de menor tamaño muestral no encontró diferencias entre ambos tratamientos62. Una revisión sistemática publicada en 2017 concluyó que había una tendencia a una menor mortalidad y mejor pronóstico funcional en pacientes tratados con HBPM, sin diferencias en la tasa de hemorragia extracraneal63.
Tratamiento anticoagulante de la trombosis venosa cerebral en caso de sospecha de trombocitopenia trombótica inducida por la vacunaLa HBPM y la heparina no fraccionada no están recomendadas en el momento actual18–34, siendo necesario utilizar un fármaco anticoagulante alternativo63. Todas las opciones terapéuticas alternativas disponen de escasa evidencia en el tratamiento de la trombosis de senos venosos cerebrales64. Argatroban parece una alternativa en el tratamiento de la HIT65,66, pero carece de evidencia sólida en el tratamiento de la trombosis venosa cerebral67, pese a que los estudios realizados en ictus isquémico apuntan a un adecuado nivel de seguridad68–71, habiéndose reportado casos en los que ha sido empleado en el tratamiento de la VITT30,50. Bivalirudina tiene una evidencia como tratamiento de la trombosis de senos venosos cerebrales casi inexistente72, si bien una revisión sistemática publicada en 2017 concluyó que los análogos de la hirudina (lepirudina y bivalirudina) tenían una tasa de complicaciones trombóticas y hemorrágicas similares a argatroban73, habiendo sido también empleada en casos de VITT50. Su administración debe realizarse bajo monitorización estrecha74. Fondaparinux75 es otro agente propuesto para el tratamiento de la HIT76, si bien su evidencia en el tratamiento de la trombosis de senos venosos cerebrales se limita a un único caso77.
En las formas menos graves se puede considerar el empleo de anticoagulantes de acción directa. Rivaroxabán78–84 y apixabán84,85 son los fármacos con una mayor evidencia, pero es de baja calidad86–89. Su recomendación también se justifica por no precisar de tratamiento concomitante con heparina al inicio del tratamiento75.
Existe evidencia limitada para recomendar la realización de tratamiento endovascular o quirúrgico de manera sistemática90–93. En centros con experiencia puede considerarse en caso de mala respuesta al tratamiento farmacológico56,57,94.
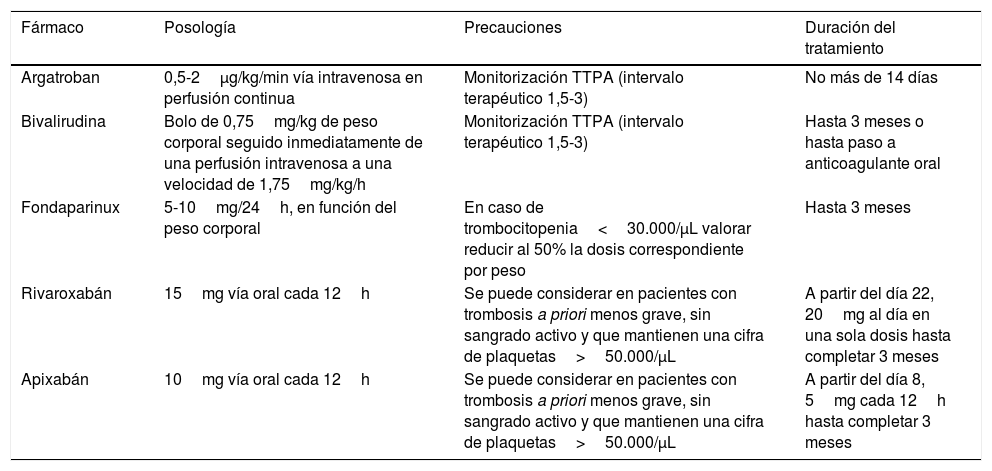
La tabla 3 describe los principales fármacos recomendados, la posología y la duración del tratamiento75. Considerando que la VITT es una trombosis venosa provocada, la duración recomendada del tratamiento anticoagulante sería de 3 meses, individualizándose en cada paciente.
Tratamiento anticoagulante en pacientes con trombosis de senos venosos cerebrales tras vacunación con vacunas de vectores no replicantes de adenovirus y sospecha de VITT
| Fármaco | Posología | Precauciones | Duración del tratamiento |
|---|---|---|---|
| Argatroban | 0,5-2μg/kg/min vía intravenosa en perfusión continua | Monitorización TTPA (intervalo terapéutico 1,5-3) | No más de 14 días |
| Bivalirudina | Bolo de 0,75mg/kg de peso corporal seguido inmediatamente de una perfusión intravenosa a una velocidad de 1,75mg/kg/h | Monitorización TTPA (intervalo terapéutico 1,5-3) | Hasta 3 meses o hasta paso a anticoagulante oral |
| Fondaparinux | 5-10mg/24h, en función del peso corporal | En caso de trombocitopenia<30.000/μL valorar reducir al 50% la dosis correspondiente por peso | Hasta 3 meses |
| Rivaroxabán | 15mg vía oral cada 12h | Se puede considerar en pacientes con trombosis a priori menos grave, sin sangrado activo y que mantienen una cifra de plaquetas>50.000/μL | A partir del día 22, 20mg al día en una sola dosis hasta completar 3 meses |
| Apixabán | 10mg vía oral cada 12h | Se puede considerar en pacientes con trombosis a priori menos grave, sin sangrado activo y que mantienen una cifra de plaquetas>50.000/μL | A partir del día 8, 5mg cada 12h hasta completar 3 meses |
TTPA: tiempo de tromboplastina parcial activada; VITT: trombocitopenia trombótica inducida por vacunación.
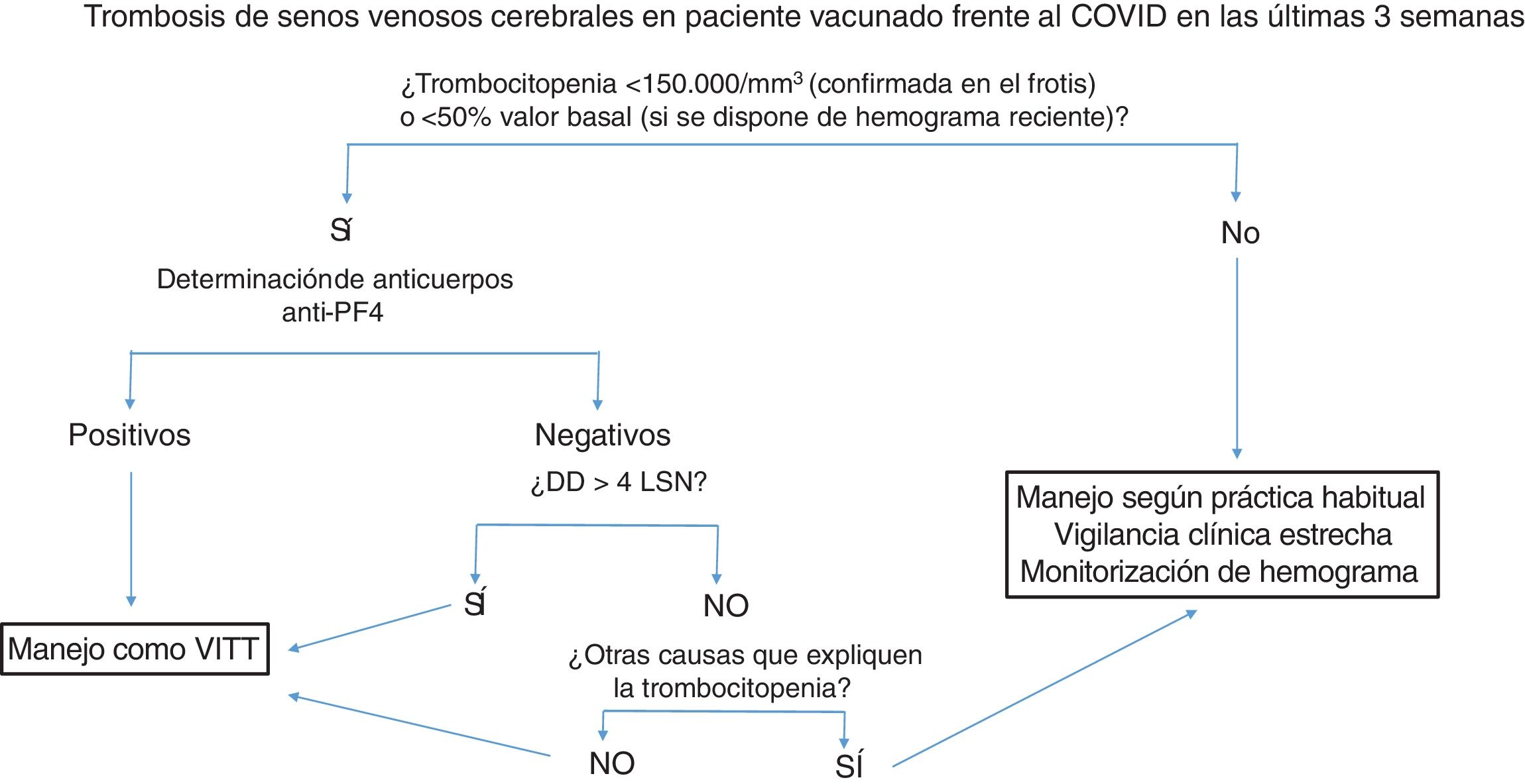
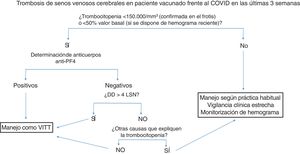
La figura 2 resume el manejo diagnóstico-terapéutico en pacientes con trombosis de senos venosos cerebrales en pacientes vacunados.
Manejo diagnóstico-terapéutico de la trombosis de senos venosos cerebrales en pacientes vacunados. Se recomienda congelar una muestra de suero basal para estudio funcional a posteriori, antes de administrar inmunoglobulinas.
Anti-PF4: anticuerpos antifactor plaquetario 4; DD: dímero-D; LSN: límite superior de la normalidad, VITT: trombocitopenia trombótica inducida por la vacuna.
Los casos sospechosos de VITT tras la administración de cualquier vacuna frente a la COVID-19 deben notificarse al Sistema Español de Farmacovigilancia a la mayor brevedad (www.notificaram.es), incluyendo toda la información que sea posible, especialmente datos demográficos (edad, sexo, antecedentes personales de interés, factores de riesgo de trombosis, antecedente de infección por COVID-19 y su gravedad), datos relacionados con la vacunación (fecha de vacunación, tipo de vacuna y lote) y datos clínicos (fecha de inicio de los síntomas y descripción detallada del caso). Es importante precisar la fecha de diagnóstico de la complicación trombótica, así como la localización, el método diagnóstico empleado y la existencia o no de hemorragia asociada (localización y deseablemente volumen). Desde el punto de vista analítico es preciso reportar las cifras de plaquetas y dímero-D tanto al diagnóstico como en la evolución, así como el resultado de la determinación de anticuerpos anti-PF4 y la técnica empleada. Si el caso fuera dudoso, los resultados del estudio etiológico convencional también serán de utilidad. En relación con el tratamiento, se deberá describir qué fármacos fueron empleados, incluyendo dosis, tratamientos concomitantes y grado de eficacia, junto con el pronóstico a corto y medio plazo.
ConclusionesEl número de casos observados de trombosis venosa cerebral en personas vacunadas con vacunas de vectores no replicantes de adenovirus excede el número de casos esperado. Se ha establecido una relación de causalidad con eventos trombóticos asociados a trombocitopenia. Las vacunas de vectores no replicantes de adenovirus pueden ocasionar muy raramente cuadros de trombosis con trombocitopenia en localizaciones menos frecuentes, como los senos venosos cerebrales. Estos casos se caracterizan por trombocitopenia o descenso de al menos el 50% en relación con cifras plaquetarias previas, presencia de niveles elevados de dímero-D y presencia de anticuerpos anti-PF4. En este contexto, se recomienda tratamiento con inmunoglobulinas y anticoagulantes de uso menos frecuente en la trombosis venosa cerebral, como argatroban, bivalirudina, fondaparinux, rivaroxabán o apixabán. Los pacientes sin los factores anteriormente mencionados pueden manejarse como una trombosis de senos venosos cerebrales convencional, si bien será de especial importancia un estrecho seguimiento clínico y analítico. Se necesita con urgencia mayor evidencia para el manejo de esta complicación.
AutoríaTodos los autores han hecho contribuciones sustanciales a la concepción del manuscrito, el borrador del artículo y su revisión de contenido intelectual, y la aprobación definitiva de la versión que se presenta.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses relativo al presente documento.
Autores:
C. Avendaño-Solá, médico especialista, Servicio de Farmacología Clínica, Hospital Universitario Puerta de Hierro, Junta Directiva de la Federación de Asociaciones Científico Médicas de España (FACME), Majadahonda, Madrid, España.
R. de la Cámara, Servicio de Hematología, Hospital de La Princesa, Madrid, España.
M. Castellanos 0000-0003-3116-1352, Servicio de Neurología, Complejo Hospitalario Universitario A Coruña, Instituto de Investigación Biomédica A Coruña, A Coruña, España.
D. Ezpeleta 0000-0002-9226-4550, Servicio de Neurología, Hospital Universitario Quirónsalud Madrid, Pozuelo de Alarcón, Madrid, España.
D. García-Azorín 0000-0002-3132-1064, Unidad de Cefaleas, Servicio de Neurología, Hospital Clínico Universitario de Valladolid, Valladolid, España.
C. Iñiguez Martínez 0000-0003-3746-3001, Servicio de Neurología, Hospital Clínico Universitario Lozano Blesa, Instituto de Investigación Sanitaria de Aragón (IIS Aragón), Zaragoza, España.
R. Lecumberri, Servicio de Hematología, Clínica Universidad de Navarra, Centro de Investigación Biomédica en Red de Enfermedades Cardiovasculares (CIBER-CV), Instituto de Salud Carlos III, Pamplona, Navarra, España.
M. Marti de Gracia 0000-0001-7843-9417, Sección de Radiología de Urgencias, Hospital Universitario La Paz, Madrid, España.
E. Redondo Margüello 0000-0003-2791-979X, Centro de Salud y Vacunación Internacional, Madrid Salud, Ayuntamiento de Madrid, Madrid, España.
A. Rovira 0000-0002-2132-6750, Sección de Neurorradiología, Hospital Universitario Vall d’Hebron, Barcelona, España.
A. Sancho-López, Servicio de Farmacología Clínica, Hospital Universitario Puerta de Hierro Majadahonda, Vocal SEFC, Grupo de Vacunas de la Federación de Asociaciones Científico Médicas Españolas (FACME), Majadahonda, Madrid, España.
P. Garrido 0000-0002-5899-6125, Servicio de Oncología Médica, Hospital Universitario Ramón y Cajal, Instituto Ramón y Cajal de Investigación Sanitaria (IRYCIS), Federación de Asociaciones Científico Médicas Españolas (FACME), Madrid, España.
En el anexo se enumeran los autores, pertenecientes al Grupo de trabajo multidisciplinar de FACME sobre el manejo de la trombosis venosa cerebral relacionada con la vacunación frente a COVID-19.
Correo electrónico: dgazorin@ucm.es (D. García-Azorín).