La guardia de neurología es frecuentemente presencial; es decir, con el neurólogo presente en el centro hospitalario; pero en algunos centros, puede ser localizada o mixta. La fibrinólisis intravenosa (FIV) es uno de los principales tratamientos reperfusores en el ictus isquémico agudo (IIA). El objetivo del siguiente trabajo es comparar el tiempo puerta-aguja (TPA) durante la guardia presencial y la guardia localizada.
Material y métodosEstudio prospectivo, observacional, desde el año 2012 hasta el año 2017 en el que se incluyeron pacientes con IIA y FIV. Se recogieron datos como sexo, edad, hora del inicio de los síntomas, hora de llegada al hospital, hora de la tomografía axial computarizada (TAC), hora de inicio de la FIV. Se consideró guardia de «Presencia» desde las 8:00 hasta las 20:00 y «Localizada» desde las 20:00 hasta las 08:00, divido en 3 grupos: guardia «Presencial», guardia «Localizada» y guardia «Localizada con residente».
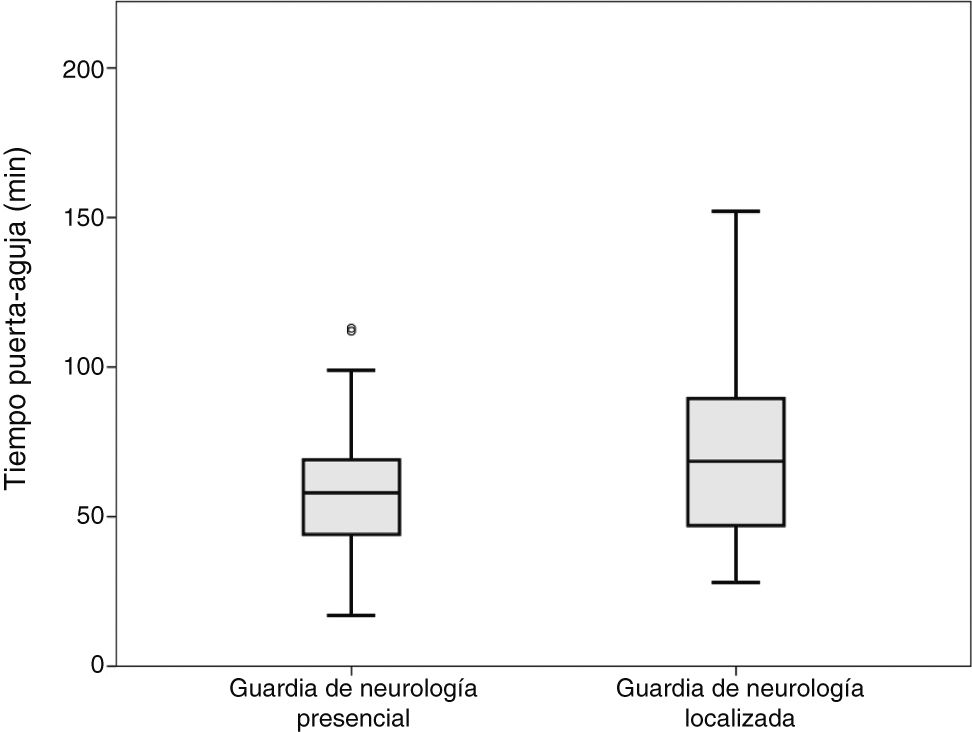
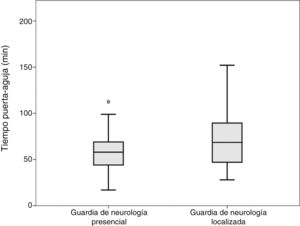
ResultadosN.°=138; edad media 69,7 años; mujeres 45,7%. Pacientes en guardia de «Presencia» 96, «Localizada» 42, de los cuales 17 con residente. Ambos grupos presentaban características basales similares. Los TPA de los grupos «Presencia» y «Localizada» fueron 59 y 72min, respectivamente (p=0,003). Los TPA de grupos «Presencia», «Localizada» y «Localizada con residente», respectivamente 59, 74 y 68min (p=0,001), con significación entre «Presencia» y «Localizada». No se observaron diferentes entre el TPA dependiendo de la franja horaria de mañana, tarde y noche ni entre días laborales y días de fin de semana.
ConclusiónLa presencia o ausencia del neurólogo en el centro hospitalario en el momento del código ictus, influye en la demora de administración del tratamiento fibrinolítico. La presencia del residente de neurología puede acelerar la realización del proceso.
Hospital on-call neurology shifts are frequently on-site, but some on-call services may be off-site or mixed. Intravenous tissue plasminogen activator (tPA) is one of the main reperfusion treatments for acute ischaemic stroke (AIS). This study assesses door-to-needle times (DNT) when the neurologist is on-site or off-site.
MethodsWe performed a prospective, observational study from 2012 to 2017, including patients with AIS and treated with tPA. Data were collected on sex, age, door-to-scan time, scan-to-needle time, and DNT. The on-duty neurologist was on-site from 08:00 to 20:00, and on call but off-site from 20:00 to 8:00. Three groups were formed: on-site, off-site, and off-site with resident present.
ResultsOur sample included 138 patients. The mean age was 69.7 years, and 45.7% of patients were women. Ninety-six patients were admitted during the on-site shift, 25 during the off-site shift, and 17 during the off-site–resident present shift. Patients admitted during the on-site and off-site shifts presented DNTs of 59 and 72minutes, respectively (P=.003). DNTs were 59, 74, and 68minutes (P=.001), respectively, for the on-site, off-site, and off-site–resident present shifts; the difference between DNTs for on-site and off-site shifts was statistically significant. No differences were observed between DNTs according to time of day (morning, afternoon, or night), or between weekdays and weekends.
ConclusionDNT is influenced by whether the on-duty neurologist is on- or off-site at the time of code stroke activation. The presence of a neurology resident can reduce DNT.
El código ictus es el protocolo de valoración urgente ante la sospecha de un accidente cerebrovascular (ACV) agudo para optimizar y acelerar las opciones terapéuticas de reperfusión cerebral. Actualmente las terapias reperfusoras indicadas en ictus isquémico son la fibrinólisis intravenosa (FIV) con alteplasa1,2 y la trombectomía mecánica (TM), mediante cateterismo arterial, la cual ha demostrado ser efectiva en ictus de arterias cerebrales de gran calibre2–9.
La precocidad en la realización de los tratamientos reperfusores es de gran relevancia en la efectividad clínica1,10–15. La demora del proceso depende de diversos factores como es el diagnóstico clínico del evento cerebrovascular, el tiempo de traslado, así como el tiempo transcurrido entre la llegada al hospital y la administración del tratamiento fibrinolítico, llamado tiempo puerta-aguja (TPA).
En la mayoría de centros hospitalarios se realizan guardias de neurología, que pueden ser de presencia (en las que el neurólogo se sitúa geográficamente en el centro hospitalario 24h al día), localizadas (en las que el facultativo no está presente en el centro, esperando a ser llamado telefónicamente para acudir al centro en caso necesario) o mixtas, en la que dependiendo de la franja horaria puede estar presente o localizado.
El objetivo principal fue valorar las diferencias en el TPA durante la guardia de neurología de presencia y el TPA durante la guardia de neurología localizada. Los objetivos secundarios fueron comprobar la influencia de la presencia o ausencia de un residente de neurología en la guardia, de la franja horaria en la que se produce el código ictus, así como del día de la semana en la que se produce el evento.
Material y métodosSe realizó un estudio prospectivo, observacional, desde el año 2012 hasta el año 2017, ambos inclusive, en el que se incluyeron pacientes con activación de código ictus intrahospitalario o extrahospitalario, tratados con FIV con o sin TM, en un hospital de nivel 2. Se excluyeron aquellos pacientes cuya historia clínica no permitiera una adecuada trazabilidad de los datos temporales del código ictus. También se excluyeron códigos ictus en pacientes previamente ingresados en el hospital o aquellos provenientes de otro centro con valoración neurológica previa o pruebas complementarias ya realizadas y aquellos pacientes con reactivación de código (en caso de AIT o mejoría), por haber sido valorados previamente a la activación.
Se recogieron variables como el sexo, la edad, la fecha del ictus, el día de la semana, la puntuación en la escala NIHSS basal, la puntuación en la escala ASPECTS, NIHSS a las 24h, ASPECTS a las 24h y mRS a los 3 meses. Las variables de tiempo recogidas fueron la hora del inicio de los síntomas, en su defecto la última hora que el paciente fue visto asintomático, hora de llegada al hospital, hora de la tomografía axial computarizada (TAC), hora de inicio de la FIV. La hora de administración de la FIV fue considerada la hora de administración del bolo inicial de tratamiento.
La organización de la guardia de neurología fue mixta; es decir, el neurólogo de guardia estuvo presente en el hospital desde las 8:00 hasta las 20:00h, posteriormente estando localizado telefónicamente desde las 20:00 a las 8:00, debiendo desplazarse al hospital por medios propios, ante la activación del código ictus. Los residentes de neurología realizan guardias de neurología durante 24h continuas (de 8:00 a 8:00 hornas del día siguiente), de forma no constante durante la semana; por ello, hubo días en los que de 20:00 a 8:00 hubo neurólogo localizado con residente de neurología en hospital y otros en los que solo hubo neurólogo localizado, sin residente presente. Los residentes asisten los códigos ictus, no iniciando la FIV hasta la llegada del neurólogo localizado al centro hospitalario y valoración del paciente. Para el análisis estadístico, se realizaron 3 grupos: guardia «Presencia», guardia «Localizada» y guardia «Localizada con residente».
El comité de ética local aprobó la realización del presente estudio. Los cálculos estadísticos se realizaron con SPSS®. Se utilizó el test de Kolmogorov-Smirnov como test de normalidad, ANOVA y la t de Student como contrastes de hipótesis. El comité de ética local aprobó la realización del presente estudio.
ResultadosMás de 600 códigos ictus fueron registrados entre 2012 y 2017, con un total de 174 pacientes con FIV. Se excluyeron 18 por inexactitud de datos temporales, 15 pacientes por haber sido reactivado el proceso hospitalario (por mejoría clínica o AIT), 2 códigos ictus intrahospitalarios, un paciente con valoración clínica y pruebas complementarias realizadas en otro centro. Finalmente, 138 pacientes cumplían criterios de inclusión y ninguno de exclusión. Los protocolos de actuación clínica fueron realizados según las guías vigentes1,2.
La edad media (media±desviación estándar) fue de 69,7±12,1 años, siendo mujeres 63 de los pacientes (46,3%). Como antecedentes, presentaron hipertensión arterial el 65,9%, dislipemia el 39,9%, cardiopatía embolígena el 36,6% y diabetes mellitus el 29,7%. Fumadores activos el 12% y nunca fumadores el 63,4%. El 12,5% de pacientes habían sufrido algún tipo de ACV previo. La puntuación en la mRS previa era igual o inferior a 1 en el 94,4% de los casos. La puntuación NIHSS media a la llegada fue de 15±6 puntos, con una puntuación ASPECTS media de 9,6. El TPA medio total fue de 63±24min. La puntuación NIHSS media a las 24h fue de 9±7 puntos, con una puntuación ASPECTS a las 24h de 7±2 puntos. La etiología del ictus fue aterotrombótica en el 42,8%, cardioembólica en el 32,6%, lacunar en el 3,6%, inhabitual en el 7,2% y otras causas (varias causas, indeterminado o criptogénico) en el 8,3%. El 41,4% de los pacientes obtuvo una puntuación mRS a los 3 meses igual o inferior a 2. Los datos más relevantes se muestran en la tabla 1, en la que se muestran las características basales similares en los diferentes grupos.
Datos demográficos, factores de riesgo y características clínicas de pacientes con IIA tratados con fibrinólisis, en relación a la guardia de neurología, presencial o localizada
| Variable | Guardia de neurología presencialN.°=96 | Guardia de neurología localizadaN.°=42 |
|---|---|---|
| Edad, años | 70±12 | 70±12 |
| Género, mujer; n (%) | 44 (45) | 19 (45,2) |
| Hipertensión; n (%) | 61 (63,5) | 30 (71,4) |
| Diabetes mellitus; n (%) | 28 (29,2) | 13 (31) |
| Glucosa basal, mg/dl | 127±38 | 131±50 |
| NIHSS basal | 15±6 | 14±5 |
| ASPECTS basal | 9,68 | 9,55 |
| Tiempo inicio fibrinólisis | 141±45 | 168±61 |
| NIHSS a las 24h | 9±7 | 9±8 |
| ASPECTS a las 24h | 7±2 | 7±3 |
| mRS a 3 meses | 3±2 | 3±2 |
ASPECTS: Alberta Stroke Program Early CT Score; IIA: ictus isquémico agudo; NIHSS: National Institute of Health Stroke Scale; mRS: Modified Rankin scale.
Se contabilizaron un total de 96 pacientes en horario de guardia de presencia (70,7%) y 42 en horario de guardia localizada, de los cuales 17 (12,2%) fueron con residente y 25 sin residente.
Se calcularon el tiempo puerta-TAC (TPT), el tiempo TAC-aguja (TTA) y el TPA para cada una de los tipos de guardia («Presencia», «Localizada» y «Localizada con residente»). El TPT se muestra similar en los 3 grupos. La media del TTA de los grupos «Presencia», «Localizada» y «Localizada con residente» fueron respectivamente 36, 52 y 45min. Se realizó el test de Kolmogorov-Smirnov (K-S) que demostró la normalidad estadísticas de los grupos; seguidamente se calculó ANOVA, que demostró diferencias significativas entre los 3 grupos, mostrando diferencias significativas (p=0,02).
Se calcularon los TPA cuyas medias de los grupos «Presencia», «Localizada» y «Localizada con residente» fueron respectivamente 59, 74 y 68min. El test de K-S mostró normalidad y ANOVA con diferencias significativas (p=0,01). Dichos resultados se muestran en la cual se representa en la tabla 2. El análisis post-hoc de ambas comparaciones demostró que las diferencias correspondía a la comparación entre los grupos «Presencia» y «Localizada» exclusivamente, no mostrando significación entre las comparaciones con el grupo «Localizada con residente».
Resultados de tiempos observados en los diferentes tipos de guardia de neurología
| Variable | Guardia de neurología presencialN.°=96 | Guardia de neurología localizadaN.°=25 | Guardia de neurología localizada con residenteN.°=17 | Valor de p |
|---|---|---|---|---|
| TPT, min | 22±12 | 20±9 | 24±11 | p=0,7 |
| TTA, min | 36±19 | 52±31 | 45±20 | p=0,02 |
| TPA, min | 59±20 | 74±32 | 68±24 | p=0,01 |
| Variable | Guardia de neurología presencialN.°=96 | Guardia de neurología localizada con y sin residenteN.°=42 | Valor de p |
|---|---|---|---|
| TPT, min | 22±12 | 21±10 | p=0,98 |
| TTA, min | 36±19 | 49±27 | p=0,008 |
| TPA, min | 59±20 | 72±29 | p=0,003 |
TPA: tiempo puerta-aguja; TPT: tiempo puerta-TAC; TTA: tiempo TAC-aguja.
Se realizó la comparación entre 2 grupos «Presencia» y «Localizada», incluyendo en localizados aquellos pacientes atendidos con y sin residente de neurología. No se observaron diferencias en TPT. Las medias de tiempo TTA fueron respectivamente 36 y 49min, el test de K-S mostró normalidad, realizando la t de Student (p=0,008). Las medias de tiempo TPA fueron respectivamente 59 y 72min, el test de K-S mostró normalidad, realizando la t de Student (p=0,003, fig. 1).
Se pretendió evaluar la posible influencia de la franja horaria (mañana, tarde o noche) en los tiempos anteriormente evaluados. La franja horaria fue considerada de mañana desde las 8:00am hasta las 15:00, de tarde desde las 15:00 hasta las 22:00 y de noche desde las 22:00 hasta las 08:00. El TPA en cada franja horaria resultó respectivamente 60±17min, 61±26min y 71±35min (p=0,15).
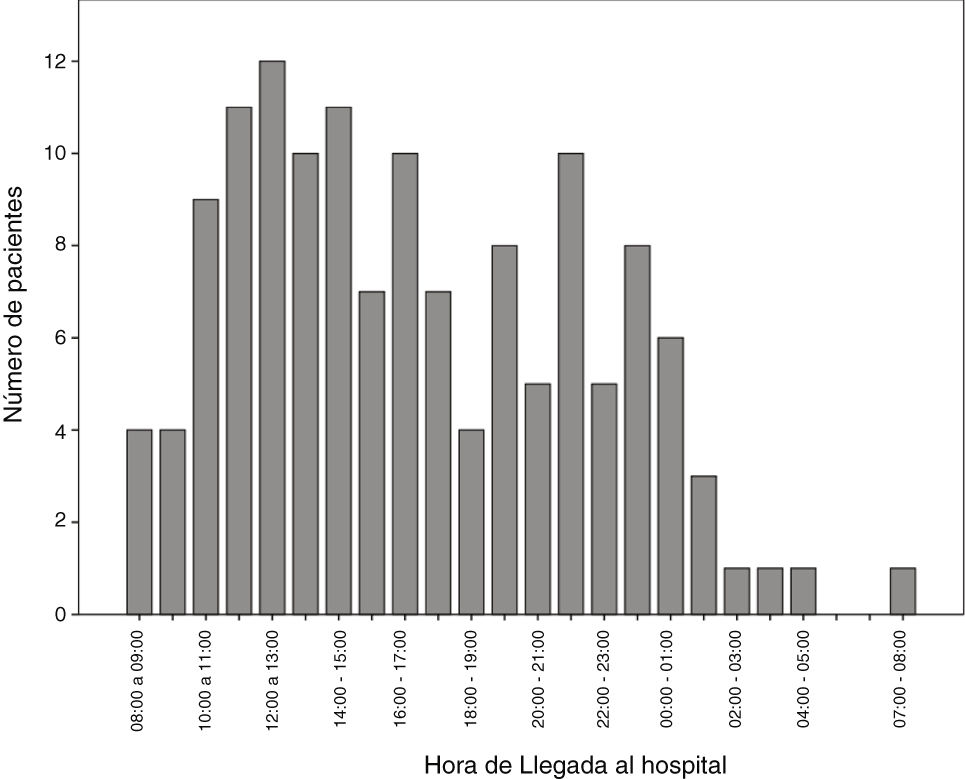
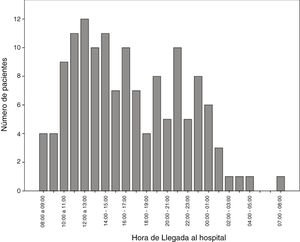
Se observa mayor incidencia de códigos ictus con FIV en horario de mañana, siendo las horas de mayor afluencia de pacientes de 12:00 a 14:00h (fig. 2).
También se pretendió evaluar la posible influencia del día de la semana en la demora del proceso. El día de la semana fue agrupado en día laboral (de lunes a viernes) y fin de semana (sábado y domingo). La media del TPA en días laborales resultó 64±22min y en fin de semana 57±22min (p=0,48).
DiscusiónEn el presente estudio se han encontrado diferencias significativas en los tiempos de actuación en el código ictus tratado con FIV en relación a la presencia o ausencia de neurólogo en el centro hospitalario, en el momento de la llegada del paciente. Los resultados muestran que la ausencia del neurólogo en el momento de la llegada del paciente, supone una demora en el proceso, y por ello un retraso en la administración del tratamiento (fig. 1). Así mismo, los datos muestran que la presencia del residente de neurología puede acelerar el proceso.
El neurólogo de guardia, en nuestra comunidad, suele estar presente 24h al día, 7 días a la semana únicamente en los hospitales de referencia. En otros centros hospitalarios puede haber neurólogo de guardia o no, y puede estar de presencia o localizado según la franja horaria. Este tipo de organización puede deberse a que la franja horaria matutina es la de mayor afluencia de códigos ictus, habiendo una menor incidencia nocturna (fig. 2). En las últimas décadas, se ha observado un aumento de las urgencias neurológicas, tanto en centros de referencia neurovascular como en otros, probablemente debido al aumento de la concienciación social, a la mayor formación neurológica de los servicios de urgencias y, sobre todo, por la indicación de nuevos tratamientos reperfusores que han aumentado la ventana terapéutica. Todo ello pone de relieve una mayor necesidad de atención especializada urgente.
Una limitación para el análisis temporal es la falta de consenso entre los conceptos de tiempo. ¿Qué se considera «puerta», la llegada al centro sanitario o la activación del código ictus en cualquier momento? Estos conceptos se ven alterados por aquellos casos en los que la valoración inicial y pruebas complementarias han sido realizadas en otros centros previos al traslado. ¿Qué se considera «aguja», la infusión del bolo o la perfusión? Algunos trabajos han considerado «aguja» incluso el momento en el que se decide realizar la infusión y no el momento en el que se administra. Para clarificar estos conceptos Kruyt et al.16 proponen una consolidación de dichos conceptos, proponiendo como «puerta» el momento en entrada en el hospital en caso de que estuviese fuera de hospital o en caso de que ya estuviese dentro de hospital, la primera consulta o llamada al equipo de neurología. Se propone como terminación de proceso «aguja» el momento de la administración del bolo de alteplasa, seguido inmediatamente de la perfusión. En el presente estudio se pretendió homogeneizar la muestra, considerando «puerta» la llegada al hospital, excluyendo pacientes ya valorados en otros centros o con pruebas complementarias externas o códigos reactivados por fluctuación clínica, y como «aguja», la administración del bolo de alteplasa. Estos criterios supusieron una disminución del tamaño muestral. A pesar de ello, se obtuvieron resultados concluyentes.
Las posibilidades terapéuticas del ictus isquémico agudo (IIA) son tiempo-dependientes y, por ello, son muchos los autores y los trabajos sobre optimización del TPA. Trabajos como el de Advani et al.17 que demuestran como la educación a médicos de atención primaria, enfermería y personal no médico disminuye de forma importante el TPA. Van Dishoeck et al.18 observan una inexplicada mejoría del TPA entre 2008 y 2012 posiblemente debida al aumento de concienciación y familiarización social y del personal hospitalario. Fonarow et al.19 describen como una iniciativa de formación nacional consigue mejorar el TPA, así como una disminución de complicaciones hemorrágicas. Sauser et al.20 realizan análisis comparativo de TPT y TTA, observando mayor demora en el TTA (60±32min) frente al TPT (22±15min), sugiriendo una mejora en la efectividad del tiempo postimagen, y siendo estos datos muy próximos a los obtenidos en el presente trabajo. Lorenzano et al.21 analizan la demora dependiendo de la franja horaria del día y la diferencia entre días de diario y fines de semana, notando mayores TPA y tiempo total de tratamiento en la franja horaria nocturna y durante los fines de semana. Según los datos analizados se observan diferencias no significativas en la franja nocturna y los fines de semana. Xian et al.22 describen y analizan las estrategias utilizadas en un grupo de hospitales americanos para mejorar el tiempo TPA: la rápida valoración por equipo neurovascular, activación de código ictus por llamada única y otros como almacenaje de alteplasa en el servicio de urgencias se asocian analíticamente con una mejora de tiempo por cada estrategia empleada, de forma acumulativa.
El orden del protocolo ha sido estudiado como parte fundamental de la optimización de tiempos. En recientes estudios, como el de Iglesias Mohedano et al.23 evalúan los tiempos de tratamiento tras optimización del protocolo, incluyendo medidas como la activación y filiación de datos extrahospitalaria, limitación inicial de pruebas salvo electrocardiograma y coagulación (si toma previa de antivitamina K), administración del bolo de FIV en la TAC y derivación directa a sala de angiología si procede, entre otras. Schrcok et al.24 analizan cómo la realización de ECG y radiografía de tórax previo a neuroimagen retrasan el TPA 6 y 13min, respectivamente, demostrando que el retraso de TPA está influido por el orden de las pruebas complementarias. Hsieh et al.25 describen estrategias que pueden reducir TPA como la realización de neuroimagen cerca del área de urgencias, marcaje de muestras de sangre para total priorización en laboratorio y video asistencia, observando una disminución de TPA de 93 a 57min. Recientemente, Tan et al.26, observan una mejoría de tiempos desde 84?a 59min tras realizar activación prehospitalaria, traslado directo a neuroimagen y rápido abordaje por neurología y enfermería de ictus. Van Schaik et al. consiguen una mejora de tiempo de 60 a 25min mediante la introducción de un protocolo de actuación estándar, y mayor concienciación de la importancia de la trombólisis intravenosa27. Bhatt et al.28 objetivan una mejora de tiempos basados en notificación prehospitalaria, almacenaje y utilización de alteplasa en la TAC, y sistema precoz de análisis de datos y feedback al equipo para una mejora constante. Ajmi et al.29 consiguen TPA de 13min tras revisión del protocolo y realización de entrenamientos de simulación al equipo de ictus.
Por todo ello, algunas de las medidas propuestas para una optimización del TPA son: notificación y filiación prehospitalaria, recepción y valoración del paciente en sala de radiología, priorizar la TAC, e inicio de alteplasa previo a otras pruebas complementarias, almacenaje y administración de tratamiento en sala de radiología, además de un continuo análisis y revisión de datos en reuniones periódicas.
Dado que la efectividad clínica de las terapias de reperfusión cerebral en el IIA dependen en gran medida del tiempo transcurrido hasta su administración, la mejora del TPA debe ser uno de los objetivos principales de cada centro. La demora en el inicio de la FIV es perjudicial para los pacientes, observando disminución de las posibilidades de mejora de forma proporcional al tiempo trascurrido30. En cualquier caso, es recomendable que los centros y servicios de salud revisen la conveniencia de mantener una guardia localizada frente a la posibilidad de una guardia de presencia física de neurología, dado que la primera situación deriva en un retraso en la administración de tratamiento reperfusor y probablemente en un peor pronóstico.
ConclusionesLa presencia o ausencia del neurólogo en el centro hospitalario en el momento del código ictus, influyó significativamente en la demora de administración de tratamiento fibrinolítico. Resultó beneficioso la presencia del neurólogo de guardia en el centro hospitalario en la asistencia del código ictus. La presencia de residente de neurología aceleró el proceso asistencial, durante el tiempo de traslado del neurólogo localizado. No se observaron diferencias de tiempos de actuación entre franja horarias del día, ni entre diferentes días de la semana.
FinanciaciónLos autores declaran no haber recibido financiación para la realización de este trabajo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.