La necesidad de un diagnóstico en fases precoces de la enfermedad de Parkinson (EP) hace que cada vez sean más los estudios sobre los signos y síntomas en estadios iniciales. Se ha indicado una progresión estereotipada y ordenada de los cuerpos de Lewy en los cerebros de los pacientes con EP1 pero este depósito de α-sinucleína no se relaciona necesariamente con la disfunción o defunción neuronal y por tanto con la sintomatología. Esto hace posible que los primeros síntomas de una EP puedan ser muy variados2. Estudios longitudinales demuestran que el trastorno de conducta del sueño REM (TCSR) puede preceder hasta en un 45% al diagnóstico de una enfermedad neurodegenerativa (α-sinucleinpatías) preferentemente EP3. Es conocido que el fallo autonómico es una complicación tardía de la EP y la demencia de cuerpos de Lewy (DCL) aunque en ocasiones puede ser el cuadro de presentación4,5. Recientemente hemos descrito como una portadora de una mutación en el gen de la α-sinucleína (SNCA) ha presentado disautonomía como signo de inicio de su enfermedad6.
Presentamos 2 pacientes con TCSR idiopático y fallo autonómico periférico sin signos ni síntomas de enfermedad neurodegenerativa. Se discute el riesgo de desarrollar una sinucleinopatía y las implicaciones de su diagnóstico precoz.
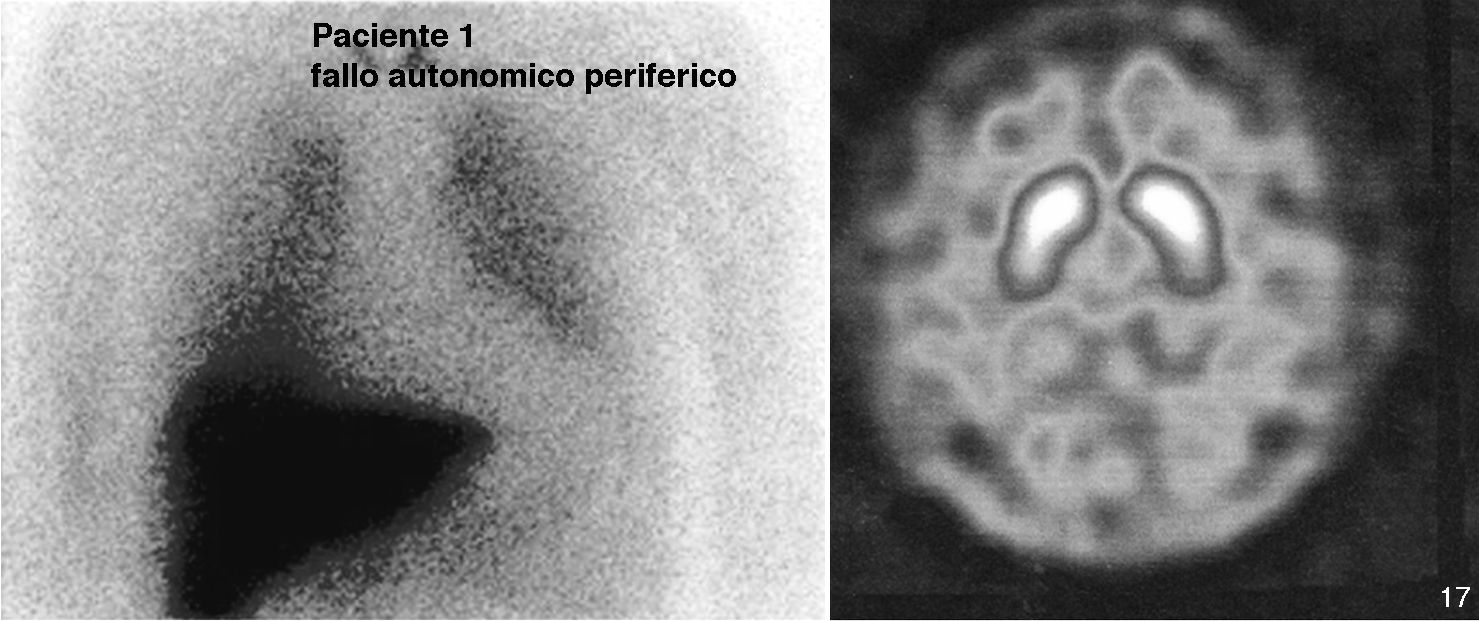
Caso 1. Varón de 66 años sin antecedentes familiares de enfermedades neurodegenerativas. En el año 2004 acudió por un trastorno del sueño que consistía en pesadillas, sueño agitado y caídas de la cama que el paciente describía desde hacía años. La polisomnografía registró durante el sueño REM un aumento de los fenómenos fásicos y una pérdida de la atonía fisiológica de esta fase. Se realizó un diagnóstico de TCSR que mejoró con clonazepam (0,5mg). Seis meses más tarde sufrió un síncope tusígeno. El estudio del sistema nervioso vegetativo mostró: una frecuencia cardiaca fija no modificada por la maniobra de Valsalva, la administración de efedrina o la bipedestación. Presentó hipotensión ortostática (decúbito 148/80 FC 53; bipedestación 120/65 FC 53). Presentaba cifras de noradrenalina en decúbito de 26 pg/ml (VN: 100-750) que se elevaban en bipedestación hasta 124 pg/ml (VN: 200-1.700). No se detectó déficit olfatorio (11/12 identificados correctamente en el Brief Smell Identification Test, BSIT). Se observó una marcada hipocaptación en la SPECT I-MIBG miocárdica (fig. 1). La TC cerebral (no pudo realizarse RM por la presencia de partículas metálicas) fue normal. La SPECT 123-I-FP-CIT no mostraba defectos de captación estriatal (fig. 1); 2 años después se repitió dicha exploración mostrando valores normales aunque los ratios de captación estríado/lóbulo occipital habían disminuido discretamente
Caso 2. Mujer de 60 años que acude por síncopes de repetición e intolerancia al ortostatismo desde hacía 10 años. Describía otros síntomas disautonómicos como estreñimiento y problemas miccionales: tenesmo y nicturia. Presentaba una disminución de la olfación (7/12 en el BSIT). Refería ensoñaciones vívidas y movimientos durante el sueño, la polisomnografía objetivó una pérdida de la atonía en la fase REM. En el estudio disautonómico se detectó hipotensión ortostática en la mesa basculante (bipedestación: 103/54mmHg FC 66; decúbito 66/34mmHg FC 55) e hipertensión arterial nocturna en el Holter de presión arterial. El estudio de catecolaminas puso de manifiesto una importante depleción de noradrenalina (decúbito 17 pg/ml; bipedestación 31 pg/ml) con un incremento de la vasopresina con el cambio postural (decúbito 3,9 pg/ml, bipestación 5,1 pg/ml). Tanto el Valsalva ratio (1,8) como la variabilidad de la FC con la respiración se situaron en el límite bajo de la normalidad. La prueba cutánea simpático-refleja fue patológica en extremidades inferiores. En la RM craneal no se detectaron anomalías que indicaran la presencia de una atrofia multisistémica (AMS). Se realizó una SPECT-MIBG cardiaca con un ratio miocardio/mediastino a las 4h de 1,8 (VN>1,7), el SPECT 123-I-FP-CIT fue normal.
Los 2 pacientes descritos cumplen criterios para el diagnóstico de TCSR. Los resultados del estudio de ambos pacientes orientan hacia un fallo autonómico primario con afectación posganglionar simpática y parasimpática7. Esta entidad engloba 3 enfermedades neurodegenerativas: el fallo autonómico puro (PAF), la enfermedad de Parkinson (EP) y la atrofia multisistémica (AMS)8. La disfunción autonómica en la AMS se debe a la degeneración de las neuronas preganglionares encontrándose inclusiones citoplasmáticas de α-sinucleína en neuronas y células gliales del tronco del encéfalo y médula espinal9. Los ganglios simpáticos y los terminales postganglionares no están afectados. En cambio, la afectación del sistema nervioso vegetativo en la EP y el FAP es de predominio postganglionares. Se encuentran cuerpos y neuritas de Lewy en los ganglios simpáticos y plexos mientéricos10 y en menor medida en las astas intermedio-laterales11.
Se han descrito casos de reducción de la captación de MIBG cardiaco en pacientes con TCSR12 sin otros síntomas adicionales, a diferencia de los casos que hemos descrito, no presentaban síntomas clínicos de disautonomía. Esto viene a demostrar que la hipoperfusión en la SPECT-MIBG cardiaca puede ser un hallazgo precoz y preceder al inicio de las manifestaciones motoras. En este grupo de pacientes también se ha descrito déficit de olfación con las mismas características que el de pacientes con EP13.
La hipótesis de que la neurodegeneración en EP y DCL puede comenzar en las neuronas autonómicas postganglionares10 tiene importantes consecuencias, terapéuticas y diagnósticas, ya que el estudio del sistema nervioso vegetativo, puede ser una herramienta útil en la identificación de pacientes en estadios premotores, previo a la degeneración neuronal de la sustancia negra. Recientemente se han detectado inclusiones de sinucleína en fibras nerviosas de glándulas sudoríparas cutáneas en pacientes con fallo autonómico puro14. La administración de fármacos con efectos neuroprotectores como la rasagilina pudiera indicarse en este grupo de pacientes, no obstante creemos que sería necesario primero definir en estudios prospectivos el valor de diferentes biomarcadores en estos trastornos15 y segundo la realización de ensayos clínicos a largo plazo con estas indicaciones (TCSR y fallo autonómico puro).