En los pacientes con el síndrome de epilepsia temporal mesial con esclerosis del hipocampo (ETM-EH) se describen alteraciones extrahipocámpicas (AEH), como hallazgo frecuente en las IRM.
Los objetivos del estudio fueron, en los pacientes con este síndrome, evaluar la frecuencia de AEH y correlacionar estos hallazgos con algunas de sus características clínicas.
Material y métodoFueron examinados pacientes con diagnóstico de ETM-EH realizado por IRM de alta resolución. Se consideraron las siguientes alteraciones extrahipocámpicas: atrofia del lóbulo temporal (ALT), del giro parahipocámpico (APH), del pilar posterior del fórnix (APF) y de los cuerpos mamilares (ACM). Se analizaron las variables edad, edad de inicio de la epilepsia, tiempo de evolución, historia de convulsiones febriles (CF) y de epilepsia familiar, historia de estatus, generalización secundaria de las crisis y respuesta al tratamiento farmacológico.
ResultadosDe los 54 enfermos incluidos solo 4 no mostraron AEH en las IRM. Dieciocho (33,3%) tuvieron ALT; 44 (81,4%) APH; 29 (53,7%) APF y 23 (42,5%) ACM. Se evaluaron AEH en una población de 17 controles. Ningún control mostró ALT o APH, tres mostraron APF (p<0,02) y 2 ACM (p<0,04).
La presencia de CF se asoció con las APH (OR=9,9 [1,1 - 225]; p=0,002). No hubo diferencias en el resto de las variables analizadas.
ConclusiónEn la ETM-EH hay una extensión del daño que excede al hipocampo, lo que sería indicativo de compromiso de la red de interconexión neuronal más que de una lesión en una estructura anatómica en particular. La asociación entre APH y la presencia de CF podría sugerir un mecanismo fisiopatológico de alteración común.
In mesial temporal lobe epilepsy patients with hippocampal sclerosis (MTLE-HS) syndrome, extrahippocampal alterations (EHA) are frequently described on MRI studies. The objectives of the study were, in patients with this syndrome, to evaluate the frequency of EHA and to correlate these findings with some of its clinical characteristics.
Material and methodWere examined MTLE-HS patients diagnosed by high resolution MRI. The following EHA were considered: atrophy of the temporal lobe (TLA), of the parahippocampal gyrus (PHA), of the fornix (FA) and the mammillary bodies (MBA). We analyzed the variables age, age at the beginning of the epilepsy, time of evolution, history of febrile convulsions (FC) and familial epilepsy, history of status, secondary generalization of the seizures and response to the pharmacological treatment.
ResultsOf the 54 patients included, only 4 of them didn’t show any EHA. Eighteen (33.3%) had TLA; 44 (81.4%) PHA; 29 (53.7%) FA and 23 (42.5%) MBA. EHA were analyzed in a population of 17 controls. Anyone of the controls showed TLA or PHA, 3 showed FA (p< 0.02) and 2 MBA (p< 0.04). The FC was associated to PHA [OR=9.9 (1.1-225); p=0.002]. There were no differences in the rest of the variables that were analyzed.
ConclusionIn MTLE-HS there is an extension of the damage beyond the hippocampus, which would be indicative of involvement of the neuronal network rather an injury in a particular anatomical structure. The association between PHA and the presence of FC may suggest a common pathophysiological mechanism of disturbance.
Las imágenes por resonancia magnética (IRM) han permitido diagnosticar, con alto grado de certeza, la esclerosis del hipocampo (EH)1,2. Esta entidad, asociada a un cortejo signo-sintomatológico ha permitido definir un síndrome epiléptico en particular, el de la epilepsia temporal mesial con EH (ETM-EH), cuyo diagnóstico hace presumir una mala respuesta al tratamiento farmacológico y una excelente respuesta al tratamiento quirúrgico1,3–5.
A través del uso de técnicas de IRM de alta resolución se han podido obtener imágenes detalladas tanto del hipocampo en sí, como de otras estructuras anatómicas que forman parte o están ampliamente conectadas con el sistema límbico, como son las cortezas del polo y la corteza temporal lateral, las cortezas perirrinal y entorrinal, las amígdalas, los tálamos, los pilares posteriores del fórnix y los cuerpos mamilares6–10.
La presencia de alteraciones en estructuras anatómicas extrahipocámpicas (AEH), asociadas a la EH, sugieren la posibilidad de que cuando se produce un daño en el hipocampo éste se haría extensivo también hacia otras áreas con las cuales se vincula anátomo-funcionalmente7,11.
Desde el punto de vista clínico estos hallazgos son controvertidos. Mientras algunos autores indican que las AEH se asocian con un pobre pronóstico después de una cirugía de la epilepsia12, otros autores no han encontrado que su presencia sea predictora de alguna alteración o comportamiento clínico en particular8,10,13.
Es por ello que los objetivos del estudio fueron evaluar la frecuencia de anomalías extrahipocámpicas en pacientes con ETM-EH y correlacionar su presencia con algunas características clínicas.
Material y métodoCaracterísticas clínicasFueron seleccionados enfermos con diagnóstico de epilepsia temporal mesial de acuerdo al interrogatorio de la semiología ictal realizado en forma directa al paciente o, indirecta al familiar que observó las crisis.
Se estableció la zona epileptógena en las estructuras mesiales del lóbulo temporal de acuerdo a las características clínicas de las crisis y a los hallazgos en el EEG y/o vídeo-EEG.
Se realizó un interrogatorio dirigido para detectar antecedentes familiares de epilepsia e historia de convulsiones febriles, así como de episodios de estado de mal epiléptico, generalización secundaria de las crisis y respuesta al tratamiento farmacológico.
Imágenes por resonancia magnéticaSe utilizó un protocolo de IRM optimizado, establecido previamente, para el estudio de enfermos con sospecha diagnóstica de epilepsia donde se visualizan de forma detallada las estructuras mesiales del lóbulo temporal14.
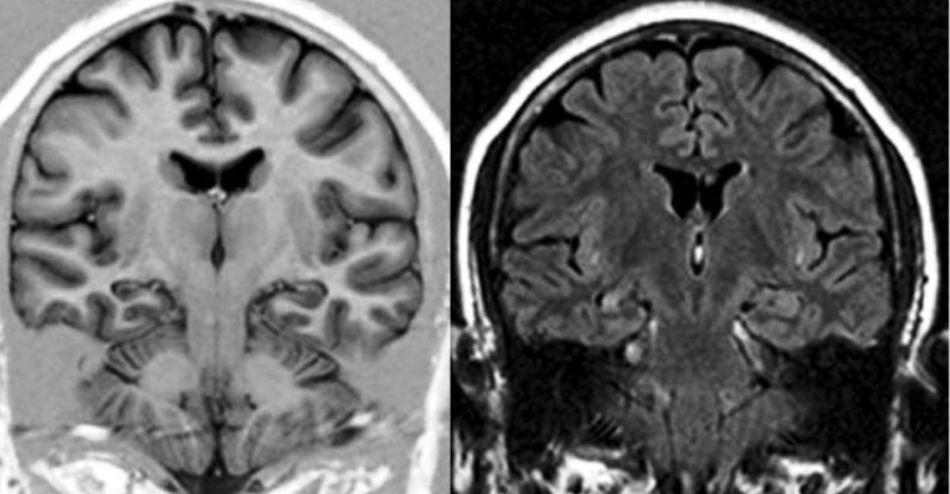
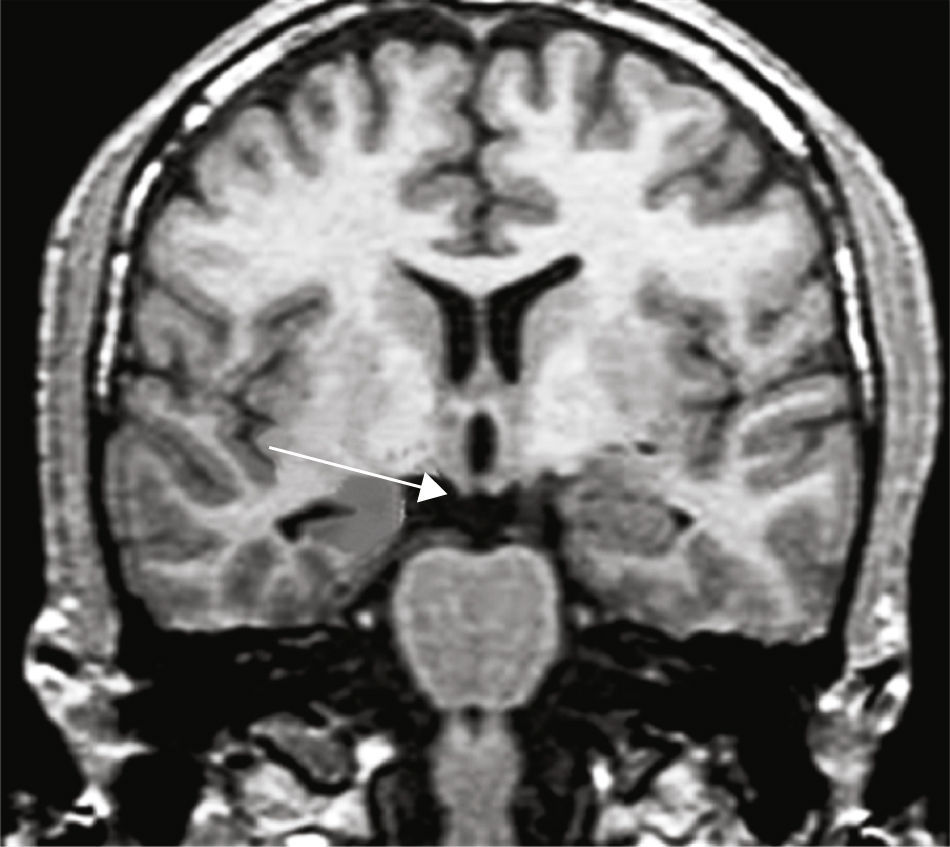
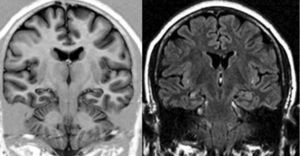
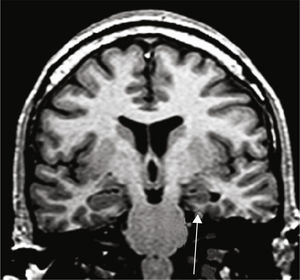
Se estableció el diagnóstico de EH por la presencia de alteración del tamaño, pérdida de la estructura interna y cambio de señal en el hipocampo afectado3 (fig. 1).
A todos los enfermos con diagnóstico de ETM-EH se les realizó además cortes de alta resolución utilizando una adquisición volumétrica mediante una secuencia T1, gradiente de Eco 3D, adquiridos en forma coronal, perpendiculares al eje mayor del hipocampo para poder obtener imágenes anatómicas detalladas tanto del hipocampo como de las estructuras extrahipocámpicas del lóbulo temporal. Para ello se utilizó un resonador Philips Gyroscan NT de 1.5 Tesla. Las características técnicas de la secuencia utilizada comprendieron field of view 220; matriz 256×256; 110 slices con un espesor de 1,5mm, sin gap; TR: 14ms; TE: 3.8ms; número de señales: 4; ángulo de flip: 30°. Esta secuencia también se utilizó para el estudio del grupo control.
Luego se procedió a identificar las AEH, cuyo diagnóstico fue realizado a través de un detallado análisis visual, por un investigador cegado al diagnóstico, lo que permitió clasificar a los pacientes en 4 grupos, a saber:
- 1.
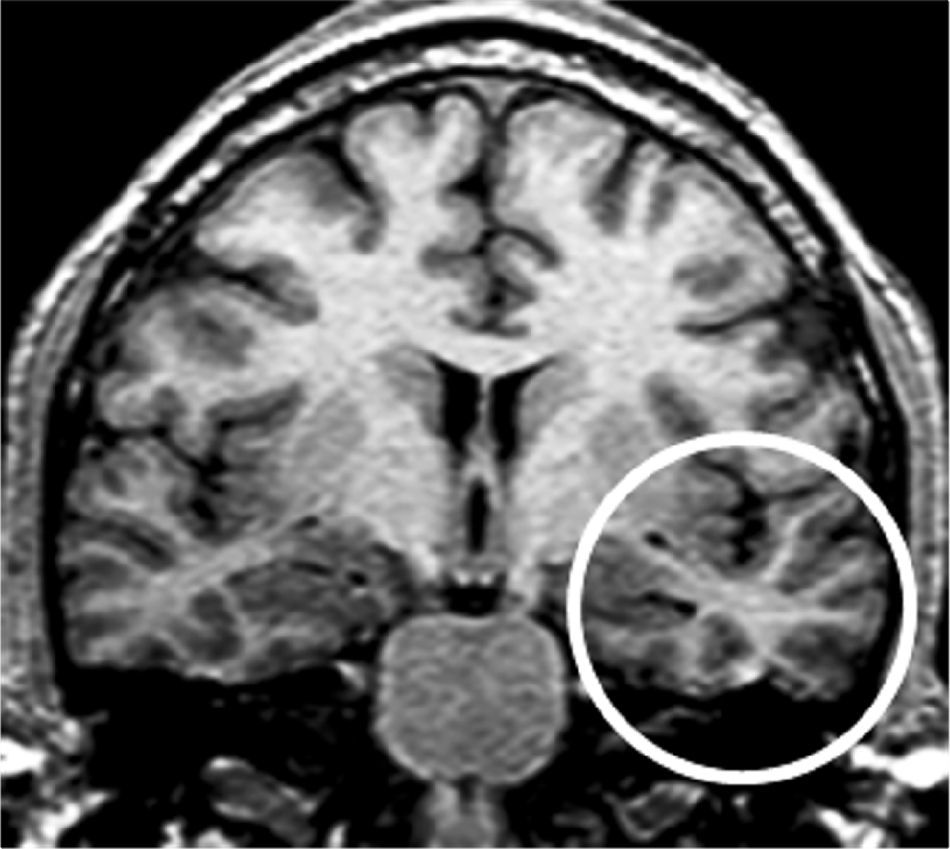
Grupo 1. Atrofia del lóbulo temporal (ALT): se definió por la disminución de tamaño del polo (corteza témporo-polar y perirrinal) y/o de los giros corticales de la corteza temporal lateral y temporal basal y medial (perirrinal), excluyendo al giro parahipocámpico (fig. 2).
- 2.
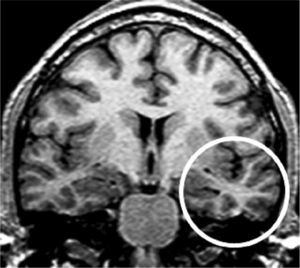
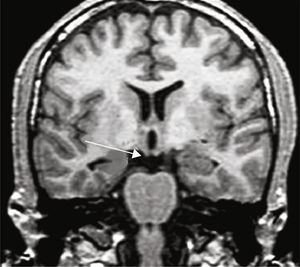
Grupo 2. Atrofia del giro parahipocámpico o corteza entorrinal (APH): se analizó la disminución de tamaño del giro parahipocámpico (fig. 3).
- 3.
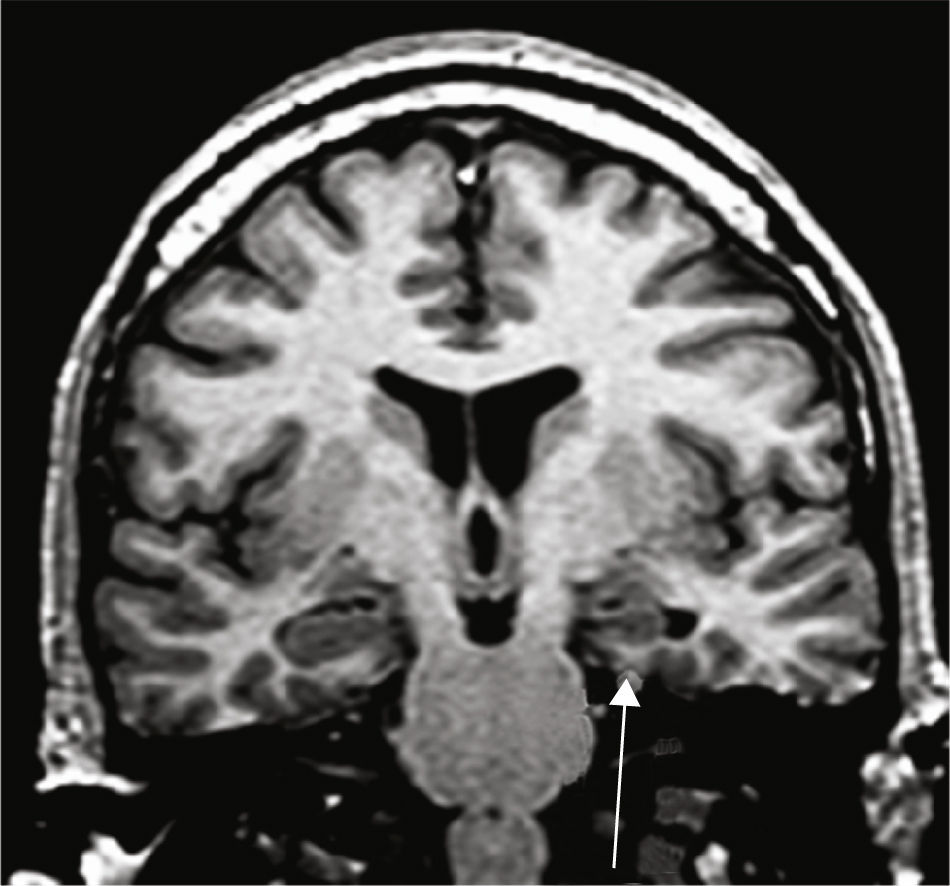
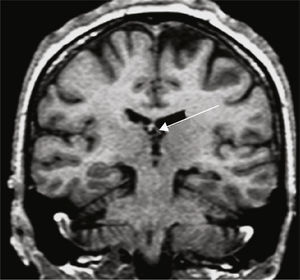
Grupo 3. Atrofia de los pilares posteriores del fórnix (APF): se definió por la disminución de tamaño del pilar posterior del fórnix, en los cortes a la altura de la cola del hipocampo (fig. 4).
- 4.
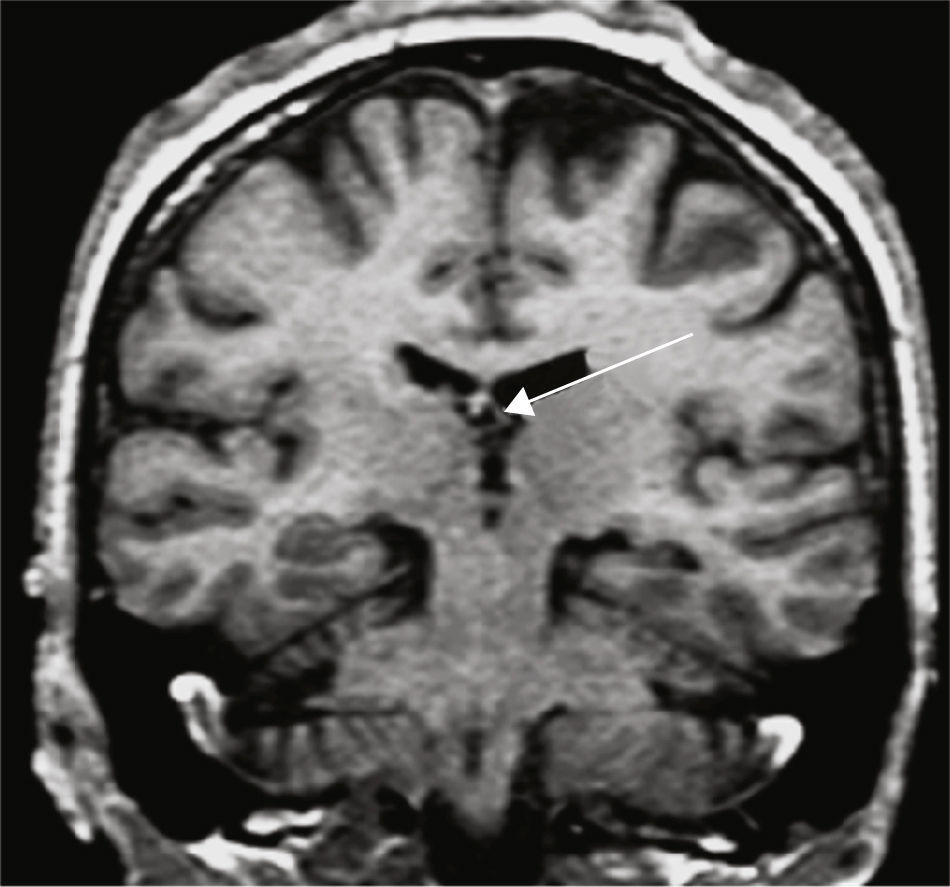
Grupo 4. Atrofia de los cuerpos mamilares (ACM): se definió por la disminución de tamaño de los cuerpos mamilares, en los cortes a la altura de la unión de la cabeza con el cuerpo (fig. 5).
Se realizó un análisis de dichas alteraciones extrahipocámpicas en un grupo de 17 controles sin epilepsia, de igual grupo etario, a los cuales se les realizaron los cortes de IRM de alta resolución tal como se ha explicado párrafos más arriba.
Análisis de los datosEn un primer paso se procedió a establecer la frecuencia de cada una de estas alteraciones, comparadas con la población control sin epilepsia.
Posteriormente se analizaron las variables clínico-epidemiológicas como la edad, la edad de inicio de la epilepsia (EIE), el tiempo de evolución de la enfermedad (TEE), la historia de convulsiones febriles (CF), los antecedentes familiares de epilepsia (AFE), la historia de estatus, la generalización secundaria de las crisis y la respuesta al tratamiento farmacológico. Luego se correlacionaron con la presencia de cada una de las AEH descritas previamente.
Se utilizaron estadísticos descriptivos y se evaluó la presencia de asociación entre las variables dicotómicas mediante prueba de Chi cuadrado. La fuerza de asociación se estimó mediante razón de productos cruzados. Se estableció nivel de significación estadística en 0,05.
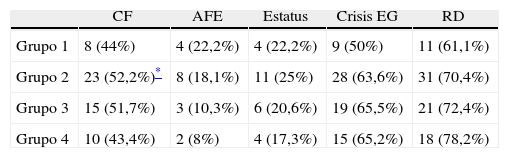
ResultadosSe incluyeron 54 enfermos portadores de ETM-EH diagnosticada a través de las IRM, que fueron clasificados en cada uno de los grupos. Solo 4 pacientes no mostraron AEH en las IRM. Es de notar que algunas de las características en las imágenes podían coexistir en un mismo paciente (tabla 1):
Distribución de los pacientes en relación con las variables analizadas
| CF | AFE | Estatus | Crisis EG | RD | |
| Grupo 1 | 8 (44%) | 4 (22,2%) | 4 (22,2%) | 9 (50%) | 11 (61,1%) |
| Grupo 2 | 23 (52,2%)* | 8 (18,1%) | 11 (25%) | 28 (63,6%) | 31 (70,4%) |
| Grupo 3 | 15 (51,7%) | 3 (10,3%) | 6 (20,6%) | 19 (65,5%) | 21 (72,4%) |
| Grupo 4 | 10 (43,4%) | 2 (8%) | 4 (17,3%) | 15 (65,2%) | 18 (78,2%) |
AFE: antecedentes familiares de epilepsia; CF: convulsiones febriles; crisis EG: crisis evolucionando a generalizadas; RD: resistente a drogas.
Mediana de edad: 33,5 años (rango: 21-60); mediana de EIE: 12,5 años (rango: 2-38); mediana de TEE: 19,5 años (rango: 4-58).
Grupo 2 (n=44 [81,4%])Mediana de edad: 35,5 años (rango: 18-60); mediana de EIE: 12 años (rango: 0-40); mediana de TEE: 22,5 años (rango: 2-58).
Grupo 3 (n=29 [53,7%])Mediana de edad: 35 años (rango: 20-60); mediana de EIE: 13,5 años (rango: 1-33); mediana de TEE: 19 años (rango: 3-58).
Grupo 4 (n=23 [42,5%])Mediana de edad: 33 años (rango: 21-60); mediana de EIE: 14 años (rango: 2-40); mediana de TEE: 16 años (rango: 2-58).
Comparación con un grupo normalNingún control mostró ALT o APH. Tres controles mostraron APF (p<0,02) y dos ACM (p<0,04).
Al realizar el análisis estadístico entre las variables clínicas, en función de las alteraciones en las imágenes, se observó una asociación entre la presencia de CF y de APH, OR=9,9 (1,1 - 225) p=0,002. No hubo diferencias en el resto de las variables analizadas en cada grupo.
DiscusiónLas estructuras anatómicas consideradas en el presente estudio, tales como el hipocampo, el fórnix, los cuerpos mamilares y la corteza entorrinal forman parte del sistema límbico, un circuito con activa participación en el mecanismo de las emociones15. Este circuito tiene una amplia red de conexión tanto entre las estructuras del circuito en sí, como con áreas relacionadas, como la corteza temporal lateral y témporo-polar16.
En nuestra serie, al igual que en la de otros autores6–11,17,18, se demostró una alta frecuencia de AEH en los pacientes con diagnóstico de ETM-EH. Estos hallazgos también fueron observados tiempo atrás en especímenes anatomopatológicos previo al advenimiento de las modernas técnicas quirúrgicas y de neuroimágenes19.
Muchas teorías han sido formuladas para tratar de explicar por qué ocurren alteraciones anatómicas que van más allá del hipocampo. Una primera hipótesis plantea que las crisis frecuentes llevan a un daño neuronal en estructuras conectadas al hipocampo. Algunos autores han observado, mediante el uso de electrodos de profundidad colocados en las estructuras mesiales del lóbulo temporal de enfermos candidatos a cirugía, que la zona de inicio ictal (ZII), es decir, la zona donde realmente comienzan las crisis, podría estar ubicada tanto en el hipocampo en sí, como en la amígdala y/o la corteza entorrinal. Esto sería indicativo de que el sistema témporo-límbico tiene múltiples potenciales generadores de crisis20,21. Este hecho podría llevar a plantear la posibilidad de que la excesiva citotoxicidad producida por las frecuentes descargas originadas en la ZII puedan desarrollar efectos deletéreos en las áreas cercanas, con efectos finales desde el punto de vista anatómico y funcional8,22–24.
Una segunda hipótesis plantea un mecanismo casi inverso al anterior, en el cual existiría un fenómeno de deaferentación de dichas estructuras interconectadas, demostrado a través de estudios de tractografía por resonancia magnética25.
Una tercera hipótesis para tratar de explicar estos fenómenos plantea que alguna noxa, que inicialmente afecta al hipocampo, tiene la capacidad de provocar una pérdida neuronal en el mismo y también de causar un daño en el resto de las estructuras anatómicas que participan en la red de conexión26.
Hasta la actualidad ninguna de estas tres hipótesis pudo ser demostrada de manera fehaciente, aunque lo más probable es que sea una combinación de estos tres mecanismos. Si hacemos un análisis desde un punto de vista evolutivo, los dos primeros hacen pensar en una probable progresión del daño; es decir, que a mayor tiempo de evolución de la enfermedad mayor será el grado de atrofia27. Sin embargo, en nuestro trabajo el tiempo de evolución de la epilepsia no tuvo correlato con el trastorno anatómico observado, aunque sí confirmamos la alta frecuencia de las AEH, sugiriendo entonces no solo un compromiso anatómico sino también funcional.
La mayoría de las variables clínicas no se asociaron con el daño en alguna estructura extrahipocámpica en particular. Estos resultados son coincidentes con los de Moran et al., que no observaron asociación entre AEH con algunas variables como duración de la epilepsia, historia de convulsiones febriles o generalización de las crisis26. En una serie de enfermos con ETM con EH, que fuera sometida a una lobectomía temporal anterior por una epilepsia refractaria, Burneo et al. tampoco encontraron diferencias clínicas entre los pacientes que tenían APF versus los que no la tenían8.
En relación con el compromiso de la corteza lateral, éste podría ser explicado por las redes neuronales que se forman entre la corteza y el hipocampo26,27. Moran et al.26 encontraron disminución en el volumen de la corteza lateral, predominando en el giro temporal superior pero, como se comentó previamente, este hallazgo no tuvo implicación clínica alguna.
En nuestra serie, a diferencia de la de otros autores, se observó que los pacientes con APH tenían una mayor frecuencia de CF. Los pacientes con el síndrome de ETM con EH tienen mayor incidencia de convulsiones febriles1,3. Si bien esta asociación ha sido bien documentada en estudios retrospectivos, no se ha podido establecer una relación fisiopatológica entre una y otra. Algunos autores proponen que la CF actuaría sobre un hipocampo previamente dañado y que, más tarde, se desarrollaría la EH28–31.
El análisis que podríamos realizar para explicar esta asociación entre CF, EH y APH sería que un enfermo con una alteración anatómica previa, tal vez determinada genéticamente (APH), tenga predisposición a desarrollar CF complicadas y llevar luego al desarrollo de ETM con EH. Fernández et al.32 han observado alteraciones anatómicas en el hipocampo de familias con convulsiones febriles que subsecuentemente desarrollaron EH, sustentando esta hipótesis. Esto podría modificar la aproximación terapéutica de los pacientes con CF prolongadas, enfocado más al uso de fármacos antiepilépticos pero con un fin más «neuroprotector»33,34.
Otra hipótesis a considerar es que la CF provocaría un daño focalizado específicamente en el hipocampo y giro parahipocámpico, con mayor frecuencia que en el resto de las áreas analizadas. En esta línea, Cendes et al.35 y Kuks et al.36 han demostrado un compromiso más severo de pérdida neuronal en los pacientes con CF y EH, pero no han analizado específicamente las alteraciones en el giro parahipocámpico.
En conclusión, nuestro trabajo concuerda con la mayoría de los autores en demostrar que en el síndrome de ETM-EH hay una extensión del daño que excede al hipocampo, lo que sería indicativo de compromiso de la red de interconexión más que de una lesión en una estructura anatómica en particular.
La presencia de un mayor número de enfermos con APH plantea un área de investigación interesante acerca de la fisiopatología de la EH en este grupo en particular.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.