Evaluar la utilidad de la escala DRAGON para estimar el riesgo de mortalidad temprana y de hemorragia intracraneana (HIC) sintomática en pacientes que reciben terapia trombolítica (TT) por vía intravenosa.
MétodosSe aplicó retrospectivamente la escala DRAGON a los pacientes con un evento cerebro vascular isquémico (ECVi) que recibieron TT en el Hospital Privado de Comunidad de Mar del Plata, entre diciembre del 2003 y mayo del 2012. La puntuación de la escala esta conformado por el signo de la arteria cerebral media hiperdensa (Dense) y signos tempranos de infarto en la tomografía inicial (ambos=2, uno solo=1, ninguno=0), puntuación> 1 en la ERm previo al ECV (prestroke modified Rankin Scale) (presente=1), edad (Age) (≥80=2, 79-65=1 y <65=0), glucemia al ingreso (Glucose level) (> 144mg/dl=1), tiempo desde el inicio síntomas al tratamiento (OTT) (>90 min=1) y puntuación NIHSS (>15=3, 10-15=2, 5-9=1, 0-4=0). Evaluamos el rendimiento de la escala con el área bajo la curva de las características operativas del receptor (ROC) y consideramos aceptable un valor >0,75.
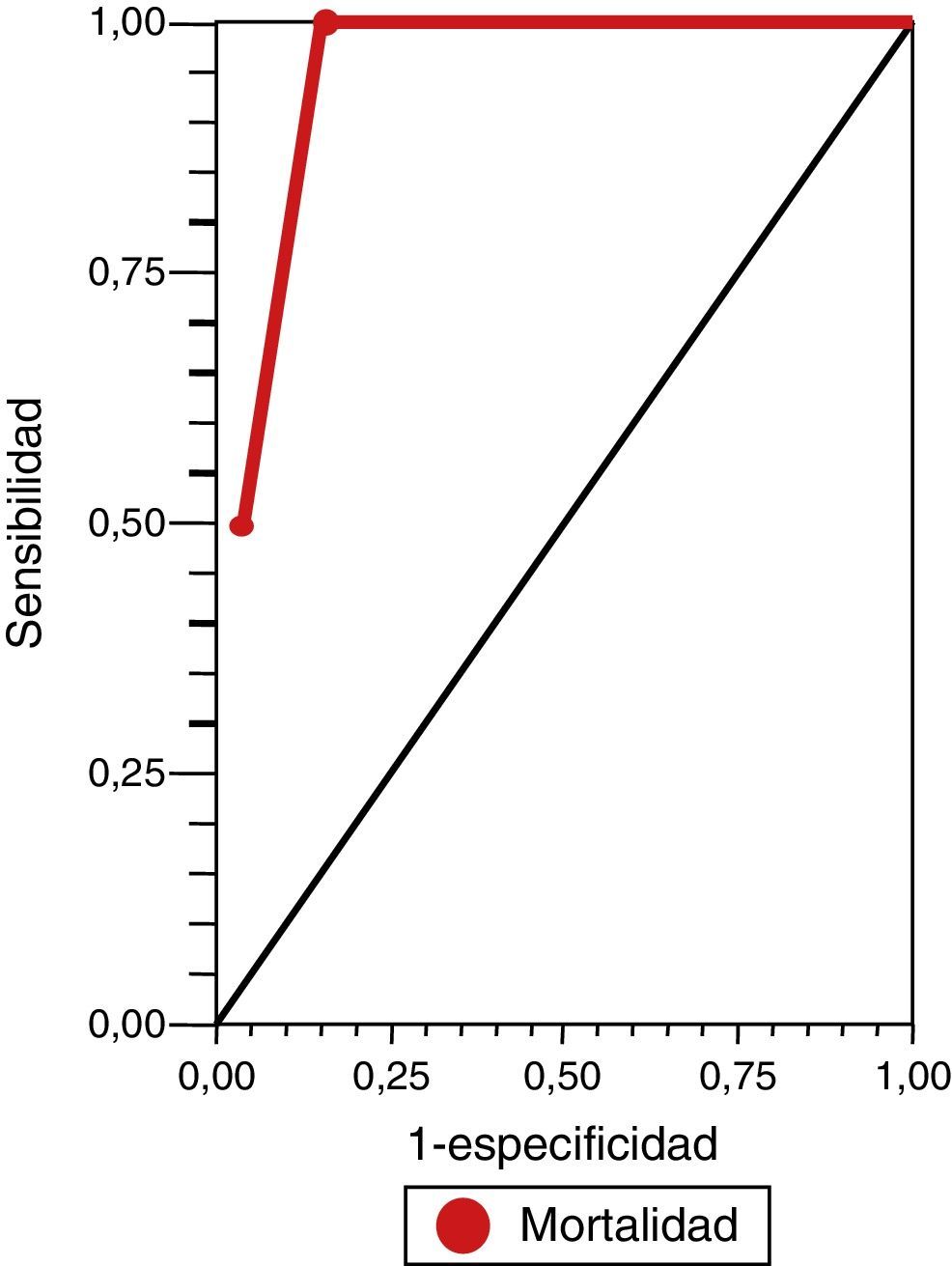
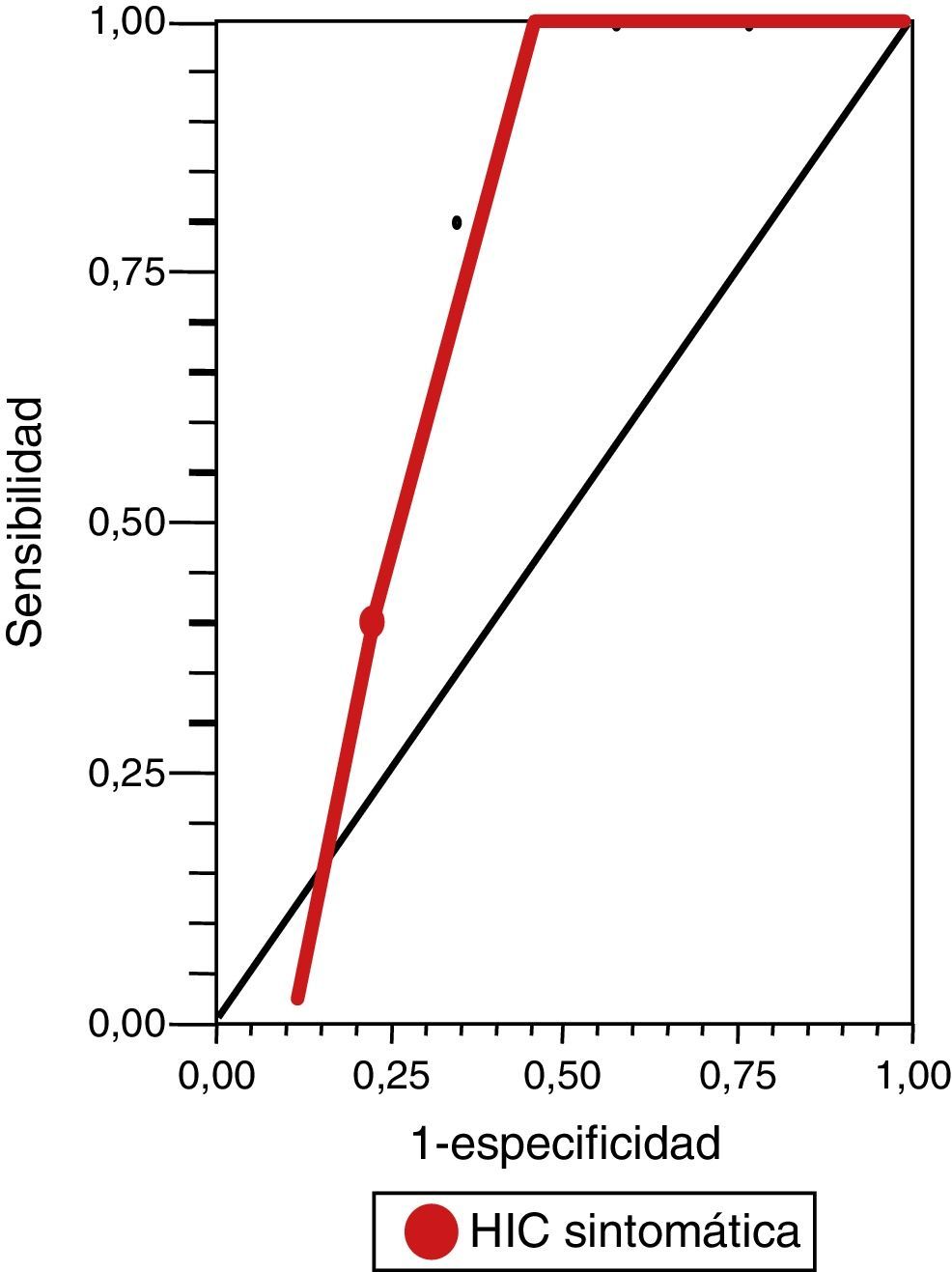
ResultadosSe aplicó la escala a 31 pacientes con ECVi que recibieron TT, mediana de edad 70 años (cuartiles: 76,2-59), sexo masculino 74,52%, mediana puntuación NIHSS al ingreso 12 (cuartiles: 17-8), mediana de OTT 170 min (cuartiles: 195-155), 6,45% con puntuación en la ERm > 1 al ingreso y una mediana en la puntuación DRAGON previo a la TT de 4 (cuartiles: 6-3). Se observó un rendimiento de la curva ROC con un corte ≥ 6 puntos en la escala DRAGON, de 0,94 (IC del 95%, 0,87-1) para la predicción de mortalidad temprana y 0,86 (IC del 95%, 0,73-0,94) con un corte ≥ 5 puntos, para la predicción de HIC sintomática.
ConclusiónEn nuestra población, observamos que la aplicación de escala DRAGON se asoció a la mortalidad temprana y el riesgo de HIC sintomática en los pacientes que recibieron TT. Esto sugiere que la escala sería de utilidad para identificar a los pacientes que tendrían un riesgo mayor y eventualmente desestimar la TT.
To evaluate the usefulness of the DRAGON scale to estimate the risk of early mortality and symptomatic ICH in patients receiving IVV thrombolytic therapy.
MethodsThe DRAGON scale was applied retrospectively to IV thrombolysis treated ischemic stroke patients, between December 2003 and May 2012 in the Hospital Privado de Comunidad of Mar del Plata. The score consists of the (hyper)Dense middle cerebral artery sign/early infarct signs on CT scan (both=2, one=1, no=0), prestroke modified Rankin Scale (mRS) score >1 (yes=1), Age (≥80 years=2, 79-65=1 and <65=0), Glucose level at baseline (>144mg/dl=1), Onset to treatment time (OTT) (>90minutes=1) and NIHSS score (>15=3, 10-15=2, 5-9=1, 0-4=0). Discrimination statistics area under the receiver operating characteristic curve (AUC-ROC) was use and we consider >0.75 as an acceptable value.
ResultsThe scale was applied to 31 thrombolysis treated ischemic stroke patients (median age 70 years (quartiles: 76.2-59), 74.52% male, median NIHSS score 12 (quartiles: 17-8), median OTT 170minutes (quartiles: 195-155), mRS score > 1 at baseline 6.45% and a median score in the DRAGON scale of 4 (quartiles: 6-3). The performance of the DRAGON score (cutoff value ≥6 points) for prediction of early mortality evaluated with AUC-ROC, was 0.94 (0.87-1) and for predicting the risk of symptomatic ICH (cutoff value ≥5 points) 0.86 (0.73-0.94).
ConclusionIn our study, we observed that the application of the DRAGON score was associated with early mortality and the risk of symptomatic ICH in thrombolysis treated stroke patients. This suggests that the scale would be useful to identify patients at increased risk and eventually reject the therapy.
El activador tisular del plasminógeno humano recombinante (rt-PA) es uno de los tratamientos más efectivos en los pacientes con un evento cerebrovascular isquémico (ECVi) agudo1. Luego de varios años, la terapia trombolítica (TT) por vía intravenosa continúa siendo el único tratamiento aprobado por la Agencia de Alimentos y Medicamentos en los Estados Unidos2 y por la Administración Nacional de Medicamentos, Alimentos y Tecnología Médica en la Argentina3, siendo el tratamiento recomendado por las guías de la práctica clínica más recientes, para su uso dentro de las primeras 3 y 4 h y media del evento4. Sin embargo, solamente entre el 15 y 5%6 de los pacientes con un ECVi reciben TT, debido a que solo una proporción pequeña de los pacientes accede en menos de 3 h de iniciados los síntomas a centros hospitalarios con experiencia y al riesgo potencial de presentar una hemorragia intracraneal (HIC) sintomática, la cual ensombrece el pronóstico de los pacientes que reciben rt-PA7. Por otra parte, no todos los pacientes presentan una respuesta favorable a la TT por vía intravenosa8,9, ya que en la mitad de los casos se logra una recanalización arterial completa y aproximadamente el 50% de los pacientes tendrá un pronóstico favorable medido con la escala de Rankin modificada (ERm) (puntuación ERm de 0 a 2) e independencia de las actividades de la vida diaria10.
Numerosos estudios analizaron diversos factores pronósticos en los pacientes con ECVi y factores predictores de respuesta a la TT. Entre ellos se evaluaron la edad, el sexo, el tiempo de iniciado los síntomas al ingreso, el tiempo desde el inicio de los síntomas hasta el tratamiento trombolítico, la glucemia al ingreso, la presión arterial media, la gravedad del ECV valorada con la escala de la National Institutes of Health (NIHSS), la presencia de síntomas de compromiso cortical y los hallazgos tempranos en la tomografía computarizada (TC)10-12.
En el año 2012 se publicaron diferentes escalas pronósticas de discapacidad a los 3 meses, en pacientes que recibieron TT10,12 y también escalas de riesgo de hemorragia intracraneana7. El objetivo de este trabajo fue evaluar la aplicación de la escala DRAGON publicada por Strbian et al.10, para valorar su utilidad en la predicción de mortalidad temprana y de riesgo de presentar una HIC sintomática en los pacientes atendidos en nuestro hospital que recibieron TT.
Materiales y métodosPoblación. El Hospital Privado de Comunidad de Mar del Plata atiende una población cautiva (cobertura médica completa y exclusiva) de aproximadamente 75.000 individuos, más pacientes con cobertura no capitada. Entre diciembre del 2003 y mayo del 2012 inclusive, se realizó TT por vía intravenosa (dosis 0,9mg/kg de peso corporal) a 33 pacientes atendidos en el Servicio de Neurología, con diagnóstico de ECVi, registrados consecutivamente en el Registro Cerebrovascular del Hospital Privado de Comunidad. Cada ECV fue evaluado y codificado en una planilla de registro según las definiciones y los criterios diagnósticos originales del manual del ReC-HPC (http//:www.hpc.org.ar/p_hospital.htm).
Se excluyó del análisis a 2 pacientes (un paciente con déficit focal no orgánico y otro con déficit focal de origen vasculítico). La escala NIHSS y la ERm fueron realizadas por residentes de neurología con entrenamiento en las mismas.
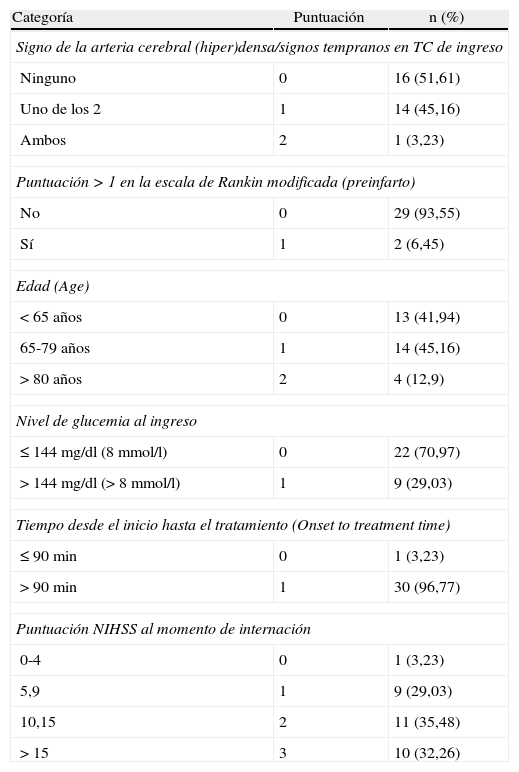
DRAGON. Es una escala que puntúa de 0 a 10 puntos (mayor puntuación equivale a peor pronóstico) diseñada para: a) la identificación temprana de pacientes con un ECVi y mayores probabilidades de obtener un resultado desfavorable (puntuación en la ERm de 3 a 6) a pesar de la TT, y b) para la estimación del pronóstico a los 3 meses (discapacidad medida con la ERm). La escala fue diseñada mediante el análisis de variables independientemente relacionadas con los desenlaces, de estudios realizados previamente9,13-16. Las variables que incluye la escala DRAGON son: el signo de la arteria cerebral media hiperdensa (Dense) y signos tempranos de isquemia en la TC de cerebro al momento de la internación (ambos presentes=2, uno solo=1, ninguno=0), puntuación mayor de 1 en la ERm previo al ECV (prestroke modified Rankin Scale) (presente = 1), edad (Age) (≥ 80=2, 79-65=1 y <65=0), niveles de glucemia en el momento del ingreso (Glucose level) (>144mg/dl=1), el tiempo desde el inicio de los síntomas hasta el tratamiento trombolítico (Onset time to treatment) (>90 min=1) y la puntuación NIHSS (>15=3, 10-15=2, 5-9=1, 0-4=0). Los signos tempranos de isquemia aguda en la TC se refieren a una hipodensidad que compromete más de un tercio del territorio de la arteria cerebral media, pérdida del contorno de los ganglios de la base, de la ínsula o el borramiento de los surcos.
Para evaluar la asociación con mortalidad y riesgo de HIC sintomática, utilizamos los valores de corte de la escala DRAGON con mayor significación estadística para cada uno de los desenlaces (6 puntos y 5 puntos, respectivamente).
Mortalidad temprana. Se refiere a aquellas muertes producidas dentro de los primeros 30 días del ECVi.
Hemorragia intracraneana sintomática. Se definieron como sintomáticas las hemorragias que producían un deterioro clínico con aumento de la puntuación NIHSS de 4 o más puntos.
Análisis estadísticos. Mediante una estadística de discriminación del área bajo la curva de las características operativas del receptor (ROC), se describió cuán bien concordaba el modelo DRAGON con los valores observados en nuestra población. Consideramos que un valor del área bajo la curva ROC > 0,75 constituía un valor aceptable. Se calcularon la sensibilidad, la especificidad, el valor predictivo positivo, el valor predictivo negativo y los índices de eficiencia pronóstica (likelihood ratio [LR]) para los valores de corte de escala. Se utilizó para el análisis el programa estadístico Statsdirect (versión 2.7.2).
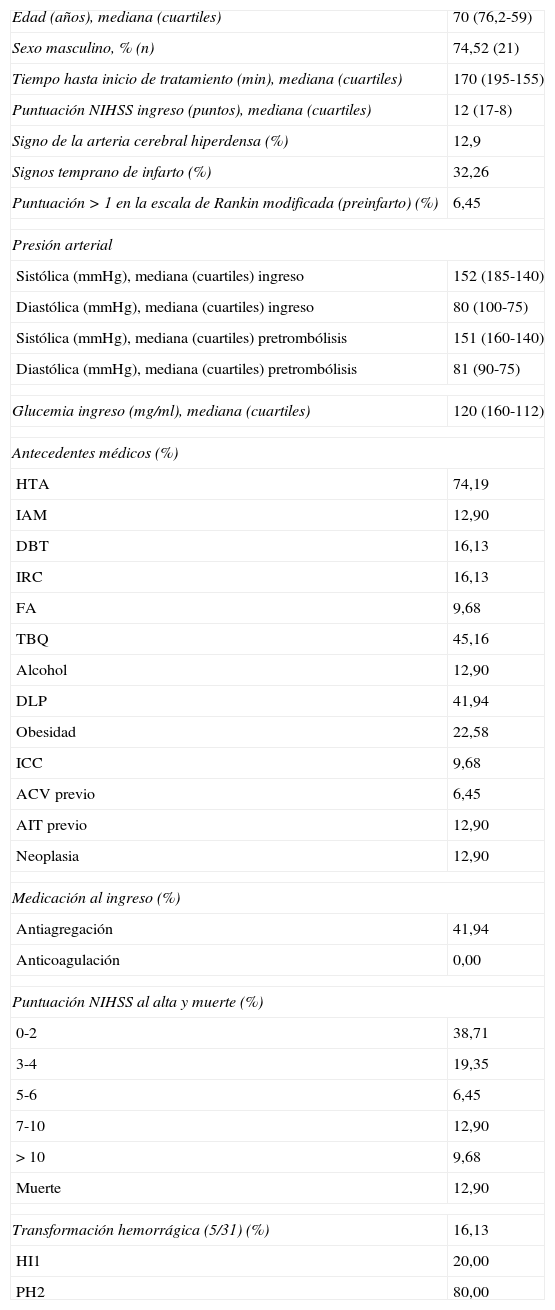
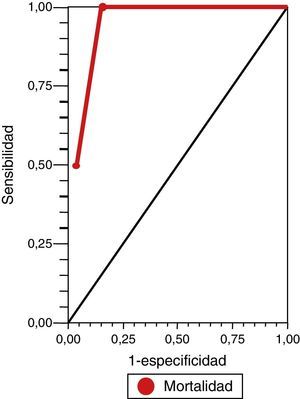
ResultadosSe incluyó en el estudio a 31 pacientes con ECVi que recibieron TT. Las características demográficas y basales de la población incluida en el análisis se presentan en la tabla 1. La mediana de edad fue de 70 años (cuartiles: 76,2-59) y el 74,52% eran hombres (n=21). La mediana de la puntuación NIHSS al ingreso fue de 12 (cuartiles: 8-17) y el porcentaje de pacientes con puntuación en la ERm mayor a 1 al ingreso fue del 6,45% (n=2). Posterior a la TT, se produjeron 4 muertes tempranas y 5 HIC (una asintomática y 4 sintomáticas). De todas las defunciones, 3 correspondían a pacientes que presentaron HIC sintomática. Se aplicó retrospectivamente la escala DRAGON con sus 6 variables para valorar su asociación a la mortalidad temprana y el riesgo de HIC sintomática postrombólisis en todos los pacientes (tabla 2). La mediana en la puntuación de la escala DRAGON previo al tratamiento fue de 4 (cuartiles: 6-3). Al realizar el análisis de la curva ROC, observamos un rendimiento de la escala DRAGON (con un valor de corte mayor o igual a 6 puntos) para evaluar la asociación a la mortalidad temprana de 0,94 (IC del 95%, 0,87-1) (fig. 1), con una sensibilidad del 100% (IC del 95%, 40-100), una especificidad del 85% (IC del 95%, 66,3-96), un valor predictivo positivo del 50% (IC del 95%, 16-84,3), un valor predictivo negativo del 100% (IC del 95%, 85,2-100), un índice de eficiencia pronóstica positivo (LR+) de 6,75 (IC del 95% 2,11-15,5) y un índice de eficiencia pronóstica negativo (LR–) de * (IC del 95%, 0-0,6) (tabla 3). No observamos cambios en la asociación hallada al excluir el único paciente con ECVi de territorio posterior que recibió TT (curva ROC 0,94 [IC del 95%, 0,86-1]).
Características demográficas en situación inicial y resultados al alta
| Edad (años), mediana (cuartiles) | 70 (76,2-59) |
| Sexo masculino, % (n) | 74,52 (21) |
| Tiempo hasta inicio de tratamiento (min), mediana (cuartiles) | 170 (195-155) |
| Puntuación NIHSS ingreso (puntos), mediana (cuartiles) | 12 (17-8) |
| Signo de la arteria cerebral hiperdensa (%) | 12,9 |
| Signos temprano de infarto (%) | 32,26 |
| Puntuación>1 en la escala de Rankin modificada (preinfarto) (%) | 6,45 |
| Presión arterial | |
| Sistólica (mmHg), mediana (cuartiles) ingreso | 152 (185-140) |
| Diastólica (mmHg), mediana (cuartiles) ingreso | 80 (100-75) |
| Sistólica (mmHg), mediana (cuartiles) pretrombólisis | 151 (160-140) |
| Diastólica (mmHg), mediana (cuartiles) pretrombólisis | 81 (90-75) |
| Glucemia ingreso (mg/ml), mediana (cuartiles) | 120 (160-112) |
| Antecedentes médicos (%) | |
| HTA | 74,19 |
| IAM | 12,90 |
| DBT | 16,13 |
| IRC | 16,13 |
| FA | 9,68 |
| TBQ | 45,16 |
| Alcohol | 12,90 |
| DLP | 41,94 |
| Obesidad | 22,58 |
| ICC | 9,68 |
| ACV previo | 6,45 |
| AIT previo | 12,90 |
| Neoplasia | 12,90 |
| Medicación al ingreso (%) | |
| Antiagregación | 41,94 |
| Anticoagulación | 0,00 |
| Puntuación NIHSS al alta y muerte (%) | |
| 0-2 | 38,71 |
| 3-4 | 19,35 |
| 5-6 | 6,45 |
| 7-10 | 12,90 |
| > 10 | 9,68 |
| Muerte | 12,90 |
| Transformación hemorrágica (5/31) (%) | 16,13 |
| HI1 | 20,00 |
| PH2 | 80,00 |
ACV: accidente cerebrovascular; AIT: accidente isquémico transitorio; DBT: diabetes mellitus; DLP: dislipidemia; FA: fibrilación auricular; HTA: hipertensión arterial; HI: infarto hemorrágico (tipo 1: pequeñas petequias); IAM: infarto agudo de miocardio; ICC: insuficiencia cardíaca congestiva; IRC: insuficiencia renal crónica; NIHSS: puntuación de la Escala de Accidente Cerebrovascular de los Institutos Nacionales de la Salud; PH: hematoma parenquimatoso (tipo 2: > 30% con efecto de masa evidente); TBQ: tabaquismo.
Puntuación escala DRAGON (0-10 puntos) para el pronóstico del resultado en pacientes que presentaron un ECVi y que recibieron terapia trombolítica por vía intravenosa
| Categoría | Puntuación | n (%) |
| Signo de la arteria cerebral (hiper)densa/signos tempranos en TC de ingreso | ||
| Ninguno | 0 | 16 (51,61) |
| Uno de los 2 | 1 | 14 (45,16) |
| Ambos | 2 | 1 (3,23) |
| Puntuación > 1 en la escala de Rankin modificada (preinfarto) | ||
| No | 0 | 29 (93,55) |
| Sí | 1 | 2 (6,45) |
| Edad (Age) | ||
| <65 años | 0 | 13 (41,94) |
| 65-79 años | 1 | 14 (45,16) |
| >80 años | 2 | 4 (12,9) |
| Nivel de glucemia al ingreso | ||
| ≤144 mg/dl (8 mmol/l) | 0 | 22 (70,97) |
| >144 mg/dl (> 8 mmol/l) | 1 | 9 (29,03) |
| Tiempo desde el inicio hasta el tratamiento (Onset to treatment time) | ||
| ≤90 min | 0 | 1 (3,23) |
| >90 min | 1 | 30 (96,77) |
| Puntuación NIHSS al momento de internación | ||
| 0-4 | 0 | 1 (3,23) |
| 5,9 | 1 | 9 (29,03) |
| 10,15 | 2 | 11 (35,48) |
| >15 | 3 | 10 (32,26) |
NIHSS: puntuación de la Escala de Accidente Cerebrovascular de los Institutos Nacionales de la Salud; TC: tomografía computarizada.
Escala DRAGON para predicción de mortalidad temprana y hemorragia intracraneana sintomática
| Aplicación | VE | S (%) | E (%) | VPP (%) | VPN (%) | LR + (%) | LR - (%) | Curva ROC (%) |
| Mortalidad | ≥6 | 100 (40-100) | 85 (66,3-96) | 50 (16-84,3) | 100 (85,2-100) | 6,75 (2,11-15,5) | * (0–0,60) | 94 (87-100) |
| HIC | ≥5 | 100 (40-100) | 67 (46-83,5) | 31 (9,1-64) | 100 (81,5-100) | 3 (1,14-5) | * (0–0,76) | 86 (73- 94) |
Curva ROC: curva característica operativa del receptor E; especificidad; LR: índice de eficiencia pronóstica (likelihood ratio); S: sensibilidad; VE: valor escala; VPN: valor predictivo negativo; VPP: valor predictivo positivo.
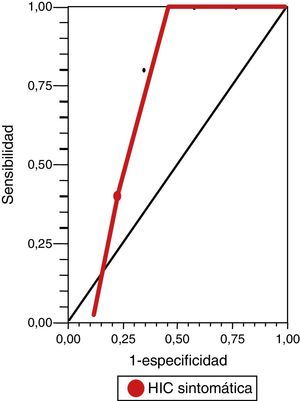
Mientras que para la evaluación de riesgo de HIC sintomática, observamos un rendimiento de la escala DRAGON (con un valor de corte mayor o igual a 5 puntos) en la curva ROC de 0,86 (IC del 95%, 0,73-0,94) (fig. 2), con una sensibilidad del 100% (IC del 95%, 40-100), una especificidad del 67% (IC del 95%, 46-83,5), un valor predictivo positivo del 31% (IC del 95%, 9,1-64), un valor predictivo negativo del 100% (IC del 95%, 81,5-100), un índice de eficiencia pronóstica positivo (LR+) de 3 (IC del 95%, 1,14-5) y un índice de eficiencia pronóstica negativo (LR–) de * (IC del 95%, 0-0,76) (tabla 3).
DiscusiónEn febrero del año 2012, Strbian et al.10 publicaron la escala DRAGON compuesta por 6 variables mencionadas anteriormente y diseñada para la identificación temprana de pacientes con un ECVi y mayores probabilidades de obtener un resultado desfavorable a pesar de recibir TT y para la evaluación de discapacidad a los 3 meses del evento (evaluada con la ERm). En una cohorte de derivación de 1.319 pacientes y en una cohorte de validación externa de 333 pacientes, se aplicó la escala con una curva ROC de 0,84 (IC del 95%, 0,80-0,87) y 0,80 (IC del 95%, 0,74-0,86), respectivamente. En nuestro trabajo realizamos un análisis previo, en el cual evaluamos la aplicabilidad de la escala DRAGON mediante la discriminación del área bajo la curva ROC, en los pacientes que recibieron TT en el Hospital Privado de Comunidad de Mar del Plata, para la evaluación del desenlace de funcionalidad (medido con la ERm) a los 3 meses, pero la misma no se comportó de manera similar que en el trabajo original de Strbian et al. Posteriormente, utilizamos la escala con las mismas variables, para valorar su asociación con la mortalidad temprana y el riesgo de HIC sintomática, con hallazgos estadísticamente relevantes para el pronóstico de estos importantes desenlaces postrombólisis. Consideramos que si bien la escala DRAGON fue diseñada originalmente para la identificación inicial de pacientes con ECVi con probabilidades elevadas de obtener un resultado desfavorable y para la evaluación del pronóstico a los 3 meses, todas las variables incluidas (excepto la puntuación >1 en la ERm previo a la TT) son también incluidas en numerosos estudios como variables predictivas de desenlaces desfavorables severos, como la mortalidad o el riesgo de HIC. La exclusión de la variable de la ERm no modificó los resultados, ya que solo 2 pacientes tenían una puntuación mayor a 1. Por otra parte, la aplicación de esta escala en nuestra población para la estimación del riesgo de HIC resultó ser de mayor utilidad en comparación con la aplicación de la escala SEDAN7 (curva ROC 0,80 [IC del 95%, 0,61-0,97] y 0,72 [IC del 95%, 0,56-0,89] para DRAGON y SEDAN, respectivamente)). Sin embargo, creemos que nuestro trabajo tiene limitaciones debido al número bajo de pacientes incluidos en el análisis, con IC amplios en los resultados analizados. Por otra parte, solo uno de los pacientes recibió la TT antes de los 90 min de iniciados los síntomas, por lo que esta variable no puede ser analizada realmente en nuestra población. Se deberán realizar estudios con un número mayor de pacientes, variables en nuestra población relacionadas independientemente con los desenlaces y eventualmente, desarrollar una escala propia para determinar los factores pronósticos útiles en la identificación temprana de pacientes con ECVi y probabilidades elevadas de obtener un resultado negativo con la TT, predicción de discapacidad a los 3 meses, riesgo de HIC sintomática y mortalidad postrombólisis.
En el año 2013, Strbian et al.17 publicaron una validación externa de la escala DRAGON en 12 centros de ataque cerebral de Europa y Australia, que incluyó a 4.519 pacientes con ECVi agudo de territorios de circulación anterior y posterior con resultados similares a los del estudio original (curva ROC 0,82 [IC del 95%, 0,80-0,83]). En el mismo trabajo, obtuvieron un rendimiento de la escala aceptable para predicción de un pronóstico desfavorable (ERm 5 y 6) a los 3 meses con un valor de la curva ROC de 0,84 (IC del 95%, 0,82-0,85), un índice de eficiencia pronóstica positivo (LR+) de 45,4 (IC del 95%, 13,9-147,6), un índice de eficiencia pronóstica negativo (LR-) 1,0 (IC del 95%, 0,9-1,0), un valor predictivo positivo del 91,7% (IC del 95%, 13,9-147,6) y una sensibilidad del 99,9% (IC del 95%, 99,8-100%).
En conclusión, en nuestra población observamos que la aplicación de la escala DRAGON se asocia a los desenlaces desfavorables tempranos de mortalidad y riesgo de HIC sintomática luego de la TT. Los resultados de nuestro trabajo indican que la escala sería de utilidad para los neurólogos y médicos de urgencias, que deben decidir sobre qué pacientes tendrían un riesgo mayor y, eventualmente, desestimar la TT con elevada sensibilidad y valor predictivo negativo, moderada especificidad y un pobre valor predictivo positivo, siendo «seguro» administrar TT a los pacientes con valores en la escala menores de 6 y de 5 (para evaluación de los desenlaces de mortalidad y HIC sintomática, respectivamente). Se requieren estudios prospectivos con un número mayor de pacientes para la confirmación de estos hallazgos.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
El trabajo fue presentado en el XLIX Congreso Argentino de Neurología 2012.