Estudios previos demostraron que la atrofia cerebral (AC) aparece precozmente en la esclerosis múltiple. Es nuestro objetivo evaluar la AC en pacientes con síndrome desmielinizante aislado (SDA) respecto a un grupo control en una población argentina.
MétodosSe incluyeron prospectivamente pacientes con SDA durante el periodo comprendido entre junio de 2008 a junio de 2009. El grupo control fueron sujetos sanos apareados por edad y sexo. Se utilizó el programa SIENAX para medir el volumen cerebral total (VCT), volumen de sustancia gris (VSG) y de sustancia blanca (VSB) en cada grupo. Los datos fueron comparados con la prueba de Mann-Whitney (p estadísticamente significativa < 0,05).
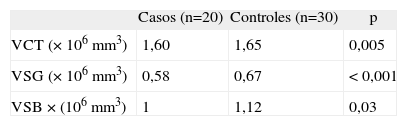
ResultadosSe incluyeron 20 pacientes con SDA y 30 controles sanos (8 frente a 17 mujeres; p = 0,11). La edad media en SDA fue de 35 ± 6 años frente a 34,4 ± 5 en controles (p = 0,61). El EDSS de los pacientes con SDA fue de 1,1 ± 0,5. Dieciocho pacientes (90%) con SDA tenían lesiones en la resonancia magnética nuclear cerebral. El VCT en SDA fue de 1,60 mm3 × 106 frente a 1,65 × 106 en controles (p = 0,005), el VSG en SDA fue de 0,58 × 106 frente a 0,67 × 106 en controles (p = < 0,001) y el VSB en SDA fue de 1 × 106 frente a 1,12 × 106 en controles (p = 0,03).
ConclusionesEste es el primer estudio en una población latinoamericana con SDA que demostró atrofia cerebral, con predomino de la sustancia gris, respecto a un grupo control. Esta herramienta es coste-efectiva para la medición de la AC, aspecto poco estudiado en nuestro medio.
Previous reports have shown that brain atrophy appears early in the course of multiple sclerosis (MS). The aim of the present study was to evaluate whether in clinically isolated syndrome (CIS) brain atrophy already exists regarding a control sample.
MethodsPatients with CIS were included prospectively during June 2008 to June 2009. A control group with healthy person and matched by age and gender with CIS was also included during the same period of time. An automated analysis tool, SIENAX, was used to obtain total brain volume (TBV), gray matter volume (GMV) and white matter volume (WMV). Mann-Whitney U test was used to analyze the data.
Results20 CIS patients and 30 healthy controls were included (8 vs. 17 females, p = 0.11). Mean age for CIS was 35 ± 6 years vs. 34.4 ± 5 in controls (p = 0.61). Mean EDSS in CIS was 1.1 ± 0.5. Eighteen patients with CIS (90%) had abnormal baseline MRI. The TBV in CIS was 1.60 mm3 × 106 vs 1.65 × 106 in controls (p = 0.005), the GMV in CIS was 0.58 × 106 vs. 0.67 × 106 in controls (p = <0.001) and the WMV in CIS was 1 × 106 vs. 1.12 × 106 in controls (p = 0.03).
ConclusionsThis is the first study dealing with brain atrophy in a CIS simple from Latin America in which brain atrophy, mainly grey matter atrophy, was showed in early stages of the disease compared with healthy individuals.
La esclerosis múltiple (EM) se caracteriza por episodios recurrentes de disfunción neurológica en el 80% de los pacientes. La mayoría de los pacientes se presentan inicialmente con un síndrome desmielinizante aislado (SDA), caracterizado por un evento neurológico bien definido que dura más de 24 horas y que compromete la sustancia blanca cerebral, el tronco cerebral, la médula espinal, el cerebelo y los nervios ópticos entre otros, habiéndose descartado otras patologías1.
Clásicamente la EM ha sido descrita como una enfermedad exclusiva de la sustancia blanca2. Sin embargo, recientes investigaciones han demostrado que junto con el daño de la mielina existe también un importante daño neuro-axonal en la sustancia gris cerebral3–5. Esto se ha demostrado mediante técnicas avanzadas de imágenes cerebrales (resonancia magnética nuclear [RMN]) y posteriormente se ha confirmado a través de estudios histopatológicos, dando origen estos trabajos a los pilares de la hipótesis neurodegenerativa como factor determinante de la progresión de la enfermedad y la discapacidad en pacientes afectados6–10.
Si bien en la EM existen evidencias claras de la pérdida neuro-axonal temprana y consecuente atrofia, esto ha sido escasamente evaluado en pacientes después del SDA11.
Considerando lo previo, el objetivo del presente trabajo fue evaluar la atrofia cerebral (AC) en pacientes con SDA comparada con un grupo control de individuos sanos.
MétodosCasosSe incluyeron de manera prospectiva pacientes con SDA evaluados en la Sección de Enfermedades Desmielinizantes del Hospital Italiano de Buenos Aires durante el periodo comprendido entre junio de 2008 a junio de 2009. Los criterios de inclusión fueron la presencia de un síndrome clínico sugestivo de desmielinización del SNC comprometiendo nervios ópticos, tronco cerebral, médula espinal u otras regiones, no atribuible a otras enfermedades. Aquellos pacientes que en el interrogatorio reportaron historia previa de un trastorno neurológico focal que hubiese durado más de 24 horas fueron excluidos. La evaluación clínica inicial fue realizada en todos los casos por un neurólogo con amplia experiencia en el manejo de enfermedades desmielinizantes, considerando aspectos clínicos, demográficos y estudios complementarios. A todos los pacientes se les realizó una RMN de cerebro y columna cervical entre el mes y medio y el tercer mes del evento. La misma se efectuó con resonador Siemens 1.5 Tesla con técnicas de adquisición estandarizadas de imágenes para pacientes con enfermedades desmielinizantes (densidad protónica, T2 convencional, FLAIR, T1 sin y con contraste endovenoso). La RMN fue evaluada por neurorradiólogos ciegos al objetivo del estudio. Se excluyeron pacientes que habían recibido glucocorticoides dentro del mes anterior a la realización de la RMN.
ControlesEl grupo control lo formaron personas sanas apareadas por edad y sexo con los casos de SDA sin historia previa de trastorno neurológico orgánico y/o funcional. El protocolo de RMN para los controles fue el mismo que para los casos.
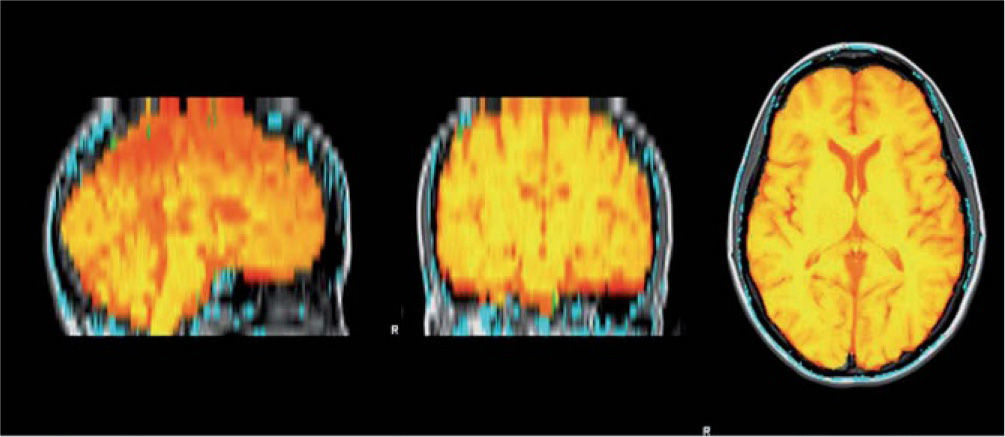
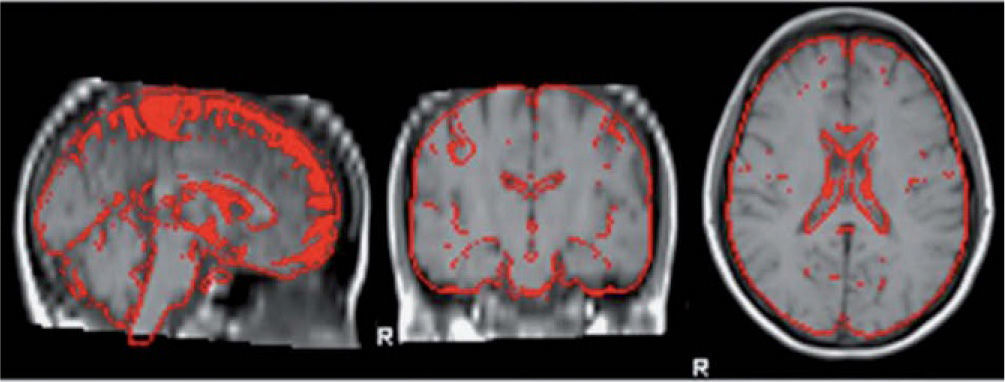
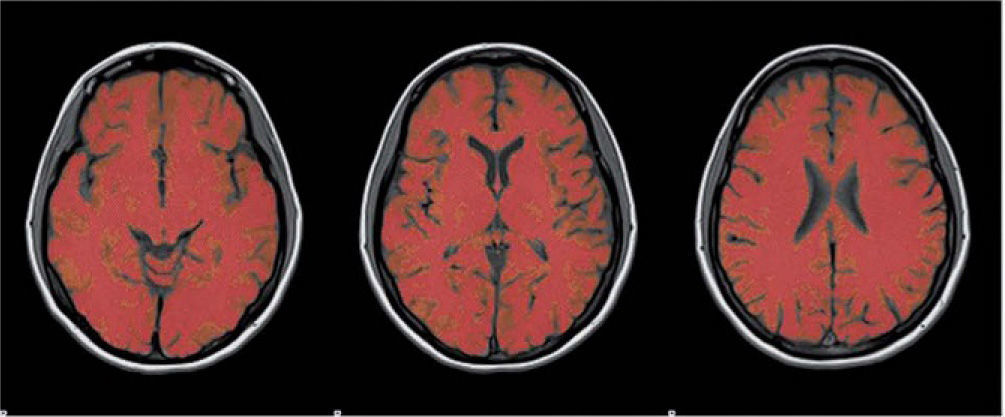
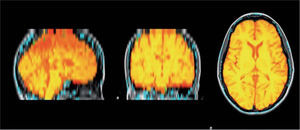
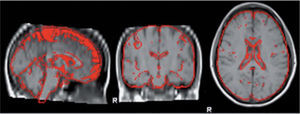
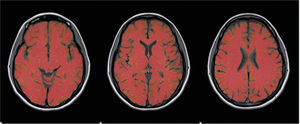
Medición del volumen cerebralUtilizando las secuencias T1 de la RMN se realizaron las mediciones de los volúmenes cerebrales (volumen cerebral total [VCT], volumen de sustancia gris neocortical [VSG] y el volumen de sustancia blanca [VSB]) aplicando el método y el software automatizado de medición de atrofia cerebral SIENAX12. Para realizar la medición SIENAX utiliza la herramienta BET (brain extraction tool), parte de los software de la librería FSL-FMRIB'S para extraer el cerebro y el cráneo de las imágenes de RMN (fig. 1). Una vez extraído, un programa de segmentación tisular (FAST, otro software parte de la librería FSL)13 posteriormente segmenta la imagen obtenida en sustancia gris neocortical, sustancia blanca y líquido cefalorraquídeo, estimado así una vez segmentado el VCT, el VSG y el VSB. De esa manera, SIENAX es capaz de obtener volúmenes cerebrales precisos y automatizadamente (fig. 2). Ese volumen cerebral una vez obtenido es luego multiplicado por un factor de normalización preestablecido, y ya incorporado al software que determina los volúmenes cerebrales finales normalizados para el paciente (fig. 3).
El estudio fue aprobado por el comité de ética de protocolos de investigación del Hospital Italiano de Buenos Aires, y todos los casos y controles dieron su consentimiento informado previo al ingreso en el estudio.
Análisis estadísticoLas características basales de la cohorte evaluada fueron reportadas en porcentajes para los datos categóricos y en media con su desviación estándar (DE) para los datos continuos. Los datos fueron comparados mediante el test exacto de Fisher y U de Mann–Whitney para datos categóricos y continuos respectivamente. Valores de p < 0,05 fueron considerados significativos. La recolección y el análisis de los datos se realizaron con el programa Stata 9.1.
ResultadosSe incluyeron en el estudio 20 pacientes con SDA y 30 controles sanos (razón 1:1,5). La edad media de los casos de SDA fue de 35 ± 6 años, mientras en los controles fue de 34,4 ± 5 años (p = 0,11). El 41% (8) de los SDA fueron mujeres frente al 58% (17) en el grupo control (p = 0,61). La presentación clínica de los SDA fue la siguiente: 8 (40%) neuritis óptica, 6 (30%) afectación de parénquima cerebral, 4 (20%) tronco cerebral y 2 (10%) médula cervical. El EDSS de los pacientes con SDA en el momento de realizar la RMN fue de 1,1 ± 0,5. En la RMN el 90% (18) de los pacientes con SDA tenía lesiones desmielinizantes en el cerebro y/o médula cervical. De los 18 pacientes con RMN y lesiones 11 (61%) tenía dos criterios de Barkhof (CB)2, 6 (33%) pacientes cumplían 3 CB y sólo un (6%) sujeto tenía 4 CB. Respecto a los datos volumétricos, el VCT en pacientes con SDA fue de 1,60 mm3 × 106 frente a 1,65 × 106 en controles (p = 0,005), el VSG en SDA fue de 0,58 × 106 frente a 0,67 × 106 en controles (p = < 0,001) y el VSB en SDA fue de 1 × 106 frente a 1,12 × 106 en controles (p= 0,03) (tabla 1).
DiscusiónEl presente trabajo muestra la presencia de AC en una población de pacientes con SDA, predominantemente de la sustancia gris, comparados con controles sanos.
Si bien existen diversos reportes en la literatura describiendo el fenómeno de AC temprana en pacientes con EM5,14–16, son escasos a día de hoy los trabajos que evalúan el fenómeno de atrofia en el momento del SDA.
Se desconocen con exactitud el mecanismo y la causa de esta atrofia global y principalmente neocortical. Se sabe que la inflamación de la sustancia blanca, por transección axonal, lleva a la pérdida neuronal y consecuente atrofia cortical5. Sin embargo, es difícil sostener este mecanismo como el responsable de la atrofia ante la presencia de escasa o eventualmente nula inflamación y/o desmielinización de la sustancia blanca subyacente14.
Basados en investigaciones previas y según nuestra observación, parece haber dos mecanismos responsables de la atrofia, el previamente descrito secundario a daño desmielinizante y transección axonal5 y, por otro lado, un proceso independiente de los cambios observables en la sustancia blanca y la desmielinización, que explica el por qué de la atrofia en presencia de escasa o nula inflamación14,16,17. Aún quedaría por elucidar los mecanismos moleculares de este proceso neurodegenerativo, aunque un proceso apoptótico inducido por un mecanismo inflamatorio podría tener un rol primordial en ello.
En conclusión, este es el primer trabajo en una población latinoamericana que explora la presencia de atrofia en pacientes con SDA. La atrofia precoz identificada en esta población respecto al grupo control se da principalmente en la sustancia gris con poca actividad inflamatoria desmielinizante sobre la sustancia blanca, haciendo suponer que un mecanismo independiente al de la neurodegeneración por transección axonal actuaría desde los momentos iniciales en la enfermedad, aún mucho más precoces al del inicio clínico, dañando progresivamente el parénquima cerebral. Futuras investigaciones ayudarán a aclarar los mecanismos moleculares que intervendrían en este proceso y el valor pronóstico del hallazgo.
Se deja constancia de que el trabajo no ha sido presentado en la SEN, sólo en el Congreso Argentino de Neurología de Mar del Plata de 2009; no ha recibido financiación alguna.