La esclerosis múltiple (EM) es una enfermedad crónica del SNC con un curso evolutivo impredecible al inicio. Esta impredecibilidad lleva a no poder ajustar e individualizar el tratamiento y los cuidados en cada paciente desde el inicio de la enfermedad. El objetivo del presente trabajo es investigar si la atrofia cerebral medida al año del inicio de la EM es un marcador pronóstico de progresión de la discapacidad a largo plazo.
MétodosSe analizaron prospectivamente pacientes con inicio y diagnóstico reciente de EM con brotes y remisiones (menos de 15 meses de la aparición del primer signo/síntoma). Se analizaron las resonancias magnéticas (RM) realizadas al inicio y al año del mismo para medir la tasa de atrofia cerebral usando el software SIENA. Se midió la progresión de la discapacidad mediante EDSS (expanded disability status scale). Mediante regresión se evaluó la asociación entre las variables clínicas y la tasa de atrofia con la progresión de la discapacidad.
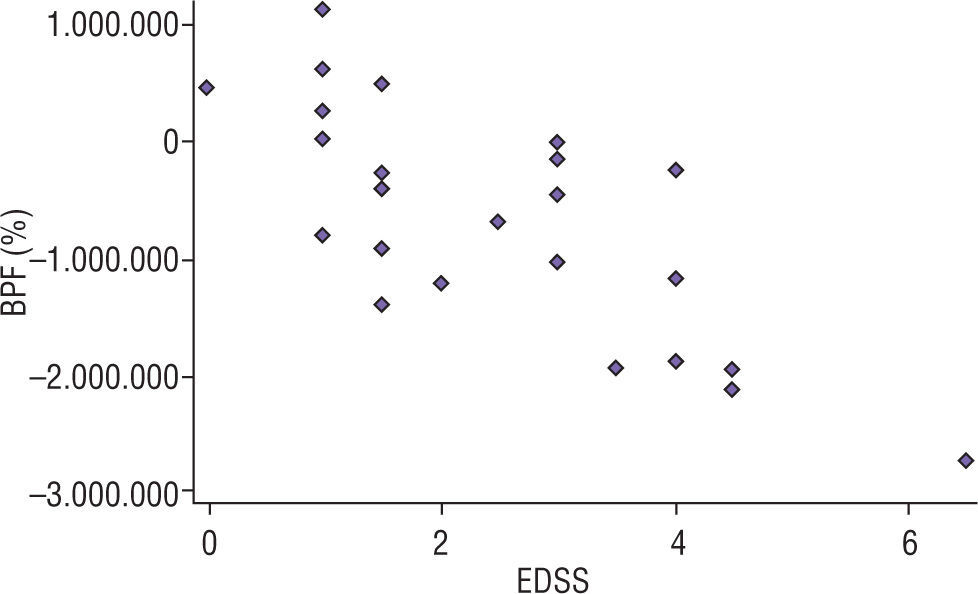
ResultadosSe incluyeron 26 pacientes, con edad de inicio de 32,8±9 años y tiempo medio de seguimiento de 9,3±5 años. El tiempo medio entre la primera y la segunda RM fue de 13±1,5 meses. Durante el seguimiento, 11 (42,1%) pacientes alcanzaron un EDSS mayor o igual a 4. El análisis mostró que la tasa de atrofia cerebral al año de inicio de la enfermedad fue el único predictor de mayor EDSS (p<0,001), ajustado por: edad al inicio, sexo, presencia de bandas oligoclonales (BO) en LCR y tratamiento inmunomodulador. La tasa de atrofia al año en los pacientes que alcanzaron un EDSS ≥4 fue de −1,12% vs. −0,28 (p=0,003) en los pacientes que no lo alcanzaron. La atrofia mayor del −0,8% se asoció a mayor discapacidad a mediano plazo (OR 4,2; IC 95%, 2,2-6,5; p=0,008).
DiscusiónLa tasa de atrofia cerebral al año de iniciada la enfermedad fue un predictor de discapacidad a medio plazo en la muestra evaluada.
Brain atrophy suggests neuroaxonal loss in multiple sclerosis (MS) with the potential to reflect disease progression to a greater extent than lesion measures. The objective of the study was to investigate whether brain atrophy during the first year of disease onset in patients with RRMS, independently predict clinical outcome (development disability during the long term follow up).
MethodsWe prospectively included RRMS patients with recently onset of the disease (less than 15 months from the appearance of the first symptom). MRI performed at the onset and after 12 months of the onset of the disease was used to measure the percentage brain atrophy rate between baseline and follow-up scans by means of SIENA software. Progression of the disease was measure with EDSS score. Cox regression test was used to analyze clinical variables and disease progression.
ResultsTwenty six patients were included, mean age at onset 32.8±9 years, time to follow up 9.3±5 years. Mean time between first and second MRI scan 13±1.5 months. 42.1% of patients reached an EDSS of or higher than 4. Adjusting by age at onset, gender, oligoclonal band son CSF, lesion load on T2 and immunomodulatory treatment, the higher brain atrophy during the first year of disease onset was significantly related to disease progression during the follow up (p<0.001). Brain atrophy rates in patients that reach EDSS ≥4 was −1.12% vs. −0.28 (p=0.003) in patients that do not reach EDDS ≥4. Brain atrophy rates higher tan −0.8% was significantly associated with a higher disability on median time (OR 4.2; CI 95%; 2.2-6.5; p=0.008).
DiscussionBrain atrophy rates over 1 year of disease onset was a predictive variable of disease progression in this population.
La esclerosis múltiple (EM) es una enfermedad crónica del SNC caracterizada patológicamente por la presencia de lesiones inflamatorias múltiples que progresan en el tiempo generando en la mayoría de los pacientes afectados una discapacidad significativa a los 20–30 años tras el inicio de la misma1–3. En un grupo de pacientes el curso suele ser particularmente agresivo y conlleva una marcada discapacidad física y cognitiva en un período corto de tiempo4. Por otra parte, la enfermedad puede tener una evolución mínimamente discapacitante tras 15 a 20 años de iniciada5. Resulta muy difícil en los estadios iniciales de la enfermedad poder predecir a qué grupo pertenecerá cada paciente6 y, por lo tanto, individualizar los cuidados y especialmente el tratamiento4,7.
La resonancia magnética (RM) ha emergido como una herramienta de suma utilidad en el diagnóstico y el seguimiento de los pacientes con EM8. También ha demostrado tener un valor pronóstico muy importante en pacientes con un primer evento desmielinizante, permitiendo identificar subgrupos con alto riesgo de conversión a EM9,10. Sin embargo, su valor pronóstico sobre la discapacidad, utilizando técnicas convencionales8, al inicio de la enfermedad no ha sido claramente demostrado. La aparición de nuevas técnicas de RM permitiría predecir precozmente la evolución8. Estas técnicas incluyen la medición longitudinal de la atrofia cerebral mediante el uso del software SIENA (Structural Image Evaluation using Normalisation of Atrophy), la evaluación del daño de la sustancia blanca con el software TBSS (Tracted Based Spatial Statistics), la medición de la atrofia cortical y subcortical localizada con técnicas de voxel based morphometry y otras más recientemente incorporadas8.
Considerando lo precedente y la importancia de poder predecir el curso de la enfermedad al inicio de la misma, diseñamos el presente estudio con el objetivo de establecer si la atrofia cerebral medida al año del inicio de la EM es un marcador pronóstico de progresión de la discapacidad.
MétodosPacientesSe incluyeron prospectivamente en el estudio pacientes con EM en forma de brotes y remisiones (EMRR) con inicio y diagnóstico reciente (menos de 15 meses de la aparición del primer signo/síntoma de la enfermedad)11,12. Los pacientes fueron reclutados de la sección de Neuroinmunología y Enfermedades Desmielinizantes del Servicio de Neurología del Hospital Italiano de Buenos Aires durante el período de enero de 2002 a enero de 2004. El diagnóstico de EMRR se confirmó según criterios de McDonald13. El comienzo de la enfermedad fue definido como la aparición del primer signo/síntoma sugestivo de desmielinización del SNC comprometiendo nervios ópticos, tronco cerebral, médula espinal u otras regiones, y no atribuible a otras enfermedades6. La evaluación clínica inicial fue realizada en todos los casos por un neurólogo con amplia experiencia en el manejo de enfermedades desmielinizantes considerando aspectos demográficos, clínicos y estudios complementarios. A todos los pacientes se les realizó una RM de cerebro y columna cervical dentro de los primeros 60 días del evento, que se efectuó con resonador Siemmens 1.5 Tesla con técnicas de adquisición estandarizadas de imágenes para pacientes con enfermedades desmielinizantes (densidad protónica, T2 convencional, FLAIR, T1 sin y con contraste intravenoso). La RM fue evaluada por neurorradiólogos ciegos al objetivo del estudio. Se excluyeron pacientes que habían recibido glucocorticoides dentro del mes previo a la realización de la RM. Se analizó la presencia de bandas oligoclonales en el líquido cefalorraquídeo (LCR) mediante técnica de isoelectroenfoque. A los 12 meses se efectuó una nueva RM (RM2) siguiendo el mismo protocolo de la RM inicial (RM1). Las imágenes de RM1 y RM2 fueron analizadas para medir el cambio del volumen cerebral durante el primer año de evolución utilizando el software SIENA14 (ver a continuación). El grado de discapacidad física fue evaluado semestralmente con el score EDSS. Para el análisis de seguimiento, se dividió a los pacientes en los que alcanzaron un EDSS de 4 o más vs. los que no lo alcanzaron.
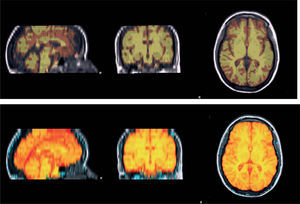
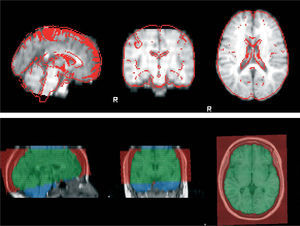
Análisis de la atrofia cerebral al año de iniciada la enfermedadSe estimó el porcentaje de cambio del volumen cerebral entre las RM1 y RM2 mediante el software SIENA (Structural Image Evaluation using Normalisation of Atrophy)14, incorporado dentro de la biblioteca FSL (www.fmrib.ox.ac.uk). El software realiza la extracción de las imágenes del cerebro y del cráneo de las secuencias axiales de T1 obtenidas en los dos puntos de tiempo separados1,14. Esas dos imágenes son luego alineadas una con la otra (fig. 1). Posteriormente, esas imágenes alineadas son segmentadas con el fin de diferenciar tejido cerebral de tejido no cerebral y desplazamientos perpendiculares (fig. 2). Luego de la segmentación y alineación, el programa mide segmento por segmento para detectar el porcentaje de cambio del parénquima cerebral entre la RM1 y la RM2. Esta técnica es utilizada actualmente para cuantificar el cambio del volumen cerebral y la atrofia en pacientes con EM.
Análisis estadísticoLas características basales de la cohorte evaluada fueron reportadas en porcentajes para los datos categóricos y en media con su desviación estándar (DS) para los datos continuos. Los datos fueron comparados mediante test de Chi cuadrado y Mann-Whitney U test para datos categóricos y continuos, respectivamente. El análisis de la asociación entre variables clínicas, paraclínicas (bandas oligoclonales [BO] en LCR) y el porcentaje de cambio entre la RM1 y la RM2 con la progresión de la discapacidad en el seguimiento se realizó a través del test de regresión multivariado de Cox. Valores de p<0,05 fueron considerados significativos. La recolección y el análisis de los datos se realizaron con el programa Stata 9.1.
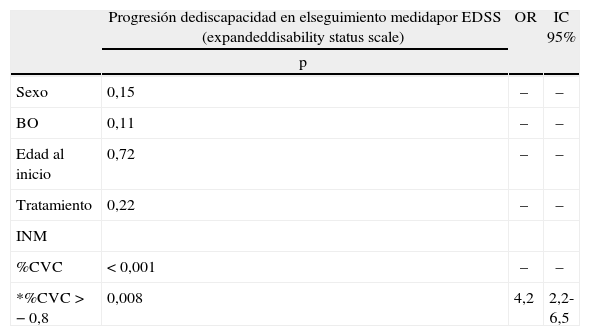
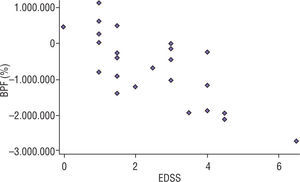
ResultadosSe incluyeron 26 pacientes con EMRR, de ellos 15 (57,7%) mujeres (tabla 1). La edad media de inicio de la enfermedad en la población fue de 32,8 ± 9 años. Se realizó punción lumbar para la detección de BO en 20 pacientes, y fueron positivas en 19 (95%). Todos los pacientes recibieron tratamiento inmunomodulador al cumplir criterios diagnósticos de EM. Esto ocurrió entre los 5 y 18 meses luego de presentado el primer signo/síntoma. El tiempo promedio transcurrido entre la RM1 y la RM2 fue de 13 ± 1,5 meses. Se siguió a la cohorte durante un tiempo medio de 9,3 ± 5 años. En 11 (42,1%) pacientes, al momento actual de la evaluación, se registró un EDSS ≥4 (media, 3,0; rango, 0–6,5). El tiempo de seguimiento para los pacientes que alcanzaron EDSS de 4 o mayor fue de 9,1 ± 1,2 años vs. 11 ± 3,1 años (p=0,12). En el análisis de regresión multivariado se observó que un mayor porcentaje de atrofia cerebral al año de iniciada la enfermedad era el único factor asociado predictor de mayor EDSS (p<0,001) en el seguimiento, ajustado por las otras variables (edad al inicio, sexo, presencia de BO en LCR y tratamiento) (tabla 2). Al analizar la media de atrofia al año en los pacientes que alcanzaron un EDSS ≥4 vs. los que no lo alcanzaron, ésta fue de −1,12% vs. -0,28 (p=0,003). Una tasa de atrofia superior a −0.8% se asoció con mayor discapacidad durante el seguimiento (p=0,008; OR, 4,2; IC 95%, 2,2-6,5) (fig. 3).
Características basales de la población
| Variable | |
| N | 26 |
| Sexo femenino, n (%) | 15 (57,7) |
| BO, n (%) | 19 (95) |
| INM, n (%) | 26 (100) |
| EDSS >4 durante seguimiento, n (%) | 11 (42,1) |
| Tiempo medio de seguimiento (media ± DS) | 9,3 ± 5 años |
BO: bandas oligoclonales en LCR; INM: inmunomodulador; EDSS: expanded disability status scale.
Análisis multivariado predictor de discapacidad durante el seguimiento
| Progresión dediscapacidad en elseguimiento medidapor EDSS (expandeddisability status scale) | OR | IC 95% | |
| p | |||
| Sexo | 0,15 | – | – |
| BO | 0,11 | – | – |
| Edad al inicio | 0,72 | – | – |
| Tratamiento | 0,22 | – | – |
| INM | |||
| %CVC | <0,001 | – | – |
| *%CVC > −0,8 | 0,008 | 4,2 | 2,2-6,5 |
BO: bandas oligoclonales en LCR; INM: inmunomodulador; %CVC: porcentaje de cambio de volumen cerebral al año; *%CVC: porcentaje de cambio de volumen cerebral dicotomizado en >−0,8%.
Nuestro estudio demostró que una mayor tasa de atrofia cerebral durante el primer año de iniciada la enfermedad EMRR fue predictor de progresión de la discapacidad a mediano plazo, siendo éste uno de los primeros trabajos en demostrar la asociación en esta población a nivel mundial.
Un estudio recientemente publicado por Di Filippo et al1 encontró resultados similares a los aquí reportados, utilizando iguales técnicas de medición, aunque en una población con síndrome desmielinizante aislado (SDA). Dicho estudio mostró que la tasa de atrofia de −0,5% al año del evento desmielinizante se asociaba con mayor riesgo de conversión a EMRR y con mayor discapacidad evaluada mediante EDSS durante el seguimiento1. En nuestro estudio encontramos que la tasa de atrofia de los pacientes fue mayor a lo reportado en pacientes con SDA (−0,8%), y que por encima de este nivel de atrofia, medida al año de iniciada la enfermedad, se incrementaba significativamente el riesgo de progresión de la discapacidad a mediano plazo (8 años de seguimiento). Esta diferencia en la tasa de atrofia podría explicarse porque las poblaciones estudiadas corresponden a distintos momentos evolutivos de la enfermedad.
Es importante destacar como limitación al presente estudio la característica observacional del mismo, a pesar de que el balanceo y lo estricto de los criterios de inclusión reducen la posibilidad de sesgos y confundidores en la observación establecida.
En resumen, nuestro estudio demuestra que la tasa de atrofia cerebral al año de iniciada la enfermedad EMRR es un factor predictor independiente de progresión de la discapacidad a mediano plazo y podría ser utilizado conjuntamente con otros marcadores para identificar pacientes con un curso evolutivo más agresivo de la enfermedad.
Futuros estudios ayudarán a confirmar nuestras observaciones iniciales.
Conflicto de interesesLos autores declaran no tener conflicto de intereses respecto al desarrollo de la investigación.
FinanciamientoEl estudio estuvo financiado por el servicio de Neurología, sección de Neuroinmunología y enfermedades desmielinizantes del Hospital Italiano de Buenos Aires.