La miositis por cuerpos de inclusión esporádica (MCIe) es una de las cuatro miopatías inflamatorias mayores junto con la dematomiositis (DM), la polimiositis (PM) y la miopatía necrotizante.
Es una miopatía lentamente progresiva que afecta a la musculatura proximal y distal y presenta rasgos histopatológicos distintivos, como hallazgos inflamatorios autoinmunes junto con degenerativos, como la presencia de vacuolas, inclusiones filamentosas y acumulaciones de proteínas con contenido amiloide.
Representa al 30% de las miopatías inflamatorias, y afecta principalmente a mayores de 50 años.
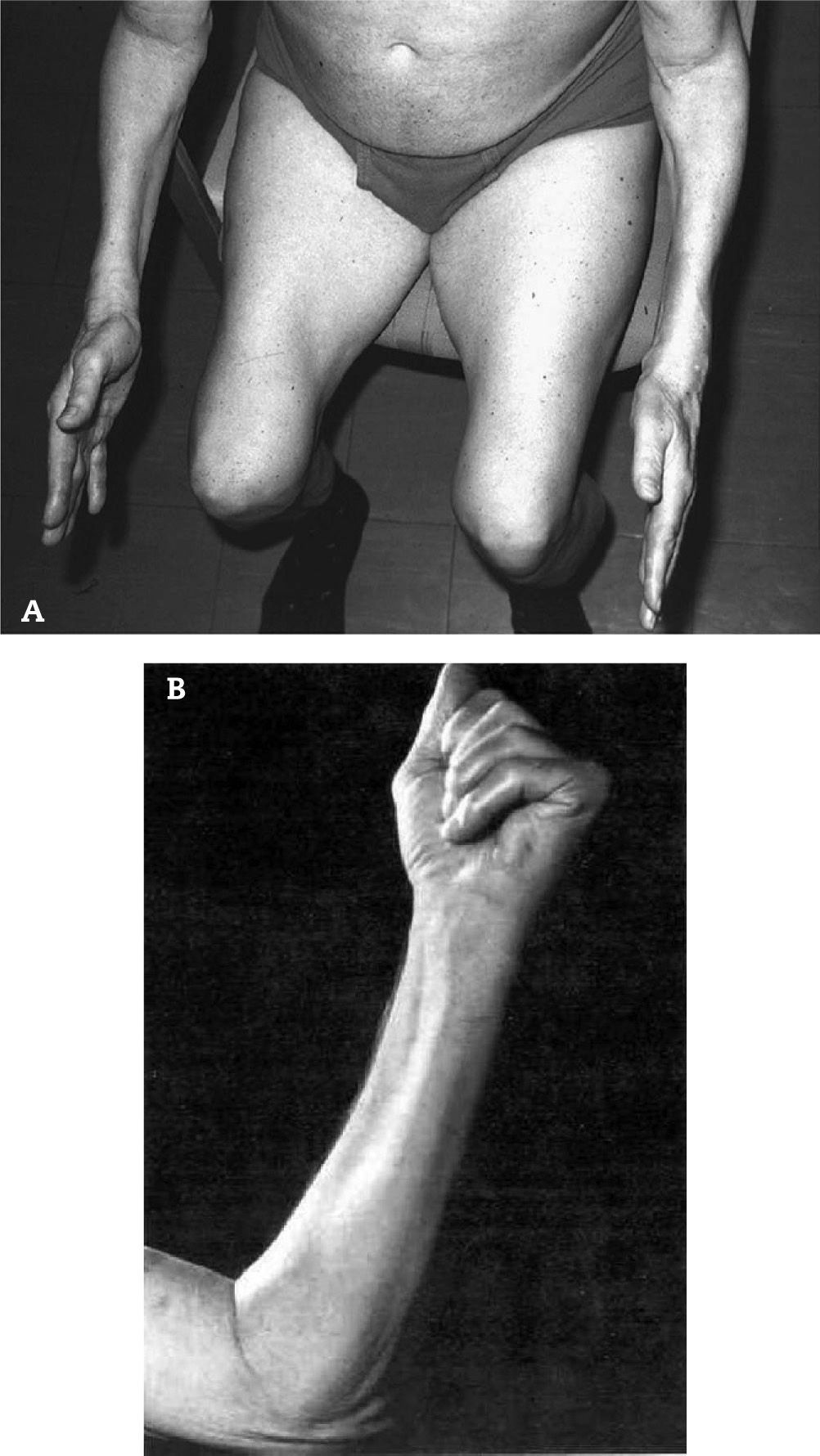
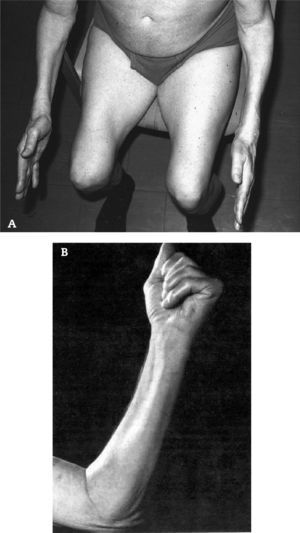
Produce debilidad y atrofia de los músculos proximales y distales, comprometiendo casi selectivamente los cuádriceps y los flexores profundos de los dedos de la mano.
El diagnóstico clínico de la MCIe se confirma por biopsia muscular y es ayudado por la electromiografía (EMG) y el dosaje de CPK.
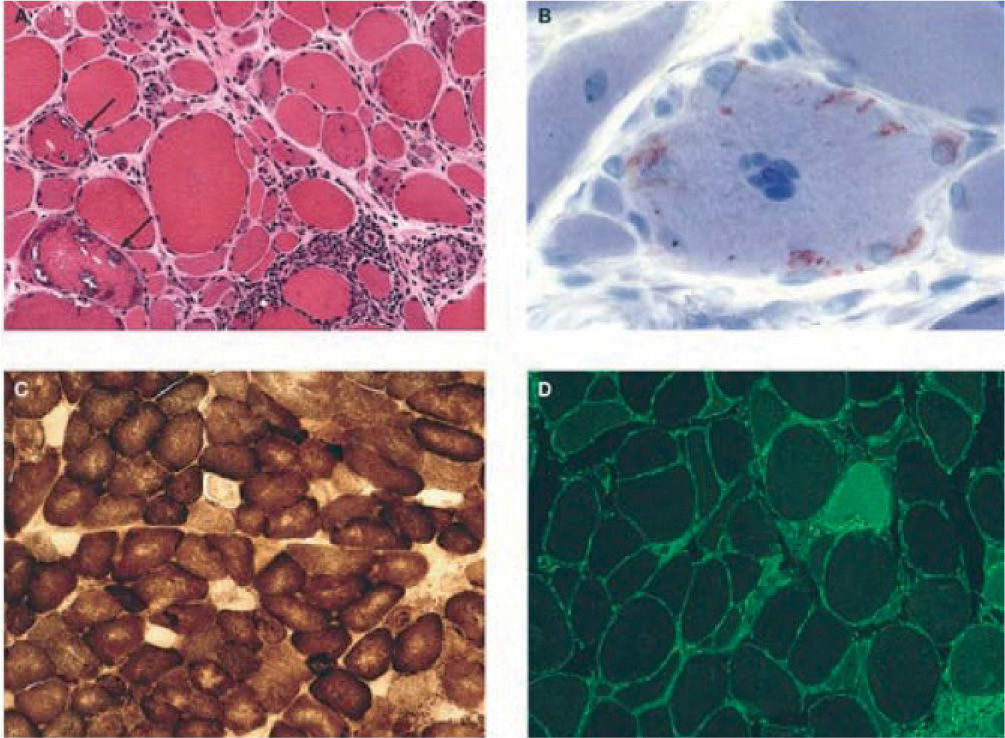
Los hallazgos histológicos “mayores” son: infiltrado linfocítico multifocal que invade fibras no necróticas, vacuolas en células no invadidas por linfocitos y depósito de amiloide Congo-rojo positivo.
La MCIe es una enfermedad compleja cuyos mecanismos fisiopatológicos aún no se conocen con claridad; uno es inmunomediado, por citotoxicidad mediada por linfocitos T, y el otro es un proceso no inmune, caracterizado por vacuolización y acumulación intracelular de contenido amiloideo probablemente secundario a stress relacionado con el complejo mayor de histocompatibilidad (CMH).
Más allá del componente inmune involucrado, esta enfermedad es resistente a las inmunoterapias, se han realizado ensayos con distintos fármacos, pero la efectividad de estas terapias y sus efectos adversos requieren posterior evaluación.
Sporadic inclusion body myositis (sIBM) is one of four major inflammatory myopathies with dematomyositis (DM), polymyositis (PM) and necrotizing myopathy.
It is a slowly progressive myopathy affecting proximal and distal muscles and has distinctive histopathological features, such as autoimmune inflammatory findings with degenerative, as the presence of vacuoles, filamentous inclusions and accumulation of amyloid-containing proteins.
Represents 30% of the inflammatory myopathies, mainly affecting older than 50 years.
It produces weakness and atrophy of proximal and distal muscles, almost selectively engaging the quadriceps and deep flexors of the fingers.
The clinical diagnosis of MCI is confirmed by muscle biopsy and is supported by the elcetromiography and dose of CPK.
Histological “major” findings are multifocal lymphocytic infiltrate invading non-necrotic fibers, vacuoles in cells not invaded by lymphocytes and amyloid deposition Congo-Red positive.
The sIBM is a complex disease whose pathophysiological mechanisms are not known clearly: an immune-mediated, cytotoxicity mediated by T cells, and other non-immune process, characterized by vacuolization and intracellular accumulation of amyloid content probably due to stress related to CMH.
Beyond the immune component involved the disease is resistant to immunotherapies, there have been trials with different drugs, but the effectiveness of these therapies and their adverse effects require further evaluation.
La miositis por cuerpos de inclusión esporádica (MCIe) es una de las cuatro miopatías inflamatorias mayores, junto con la dematomiositis (DM), la polimiositis (PM) y la miopatía necrotizante1. Tienen en común ciertas características, como por ejemplo inflamación en el endomisio, necrosis, elevación de la creatinfosfocinasa (CPK) y debilidad muscular de gravedad y distribución variables.
Hoy sabemos que estas entidades, a las que siempre se las consideró distintos estadios de la misma enfermedad, son parecidas pero diferentes.
La DM se presenta en forma subaguda tanto en niños como en adultos, acompañada por lesiones en la piel, mientras que la PM también se presenta en forma subaguda pero rara vez afecta a los niños.
Por el contrario, la MCIe es una miopatía lentamente progresiva que afecta a la musculatura proximal y distal y que presenta rasgos histopatológicos distintivos: hallazgos inflamatorios autoinmunes junto con degenerativos, como la presencia de vacuolas, inclusiones filamentosas (de allí vienen “los cuerpos de inclusión”) y acumulación de proteínas con contenido amiloide2.
Es una enfermedad a la que se confunde con otras, sobre todo en los pacientes con diagnóstico de PM que no respondieron al tratamiento inmunosupresor y que al ser re-biopsiados presentaban los hallazgos característicos de la MCI3.
Si bien es esporádica por naturaleza, existen escasos reportes de MCI en padres, hijos y hermanos de pacientes afectados. Esto último sugiere una posible predisposición genética para desarrollar la enfermedad.
Las miopatías por cuerpos de inclusión hereditarias (MCIh) son menos frecuentes, sin inflamación en la biopsia muscular y bastante heterogéneas fenotípicamente (tabla 1).
Factores inmunopatogénicos y degenerativos de la MCI
| Inmunopatogénicos | Degenerativos |
|
|
La MCIe es la miopatía adquirida más frecuente en pacientes mayores de 50 años y afecta más a hombres que a mujeres. Representa al 30% de las miopatías inflamatorias. La prevalencia estimada varía entre 4,3 y 9,3 por 1.000.000 de habitantes y aumenta a 35,3/1.000.000 en mayores de 50 años.
El tiempo al diagnóstico varía entre 5 a 8 años desde el comienzo de los síntomas4-5.
Produce debilidad y atrofia de los músculos proximales y distales, comprometiendo casi selectivamente los cuádriceps y los flexores profundos de los dedos de la mano (fig. 1).
Debido a esta particularidad clínica, los pacientes consultan por caídas frecuentes e incapacidad para manipular llaves o realizar otras actividades manuales.
Los músculos flexores y extensores del cuello se afectan en estos pacientes, pero el síndrome de cabeza caída (head drop) o la camptocornia son infrecuentes.
El 60% de los pacientes tiene disfagia, con frecuentes episodios de chocking, y algunos de ellos tienen debilidad facial prominente, pero la musculatura extraocular se encuentra conservada6-7.
Si bien no existe afectación sensitiva, se observa en algunos pacientes alteración en la propiocepción y palestesia atribuible al grupo etario o a neuropatía concomitante.
Los reflejos osteotendinosos pueden desaparecer a medida que la debilidad y la atrofia afectan a los grupos musculares mayores.
En un estudio publicado recientemente en Australia, los síntomas iniciales en la mayoría de los casos son: debilidad de cuádriceps (79%), debilidad de los dedos (12%), foot drop (7%) y disfagia (1,8%)4.
La debilidad muscular y la atrofia son generalmente asimétricas, lo que provoca que la MCIe pueda ser confundida con enfermedades de la motoneurona inferior.
La progresión de la enfermedad es lenta pero continua, comportándose como una distrofia muscular, y la mayoría de los pacientes requerirán asistencia con bastón, walker o silla de ruedas.
Diagnóstico de la miositis por cuerpos de inclusiónEl diagnóstico clínico de la MCI se confirma por biopsia muscular y es ayudado por la electromiografía (EMG) y el dosaje de CPK.
La CPK puede estar elevada inicialmente hasta más de diez veces de su valor, para luego mantenerse ligeramente elevada o normal en casos aislados durante el curso de la enfermedad.
El electromiograma presenta potenciales de características miopáticas con aumento de la actividad espontánea como fibrilaciones, descargas repetitivas complejas y ondas agudas positivas. También es frecuente el hallazgo de algunos potenciales neurógenos mezclados con los miopáticos, que evidencia la cronicidad del proceso.
Si bien la resonancia magnética nuclear es de escaso valor diagnóstico, se puede apreciar la atrofia del cuádriceps y de los músculos del antebrazo.
La biopsia muscular es esencial para el diagnóstico de la MCI, evidenciando signos de cronicidad como fibras hipertróficas, atróficas, particiones, núcleos centrales e incremento del tejido conectivo.
Los hallazgos histológicos “mayores” son: infiltrado linfocítico multifocal que invade fibras no necróticas, vacuolas en células no invadidas por linfocitos (estas vacuolas tipo rimmed contienen depósitos granulares basófilos) y depósito de amiloide Congo-rojo positivo8-9.
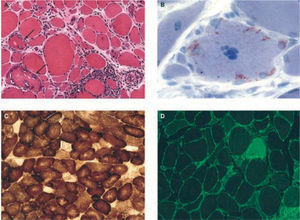
Es frecuente el hallazgo de fibras del tipo ragged red o “rojas rasgadas” y citocromo-oxidasa negativas, como consecuencia de disfunción mitocondrial (fig. 2).
Hallazgos histológicos característicos en biopsias de pacientes con miositis por cuerpos de inclusión esporádica. A) Inflamación y vacuolas. Se observa inflamación endomisial, con linfocitos que invaden fibras musculares no necróticas de aspecto normal, y vacuolas red rimmed en 2 fibras musculares (flechas). B) Depósitos intracelulares de amiloide, fácilmente identificados con tinción de cristal violeta. C) Fibras citocromo-oxidasa (COX) negativas, indicativas de disfunción mitocondrial. D) Marcada expresión en todas las fibras del complejo mayor de histocompatibilidad clase 1 (verde) invadidas por células T o no.
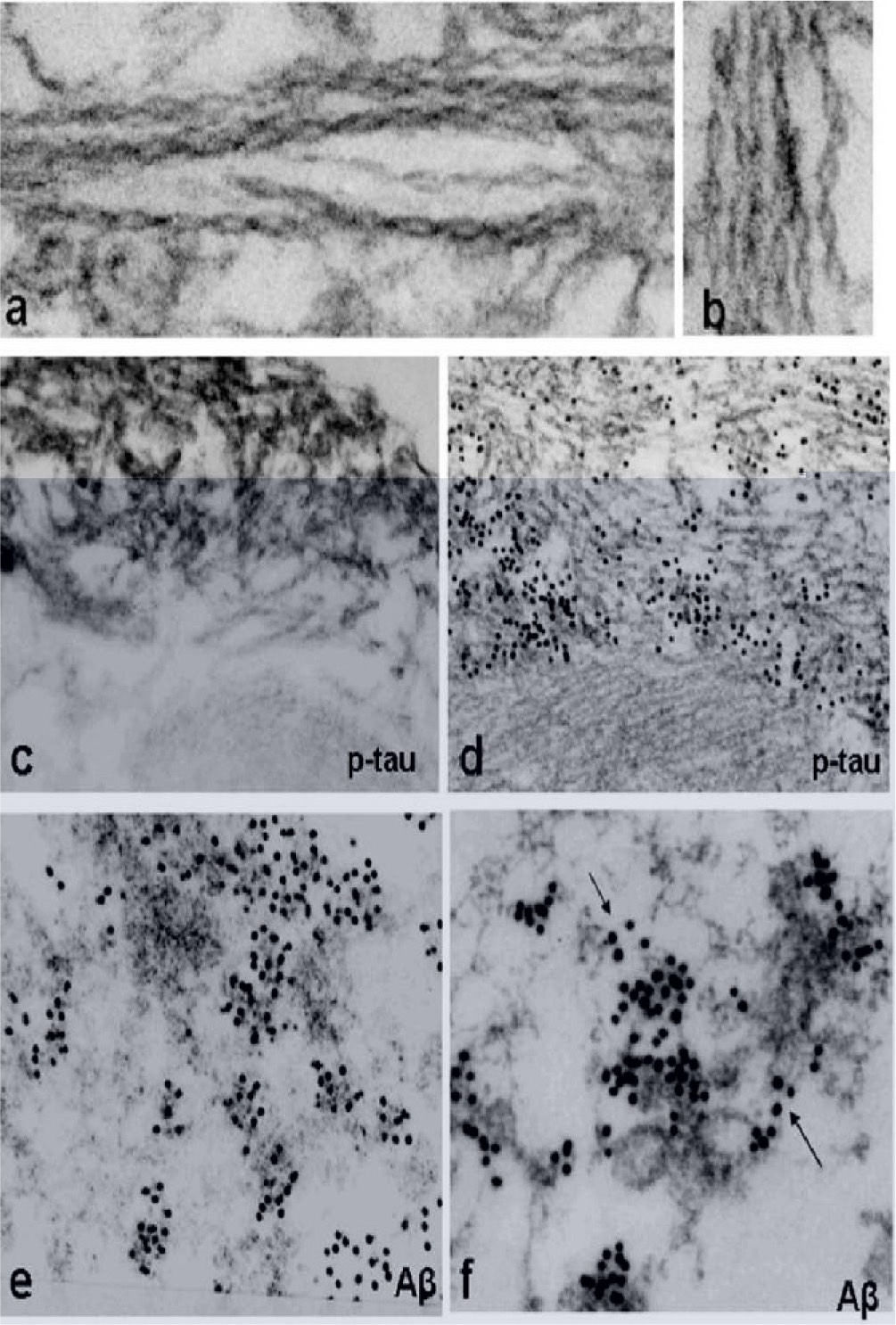
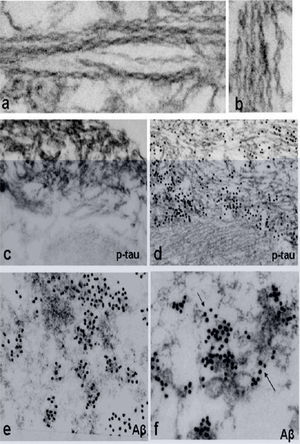
La microscopia electrónica muestra la acumulación de inclusiones túbulo-filamentosas de 15–21nm, colecciones citoplasmáticas de filamentos amiloide-like de 6–10 nm10 y de proteínas que se depositan en el músculo de estos pacientes (fig. 3).
Existen otras “miopatías vacuolares”, como las disferlinopatías, las miopatías miofibrilares, la distrofia facioescapulohumeral y la distrofia de Emery-Dreyfuss, así como también miopatías metabólicas, como la enfermedad de Pompe o déficit de maltasa ácida, y procesos neurógenos crónicos o PM crónica.
Si el paciente tiene el fenotipo de MCI pero la biopsia muestra hallazgos de miopatía inflamatoria crónica (inflamación, hipertrofia, partición, aumento del tejido conectivo, pero no vacuolas), el diagnóstico es de MCI probable. Si se observa además up-regulation de antígenos del complejo mayor de histocompatibilidad (CMH) clase 1 y fibras citocromo-oxidasa negativas, el diagnóstico es más certero11-12.
Diagnósticos diferencialesEstrechar la mano a un paciente podría ser el primer indicio de que el paciente tiene MCI; más aún, si tiene historia de caídas frecuentes por debilidad de rodillas y pies, cuádriceps atróficos, y no refiere parestesias y calambres.
De todos modos, el camino parece ser más complicado, ya que varias entidades en el paciente adulto pueden confundirse con la MCI.
Si el cuadro de debilidad y atrofia es asimétrico o limitado a los miembros inferiores crece la sospecha de enfermedad de la motoneurona inferior. La esclerosis lateral amiotrófica se diferencia de la MCI por la presencia de hiperreflexia, calambres, fasciculaciones y el patrón electromiográfico.
La polimiositis es el principal diagnóstico diferencial por la interpretación simplista de la presencia de elevación de la CK acompañada de inflamación endomisial en los pacientes que son biopsiados. A diferencia de la MCI, el comienzo es subagudo, con debilidad proximal y simétrica, elevación marcada de la CK y sin signos de cronicidad en la anatomía patológica.
Diferenciar a los pacientes con MCI y otras miopatías vacuolares hereditarias como las miopatías miofibrilares o la miopatía por cuerpos de inclusión hereditaria (MCIh) es aún más dificultoso, porque el cuadro clínico y las vacuolas son similares a la MCI esporádica. La presencia de inflamación endomisial, ausente en las formas hereditarias, y la expresión de antígenos del CMH clase 1 sostienen el diagnóstico de esta última.
Otras enfermedades de diferentes mecanismos fisiopatológicos, como algunas distrofias musculares, la enfermedad de Pompe o el déficit de maltasa ácida, e inclusive pacientes con formas severas de miastenia gravis, se pueden confundir con MCI en el paciente adulto
Mecanismos patológicos en la miositis por cuerpos de inclusión esporádicaLa MCIe es una enfermedad compleja cuyos mecanismos fisiopatológicos aún no se conocen con claridad.
El hecho de que fibras musculares intactas estén invadidas por linfocitos T, y fibras musculares con vacuolas, sin autoinvasión de células T, pero con una fuerte expresión de antígenos clase I del CMH, sugiere la presencia de dos procesos diferentes que ocurren en paralelo15: uno inmunomediado, por citotoxicidad mediada por linfocitos T, y otro proceso no inmune, caracterizado por vacuolización y acumulación intracelular de contenido amiloideo probablemente secundario a stress relacionado con el CMH16-17.
Desde la descripción de la MCI, grupos de investigación discuten acerca del origen “inflamatorio” o “degenerativo” de esta entidad, presentando evidencias que sustentan una teoría u otra (tabla 1)13–22.
TratamientoMás allá del componente inmune involucrado en la patogénesis de la MCI, la enfermedad es resistente a las inmunoterapias.
En algunos aspectos la MCI se asemeja a la esclerosis múltiple primaria progresiva, en la cual factores inmunes y degenerativos coexisten, pero la enfermedad es resistente a distintos tipos de terapias23.
La MCI es una enfermedad incapacitante, ya que entre los 5 y 10 años de comienzo la mayoría de los pacientes requieren asistencia para movilizarse.
En general, cuanto más tardío es el comienzo, más rápido es el curso.
A pesar de que la mayoría de los agentes usados —como corticoides, azatioprina, metotrexato, ciclosporina, ciclofosfamida o irradiación linfoidea total— fueron inefectivos, algunos pacientes presentaron cierto grado de mejoría por un corto período de tiempo.
Este fenómeno se produciría por mejoría del componente “inflamatorio” y porque la enfermedad, en su curso natural, presenta un período de estabilización clínica.
En tres trabajos aleatorizados, doble-ciego con inmunoglobulina intravenosa, el 30% de los participantes experimentaron beneficios mínimos y de corta duración, y también se observó que la mejoría, en los pacientes con disfagia, podía ser significativa24.
Se realizaron otras pruebas con distintos fármacos, como el etanercept, que bloquea a los receptores de factor de necrosis tumoral, el interferón β 1A, la oxandrolona (agonista del receptor androgénico) y el alemtuzumab, pero la efectividad de estas terapias y sus efectos adversos requieren una posterior evaluación.
ConclusiónEsta enfermedad lenta y progresiva es de difícil sospecha diagnóstica en los pacientes mayores de 50 años, como ocurre con otras enfermedades neuromusculares de características clínicas similares, como la miastenia gravis, la enfermedad de motoneurona u otras miopatías
Es por esta razón que decimos que la miositis por cuerpos de inclusión es una enfermedad subdiagnosticada en nuestro medio
El diagnóstico anatomopatológico luego de la sospecha clínica es de gran utilidad para evitar errores y, por ende, no exponer al paciente a un tratamiento inmunosupresor innecesario, ya que esta enfermedad es refractaria al mismo.