Aunque la asociación de arteritis de la temporal e ictus isquémico no es frecuente, su diagnóstico y su manejo posterior plantean serias dificultades, requiriendo un alto índice de sospecha.
MétodosAnalizamos una serie de 6 pacientes con arteritis de la temporal confirmada por biopsia con ictus isquémico como forma de presentación. Discutimos las características clínicas y las dificultades en su valoración, su evolución a corto y largo plazo, el tratamiento realizado y la utilidad de las nuevas pruebas diagnósticas.
ResultadosNuestra serie de 6 pacientes tenía una edad media de 68,3 años y el 50% eran mujeres. La mayoría de los pacientes asociaba síntomas sistémicos. No hubo diferencias en la afectación de territorio anterior y posterior. La RM y angio, el Doppler y la PET-TAC fueron muy útiles en el diagnóstico y la orientación terapéutica de los pacientes. El seguimiento medio fue de 26 meses y la evolución distó de ser benigna: el 33% quedó con Rankin≥3, falleciendo un paciente. Además, 2 pacientes, tratados con corticoides a dosis plena, tuvieron nuevos ictus. Dos pacientes fueron tratados con angioplastia.
ConclusionesEl ictus provocado por la arteritis de células gigantes es una enfermedad potencialmente grave, que requiere una alta sospecha diagnóstica y un tratamiento corticoideo temprano. Los nuevos métodos diagnósticos ayudan a refinar la correcta evaluación de los pacientes y a determinar el tratamiento óptimo. El tratamiento endovascular puede ser una opción terapéutica válida en casos seleccionados.
Though uncommon, ischaemic stroke due to temporal arteritis carries serious difficulties for diagnosis and subsequent management and requires a high level of suspicion.
MethodsWe analysed a series of 6 patients with biopsy-proven temporal arteritis presenting with ischaemic stroke. We discuss clinical characteristics, difficulties of assessment, short- and long-term progression, treatment, and the usefulness of new diagnostic techniques.
ResultsOur sample of 6 patients had a mean age of 68.3 years; 50% were women. The majority of patients showed systemic symptoms. Anterior and posterior circulation were affected similarly. MRI angiography, Doppler sonography, and PET-CT proved to be very useful for diagnosis and treatment. Mean follow-up time was 26 months. Clinical outcomes were far from good: 33% scored≥3 on the modified Rankin scale, including one death. Two patients had recurrent stroke despite treatment with full doses of corticosteroids, and 2 underwent angioplasty.
ConclusionsStroke caused by giant cell arteritis is a serious and potentially severe condition which requires a high level of suspicion and early treatment with corticosteroids. New diagnostic techniques contribute to refining patient assessment and identifying the optimal treatment. Endovascular treatment may be a valid therapeutic option in selected patients.
La arteritis de células gigantes (ACG) es una vasculitis granulomatosa que afecta preferentemente a vasos de mediano y gran calibre. Es la forma más común de vasculitis en el adulto1. Las ramas de la arteria carótida externa son las más frecuentemente afectadas, siendo la consecuencia, si no se instaura tratamiento precoz, la pérdida de visión2.
Una complicación potencialmente grave es el infarto cerebral, a pesar de que los ictus atribuidos a la ACG son poco frecuentes; la prevalencia de ACG, en un registro de más de 4.000 casos de ictus, fue de 0,15%3. Además, en una serie hospitalaria de 2.000 pacientes consecutivos con ictus en nuestro país, la arteritis de la temporal supuso un diagnóstico infrecuente entre los infartos de etiología inhabitual (5,7% de los casos, 4 de 70 pacientes)4.
Por otro lado, de 287 casos de arteritis de la temporal confirmada por biopsia, solo un 3% presentó ictus las primeras 4 semanas tras el diagnóstico5. Aun así, su aparición empeora claramente el pronóstico, pues es el responsable del 10% de las muertes producidas por ACG confirmadas por biopsia6.
La arteritis de la temporal sigue siendo un desafío diagnóstico. Es deseable una detección precoz por las consecuencias irreversibles, la pérdida de visión, que tiene si no se instaura tratamiento corticoideo de forma rápida. También es un desafío para el neurólogo vascular, requiriendo tanto un diagnóstico como un tratamiento temprano, ya que la evolución de los ictus asociados a arteritis de la temporal puede ser catastrófica7.
La prueba diagnóstica patognomónica sigue siendo la biopsia de la arteria temporal, aunque, dado el carácter parcelar de la arteritis, puede ser negativa. En los últimos años se han incorporado nuevos métodos diagnósticos, además de los reactantes de fase aguda, que apoyan la presunción clínica. Ninguno es específico, pero sí de gran utilidad para el clínico: el Doppler con el signo del halo, tanto para el diagnóstico como para la selección del vaso a biopsiar8, la RM y la angio-RM9, y la combinación de la tomografía por emisión de positrones con la tomografía axial computarizada (PET-TAC)10.
Analizamos una serie de 6 pacientes con arteritis de la temporal confirmada por biopsia con ictus isquémico como forma de presentación. Discutimos las características y las dificultades en su valoración, su evolución y su tratamiento, así como la utilidad de las nuevas pruebas diagnósticas.
Pacientes y métodoPresentamos 6 casos de ictus isquémico secundario a arteritis de la temporal confirmada por biopsia recogidos entre julio de 2009 y julio de 2015; la edad media fue de 68,3 años y el 50% fueron mujeres. A todos los pacientes se les practicó angio-RM y Doppler, y al 66,6%, PET-TAC. Las características de los pacientes se resumen en la tabla 1.
Características de los pacientes
| Edad (años) | Sexo | Cefalea | VSG>50mm/h | PCR>8mg/L | Signo del halo | Afectación carotídea | Afectación VB | AGP | PET-TAC | Seguimiento (meses) | R3m | |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Caso 1 | 59 | F | No | Sí | Sí | No | Sí | Sí | No | Sí + | 31 | 0 |
| Caso 2 | 72 | F | Sí | Sí | – | Sí | Sí | Sí | Sí | Sí − | 16 | 2 |
| Caso 3 | 69 | M | Sí | No | Sí | Sí | Sí | Sí | No | No | 71 | 1 |
| Caso 4 | 73 | F | Sí | Sí | Sí | Sí | Sí | No | No | No | 3 | 6 |
| Caso 5 | 64 | M | No | Sí | Sí | Sí | No | Sí | No | Sí + | 19 | 1 |
| Caso 6 | 73 | M | Sí | Sí | Sí | Sí | Sí | Sí | Sí | Sí − | 17 | 3 |
| Total | 68,3 | 50% F | 66,7% | 83,3% | 100% | 83,3% | 83,3% | 83,3% | 33,3% | 50% | 26,2 |
AGP: angioplastia; F: femenino; M: masculino; PCR: proteína C reactiva; PET: tomografía por emisión de positrones; R3m: escala de Rankin a los 3 meses; TAC: tomografía axial computarizada; VB: vertebrobasilar; VSG: velocidad de sedimentación globular.
Mujer de 59 años de edad, con dislipidemia y artrosis como únicos antecedentes. Rankin previo: 0. Acude a Urgencias por episodios autolimitados, recurrentes, de debilidad en el miembro superior derecho de minutos de duración. Se inició hace unas semanas y son prácticamente diarios. En uno de los episodios presentó desviación de la comisura bucal y disartria. Además, presenta desde hace meses mialgias y artralgias difusas que ha atribuido a su artrosis. No refiere cefalea franca, pérdida de visión ni claudicación mandibular. Exploración en Urgencias: debilidad distal en el miembro superior derecho.
Análisis: PCR 77,8mg/L, VSG 97mm/h, Hb 10,7g/dl.
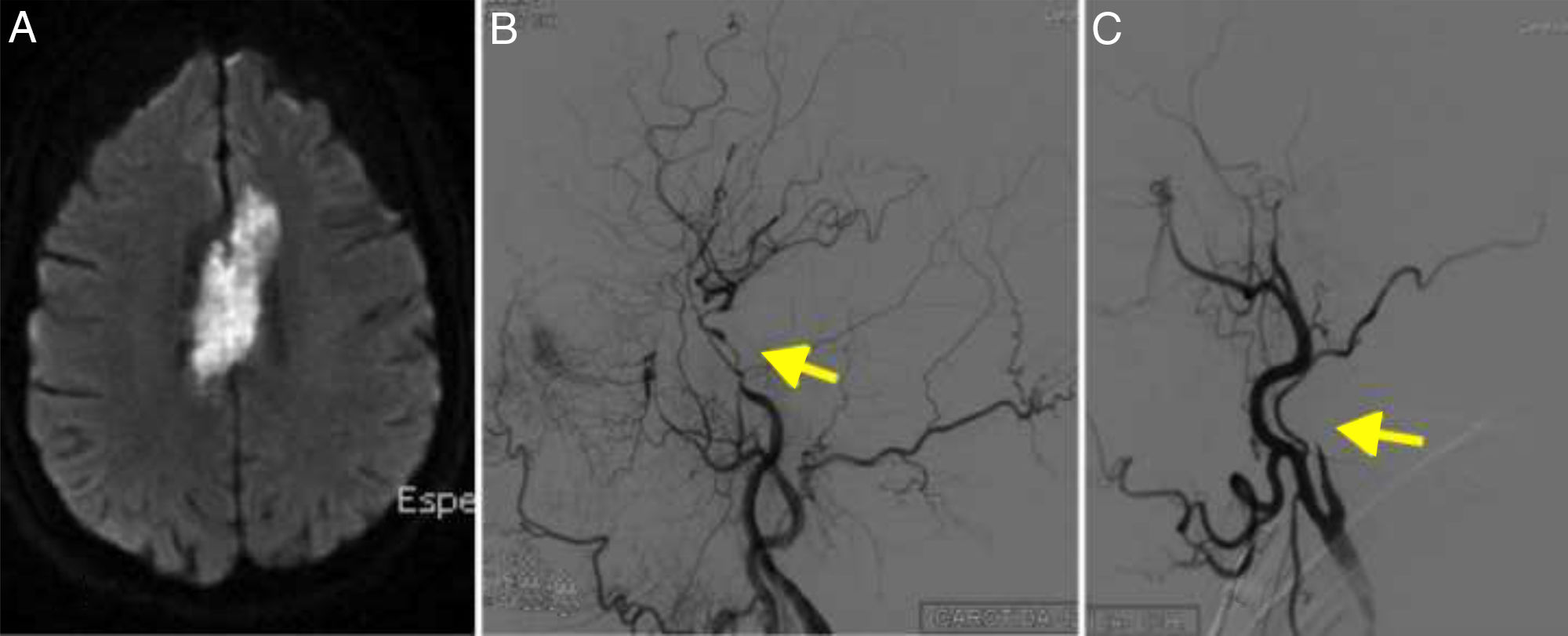
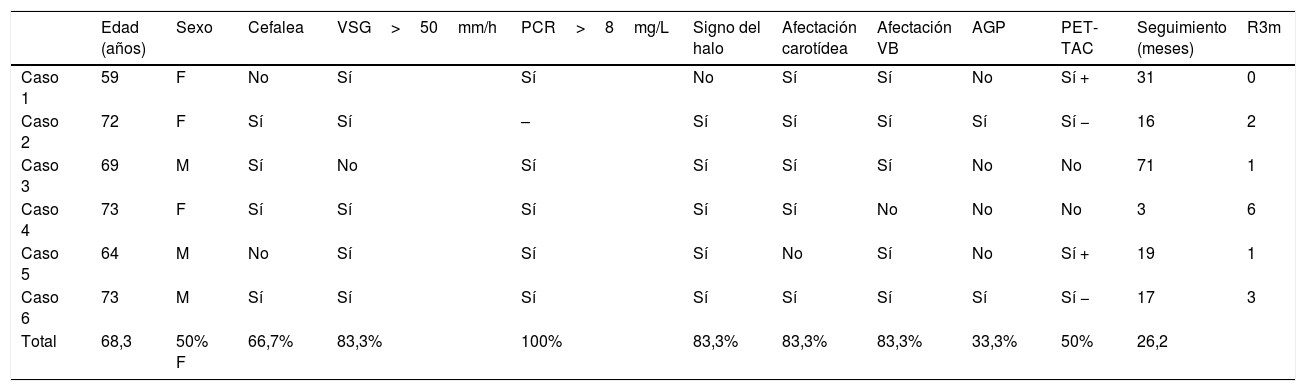
La angio-RM y el DIVAS confirman el infarto silviano izquierdo en territorio frontera y las estenosis carotídeas y vertebrales intracraneales (fig. 1).
En el estudio power Doppler no se aprecia el signo del halo.
PET-TAC: hipermetabolismo lineal y continuo en vasos medianos supraaórticos. Destaca una actividad lineal en subclavias y carótidas, siempre más llamativa en el lado izquierdo.
Además de AAS, se inició tratamiento con megadosis de corticoides durante 5 días (1 g de metilprednisolona al día), seguido de prednisona 60 mg/día, con resolución de los síntomas y normalización progresiva de los parámetros analíticos. Actualmente está asintomática, con tratamiento de 2,5 mg de prednisona al día, con un seguimiento de 31 meses.
La biopsia de la arteria temporal mostró signos de ACG.
Caso 2Mujer de 72 años de edad que ingresa por mareo y pérdida de visión. Es hipertensa, no tiene hábitos tóxicos y había sido intervenida por obesidad mórbida. Presentó cefalea pulsátil y mareo de 3 meses de evolución, seguido de pérdida de visión en OI. Acudió al neurólogo de otro hospital; VSG 50 primera hora, fibrinógeno 570mg/dl. Se inició empíricamente prednisona 60mg/día con resolución de la clínica. No se realizó biopsia temporal. Estando con 45mg de prednisona al día vuelve a estar mareada, y el 1 de mayo presenta pérdida de visión en OD, acompañada de cefalea pulsátil hemicraneal izquierda, motivo por el que acude a nuestro hospital.
Exploración: cuadrantanopsia inferior derecha.
PCR 0,6mg/L; VSG 12mm/h.
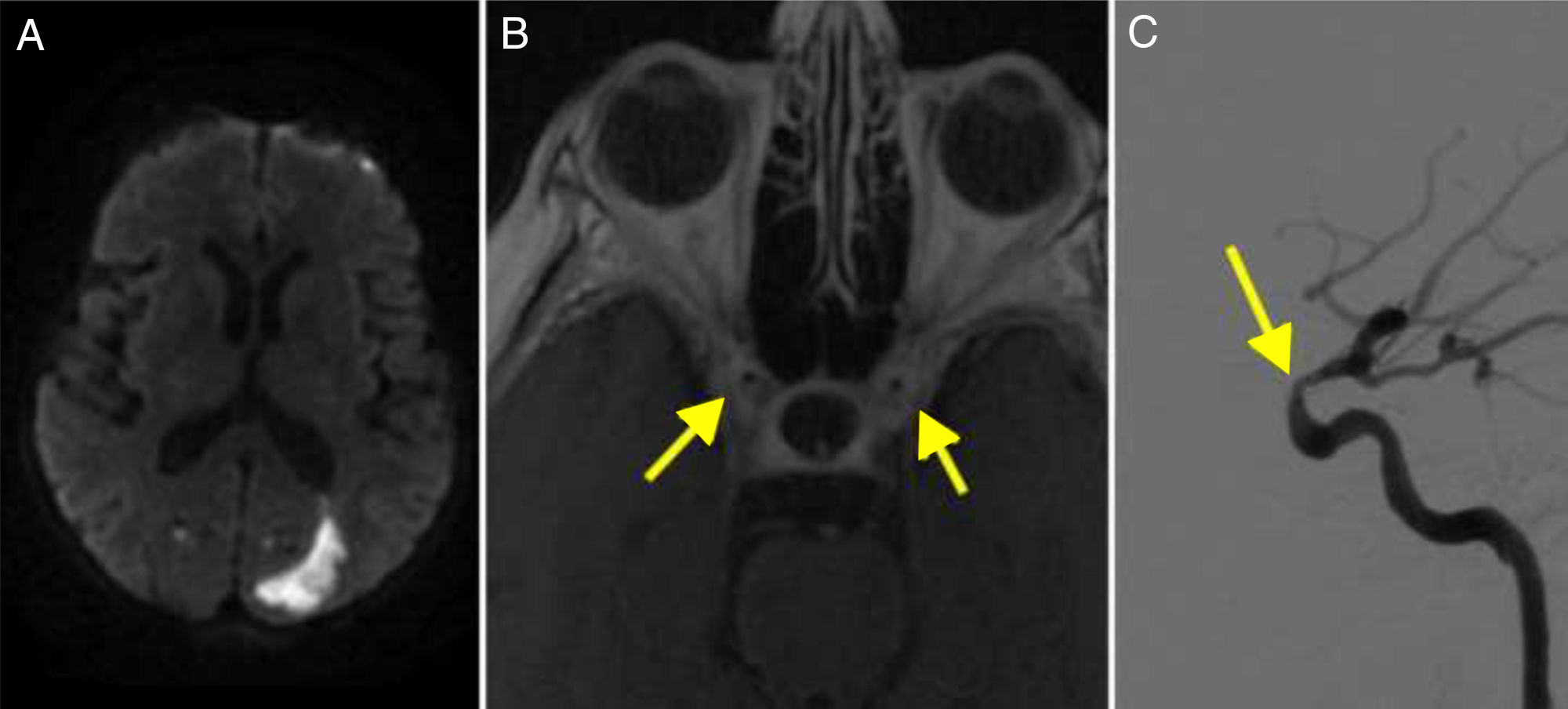
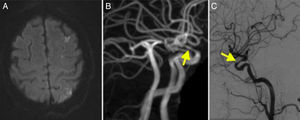
RM-difusión: infartos puntiformes en territorios frontera bicarotídeo, mayor en el izquierdo, con infarto occipital (fig. 2A).
DIVAS: estenosis bilateral del sifón carotídeo, mayor en el izquierdo (fig. 2C). Oclusión de ambas vertebrales.
PET-TAC: no hay presencia de actividad metabólica sobre las paredes de vasos grandes ni medianos.
Considerando el origen del ictus hemodinámico, el 18 de mayo se dilata el segmento carótido-oftálmico de la ACI-I, con mejoría significativa de la estenosis.
Durante el ingreso recibió, además de antiagregación, megadosis de corticoides, seguida de prednisona 60mg/día.
Biopsia de la arteria temporal: ACG. Secuela: pérdida de visión. Se realizó un seguimiento de 16 meses; en la actualidad está siendo tratada con 15mg diarios de prednisona.
Caso 3Varón de 69 años que ingresó en Neurología por ictus vertebrobasilar. DM tipo 2 con buen control. Exfumador (3-4 paquetes al día) hace más de 30 años. Desde hace mes y medio presenta vértigo acompañado de náuseas, sudoración y tinnitus derecho. También cefalea. El motivo de ingreso es un empeoramiento claro, con vómitos e inestabilidad intensa que impide la deambulación y la bipedestación. El paciente refiere haber perdido 10kg en el último mes, con anorexia y astenia asociadas. No ha habido historia de claudicación mandibular. Sí refiere dolores articulares.
Exploración: nistagmo espontáneo horizontal en todas las direcciones de la mirada, mayor hacia la izquierda. Dismetría clara en el miembro superior derecho en maniobra dedo-nariz con disdiadococinesia.
PCR 28mg/L (0-8); VSG 21mm/h.
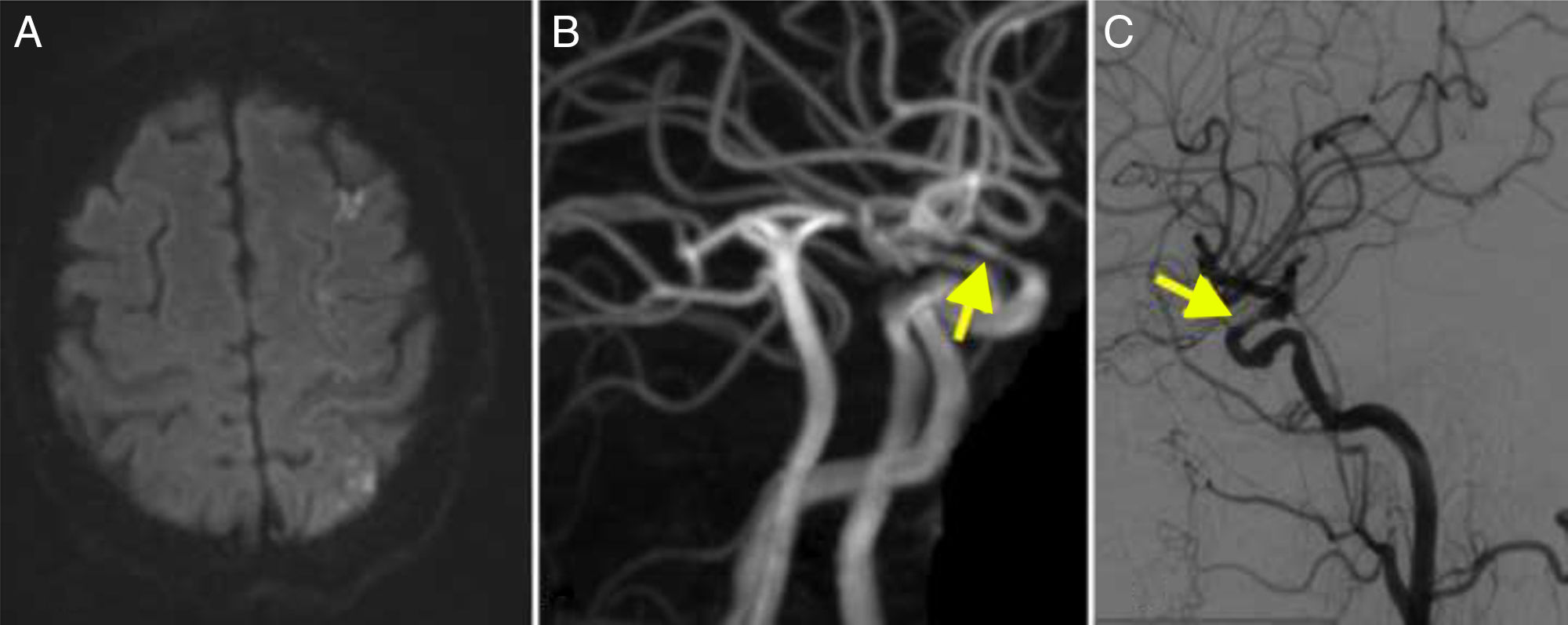
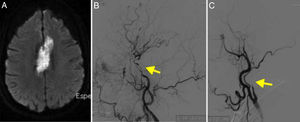
Además de un infarto reciente cerebeloso derecho en RM-difusión, las arterias vertebrales tienen múltiples irregularidades, siendo filiforme la arteria vertebral izquierda, que se confirma por DIVAS (fig. 3). También hay múltiples estenosis carotídeas intracerebrales.
A. RM secuencia difusión que muestra infarto en el territorio del pedúnculo cerebeloso derecho. B. Angiografía cerebral de la carótida izquierda que muestra múltiples estenosis en la arteria carótida interna (flecha). C. Angiografía de la arteria vertebral derecha que muestra estenosis de los segmentos extracraneales (flecha). D. Angio-RM realizada 2 años después en la que se observa la recuperación de las estenosis.
Doppler: ambas temporales permeables, amplio halo hipoecoico a su alrededor, más pronunciado en el lado derecho.
Recibió tratamiento corticoideo a dosis plenas, con un seguimiento de 71 meses; actualmente toma 5mg de prednisona a días alternos. En una angio-RM de control se observa la práctica resolución de las estenosis intracraneales (fig. 3).
Caso 4Mujer de 73 años de edad que ingresa en Neurología por una lesión ocupante de espacio. Es obesa, hipertensa, diabética y dislipidémica. Rankin previo: 0. Presenta cefalea de un año de evolución, junto con anemia, tratada con transfusiones. Aquejaba artralgias. Su cuadro se hace florido mes y medio antes del ingreso, con cansancio extremo y debilidad focal que revertía y que enfocaron como insuficiencia cardiaca. Mejoró con transfusión.
En la exploración en Urgencias: bradipsíquica, disártrica, desinhibida. Facial derecho supranuclear. Claudicación de miembros derechos, hipoestesia faciobraquiocrural derecha. Reflejo plantar derecho extensor.
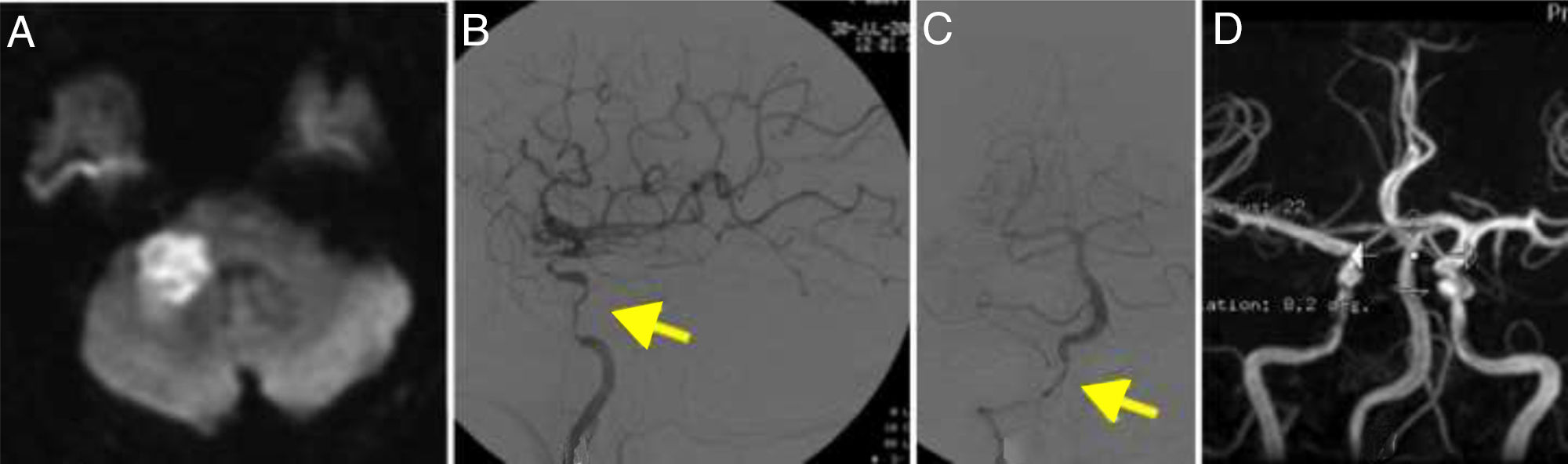
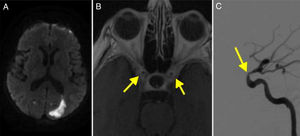
TAC craneal: imagen hipodensa en el cuerpo calloso que se extiende a ambos lados de la línea media; la lesión brilla en RM-difusión (fig. 4A), que muestra además 2 pequeños infartos isquémicos agudos en el territorio frontera silvianos izquierdos.
A. RM secuencia difusión que muestra un infarto en el territorio de ambas arterias cerebrales anteriores. B. Angiografía cerebral de la carótida izquierda que muestra múltiples estenosis en la arteria carótida interna (flecha). C. Angiografía que muestra la oclusión de la carótida interna derecha, simulando una disección (flecha).
Durante los primeros días de ingreso presentó un claro empeoramiento, añadiendo paresia crural izquierda y menor fluencia del lenguaje, a pesar de estar anticoagulada. Ante la sospecha de ACG en el contexto de lesiones isquémicas en distintos territorios vasculares y VSG elevada, se inicia megadosis de corticoides, tras lo cual la paciente presenta una discreta mejoría clínica, con mayor movilidad en la pierna derecha y mejoría del lenguaje.
En la angio-RM, ratificada por DIVAS (fig. 4, B y C), se observa oclusión completa bicarotídea, con imagen indicativa de disección en ACI-I. No hay imagen de estenosis en el sistema vertebrobasilar.
Es dada de alta a centro de crónicos con un Rankin 4 y pauta descendente de corticoides. Fallece 2 meses después por sepsis.
Caso 5Varón de 64 años de edad, hipertenso, dislipidémico y fumador. Polimialgia reumática en seguimiento por Reumatología: 4 años antes del ingreso, cuadro polimioartrálgico con VSG 80-100mm/h que mejoró con corticoides orales. Rankin previo: 0. Controlado con metilprednisolona 1mg al día. Ingresa en la Unidad de Ictus por presentar, de manera brusca, sensación de parestesias y adormecimiento en la hemicara izquierda, con posterior aparición de torpeza en el hemicuerpo izquierdo y tendencia a la caída al andar. Evolución hacia la mejoría en el día posterior. En las puertas de Urgencias, la exploración revela hipoestesia hemifacial izquierda, leve afectación facial izquierda y leve disdiadococinesia en el miembro superior izquierdo. Sin dismetría. Fuerza normal. Ataxia troncal, con aumento espontáneo de la base de sustentación y tándem imposible. NIHSS: 3.
PCR 49,1mg/L; VSG 80 primera hora.
RM cerebral: infarto bulbar lateral izquierdo.
Angio-TAC cerebral: oclusión de la arteria vertebral izquierda.
La ecografía en modo B mostró las arterias temporales engrosadas. En el estudio power Doppler se apreció en algunos segmentos el signo del halo.
PET-TAC TSA/arco aórtico: intensa actividad metabólica en vasos medianos con mayor repercusión en vasos supraaórticos (subclavia y carótida común bilateral) y en menor grado en ejes ilíacos.
Una biopsia de la arteria temporal confirmó el diagnóstico de ACG.
Durante el ingreso el paciente recibió una megadosis de 1g de metilprednisolona iv durante 5 días con posterior pauta de 1mg/kg de prednisona, con reducción posterior. Actualmente, tras 19 meses de seguimiento, toma prednisona 2,5mg/día y está asintomático. Rankin: 1.
Caso 6Varón de 73 años, hipertenso, diabético y exfumador. Ingresó en Neurología por inestabilidad de la marcha, disartria y torpeza en los miembros izquierdos de 3 días de evolución. Además, aquejaba cefalea desde hacía 6 meses, sin otros síntomas acompañantes. Una TAC practicada en Urgencias mostró infarto bilateral en el territorio de la PICA.
Análisis: PCR 49,5mg/L; VSG 68mm/h.
La RM confirmó infarto agudo en ambos hemisferios cerebelosos y pedúnculo cerebeloso medio izquierdo. El estudio vascular puso de manifiesto estenosis vertebrales bilaterales intracraneales y disminución del calibre de segmentos cavernosos de las arterias carótidas internas.
Ante la fuerte sospecha de arteritis de la temporal, apoyada por el signo del halo positivo en el estudio Doppler, y aunque la biopsia de la arteria temporal fue negativa, recibió tratamiento corticoideo a dosis plenas, con mejoría de la clínica. Un mes después reingresa por ictus isquémico vertebrobasilar de repetición a pesar del tratamiento corticoideo. La RM-difusión mostró nuevas áreas infartadas en el cerebelo.
Se repitió la angio-RM: oclusión V2 distal izquierda. Oclusión V2 derecha. Irregularidad marcada de V4 bilateral (vertebral intradural). En esta ocasión, PCR y VSG fueron normales.
Biopsia temporal: ACG.
PET-TAC: leve actividad en vasos axilares.
DIVAS: se hace angioplastia en la estenosis vertebral izquierda, con reducción de las estenosis en el control final. El paciente, tras 17 meses de seguimiento, mejoró, con un Rankin de 3 y prednisona 5mg al día.
DiscusiónPresentamos 6 casos de ictus secundario a arteritis de la temporal confirmada con biopsia; el diagnóstico es complejo, precisando de un alto índice de sospecha, al no existir prueba patognomónica fuera de la biopsia. Los nuevos métodos diagnósticos ayudan a refinar la correcta evaluación de los pacientes y a determinar el tratamiento óptimo. El pronóstico dista de ser benigno.
Aunque las arterias intracraneales están generalmente preservadas en la ACG, un 3-6% de los pacientes asocian ictus isquémico o demencia multiinfarto, por la participación de las ramas intracraneales de las arterias carótidas y vertebrales5,11–13.
La causa del ictus en la ACG ha sido ampliamente discutida. Dada la edad de los pacientes y la alta prevalencia de factores de riesgo vascular, en un principio se atribuyó a aterosclerosis subyacente, coincidiendo con la ACG. Sin embargo, posteriormente y de forma fehaciente se ha demostrado la afectación vasculítica intracraneal; además, en los últimos años se ha revelado superior a lo que se creía9. Más infrecuente aún es la afectación vascular intradural, ya que, como Wilkinson y Russel plantearon en su artículo pionero14, el desencadenante patológico de la ACG sería una reacción autoinmune hacia el tejido elástico arterial, de ahí la escasa afectación de las arterias intradurales, al carecer prácticamente estas arterias de tejido elástico.
El proceso inflamatorio arterial produciría un engrosamiento de la íntima, irregularidades de la luz del vaso, con estenosis y finalmente oclusión, que provocaría infarto o hipoperfusión en territorios frontera15. También puede producirse oclusión o embolización distal por trombosis in situ16,17, estando descrito también por disección arterial15. Hay que recordar que la arteritis temporal, así como el resto de las vasculitis inflamatorias, además de infartos corticales o en territorio frontera, puede originar también infartos cerebrales de tipo lacunar18.
En el ictus atribuido a ACG se ha descrito una mayor afectación de territorio posterior5,19. Sin embargo, en nuestra serie la afectación de ambos territorios es similar: 4 pacientes tenían tanto afectación carotídea como vertebrobasilar, uno solo afectación carotídea, y otro solo afectación vertebrobasilar.
La imagen en el caso 4 (fig. 4C) era típica de disección carotídea. Ya Parra et al. describieron a un paciente con arteritis de la temporal y disecciones cerebrales intracraneales15. Este hecho dificulta aún más el diagnóstico, teniendo que recordar en cada momento la hipótesis vasculítica en el diagnóstico diferencial del ictus isquémico.
La ACG sigue requiriendo un alto índice de sospecha. La clínica sistémica previa al ictus, aunque muchas veces inespecífica, tal como cefalea, artralgias y pérdida de peso, puede orientar el diagnóstico; este se apoyará, además, en los marcadores inflamatorios alterados; estos marcadores son primordiales tanto para el diagnóstico como para la monitorización de la respuesta terapéutica. La PCR se ha revelado como un marcador más sensible que la VSG; aun así, hay que tener en cuenta que su normalidad no excluye el diagnóstico: una pequeña proporción de pacientes con arteritis de la temporal puede tener los marcadores inflamatorios normales20.
Entre el resto de las pruebas complementarias el Doppler nos va a permitir tanto enfocar el diagnóstico, con el signo del halo, reflejo de la inflamación de la arteria temporal, como la selección del vaso a biopsiar8. También nos permitirá confirmar la respuesta terapéutica, con la desaparición del signo del halo en la arteria temporal cuando cede la inflamación.
La ACG es la vasculitis más frecuente del adulto1. El diagnóstico de vasculitis se ha refinado con la RM: la hipercaptación del vaso tanto extra como intracraneal es un hallazgo frecuente en la ACG, que traduce la inflamación mural de las arterias9. Recordamos que los criterios diagnósticos de vasculitis intracraneal son la captación intramural de contraste, combinada en muchos casos con un engrosamiento de la pared arterial21 (fig. 2B).
La combinación PET-TAC ha surgido en los últimos años como técnica de imagen de soporte para el diagnóstico de la ACG22. En nuestra serie nos ayudó tanto a apoyar el diagnóstico como a tomar decisiones terapéuticas. El caso 5 era un varón con importantes factores de riesgo vascular y un infarto bulbar lateral por oclusión vertebral; la PET-TAC demostró una intensa actividad metabólica en subclavias y carótidas, ratificando el origen vasculítico del ictus.
Como está descrito en la literatura, en algunos casos (2 y 6) se siguieron produciendo ictus a pesar del tratamiento corticoideo1,7,19. En ese momento, es importante determinar la actividad de la enfermedad, antes de someter a los pacientes a otras medicaciones potencialmente deletéreas, como pudieran ser otros inmunosupresores (que, además, no han demostrado su eficacia en el tratamiento de la ACG); en nuestro caso, lo realizamos con los marcadores inflamatorios, VSG y PCR, normales en ambos casos. También nos fue de utilidad la PET-TAC, negativa en ambos pacientes en ese momento de la enfermedad: ratificó la remisión de la inflamación; la clínica se atribuyó principalmente a hipoperfusión, dada la circulación comprometida en ambos (con corticoides a dosis plenas), que se resolvió con angioplastia, mejorando la circulación en el territorio afecto23. En nuestra serie, la terapia de reperfusión supuso el 33%.
El seguimiento medio de los pacientes fue de 26 meses (tabla 1). El pronóstico dista de ser benigno, particularmente en los pacientes en los que se produce retraso terapéutico, como el caso 4. Esta mujer falleció, confirmando la gravedad de la afección que nos ocupa. Hay que considerar que, desgraciadamente, se produjo una demora importante en el diagnóstico, probablemente de un año, lo que contribuyó a que el inicio vascular fuera catastrófico7, con lesiones múltiples e irreversibles. Otro paciente (caso 6) quedó con importantes secuelas de sus ictus de repetición, a pesar de un diagnóstico y tratamiento precoces.
En algunos casos se ha confirmado la regresión de las estenosis intracraneales tras el tratamiento corticoideo24,25. En nuestra serie, el caso 3 presentaba estenosis carotídeas intrapetrosas significativas y bilaterales. El estudio de vasos en el seguimiento confirmó la regresión de las estenosis intracraneales (fig. 3D).
Concluimos que el ictus provocado por la ACG es una enfermedad potencialmente grave, que requiere una alta sospecha diagnóstica. Las nuevas técnicas de imagen juegan un papel importante tanto en el diagnóstico como en el manejo terapéutico del paciente. El tratamiento endovascular es una opción terapéutica válida en casos seleccionados.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.