El diagnóstico etiológico de las ataxias de inicio en el adulto supone un desafío diagnóstico, y descartar las causas potencialmente tratables debe ser una prioridad1. Dentro de estas, destacamos los síndromes paraneoplásicos neurológicos (SPN) por la importancia de asociarse con una neoplasia subyacente. Sin embargo, un diagnóstico erróneo puede derivar en iatrogenia por una inmunosupresión innecesaria. Presentamos el caso de un paciente con una ataxia progresiva de inicio tardío diagnosticado inicialmente de un SPN que finalmente demostró tener un origen neurodegenerativo.
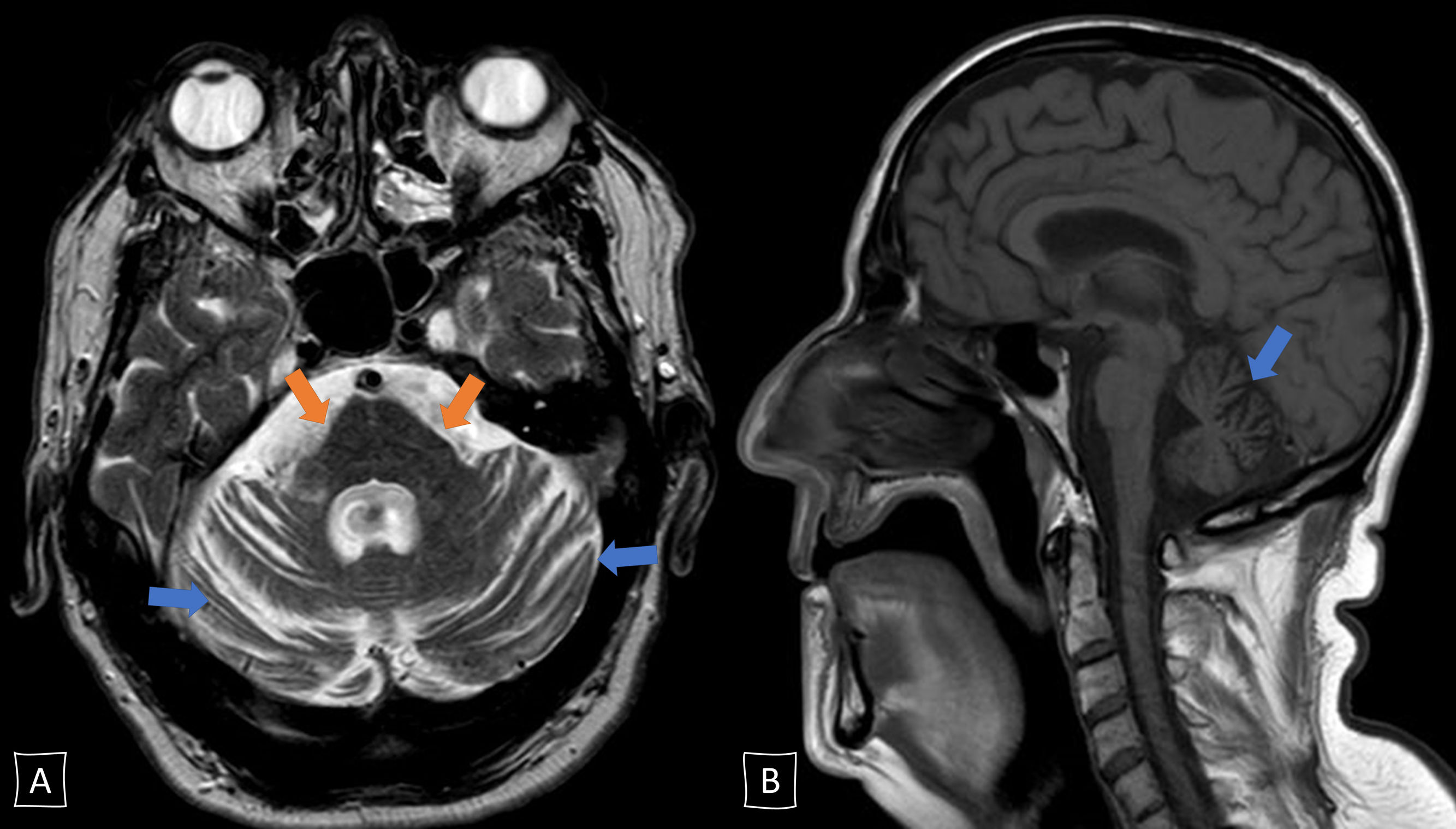
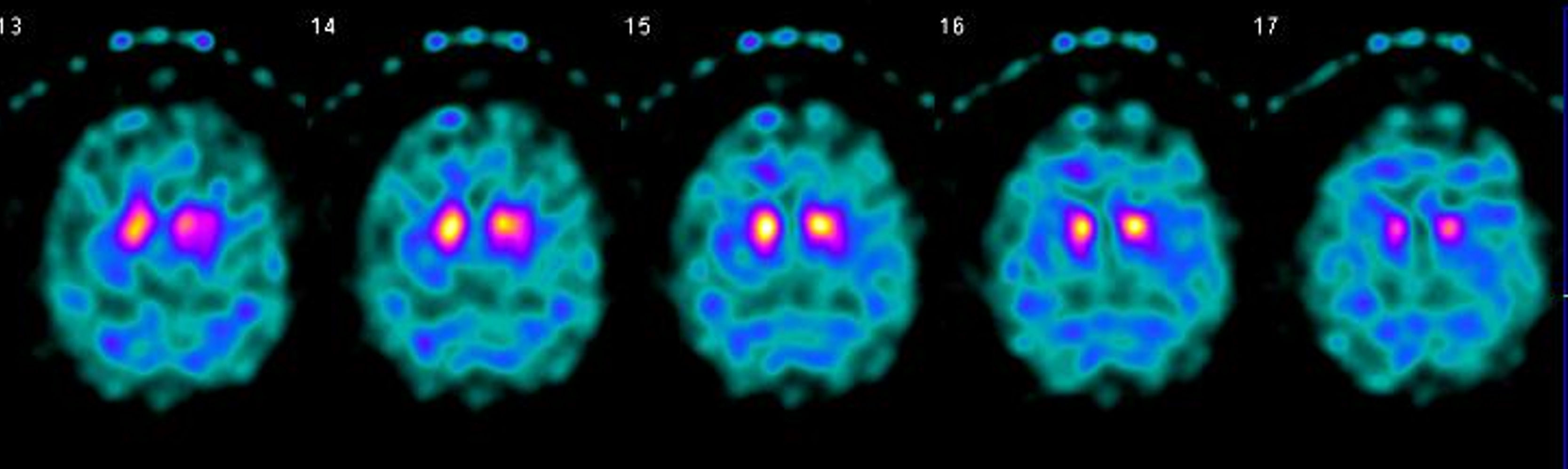
Varón de 65 años sin antecedentes familiares ni personales de interés salvo tabaquismo y dislipemia, que consultó en 2017 por un trastorno progresivo de la marcha de dos años de evolución. En la exploración se objetivó disartria escandida, sacadas fragmentadas, dismetría apendicular bilateral, ataxia troncal leve y moderada de la marcha. Negaba enolismo o exposición a otros tóxicos. La RM cerebral mostró atrofia pontina y cerebelosa sin otros hallazgos reseñables (fig. 1). En la analítica destacó la positividad de los anticuerpos anti-Ma2 en suero (Immunoblot, EUROIMMUN AG) y leve elevación de marcadores tumorales (CEA 10,2 ng/mL [0-3,4] y anti células escamosas 2,0 ng/ml [0-1,5]), siendo normal el resto incluyendo autoinmunidad, vitaminas B1-B12-E y estudio de líquido cefalorraquídeo, este último incluyendo determinación de anticuerpos antineuronales. El paciente fue diagnosticado de ataxia cerebelosa de etiología paraneoplásica, aunque el estudio de neoplasia oculta (TC cérvico-torácico-abdominal-pélvico, ecografía genitourinaria, colonoscopia, broncoscopia y PET) durante los dos siguientes años fue negativo. Se inició inmunoterapia con inmunoglobulinas intravenosas (IGIV), posteriormente megadosis de corticoides, y al no obtener beneficio se pasó a rituximab en junio de 2018. A pesar de ello, el paciente continuó empeorando a lo largo del año 2018: precisaba apoyo para la marcha, desarrolló disfagia, afectación cognitiva, temblor, incontinencia urinaria y trastorno de conducta del sueño REM. A comienzos de 2019, aparecieron datos de parkinsonismo y empeoró la disautonomía (hipotensión ortostática y cambios vasomotores en las manos). Se decidió interrumpir la inmunoterapia y replantear el diagnóstico; en este contexto realizamos una nueva determinación de anticuerpos anti-Ma2 en nuestro centro (Immunoblot, EUROIMMUN AG) que siguió siendo positivo débil, y de forma simultánea en un laboratorio de referencia (inmunohistoquímica realizada sobre cerebelo de rata; IDIBAPS, Hospital Clinic de Barcelona) siendo esta negativa. Además, se solicitó un tomografía computarizada de emisión monofotónica cerebral que reveló un hipometabolismo dopaminérgico bilateral (fig. 2). Todos estos datos permitieron el diagnóstico final de atrofia multisistémica de tipo cerebeloso. Se inició tratamiento sintomático con levodopa y terapia física con escasa respuesta. Desafortunadamente, el paciente falleció en mayo de 2019. La familia denegó la necropsia.
La degeneración cerebelosa es uno de los SPN más comunes (hasta el 40%)2 y suele tener un curso subagudo, con un rápido deterioro clínico en menos de 12 semanas. La neuroimagen o bien es normal, o revela una leve atrofia cerebelosa, y el líquido cefalorraquídeo suele mostrar inflamación (pleocitosis, hiperproteinorraquia o bandas oligoclonales IgG). Se ha descrito asociado a diferentes tumores y anticuerpos onconeuronales dirigidos contra antígenos intracelulares, entre ellos, aunque de forma infrecuente a anticuerpos anti-Ma2. Estos casos con afectación cerebelosa predominante son pacientes con reactividad simultánea para ambos antígenos Ma1 y Ma2, mientras que en los que solo tienen anticuerpos anti-Ma2, la ataxia forma parte de un cuadro más complejo donde predomina la afectación límbica o troncoencefálica3,4. Los anticuerpos anti-Ma2 se asocian a neoplasias hasta en el 75% de los casos, principalmente de testículo y carcinoma no microcítico de pulmón3, por lo que su hallazgo apoya fuertemente el diagnóstico de un SPN. Sin embargo, hay una minoría de casos descritos sin evidencia de malignidad3,4. El tratamiento de los SPN asociados a anti-Ma2 se basa en la identificación y manejo oncológico de la neoplasia subyacente, así como en la inmunoterapia con corticoides, IGIV, ciclofosfamida o rituximab3. Con todo, ante un síndrome clínico atípico, de tiempo de evolución superior a los 6 meses, títulos bajos de anticuerpos, ausencia de neoplasia maligna y ausencia de respuesta al tratamiento debe plantearse un falso positivo a estos anticuerpos.
No hemos encontrado en la literatura otros casos de falso positivo para anticuerpos anti-Ma2, pero sí para otros anticuerpos antineuronales, sobre todo al ser analizados por técnicas inadecuadas. Conviene señalar que el tratamiento con IGIV comerciales puede producir falsos positivos para anticuerpos como anti-GAD o anti aquaporina-4 cuando las muestras se analizan mediante ELISA5. Sin embargo, no existieron falsos positivos con técnicas celulares5, cuyo uso debe primar cuando los anticuerpos patogénicos reconocen epítopos conformacionales de las proteínas (antígenos extracelulares). Diferentes trabajos ponen de manifiesto la dificultad que los laboratorios poco experimentados tienen para interpretar patrones de reactividad de los autoanticuerpos con kits comerciales6,7. Asimismo, los anticuerpos onconeurales pueden ser positivos en pacientes con neoplasias pero sin clínica neurológica8 y además pueden existir autoanticuerpos positivos a títulos bajos en población sana9. Dada la importancia del diagnóstico de un SPN y los riesgos asociados al tratamiento inmunosupresor, es recomendable que la seropositividad de los anticuerpos onconeuronales sea confirmada en centros experimentados y por dos técnicas diferentes: idealmente primero inmunofluorescencia sobre tejido nervioso de primate o rata, luego confirmación mediante inmunotransferencia o células transfectadas, según sea un antígeno intracelular o extracelular, respectivamente10.
La evolución inicial de este caso fue comunicada como póster en la LXIX Reunión Anual de la Sociedad Española de Neurología que tuvo lugar del 21 al 25 de noviembre de 2017 en Valencia titulado «Degeneración cerebelosa paraneoplásica crónica con anti-Ma2 positivos».